腸管上皮幹細胞における細胞周期はPaneth細胞を介して概日周期と共役する
松浦 徹・Christian I. Hong
(米国Cincinnati大学Department of Molecular and Cellular Physiology)
email:松浦 徹
DOI: 10.7875/first.author.2016.124
Intercellular coupling of the cell cycle and circadian clock in adult stem cell culture.
Toru Matsu-ura, Andrey Dovzhenok, Eitaro Aihara, Jill Rood, Hung Le, Yan Ren, Andrew E. Rosselot, Tongli Zhang, Choogon Lee, Karl Obrietan, Marshall H. Montrose, Sookkyung Lim, Sean R. Moore, Christian I. Hong
Molecular Cell, 64, 900-912 (2016)
細胞周期と概日周期の2つの振動子の共役はシアノバクテリアから哺乳類まで多くの種において観察されており,細胞における分子ネットワークによりこれら2つの振動子が共役していることが知られている.しかし,この現象は細菌や培養細胞など単一の細胞の集団でしか研究されておらず,哺乳類の組織のようにさまざまな細胞が混在する状態においてこれら2つの振動子がどのように関与しあうのかはわかっていなかった.筆者らは,マウスの腸管上皮幹細胞から作製した小腸オルガノイドにおいて,細胞周期と概日周期が細胞間で共役していることを発見した.小腸オルガノイドは腸管上皮幹細胞,前駆細胞,終末分化細胞から構成され,立体的な組織構造体を形成する.小腸オルガノイドにおいては同期した細胞分裂が12時間の周期で観察され,この同期した細胞分裂は概日周期により制御されていた.細胞分裂する腸管上皮幹細胞および前駆細胞において概日周期の機能は弱かった.これらの結果から,終末分化した細胞からのシグナルが腸管上皮幹細胞および前駆細胞において細胞周期を制御することが示唆された.コンピューターシミュレーションおよび実験による検証により,腸管上皮にあるPaneth細胞から分泌されたWNTが細胞周期と概日周期の2つの振動子の共役において重要な役割をはたすことが明らかにされた.
共役した複数の振動子は自然界に広く見い出され,同期からカオス的な相互作用まで幅広いパターンのふるまいを示す.生命現象においても,ホタルの同期発光,心筋の同期収縮,異なる脳の領域のポリリズム相互作用などさまざまな振動子の共役が知られている.細胞周期および概日周期も生命現象において見い出される振動子であり,哺乳類の培養細胞であるNIH3T3細胞においてこれらの振動子が1細胞にておよそ1対1の比で共役していることが報告されている1).また,細胞周期に関連するいくつかの遺伝子は概日周期をつかさどる時計遺伝子により制御されることが知られている.たとえば,細胞周期のチェックポイントキナーゼWEE1やサイクリン依存性キナーゼ阻害タンパク質p21が時計遺伝子であるBMAL1遺伝子,REV-ERBα遺伝子,REV-ERBβ遺伝子により制御されることや2,3),細胞周期のチェックポイントキナーゼCHEK2やサイクリン依存性キナーゼ阻害タンパク質p21が時計遺伝子であるPER1遺伝子やPER2遺伝子により制御されることが知られており4,5),これらの分子間の相互作用が細胞において細胞周期と概日周期を共役させる.
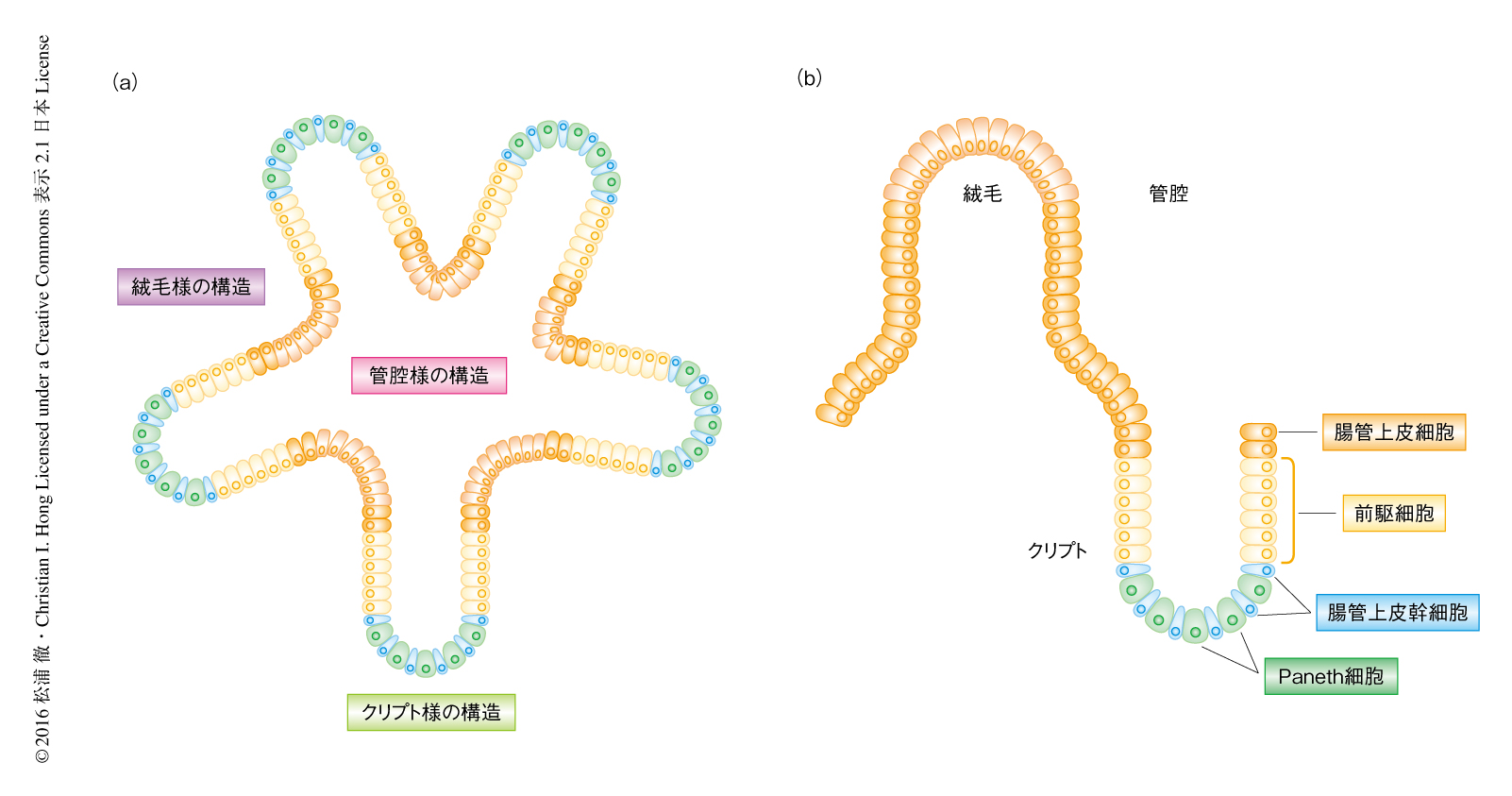
これまで,細胞周期と概日周期の共役は培養細胞など単一の細胞の集団において研究されてきたが,筆者らは,多様な細胞が存在する小腸オルガノイドを用いた(図1a).小腸オルガノイドは腸管上皮幹細胞から自己形成され,小腸と同様のクリプト,絨毛,管腔様の構造をもち,腸管上皮幹細胞,前駆細胞,さらには,腸細胞,ゴブレット細胞,腸内分泌細胞,Paneth細胞などの終末分化細胞を含む6).Paneth細胞は分泌細胞であり,クリプトの底に配置されWNTなどの成長因子を分泌することにより腸管上皮幹細胞や前駆細胞の自己複製能を維持する(図1b).
筆者らは,以前の研究において,ひとつのプレートにおいて多数の小腸オルガノイドのあいだで概日周期が自主的に同期することを発見した7).今回,小腸オルガノイドを用い,細胞周期と概日周期のイメージング法による解析およびコンピューターシミュレーションにより,これら2つの振動子のふるまいについて調べた.
小腸オルガノイドにおける細胞周期および概日周期について調べるため,ルシフェラーゼを用いたセンサーを作製した.細胞周期のセンサーとしてS期からM期のあいだに発現するhGemininと緑色ルシフェラーゼとの融合タンパク質を,また,概日周期のセンサーとして時計遺伝子であるPer2遺伝子のプロモーターにより赤色ルシフェラーゼの発現を制御するコンストラクトを作製した.これらのセンサーをレンチウイルスを用いて小腸オルガノイドに発現させ,緑色ルシフェラーゼおよび赤色ルシフェラーゼの発光を同時にモニタリングした結果,ひとつのプレートの多数の小腸オルガノイドのあいだで細胞周期と概日周期の自主的な同期が観察された.また,小腸オルガノイドの集団において,細胞周期の長さは12時間,概日周期の長さは24時間であることが確認された.
細胞周期および概日周期をひとつの小腸オルガノイドのレベルで観察するため,細胞周期のセンサーであるFUCCI2を発現するトランスジェニックマウスから小腸オルガノイドを作製した8).FUCCI2はS期からM期のあいだにmVenusによる緑色の蛍光,G1期およびG0期にmCherryによる赤色の蛍光を発する.FUCCI2を発現した小腸オルガノイドにおいても,小腸オルガノイドの集団と同様に,ひとつの小腸オルガノイドのレベルで同期した12時間の細胞周期が観察された.shRNAにより時計遺伝子であるBmal1遺伝子をノックダウンした小腸オルガノイドにおいて細胞周期の同期は弱くなった.この結果から,細胞周期は概日周期により同期していることが強く示唆された.
細胞周期の概日周期による制御の機構について探るため,細胞周期のセンサーであるFUCCI2を発現する小腸オルガノイドの細胞周期を1細胞のレベルで測定した結果,おのおのの細胞の細胞周期の長さはバラバラであり,ヒストグラムを作成すると多様なピークが現われた.また,細胞周期の平均の長さは18.4±7.0時間であり,小腸オルガノイドの集団およびひとつの小腸オルガノイドにおいて観察された12時間の周期とは大きな差があった.このことから,12時間の周期は1細胞のレベルではなく,細胞の集団として細胞周期が同期することにより形成されることが示唆された.また,おのおのの細胞の細胞周期の長さとG1期の長さのあいだには非常に強い相関がみられた.このことから,小腸オルガノイドではG1期からS期への移行が細胞周期の長さを制御するキーファクターであることが示唆された.
観察された現象のコンピューターシミュレーションによる再現を試みた.ひとつのモデルは,一般的に信じられている細胞周期と概日周期のモデルである.このモデルにおいては,サイクリンB-CDK複合体を抑制することによりG2期からM期への移行を抑制するWEE1の発現が概日周期により制御されることによって細胞周期と概日周期が共役する9).もうひとつのモデルは,小腸オルガノイドにおいて細胞周期の長さとG1期の長さとのあいだに非常に強い相関がみられることを考慮して新たに作成したものである.このモデルにおいては,小腸上皮において腸管上皮幹細胞および前駆細胞の増殖を制御することの知られるWNTにより細胞周期と概日周期が共役する.WNTはGSK3βを抑制することによりG1期からS期への移行を促進することが知られている.この2つのモデルにおいて,以前の報告から,腸管上皮幹細胞における細胞周期の平均の長さを26時間,前駆細胞における細胞周期の平均の長さを16時間とした.
シミュレーションの結果,どちらのモデルにおいても,細胞周期と概日周期が共役することによりおのおのの細胞が多様な細胞周期の長さをもつことが再現された.また,どちらのモデルにおいても,細胞の集団が1日に2回の細胞分裂のピークをもつことが再現された.しかしながら,WEE1のモデルにおいてはG2期からM期への移行の抑制のためWEE1の発現の高い時期に細胞分裂の長い休止期が生じ,細胞分裂の2回のピークのあいだの長さはそのぶん12時間よりも短くなった.それに対し,WNTのモデルにおいては12時間の細胞分裂のピークが正しく再現された.
腸管上皮幹細胞あるいは前駆細胞のそれぞれの細胞の集団に対し別々にシミュレーションしたところ,どちらのモデルにおいても,腸管上皮幹細胞は1日に1回の細胞分裂のピークをもち,前駆細胞は1日に2回の細胞分裂のピークをもつことが示唆された.そこで,FUCCI2を発現する小腸オルガノイドのイメージング法による解析から得られた1細胞のレベルでの細胞周期の長さのデータから,細胞周期が20時間より短い細胞と20時間より長い細胞を選別した.その結果,細胞周期が20時間より短い細胞の集団は12時間の細胞周期,細胞周期が20時間より長い細胞の集団は24時間の細胞周期をもつことがわかった.また,細胞周期の長い細胞の集団は腸管上皮幹細胞の局在するクリプトの底に,細胞周期の短い集団は前駆細胞の局在するクリプトのTA領域に観察された.つまり,腸管上皮幹細胞と前駆細胞とでは概日周期と細胞周期の共役比が異なることが明らかにされた.
腸管上皮幹細胞あるいは前駆細胞には概日周期があるのだろうか.1細胞のレベルにおいて細胞周期および概日周期をイメージング法により解析した.核を核タンパク質H2Bと蛍光タンパク質EGFPとの融合タンパク質により可視化することにより細胞分裂を観察し,時計遺伝子であるPer2遺伝子のプロモーターにより蛍光タンパク質mCherryの発現を制御するコンストラクトにより概日周期を観察した.その結果,細胞分裂をしていない細胞においてはmCherryの蛍光の振動が観察されたが,細胞分裂をしている細胞ではmCherryの蛍光の振動は弱かった.この結果から,腸管上皮幹細胞や前駆細胞など増殖する細胞においては,増殖しない終末分化細胞に比べ概日周期の機能が弱いことが示唆された.
このことを確認するため,概日周期のセンサーとしてPer2遺伝子のプロモーターによりルシフェラーゼの発現を制御するコンストラクトをノックインしたマウスから小腸オルガノイドを作製し,WNTのアゴニストであるCHIR99021およびクロマチンの修飾剤であるバルプロ酸の存在のもとで培養することにより,小腸オルガノイドを構成する細胞の90%以上を腸管上皮幹細胞あるいは前駆細胞にした.その結果,腸管上皮幹細胞および前駆細胞においてはルシフェラーゼの発光の振動が有意に弱い,つまり,概日周期の機能が弱いことが確認された.
腸管上皮幹細胞および前駆細胞においては概日周期の機能が弱いことから,細胞において細胞周期と概日周期がWEE1により共役することはむずかしいと示唆された.それでは,もうひとつの候補であるWNTが小腸オルガノイドにおいて細胞周期と概日周期を共役するのだろうか? Wnt3a遺伝子の発現が24時間の周期をもつことがqRT-PCR法により確認され,また,小腸オルガノイドの培養液においてWNTの活性が24時間の周期をもつことも確認された.さらに,時計遺伝子であるBmal1遺伝子のshRNAによるノックダウンによりこれらの24時間の周期の振動は弱まったことから,WNTの発現および分泌が概日周期により制御されることが示唆された.
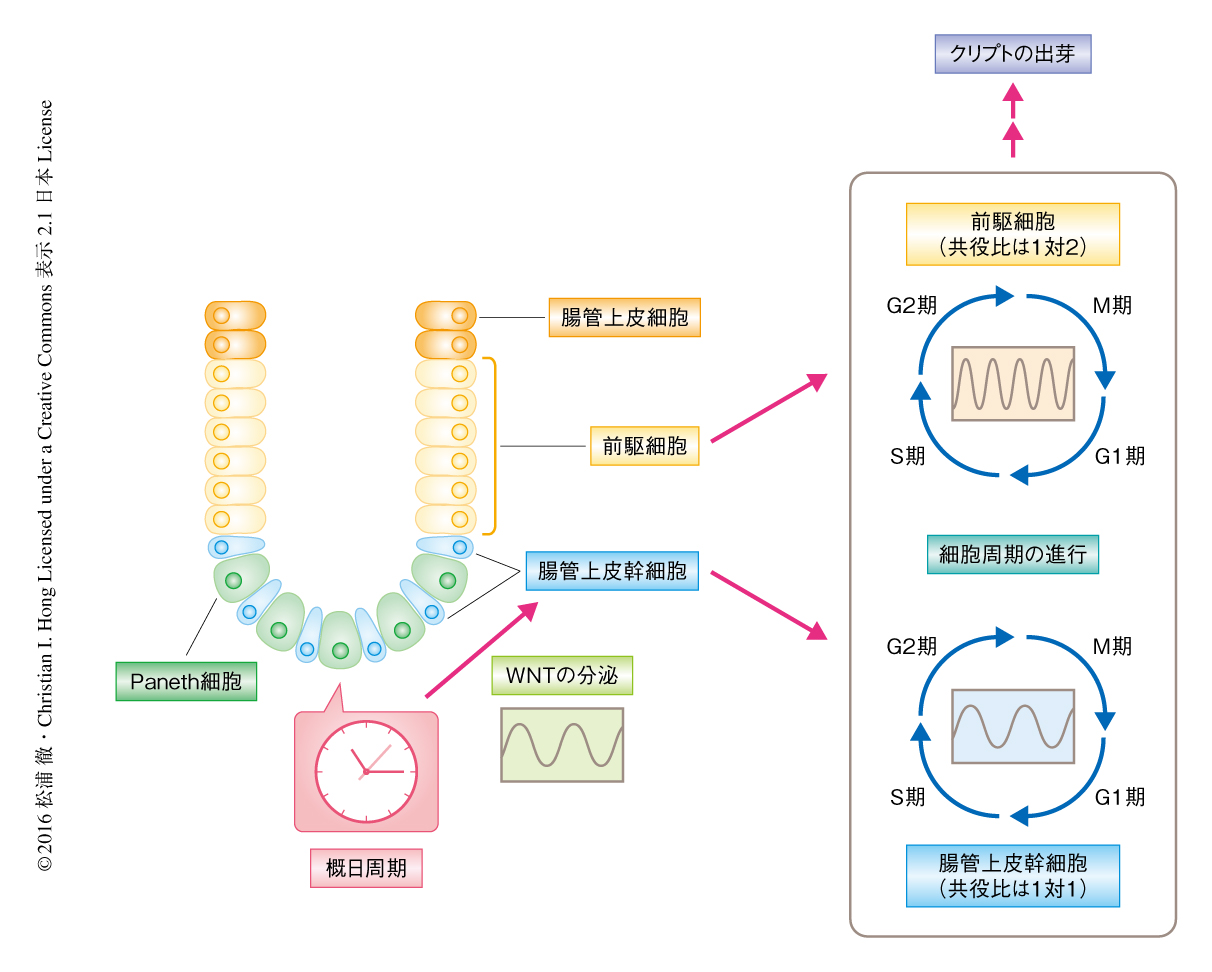
小腸オルガノイドの培養液にWNTのアゴニストであるCHIR99021をくわえWNTの活性を飽和させることにより,細胞周期の同期した振動は抑制された.WNTはクリプトの底部に局在するPaneth細胞により分泌されることから,レーザーによるPaneth細胞の除去,および,Paneth細胞の分化に必須であるAtoh1遺伝子のshRNAによるノックダウンにより,Paneth細胞を小腸オルガノイドから取り除いた.その結果,どちらの処理によっても細胞周期の同期した振動は抑制された.Paneth細胞における概日周期は免疫染色およびPaneth細胞に特異的なCryptdinの周期的な発現により確認された.以上の結果から,概日周期の機能の弱い腸管上皮幹細胞および前駆細胞における細胞周期は,Paneth細胞からのWNTの産生および分泌により制御されることが示唆された(図2).
腸管上皮幹細胞における細胞周期と概日周期の細胞間の共役は生理的にどのような意義をもつのだろうか? 小腸オルガノイドにおけるクリプトの出芽にも細胞周期と同じ12時間の周期があった.また,時計遺伝子であるPer1遺伝子およびPer2遺伝子のダブルノックアウトマウスの小腸においてはクリプトの数が少なかった.これらのことから,周期的な細胞分裂とクリプトの分裂に関連のあることが示唆された.
今回の研究により,Paneth細胞はWNTなどの成長因子を分泌することにより,腸管上皮幹細胞の幹細胞ニッチを構成するだけでなく,WNTの分泌を介して腸管上皮幹細胞および前駆細胞の細胞周期を共役させるという役割をもつことが明らかにされた(図2).この役割は,概日周期の機能が弱い腸管上皮幹細胞および前駆細胞をサポートするものと考えられた.また,さらに未分化な多能性幹細胞では概日周期が機能していないことが知られており10),腸管上皮幹細胞のような成体幹細胞は概日周期が発達する途中の過程であることが予想された.WNTシグナルは消化管,乳腺,造血系,神経系などさまざまな成体幹細胞の自己複製を制御することが知られていることから,今回,発見されたWNTを介した細胞周期と概日周期の細胞間の共役という現象は,ほかの成体幹細胞においても機能している可能性があるだろう.
略歴:2006年 東京大学大学院医学系研究科博士課程 修了,同年 理化学研究所脳科学総合研究センター 博士研究員を経て,2011年より米国Cincinnati大学Research Scientist.
研究テーマ:生物における振動現象および合成生物学.
Christian I. Hong
米国Cincinnati大学 准教授.
研究室URL:https://honglab.wordpress.com/
© 2016 松浦 徹・Christian I. Hong Licensed under CC 表示 2.1 日本
(米国Cincinnati大学Department of Molecular and Cellular Physiology)
email:松浦 徹
DOI: 10.7875/first.author.2016.124
Intercellular coupling of the cell cycle and circadian clock in adult stem cell culture.
Toru Matsu-ura, Andrey Dovzhenok, Eitaro Aihara, Jill Rood, Hung Le, Yan Ren, Andrew E. Rosselot, Tongli Zhang, Choogon Lee, Karl Obrietan, Marshall H. Montrose, Sookkyung Lim, Sean R. Moore, Christian I. Hong
Molecular Cell, 64, 900-912 (2016)
要 約
細胞周期と概日周期の2つの振動子の共役はシアノバクテリアから哺乳類まで多くの種において観察されており,細胞における分子ネットワークによりこれら2つの振動子が共役していることが知られている.しかし,この現象は細菌や培養細胞など単一の細胞の集団でしか研究されておらず,哺乳類の組織のようにさまざまな細胞が混在する状態においてこれら2つの振動子がどのように関与しあうのかはわかっていなかった.筆者らは,マウスの腸管上皮幹細胞から作製した小腸オルガノイドにおいて,細胞周期と概日周期が細胞間で共役していることを発見した.小腸オルガノイドは腸管上皮幹細胞,前駆細胞,終末分化細胞から構成され,立体的な組織構造体を形成する.小腸オルガノイドにおいては同期した細胞分裂が12時間の周期で観察され,この同期した細胞分裂は概日周期により制御されていた.細胞分裂する腸管上皮幹細胞および前駆細胞において概日周期の機能は弱かった.これらの結果から,終末分化した細胞からのシグナルが腸管上皮幹細胞および前駆細胞において細胞周期を制御することが示唆された.コンピューターシミュレーションおよび実験による検証により,腸管上皮にあるPaneth細胞から分泌されたWNTが細胞周期と概日周期の2つの振動子の共役において重要な役割をはたすことが明らかにされた.
はじめに
共役した複数の振動子は自然界に広く見い出され,同期からカオス的な相互作用まで幅広いパターンのふるまいを示す.生命現象においても,ホタルの同期発光,心筋の同期収縮,異なる脳の領域のポリリズム相互作用などさまざまな振動子の共役が知られている.細胞周期および概日周期も生命現象において見い出される振動子であり,哺乳類の培養細胞であるNIH3T3細胞においてこれらの振動子が1細胞にておよそ1対1の比で共役していることが報告されている1).また,細胞周期に関連するいくつかの遺伝子は概日周期をつかさどる時計遺伝子により制御されることが知られている.たとえば,細胞周期のチェックポイントキナーゼWEE1やサイクリン依存性キナーゼ阻害タンパク質p21が時計遺伝子であるBMAL1遺伝子,REV-ERBα遺伝子,REV-ERBβ遺伝子により制御されることや2,3),細胞周期のチェックポイントキナーゼCHEK2やサイクリン依存性キナーゼ阻害タンパク質p21が時計遺伝子であるPER1遺伝子やPER2遺伝子により制御されることが知られており4,5),これらの分子間の相互作用が細胞において細胞周期と概日周期を共役させる.
これまで,細胞周期と概日周期の共役は培養細胞など単一の細胞の集団において研究されてきたが,筆者らは,多様な細胞が存在する小腸オルガノイドを用いた(図1a).小腸オルガノイドは腸管上皮幹細胞から自己形成され,小腸と同様のクリプト,絨毛,管腔様の構造をもち,腸管上皮幹細胞,前駆細胞,さらには,腸細胞,ゴブレット細胞,腸内分泌細胞,Paneth細胞などの終末分化細胞を含む6).Paneth細胞は分泌細胞であり,クリプトの底に配置されWNTなどの成長因子を分泌することにより腸管上皮幹細胞や前駆細胞の自己複製能を維持する(図1b).
筆者らは,以前の研究において,ひとつのプレートにおいて多数の小腸オルガノイドのあいだで概日周期が自主的に同期することを発見した7).今回,小腸オルガノイドを用い,細胞周期と概日周期のイメージング法による解析およびコンピューターシミュレーションにより,これら2つの振動子のふるまいについて調べた.
1.小腸オルガノイドにおいては24時間の概日周期と12時間の細胞周期が1対2の比で共役する
小腸オルガノイドにおける細胞周期および概日周期について調べるため,ルシフェラーゼを用いたセンサーを作製した.細胞周期のセンサーとしてS期からM期のあいだに発現するhGemininと緑色ルシフェラーゼとの融合タンパク質を,また,概日周期のセンサーとして時計遺伝子であるPer2遺伝子のプロモーターにより赤色ルシフェラーゼの発現を制御するコンストラクトを作製した.これらのセンサーをレンチウイルスを用いて小腸オルガノイドに発現させ,緑色ルシフェラーゼおよび赤色ルシフェラーゼの発光を同時にモニタリングした結果,ひとつのプレートの多数の小腸オルガノイドのあいだで細胞周期と概日周期の自主的な同期が観察された.また,小腸オルガノイドの集団において,細胞周期の長さは12時間,概日周期の長さは24時間であることが確認された.
細胞周期および概日周期をひとつの小腸オルガノイドのレベルで観察するため,細胞周期のセンサーであるFUCCI2を発現するトランスジェニックマウスから小腸オルガノイドを作製した8).FUCCI2はS期からM期のあいだにmVenusによる緑色の蛍光,G1期およびG0期にmCherryによる赤色の蛍光を発する.FUCCI2を発現した小腸オルガノイドにおいても,小腸オルガノイドの集団と同様に,ひとつの小腸オルガノイドのレベルで同期した12時間の細胞周期が観察された.shRNAにより時計遺伝子であるBmal1遺伝子をノックダウンした小腸オルガノイドにおいて細胞周期の同期は弱くなった.この結果から,細胞周期は概日周期により同期していることが強く示唆された.
2.12時間の細胞周期は多様な長さの細胞周期をもつ細胞の集団が概日周期と共役することにより形成される
細胞周期の概日周期による制御の機構について探るため,細胞周期のセンサーであるFUCCI2を発現する小腸オルガノイドの細胞周期を1細胞のレベルで測定した結果,おのおのの細胞の細胞周期の長さはバラバラであり,ヒストグラムを作成すると多様なピークが現われた.また,細胞周期の平均の長さは18.4±7.0時間であり,小腸オルガノイドの集団およびひとつの小腸オルガノイドにおいて観察された12時間の周期とは大きな差があった.このことから,12時間の周期は1細胞のレベルではなく,細胞の集団として細胞周期が同期することにより形成されることが示唆された.また,おのおのの細胞の細胞周期の長さとG1期の長さのあいだには非常に強い相関がみられた.このことから,小腸オルガノイドではG1期からS期への移行が細胞周期の長さを制御するキーファクターであることが示唆された.
観察された現象のコンピューターシミュレーションによる再現を試みた.ひとつのモデルは,一般的に信じられている細胞周期と概日周期のモデルである.このモデルにおいては,サイクリンB-CDK複合体を抑制することによりG2期からM期への移行を抑制するWEE1の発現が概日周期により制御されることによって細胞周期と概日周期が共役する9).もうひとつのモデルは,小腸オルガノイドにおいて細胞周期の長さとG1期の長さとのあいだに非常に強い相関がみられることを考慮して新たに作成したものである.このモデルにおいては,小腸上皮において腸管上皮幹細胞および前駆細胞の増殖を制御することの知られるWNTにより細胞周期と概日周期が共役する.WNTはGSK3βを抑制することによりG1期からS期への移行を促進することが知られている.この2つのモデルにおいて,以前の報告から,腸管上皮幹細胞における細胞周期の平均の長さを26時間,前駆細胞における細胞周期の平均の長さを16時間とした.
シミュレーションの結果,どちらのモデルにおいても,細胞周期と概日周期が共役することによりおのおのの細胞が多様な細胞周期の長さをもつことが再現された.また,どちらのモデルにおいても,細胞の集団が1日に2回の細胞分裂のピークをもつことが再現された.しかしながら,WEE1のモデルにおいてはG2期からM期への移行の抑制のためWEE1の発現の高い時期に細胞分裂の長い休止期が生じ,細胞分裂の2回のピークのあいだの長さはそのぶん12時間よりも短くなった.それに対し,WNTのモデルにおいては12時間の細胞分裂のピークが正しく再現された.
3.腸管上皮幹細胞と前駆細胞とでは細胞周期と概日周期の共役比が異なる
腸管上皮幹細胞あるいは前駆細胞のそれぞれの細胞の集団に対し別々にシミュレーションしたところ,どちらのモデルにおいても,腸管上皮幹細胞は1日に1回の細胞分裂のピークをもち,前駆細胞は1日に2回の細胞分裂のピークをもつことが示唆された.そこで,FUCCI2を発現する小腸オルガノイドのイメージング法による解析から得られた1細胞のレベルでの細胞周期の長さのデータから,細胞周期が20時間より短い細胞と20時間より長い細胞を選別した.その結果,細胞周期が20時間より短い細胞の集団は12時間の細胞周期,細胞周期が20時間より長い細胞の集団は24時間の細胞周期をもつことがわかった.また,細胞周期の長い細胞の集団は腸管上皮幹細胞の局在するクリプトの底に,細胞周期の短い集団は前駆細胞の局在するクリプトのTA領域に観察された.つまり,腸管上皮幹細胞と前駆細胞とでは概日周期と細胞周期の共役比が異なることが明らかにされた.
4.腸管上皮幹細胞および前駆細胞においては概日周期の機能が弱い
腸管上皮幹細胞あるいは前駆細胞には概日周期があるのだろうか.1細胞のレベルにおいて細胞周期および概日周期をイメージング法により解析した.核を核タンパク質H2Bと蛍光タンパク質EGFPとの融合タンパク質により可視化することにより細胞分裂を観察し,時計遺伝子であるPer2遺伝子のプロモーターにより蛍光タンパク質mCherryの発現を制御するコンストラクトにより概日周期を観察した.その結果,細胞分裂をしていない細胞においてはmCherryの蛍光の振動が観察されたが,細胞分裂をしている細胞ではmCherryの蛍光の振動は弱かった.この結果から,腸管上皮幹細胞や前駆細胞など増殖する細胞においては,増殖しない終末分化細胞に比べ概日周期の機能が弱いことが示唆された.
このことを確認するため,概日周期のセンサーとしてPer2遺伝子のプロモーターによりルシフェラーゼの発現を制御するコンストラクトをノックインしたマウスから小腸オルガノイドを作製し,WNTのアゴニストであるCHIR99021およびクロマチンの修飾剤であるバルプロ酸の存在のもとで培養することにより,小腸オルガノイドを構成する細胞の90%以上を腸管上皮幹細胞あるいは前駆細胞にした.その結果,腸管上皮幹細胞および前駆細胞においてはルシフェラーゼの発光の振動が有意に弱い,つまり,概日周期の機能が弱いことが確認された.
5.腸管上皮幹細胞および前駆細胞における細胞周期はPaneth細胞から周期的に分泌されるWNTにより概日周期と共役する
腸管上皮幹細胞および前駆細胞においては概日周期の機能が弱いことから,細胞において細胞周期と概日周期がWEE1により共役することはむずかしいと示唆された.それでは,もうひとつの候補であるWNTが小腸オルガノイドにおいて細胞周期と概日周期を共役するのだろうか? Wnt3a遺伝子の発現が24時間の周期をもつことがqRT-PCR法により確認され,また,小腸オルガノイドの培養液においてWNTの活性が24時間の周期をもつことも確認された.さらに,時計遺伝子であるBmal1遺伝子のshRNAによるノックダウンによりこれらの24時間の周期の振動は弱まったことから,WNTの発現および分泌が概日周期により制御されることが示唆された.
小腸オルガノイドの培養液にWNTのアゴニストであるCHIR99021をくわえWNTの活性を飽和させることにより,細胞周期の同期した振動は抑制された.WNTはクリプトの底部に局在するPaneth細胞により分泌されることから,レーザーによるPaneth細胞の除去,および,Paneth細胞の分化に必須であるAtoh1遺伝子のshRNAによるノックダウンにより,Paneth細胞を小腸オルガノイドから取り除いた.その結果,どちらの処理によっても細胞周期の同期した振動は抑制された.Paneth細胞における概日周期は免疫染色およびPaneth細胞に特異的なCryptdinの周期的な発現により確認された.以上の結果から,概日周期の機能の弱い腸管上皮幹細胞および前駆細胞における細胞周期は,Paneth細胞からのWNTの産生および分泌により制御されることが示唆された(図2).
腸管上皮幹細胞における細胞周期と概日周期の細胞間の共役は生理的にどのような意義をもつのだろうか? 小腸オルガノイドにおけるクリプトの出芽にも細胞周期と同じ12時間の周期があった.また,時計遺伝子であるPer1遺伝子およびPer2遺伝子のダブルノックアウトマウスの小腸においてはクリプトの数が少なかった.これらのことから,周期的な細胞分裂とクリプトの分裂に関連のあることが示唆された.
おわりに
今回の研究により,Paneth細胞はWNTなどの成長因子を分泌することにより,腸管上皮幹細胞の幹細胞ニッチを構成するだけでなく,WNTの分泌を介して腸管上皮幹細胞および前駆細胞の細胞周期を共役させるという役割をもつことが明らかにされた(図2).この役割は,概日周期の機能が弱い腸管上皮幹細胞および前駆細胞をサポートするものと考えられた.また,さらに未分化な多能性幹細胞では概日周期が機能していないことが知られており10),腸管上皮幹細胞のような成体幹細胞は概日周期が発達する途中の過程であることが予想された.WNTシグナルは消化管,乳腺,造血系,神経系などさまざまな成体幹細胞の自己複製を制御することが知られていることから,今回,発見されたWNTを介した細胞周期と概日周期の細胞間の共役という現象は,ほかの成体幹細胞においても機能している可能性があるだろう.
文 献
- Feillet, C., Krusche, P., Tamanini, F. et al.: Phase locking and multiple oscillating attractors for the coupled mammalian clock and cell cycle. Proc. Natl. Acad. Sci, USA, 111, 9828-9833 (2014)[PubMed]
- Grechez-Cassiau, A., Rayet, B., Guillaumond, F. et al.: The circadian clock component BMAL1 is a critical regulator of p21WAF1/CIP1 expression and hepatocyte proliferation. J. Biol. Chem., 283, 4535-4542 (2008)[PubMed]
- Matsuo, T., Yamaguchi, S., Mitsui, S. et al.: Control mechanism of the circadian clock for timing of cell division in vivo. Science, 302, 255-259 (2003)[PubMed]
- Gery, S., Komatsu, N., Baldjyan, L. et al.: The circadian gene per1 plays an important role in cell growth and DNA damage control in human cancer cells. Mol. Cell, 22, 375-382 (2006)[PubMed]
- Kowalska, E., Ripperger, J. A., Hoegger, D. C. et al.: NONO couples the circadian clock to the cell cycle. Proc. Natl. Acad. Sci. USA, 110, 1592-1599 (2013)[PubMed]
- Sato, T., Vries, R. G., Snippert, H. J. et al.: Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature, 459, 262-265 (2009)[PubMed]
- Moore, S. R., Pruszka, J., Vallance, J. et al.: Robust circadian rhythms in organoid cultures from PERIOD2::LUCIFERASE mouse small intestine. Dis. Model Mech., 7, 1123-1130 (2014)[PubMed]
- Abe, T., Sakaue-Sawano, A., Kiyonari, H. et al.: Visualization of cell cycle in mouse embryos with Fucci2 reporter directed by Rosa26 promoter. Development, 140, 237-246 (2013)[PubMed]
- Zamborszky, J., Hong, C. I. & Csikasz Nagy, A.: Computational analysis of mammalian cell division gated by a circadian clock: quantized cell cycles and cell size control. J. Biol. Rhythms, 22, 542-553 (2007)[PubMed]
- Yagita, K., Horie, K., Koinuma, S. et al.: Development of the circadian oscillator during differentiation of mouse embryonic stem cells in vitro. Proc. Natl. Acad. Sci. USA, 107, 3846-3851 (2010)[PubMed]
著者プロフィール
略歴:2006年 東京大学大学院医学系研究科博士課程 修了,同年 理化学研究所脳科学総合研究センター 博士研究員を経て,2011年より米国Cincinnati大学Research Scientist.
研究テーマ:生物における振動現象および合成生物学.
Christian I. Hong
米国Cincinnati大学 准教授.
研究室URL:https://honglab.wordpress.com/
© 2016 松浦 徹・Christian I. Hong Licensed under CC 表示 2.1 日本