前脳に特異的なAMPA受容体のアンタゴニストによる副作用の少ないてんかんの抑制
加藤 明彦
(米国Eli Lilly and Company,Neuroscience Discovery)
email:加藤明彦
DOI: 10.7875/first.author.2016.120
Forebrain-selective AMPA-receptor antagonism guided by TARPγ-8 as an antiepileptic mechanism.
Akihiko S. Kato, Kevin D. Burris, Kevin M. Gardinier, Douglas L. Gernert, Warren J. Porter, Jon Reel, Chunjin Ding, Yuan Tu, Douglas A. Schober, Matthew R. Lee, Beverly A. Heinz, Thomas E. Fitch, Scott D. Gleason, John T. Catlow, Hong Yu, Stephen M. Fitzjohn, Francesca Pasqui, He Wang, Yuewei Qian, Emanuele Sher, Ruud Zwart, Keith A. Wafford, Kurt Rasmussen, Paul L. Ornstein, John T. R Isaac, Eric S. Nisenbaum, David S. Bredt, Jeffrey M. Witkin
Nature Medicine, 22, 1496-1501 (2016)
AMPA受容体は興奮性のシナプス伝達の根幹を担うイオン透過型のグルタミン酸受容体である.AMPA受容体のアンタゴニストは効果的な抗てんかん薬になりうるが,AMPA受容体は神経系に普遍的に存在するため,副作用として運動障害や過剰な鎮静状態をひき起こす.筆者らは,前脳に特異的に発現するAMPA受容体の補助サブユニットであるTARPγ-8を含むAMPA受容体のみを阻害し,それ以外のAMPA受容体には効果のない化合物を発見した.この化合物のTARPγ-8への依存性は膜貫通ドメインに存在する2つのユニークなアミノ酸残基により決定されていた.この化合物はTARPγ-8の発現する海馬および大脳皮質においてAMPA受容体の活性を抑制したが,TARPγ-8の発現しない小脳のプルキンエ細胞においてはAMPA受容体の活性に影響せず,さらに,これまでのTARPに非依存的なAMPA受容体のアンタゴニストとは異なり,マウスおよびラットのいくつかのてんかんモデルを副作用なしに効果的に抑制した.主要サブユニットと補助サブユニットとの組合せを用いた神経回路に特異的な修飾は,より効果的かつ副作用の少ない新薬の開発の戦略となりうるだろう.
神経回路の薬理学的な修飾の理想は,病的な状態にある神経回路にのみ作用し,正常な状態にあるほかの神経回路には影響しないことである.この考え方は,抗がん剤の理想を連想させる.すなわち,がん細胞のみを死滅させ正常な細胞には影響しない抗がん剤が望まれるのと同じである.モデル生物において,脳の領域あるいは時期に特異的な神経回路の修飾は光遺伝学的あるいは化学遺伝学的な手法によりかなり厳密に行うことができる.しかしながら,これらの方法は侵襲性であり,外来性のタンパク質を発現させる必要があるためヒトの医療に応用するには敷居が高い.そこで,脳の領域に特異的な神経回路の修飾を,領域に特異的に発現する内在性のタンパク質を活用することにより実現することを考えた.
これまで,筆者らは,哺乳動物において興奮性のシナプス伝達に決定的な役割をはたすイオン透過性のグルタミン酸受容体であるAMPA受容体について研究してきた.生体においてAMPA受容体は補助サブユニットと結合しており1),いくつかの補助サブユニットはAMPA受容体の性質を大きく変化させることが報告されている.とくに,TARPファミリーはAMPA受容体の輸送および局在,物理的な特性,薬理学的な特性を劇的に変化させることが明らかにされている2).
哺乳類のゲノムにはTARPと相同性をもつ8つの遺伝子が同定されており,そのうち6つはAMPA受容体の機能を修飾する2,3).さらに,進化的により保存されている4つ,TARPγ-2,TARPγ-3,TARPγ-4,TARPγ-8は機能的に似かよっており,AMPA受容体の機能の失われたTARPγ-2ノックアウトマウスの小脳の顆粒細胞において,外来性に発現させるとAMPA受容体の機能をレスキューすることができる4).これら4つはI型TARPと名づけられている3).I型TARPは脳における発現に領域の特異性があり,TARPγ-2は小脳,TARPγ-3は大脳皮質,TARPγ-4は発生の初期および線条体,TARPγ-8は前脳とくに海馬に多く発現する4).
TARPγ-8のもつ薬理学的な特性および前脳に特異的な発現に注目し,TARPγ-8を含むAMPA受容体の機能を特異的に修飾する化合物のスクリーニングを試みた.ハイスループットなスクリーニング系の構築のため細胞内Ca2+濃度をハイスループットで測定できる装置を用い,Ca2+透過性のAMPA受容体サブユニットであるGluA1およびTARPを一過性に共発現したCHO-S細胞にCa2+指示薬を取り込ませて,AMPA受容体を介したCa2+の流入による細胞内Ca2+濃度の上昇を測定した.このとき,グルタミン酸の投与だけでは蛍光シグナルの十分な上昇が観察されなかったが,追加でグルタミン酸およびAMPA受容体の増強物質であるシクロチアジドを投与することにより,信頼性がありかつ十分な細胞内Ca2+濃度の上昇が得られた.AMPA受容体の既知のアンタゴニストであるGYKI,グルタミン酸,シクロチアジドを投与したところ,GluA1単独の発現,GluA1 + TARPγ-2の発現,GluA1 + TARPγ-8の発現のいずれの場合も,細胞内Ca2+濃度はまったく上昇しなかった.このことから,この系においてAMPA受容体のアンタゴニストを検出できることが示された.
この系を用いて十数万種の化合物をスクリーニングしたところ,GluA1 + TARPγ-8を抑制したものの,GluA1 + TARPγ-2あるいはGluA1単独を抑制しない複数の化合物が見い出された.最適化ののち得られたLY3130481(現在は,CERC-611とよばれている)は,既存の薬剤のいずれとも類似性のない化合物であった.
LY3130481の薬理学的な特性をより詳細に評価するため,AMPA受容体のグルタミン酸に対する応答電流について電気生理学的に検討した.TARPに対する依存性について網羅的に調べたところ,LY3130481はGluA1 + TARPγ-8を50%阻害濃度16 nMという低い濃度で抑制したのに対し,TARPγ-8ともっとも相同性の高いTARPγ-4でも100倍以上も高い50%阻害濃度を示し,それ以外のTARPはGluA1をほとんど抑制しなかった.LY3130481はGluA1が単独のときには抑制せず,GluA1と別のファミリーのAMPA受容体の補助サブユニットであるCNIH-2 5) を共発現させたときも抑制しなかった.LY3130481のTARPγ-8に対する依存性がAMPA受容体のサブユニットに依存するかどうか評価したところ,いずれのサブユニット,GluA1,GluA2,GluA3,GluA4においてもTARPγ-8に選択的に抑制された.
生体に存在するAMPA受容体はGluA2を含むヘテロマーである6).LY3130481は海馬に存在するTARPγ-8を含むGluA1とGluA2からなるヘテロマーを抑制した.さらに,海馬のAMPA受容体に対しTARPγ-8とともにはたらくCNIH-2 5,7) 存在のもとでも,LY3130481はこれをTARPγ-8に選択的に阻害した.それでは,TARPγ-8に対する選択性は分子レベルにおいてどのように実現されているのだろうか.互いにもっとも近縁でありながらLY3130481に対する感受性の異なるTARPγ-8とTARPγ-4のキメラを系統的に作製し,GluA1と共発現させてグルタミン酸に対する応答についてLY3130481の50%阻害濃度を測定した.その結果,TARPγ-8の3番目の膜貫通領域および4番目の膜貫通領域が重要であり,点変異を導入した結果,3番目の膜貫通領域に存在するVla177および4番目の膜貫通領域に存在するGly210により選択性が決定されることが明らかにされた.
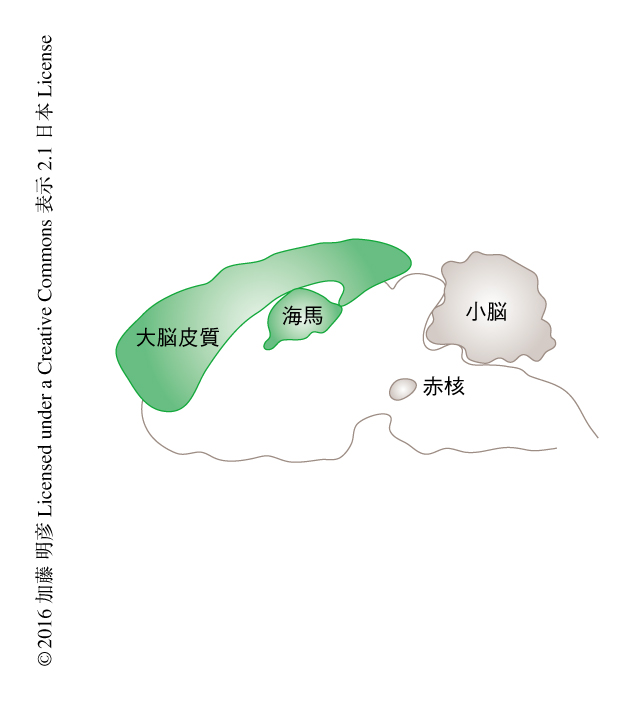
生体におけるAMPA受容体に対するLY3130481の作用について検討した.ラットの海馬,大脳皮質,小脳からニューロンを単離し,AMPA受容体のグルタミン酸に対する応答電流におよぼすLY3130481の効果について検討した.その結果,TARPγ-8の発現する海馬および大脳皮質のAMPA受容体はLY3130481により抑制されたのに対し,TARPγ-8の発現しない小脳のAMPA受容体は抑制されなかった.さらに,海馬および大脳皮質におけるグルタミン酸に対する応答電流の抑制がTARPγ-8に依存することがTARPγ-8ノックアウトマウスにおいて確認された.これらのことから,LY3130481は脳の領域に特異的なAMPA受容体のアンタゴニストであることが示された.
AMPA受容体の主要な機能は興奮性のシナプス伝達である.そこで,LY3130481がTARPγ-8を発現する海馬においてシナプス伝達を抑制するかどうかを,Shaffer側枝-CA1シナプスにおける細胞外記録により興奮性シナプス後場電位を測定して評価した.その結果,LY3130481は野生型のマウスにおいて興奮性シナプス後場電位を抑制した一方,TARPγ-8ノックアウトマウスにおいてはまったく抑制しなかったことより,LY3130481は興奮性のシナプス伝達をTARPγ-8に依存的に阻害することが明らかにされた.また,興奮性シナプス後場電位の阻害における50%阻害濃度は組換え体において測定された値とよく一致した.
全身性に投与されたLY3130481が活性をもつかどうか評価した.麻酔をしたラットの海馬CA1領域に複数のガラス管が束になっている微小ピペットを挿し込み,おのおののガラス管にAMPA溶液,NMDA溶液,細胞外記録用溶液をそれぞれ満たし,AMPAとNMDAを交互に投与して,その際に誘起される電位の変化を細胞外記録した.AMPAあるいはNMDAのいずれの投与によっても一過性の活動電位が記録されたが,LY3130481を静脈より投与するとAMPAにより誘導される活動電位のみが用量に依存的に減少し,NMDAにより誘導される活動電位は影響されなかった.一方,TARPγ-8が発現しない赤核においては,LY3130481はAMPAあるいはNMDAにより誘導される活動電位に影響を及ぼさなかった.以上のことから,全身性に投与されたLY3130481も脳の領域に特異的なAMPA受容体の阻害活性を示すことが明らかにされた.
LY3130481は前脳においてニューロンの興奮性を抑制したことから,海馬などを起源とするてんかんへの効用を期待し,てんかんモデルにおいてその効果を評価した.ラットにGABAA受容体のアンタゴニストであるペンチレンテトラゾールを投与するとけいれん発作が生じるが,LY3130481を事前に経口投与しておくことによりけいれん発作は効果的に抑制された.一方,TARPに非依存的なAMPA受容体のアンタゴニストの投与により観察される運動障害は,最大用量のLY3130481の投与でも観察されなかった.ペンチレンテトラゾールにより誘導されるけいれん発作のLY3130481による抑制がTARPγ-8に依存することは,けいれんの抑制活性がTARPγ-8ノックアウトマウスにおいて完全に失われることにより確認された.さらに,けいれんの抑制活性はペンチレンテトラゾールにより誘導されるてんかんモデルにかぎらず,複数のてんかんモデルに対して効果があった.
今後の臨床への応用の可能性を探るため,LY3130481がヒトのAMPA受容体に対しても脳の領域に特異的に作用するかどうか評価するため,ヒトの海馬および小脳の凍結試料から膜画分を調製しアフリカツメガエルの卵母細胞に注入した.膜画分は卵母細胞の細胞膜に融合して取り込まれ,外来性の膜画分に含まれるイオンチャネルの機能を電気生理学的に評価することができる8).この系を用いてAMPA受容体の機能を評価した結果,LY3130481は海馬においてAMPA受容体の機能を抑制するが,小脳においてはAMPA受容体の機能に影響しないという,ラットおよびマウスと一貫した結果が得られた(図1).
この研究は,知るかぎり,主要サブユニットと補助サブユニットとの特定の組合せのみ効果を示す化合物をスクリーニングした最初の例である.これまでにも,補助サブユニットと結合する化合物として上市されている薬剤はいくつかあるが9),これらの薬剤は補助サブユニットと結合する化合物を意図したスクリーニングにより得られたわけではなく,また,神経回路を特異的に制御することを意図したわけでもない.神経伝達物質の受容体の多くは補助サブユニットをもち,現在も,補助サブユニットの同定は進んでいる2,10).
筆者らは,この研究には2つの概念的な新規性が含まれると考えている.内在性のタンパク質の組み合わせることにより神経回路をより効果的かつ低副作用で修飾する新規の化合物を得たこと,枯渇ぎみの薬剤の標的に対し主要サブユニットと補助サブユニットとの組合せを用いることにより新たな次元をくわえられる可能性を示唆したこと,である.この研究における化合物のスクリーニングの戦略はAMPA受容体にとどまらず,ほかの補助サブユニットを含む神経伝達物質の受容体にも応用できるかもしれず,さらなる応用性を示唆するのかもしれない.
Schwenk, J., Harmel, N., Brechet, A. et al.: High-resolution proteomics unravel architecture and molecular diversity of native AMPA receptor complexes. Neuron, 74, 621-633 (2012)[PubMed]
Jackson, A. C. & Nicoll, R. A.: The expanding social network of ionotropic glutamate receptors: TARPs and other transmembrane auxiliary subunits. Neuron, 70, 178-199 (2011)[PubMed]
Kato, A. S., Gill, M. B., Yu, H. et al.: TARPs differentially decorate AMPA receptors to specify neuropharmacology. Trends Neurosci., 33, 241-248 (2010)[PubMed]
Tomita, S., Chen, L., Kawasaki, Y. et al.: Functional studies and distribution define a family of transmembrane AMPA receptor regulatory proteins. J. Cell Biol., 161, 805-816 (2003)[PubMed]
Schwenk, J., Harmel, N., Zolles, G. et al.: Functional proteomics identify cornichon proteins as auxiliary subunits of AMPA receptors. Science, 323, 1313-1319 (2009)[PubMed]
Geiger, J. R., Melcher, T., Koh, D. S. et al.: Relative abundance of subunit mRNAs determines gating and Ca2+ permeability of AMPA receptors in principal neurons and interneurons in rat CNS. Neuron, 15, 193-204 (1995)[PubMed]
Kato, A. S., Gill, M. B., Ho, M. T. et al.: Hippocampal AMPA receptor gating controlled by both TARP and cornichon proteins. Neuron, 68, 1082-1096 (2010)[PubMed] [新着論文レビュー]
Miledi, R., Eusebi, F., Martinez-Torres, A. et al.: Expression of functional neurotransmitter receptors in Xenopus oocytes after injection of human brain membranes. Proc. Natl. Acad. Sci. USA, 99, 13238-13242 (2002)[PubMed]
Kato, A. S. & Bredt, D. S.: Pharmacological regulation of ion channels by auxiliary subunits. Curr. Opin. Drug Discov. Devel., 10, 565-572 (2007)[PubMed]
Tomita, S. & Castillo, P. E.: Neto1 and Neto2: auxiliary subunits that determine key properties of native kainate receptors. J. Physiol., 590, 2217-2223 (2012)[PubMed]
略歴:1995年 東京大学大学院理学系研究科博士課程 修了,三菱化学生命科学研究所 特別研究員,1997年 九州大学大学院理学研究院 助手,2002年 米国California大学San Francisco校Postdoc,2005年 米国Eli Lilly and CompanyにてPostdocを経て,2009年より同Research Scientist.
研究テーマ:脳の機能の根幹をつかさどるシナプス伝達の重要かつ詳細な分子機構.
抱負:このテーマから得られる研究の成果は,われわれの脳のしくみを知る喜びを共有するという基礎研究における貢献にくわえ,新しい創薬の可能性を開くものだと考えています.脳科学にかぎりませんが,自然界には多くの謎があります.永年にわたり解き明かされていなかった謎をひとつでも解決することができればと思っています.
© 2016 加藤 明彦 Licensed under CC 表示 2.1 日本
(米国Eli Lilly and Company,Neuroscience Discovery)
email:加藤明彦
DOI: 10.7875/first.author.2016.120
Forebrain-selective AMPA-receptor antagonism guided by TARPγ-8 as an antiepileptic mechanism.
Akihiko S. Kato, Kevin D. Burris, Kevin M. Gardinier, Douglas L. Gernert, Warren J. Porter, Jon Reel, Chunjin Ding, Yuan Tu, Douglas A. Schober, Matthew R. Lee, Beverly A. Heinz, Thomas E. Fitch, Scott D. Gleason, John T. Catlow, Hong Yu, Stephen M. Fitzjohn, Francesca Pasqui, He Wang, Yuewei Qian, Emanuele Sher, Ruud Zwart, Keith A. Wafford, Kurt Rasmussen, Paul L. Ornstein, John T. R Isaac, Eric S. Nisenbaum, David S. Bredt, Jeffrey M. Witkin
Nature Medicine, 22, 1496-1501 (2016)
要 約
AMPA受容体は興奮性のシナプス伝達の根幹を担うイオン透過型のグルタミン酸受容体である.AMPA受容体のアンタゴニストは効果的な抗てんかん薬になりうるが,AMPA受容体は神経系に普遍的に存在するため,副作用として運動障害や過剰な鎮静状態をひき起こす.筆者らは,前脳に特異的に発現するAMPA受容体の補助サブユニットであるTARPγ-8を含むAMPA受容体のみを阻害し,それ以外のAMPA受容体には効果のない化合物を発見した.この化合物のTARPγ-8への依存性は膜貫通ドメインに存在する2つのユニークなアミノ酸残基により決定されていた.この化合物はTARPγ-8の発現する海馬および大脳皮質においてAMPA受容体の活性を抑制したが,TARPγ-8の発現しない小脳のプルキンエ細胞においてはAMPA受容体の活性に影響せず,さらに,これまでのTARPに非依存的なAMPA受容体のアンタゴニストとは異なり,マウスおよびラットのいくつかのてんかんモデルを副作用なしに効果的に抑制した.主要サブユニットと補助サブユニットとの組合せを用いた神経回路に特異的な修飾は,より効果的かつ副作用の少ない新薬の開発の戦略となりうるだろう.
はじめに
神経回路の薬理学的な修飾の理想は,病的な状態にある神経回路にのみ作用し,正常な状態にあるほかの神経回路には影響しないことである.この考え方は,抗がん剤の理想を連想させる.すなわち,がん細胞のみを死滅させ正常な細胞には影響しない抗がん剤が望まれるのと同じである.モデル生物において,脳の領域あるいは時期に特異的な神経回路の修飾は光遺伝学的あるいは化学遺伝学的な手法によりかなり厳密に行うことができる.しかしながら,これらの方法は侵襲性であり,外来性のタンパク質を発現させる必要があるためヒトの医療に応用するには敷居が高い.そこで,脳の領域に特異的な神経回路の修飾を,領域に特異的に発現する内在性のタンパク質を活用することにより実現することを考えた.
これまで,筆者らは,哺乳動物において興奮性のシナプス伝達に決定的な役割をはたすイオン透過性のグルタミン酸受容体であるAMPA受容体について研究してきた.生体においてAMPA受容体は補助サブユニットと結合しており1),いくつかの補助サブユニットはAMPA受容体の性質を大きく変化させることが報告されている.とくに,TARPファミリーはAMPA受容体の輸送および局在,物理的な特性,薬理学的な特性を劇的に変化させることが明らかにされている2).
哺乳類のゲノムにはTARPと相同性をもつ8つの遺伝子が同定されており,そのうち6つはAMPA受容体の機能を修飾する2,3).さらに,進化的により保存されている4つ,TARPγ-2,TARPγ-3,TARPγ-4,TARPγ-8は機能的に似かよっており,AMPA受容体の機能の失われたTARPγ-2ノックアウトマウスの小脳の顆粒細胞において,外来性に発現させるとAMPA受容体の機能をレスキューすることができる4).これら4つはI型TARPと名づけられている3).I型TARPは脳における発現に領域の特異性があり,TARPγ-2は小脳,TARPγ-3は大脳皮質,TARPγ-4は発生の初期および線条体,TARPγ-8は前脳とくに海馬に多く発現する4).
1.AMPA受容体の機能を修飾する化合物を同定するためのハイスループットなスクリーニング系の構築
TARPγ-8のもつ薬理学的な特性および前脳に特異的な発現に注目し,TARPγ-8を含むAMPA受容体の機能を特異的に修飾する化合物のスクリーニングを試みた.ハイスループットなスクリーニング系の構築のため細胞内Ca2+濃度をハイスループットで測定できる装置を用い,Ca2+透過性のAMPA受容体サブユニットであるGluA1およびTARPを一過性に共発現したCHO-S細胞にCa2+指示薬を取り込ませて,AMPA受容体を介したCa2+の流入による細胞内Ca2+濃度の上昇を測定した.このとき,グルタミン酸の投与だけでは蛍光シグナルの十分な上昇が観察されなかったが,追加でグルタミン酸およびAMPA受容体の増強物質であるシクロチアジドを投与することにより,信頼性がありかつ十分な細胞内Ca2+濃度の上昇が得られた.AMPA受容体の既知のアンタゴニストであるGYKI,グルタミン酸,シクロチアジドを投与したところ,GluA1単独の発現,GluA1 + TARPγ-2の発現,GluA1 + TARPγ-8の発現のいずれの場合も,細胞内Ca2+濃度はまったく上昇しなかった.このことから,この系においてAMPA受容体のアンタゴニストを検出できることが示された.
この系を用いて十数万種の化合物をスクリーニングしたところ,GluA1 + TARPγ-8を抑制したものの,GluA1 + TARPγ-2あるいはGluA1単独を抑制しない複数の化合物が見い出された.最適化ののち得られたLY3130481(現在は,CERC-611とよばれている)は,既存の薬剤のいずれとも類似性のない化合物であった.
2.LY3130481はTARPγ-8を含むAMPA受容体に特異的に作用する
LY3130481の薬理学的な特性をより詳細に評価するため,AMPA受容体のグルタミン酸に対する応答電流について電気生理学的に検討した.TARPに対する依存性について網羅的に調べたところ,LY3130481はGluA1 + TARPγ-8を50%阻害濃度16 nMという低い濃度で抑制したのに対し,TARPγ-8ともっとも相同性の高いTARPγ-4でも100倍以上も高い50%阻害濃度を示し,それ以外のTARPはGluA1をほとんど抑制しなかった.LY3130481はGluA1が単独のときには抑制せず,GluA1と別のファミリーのAMPA受容体の補助サブユニットであるCNIH-2 5) を共発現させたときも抑制しなかった.LY3130481のTARPγ-8に対する依存性がAMPA受容体のサブユニットに依存するかどうか評価したところ,いずれのサブユニット,GluA1,GluA2,GluA3,GluA4においてもTARPγ-8に選択的に抑制された.
生体に存在するAMPA受容体はGluA2を含むヘテロマーである6).LY3130481は海馬に存在するTARPγ-8を含むGluA1とGluA2からなるヘテロマーを抑制した.さらに,海馬のAMPA受容体に対しTARPγ-8とともにはたらくCNIH-2 5,7) 存在のもとでも,LY3130481はこれをTARPγ-8に選択的に阻害した.それでは,TARPγ-8に対する選択性は分子レベルにおいてどのように実現されているのだろうか.互いにもっとも近縁でありながらLY3130481に対する感受性の異なるTARPγ-8とTARPγ-4のキメラを系統的に作製し,GluA1と共発現させてグルタミン酸に対する応答についてLY3130481の50%阻害濃度を測定した.その結果,TARPγ-8の3番目の膜貫通領域および4番目の膜貫通領域が重要であり,点変異を導入した結果,3番目の膜貫通領域に存在するVla177および4番目の膜貫通領域に存在するGly210により選択性が決定されることが明らかにされた.
3.LY310481はTARPγ-8の発現する脳の領域に特異的にはたらくAMPA受容体のアンタゴニストである
生体におけるAMPA受容体に対するLY3130481の作用について検討した.ラットの海馬,大脳皮質,小脳からニューロンを単離し,AMPA受容体のグルタミン酸に対する応答電流におよぼすLY3130481の効果について検討した.その結果,TARPγ-8の発現する海馬および大脳皮質のAMPA受容体はLY3130481により抑制されたのに対し,TARPγ-8の発現しない小脳のAMPA受容体は抑制されなかった.さらに,海馬および大脳皮質におけるグルタミン酸に対する応答電流の抑制がTARPγ-8に依存することがTARPγ-8ノックアウトマウスにおいて確認された.これらのことから,LY3130481は脳の領域に特異的なAMPA受容体のアンタゴニストであることが示された.
AMPA受容体の主要な機能は興奮性のシナプス伝達である.そこで,LY3130481がTARPγ-8を発現する海馬においてシナプス伝達を抑制するかどうかを,Shaffer側枝-CA1シナプスにおける細胞外記録により興奮性シナプス後場電位を測定して評価した.その結果,LY3130481は野生型のマウスにおいて興奮性シナプス後場電位を抑制した一方,TARPγ-8ノックアウトマウスにおいてはまったく抑制しなかったことより,LY3130481は興奮性のシナプス伝達をTARPγ-8に依存的に阻害することが明らかにされた.また,興奮性シナプス後場電位の阻害における50%阻害濃度は組換え体において測定された値とよく一致した.
全身性に投与されたLY3130481が活性をもつかどうか評価した.麻酔をしたラットの海馬CA1領域に複数のガラス管が束になっている微小ピペットを挿し込み,おのおののガラス管にAMPA溶液,NMDA溶液,細胞外記録用溶液をそれぞれ満たし,AMPAとNMDAを交互に投与して,その際に誘起される電位の変化を細胞外記録した.AMPAあるいはNMDAのいずれの投与によっても一過性の活動電位が記録されたが,LY3130481を静脈より投与するとAMPAにより誘導される活動電位のみが用量に依存的に減少し,NMDAにより誘導される活動電位は影響されなかった.一方,TARPγ-8が発現しない赤核においては,LY3130481はAMPAあるいはNMDAにより誘導される活動電位に影響を及ぼさなかった.以上のことから,全身性に投与されたLY3130481も脳の領域に特異的なAMPA受容体の阻害活性を示すことが明らかにされた.
4.LY310481は複数のてんかんモデルに有効であり運動障害の副作用はみられない
LY3130481は前脳においてニューロンの興奮性を抑制したことから,海馬などを起源とするてんかんへの効用を期待し,てんかんモデルにおいてその効果を評価した.ラットにGABAA受容体のアンタゴニストであるペンチレンテトラゾールを投与するとけいれん発作が生じるが,LY3130481を事前に経口投与しておくことによりけいれん発作は効果的に抑制された.一方,TARPに非依存的なAMPA受容体のアンタゴニストの投与により観察される運動障害は,最大用量のLY3130481の投与でも観察されなかった.ペンチレンテトラゾールにより誘導されるけいれん発作のLY3130481による抑制がTARPγ-8に依存することは,けいれんの抑制活性がTARPγ-8ノックアウトマウスにおいて完全に失われることにより確認された.さらに,けいれんの抑制活性はペンチレンテトラゾールにより誘導されるてんかんモデルにかぎらず,複数のてんかんモデルに対して効果があった.
今後の臨床への応用の可能性を探るため,LY3130481がヒトのAMPA受容体に対しても脳の領域に特異的に作用するかどうか評価するため,ヒトの海馬および小脳の凍結試料から膜画分を調製しアフリカツメガエルの卵母細胞に注入した.膜画分は卵母細胞の細胞膜に融合して取り込まれ,外来性の膜画分に含まれるイオンチャネルの機能を電気生理学的に評価することができる8).この系を用いてAMPA受容体の機能を評価した結果,LY3130481は海馬においてAMPA受容体の機能を抑制するが,小脳においてはAMPA受容体の機能に影響しないという,ラットおよびマウスと一貫した結果が得られた(図1).
おわりに
この研究は,知るかぎり,主要サブユニットと補助サブユニットとの特定の組合せのみ効果を示す化合物をスクリーニングした最初の例である.これまでにも,補助サブユニットと結合する化合物として上市されている薬剤はいくつかあるが9),これらの薬剤は補助サブユニットと結合する化合物を意図したスクリーニングにより得られたわけではなく,また,神経回路を特異的に制御することを意図したわけでもない.神経伝達物質の受容体の多くは補助サブユニットをもち,現在も,補助サブユニットの同定は進んでいる2,10).
筆者らは,この研究には2つの概念的な新規性が含まれると考えている.内在性のタンパク質の組み合わせることにより神経回路をより効果的かつ低副作用で修飾する新規の化合物を得たこと,枯渇ぎみの薬剤の標的に対し主要サブユニットと補助サブユニットとの組合せを用いることにより新たな次元をくわえられる可能性を示唆したこと,である.この研究における化合物のスクリーニングの戦略はAMPA受容体にとどまらず,ほかの補助サブユニットを含む神経伝達物質の受容体にも応用できるかもしれず,さらなる応用性を示唆するのかもしれない.
文 献
著者プロフィール
略歴:1995年 東京大学大学院理学系研究科博士課程 修了,三菱化学生命科学研究所 特別研究員,1997年 九州大学大学院理学研究院 助手,2002年 米国California大学San Francisco校Postdoc,2005年 米国Eli Lilly and CompanyにてPostdocを経て,2009年より同Research Scientist.
研究テーマ:脳の機能の根幹をつかさどるシナプス伝達の重要かつ詳細な分子機構.
抱負:このテーマから得られる研究の成果は,われわれの脳のしくみを知る喜びを共有するという基礎研究における貢献にくわえ,新しい創薬の可能性を開くものだと考えています.脳科学にかぎりませんが,自然界には多くの謎があります.永年にわたり解き明かされていなかった謎をひとつでも解決することができればと思っています.
© 2016 加藤 明彦 Licensed under CC 表示 2.1 日本