2つのヒストンリン酸化修飾が染色体の2方向性結合の確立に寄与する
山岸有哉・本田貴史・渡邊嘉典
(東京大学分子細胞生物学研究所 染色体動態研究分野)
email:山岸有哉
DOI: 10.7875/first.author.2010.052
Two histone marks establish the inner centromere and chromosome bi-orientation.
Yuya Yamagishi, Takashi Honda, Yuji Tanno, Yoshinori Watanabe
Science, 330, 239-243 (2010)
細胞が分裂する際,複製された姉妹染色分体は動原体が両極から伸びるスピンドル微小管によりそれぞれ反対方向からとらえられることで正確に娘細胞へと分配される.染色体パッセンジャー複合体は姉妹動原体のあいだのインナーセントロメアとよばれる領域に局在し,スピンドル微小管と動原体とのあいだの誤った結合を特異的に不安定化することによって染色体の正しい2方向性結合の確立に必須の役割を担っている.しかし,インナーセントロメアを規定する分子機構は不明であり,染色体パッセンジャー複合体のインナーセントロメアへの局在化機構の詳細もよくわかっていなかった.今回,筆者らは,保存されたキナーゼであるHaspinによるヒストンH3のリン酸化と,同じく保存されたキナーゼであるBub1によるヒストンH2Aのリン酸化とが協調してはたらくことで,染色体パッセンジャー複合体をインナーセントロメアへと局在させていることを明らかにした.さらに,この2つのヒストンリン酸化修飾の交差する部分がインナーセントロメアを規定していることを提唱した.
細胞分裂の際に姉妹染色分体を娘細胞に正確に分配することは生物の増殖や発生に必須であり,染色体分配にミスが起こると,体細胞においては細胞死や細胞のがん化をひき起こし,生殖細胞においては先天性異常や流産の原因となる.そのため,細胞は正確に姉妹染色体を分配するためにさまざまな機構を備えている,そのひとつが,染色体パッセンジャー複合体(chromosomal passenger complex:CPC)による動原体とスピンドル微小管とのあいだの誤った結合の修正である.染色体パッセンジャー複合体はAurora B,Survivin,Borealin,INCENPという進化的に保存された4つのタンパク質からなる複合体であり,分裂前中期から分裂中期にかけて姉妹動原体のあいだのインナーセントロメアに局在し,分裂期に頻繁に生じる動原体とスピンドル微小管とのあいだの誤った結合を特異的に不安定化することによりこれを修正して2方向性結合の確立を促す1,2).染色体パッセンジャー複合体がこの機能を行うためにはインナーセントロメアに局在することが必須である.その局在化については,以前の筆者らのグループによる研究から,Shugoshin(Sgo)とよばれるタンパク質がBub1によるヒストンH2Aのリン酸化に依存してインナーセントロメアに局在し,染色体パッセンジャー複合体の構成タンパク質と直接に結合することでインナーセントロメアへと局在させる,という機構が明らかになっていた3,4).しかし,Shugoshinに依存しない機構の存在することもわかっており,染色体パッセンジャー複合体のインナーセントロメアへの局在化機構については未解明の部分が多かった.さらに,インナーセントロメアはShugoshinや染色体パッセンジャー複合体など染色体分配に必須の役割をなすタンパク質が局在する領域であるが,その領域を規定する分子機構についてはわかっていなかった.今回,筆者らは,分裂酵母とヒト培養細胞を用いてこれらの機構の一端を明らかにした.
Haspinは酵母からヒトにまで保存されたキナーゼであり,ヒト培養細胞においてヒストンH3の3番目のThr残基をリン酸化することが知られていた5).さらに,ヒト培養細胞におけるノックダウン実験からHaspinは正確な染色体分配に必要であることがわかっていたが,その分子機構はよくわかっていなかった.そこで,分裂酵母のHaspinホモログHrk1の解析をとおしてHaspinの分子機能の解明を試みた.はじめに,hrk1遺伝子破壊株を作製したところ染色体分配のミスを起こし,さらに,染色体パッセンジャー複合体のセントロメアへの局在を促進するsgo2遺伝子との二重破壊株は増殖に著しい欠損を示した.その原因を探るため,hrk1遺伝子破壊株における染色体パッセンジャー複合体のセントロメアへの局在を観察したところその局在は減少しており,sgo2遺伝子との二重破壊株においては染色体パッセンジャー複合体のセントロメアへの局在はほぼ完全に消失していた.これらの結果から,分裂酵母のHaspinホモログHrk1は染色体パッセンジャー複合体のセントロメアへの局在を促進する機能をもつことが明らかになった.
また,ヒト培養細胞においてもHaspinをRNAiによりノックダウンすると染色体パッセンジャー複合体のセントロメアへの局在が失われたことから,Haspinによる染色体パッセンジャー複合体の局在制御は種をこえて保存されているものと考えられた.
つぎに,Hrk1によるヒストンH3の3番目のThr残基のリン酸化がこの機能に必要であるかどうかを調べるため,分裂酵母に3つ存在するヒストンH3の遺伝子について3番目のスレオニン残基がすべて非リン酸化型のアラニン残基に置換されるようにした変異株h3-TA株を作製した.このh3-TA株ではhrk1遺伝子破壊株と同様に染色体分配に異常を生じ染色体パッセンジャー複合体のセントロメアへの局在が減少していた.さらに,sgo2遺伝子破壊株との二重変異株では染色体パッセンジャー複合体のセントロメアへの局在はほぼ完全に消失し著しい生育欠損を示した.以上のことから,Hrk1はヒストンH3の3番目のThr残基をリン酸化することによって,Sgo2とは独立に染色体パッセンジャー複合体のセントロメアへの局在を制御していることが示唆された.
ヒストンH3の3番目のThr残基のリン酸化はどのような分子機構で染色体パッセンジャー複合体をセントロメアへと局在化させるのだろうか? ヒト培養細胞においてこのリン酸化は染色体パッセンジャー複合体が局在するセントロメア領域に観察されることから,染色体パッセンジャー複合体とリン酸化ヒストンH3とが直接に結合する可能性が考えられた.これを確かめるため,in vitroプルダウンアッセイによりヒストンH3と染色体パッセンジャー複合体の構成タンパク質との相互作用を検討したところ,HaspinによるヒストンH3のリン酸化がSurvivinとヒストンH3との結合を促進することがわかった.また,この相互作用は染色体パッセンジャー複合体のセントロメアへの局在に機能することが知られるSurvivinのBIRドメインに変異を導入することで失われたことから,SurvivinはBIRドメインを介してリン酸化ヒストンH3と結合するものと考えられた.さらに重要なことに,リン酸化ヒストンH3との結合能を失ったSurvivinはHeLa細胞においてセントロメアに局在できなかった.これらの結果から,HaspinによるヒストンH3の3番目のThr残基のリン酸化はSurvivinとヒストンH3との相互作用を促進することにより染色体パッセンジャー複合体をセントロメアに局在させているものと考えられた.
Haspinによってリン酸化されたヒストンH3がSurvivinと直接に相互作用することにより染色体パッセンジャー複合体がインナーセントロメアへと局在化することから,HaspinによるヒストンH3のリン酸化はインナーセントロメアにおいて特異的に起こっている可能性が考えられた.これを確かめるため,クロマチン免疫沈降法により分裂酵母の染色体のどの部分でヒストンH3の3番目のThr残基のリン酸化が起こっているかを調べたところ,インナーセントロメアにあたる部分だけではなく分裂酵母の染色体に3つ存在するヘテロクロマチン領域においてこのリン酸化が起こっていることが明らかになった.さらに,このリン酸化はヘテロクロマチンタンパク質Swi6に依存して起こっていることもわかった.つづいて,Hrk1の染色体における局在を調べたところ,Hrk1はSwi6に依存してヘテロクロマチン領域に局在していた.これらのことから,Hrk1はヘテロクロマチンタンパク質Swi6に依存してインナーセントロメアを含むヘテロクロマチン領域に局在しヒストンH3をリン酸化していることが明らかになった.
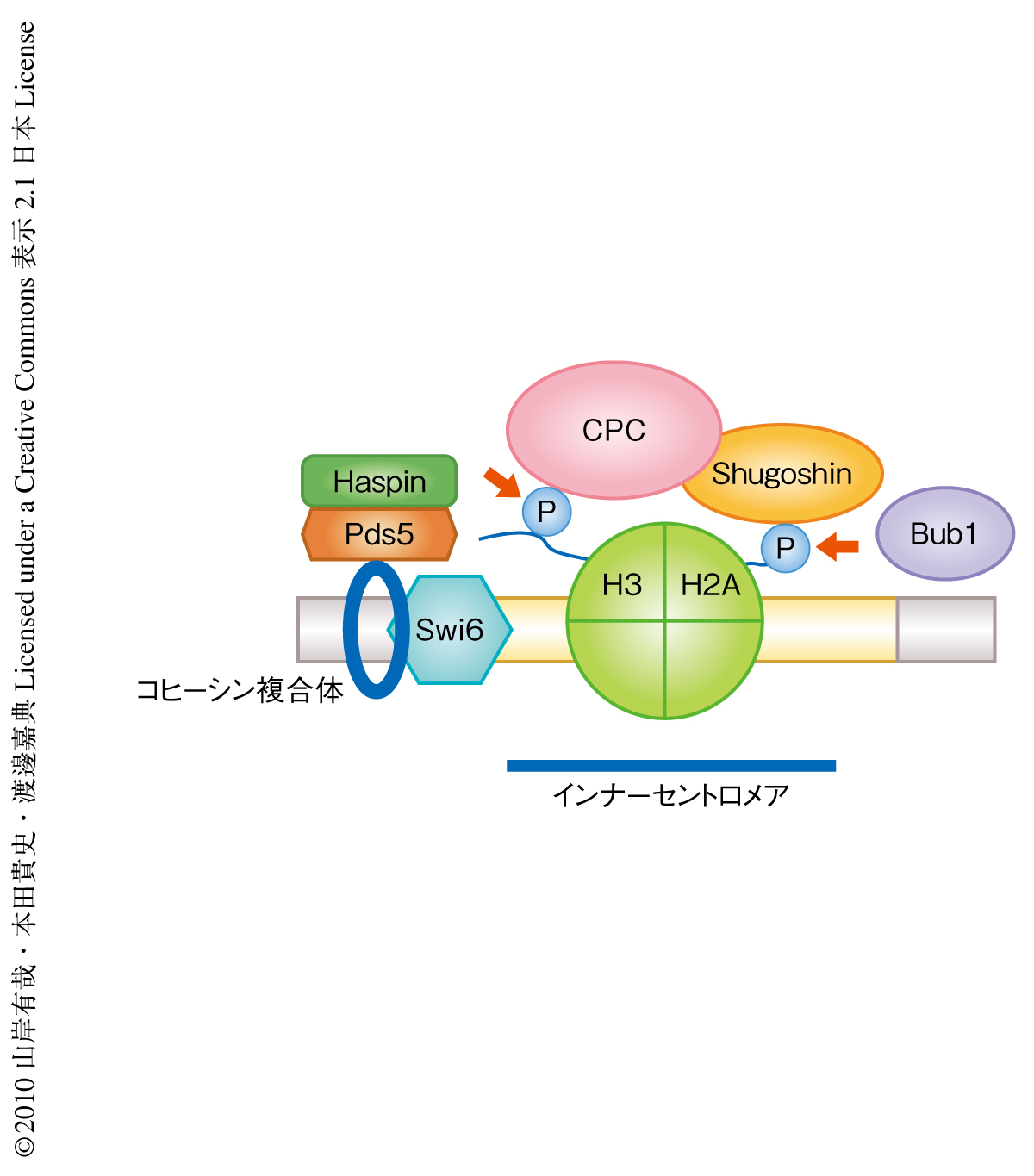
分裂酵母においては複製した姉妹染色分体をつなぐ役割をはたすコヒーシン複合体が,Swi6に依存してヘテロクロマチン領域に濃縮することが知られている6).さらに,いくつかのモデル生物においてこのコヒーシン複合体が染色体パッセンジャー複合体のセントロメアへの局在に必要であることもわかっていた7,8).そこで,このコヒーシン複合体の濃縮がHrk1のヘテロクロマチン領域への局在化に必要である可能性を考え,コヒーシン複合体およびコヒーシン複合体と相互作用するタンパク質とHrk1との相互作用を酵母ツーハイブリッド法により調べたところ,コヒーシン複合体と相互作用するタンパク質Pds5がHrk1と結合することがわかった.興味深いことに,pds5遺伝子破壊株ではHrk1の染色体への局在,および,ヒストンH3の3番目のThr残基のリン酸化が完全に消失していた.これらの解析から,Hrk1はPds5との相互作用を介してインナーセントロメア部分を含む染色体に局在していることが明らかになった(図1).
Swi6-Pds5-Hrk1-ヒストンH3という経路が,以前の研究で明らかになっていたBub1-ヒストンH2A-Sgo2という経路とは独立に染色体パッセンジャー複合体のセントロメアへの局在を促進するとすれば(図1),染色体パッセンジャー複合体のセントロメアへの局在は,HaspinによるヒストンH3のリン酸化と,Bub1によるヒストンH2Aのリン酸化という2つのヒストンリン酸化修飾によって制御されていることになる.このモデルと一致することとして,すべてのヒストンH3を非リン酸化型とした変異株h3-TA株と,すべてのヒストンH2Aを非リン酸化型とした変異株h2a-SA株とを組み合わせた二重変異株h3-TA h2a-SA株においては,染色体パッセンジャー複合体のセントロメアへの局在はほぼ完全に消失し細胞は著しい染色体分配の異常を示した.もし,この異常が染色体パッセンジャー複合体のセントロメアへの局在が失われたことによってひき起こされているとすれば,このh3-TA h2a-SA株において染色体パッセンジャー複合体を人為的にセントロメアへ局在化させれば異常が抑圧されるものと考えられる.実際,染色体パッセンジャー複合体の構成タンパク質のひとつBir1(分裂酵母Survivinホモログ)にクロモドメイン(ヘテロクロマチン領域に結合するドメイン)を融合させたタンパク質をh3-TA h2a-SA株に発現させると染色体分配の異常が抑圧された.
つぎに,クロマチン免疫沈降法を用いて,染色体におけるヒストンH3の3番目のThr残基のリン酸化部位とヒストンH2Aの121番目のSer残基のリン酸化部位,そして,染色体パッセンジャー複合体の局在部位を詳細に検討した.その結果,ヒストンH3の3番目のThr残基のリン酸化はインナーセントロメアを含む3つのヘテロクロマチン領域において,ヒストンH2Aの121番目のSer残基のリン酸化は動原体の形成領域およびインナーセントロメア領域において起こっており,染色体パッセンジャー複合体はこの2つのヒストンリン酸化修飾がともに起こっているインナーセントロメア領域に濃縮して局在していることが示された.
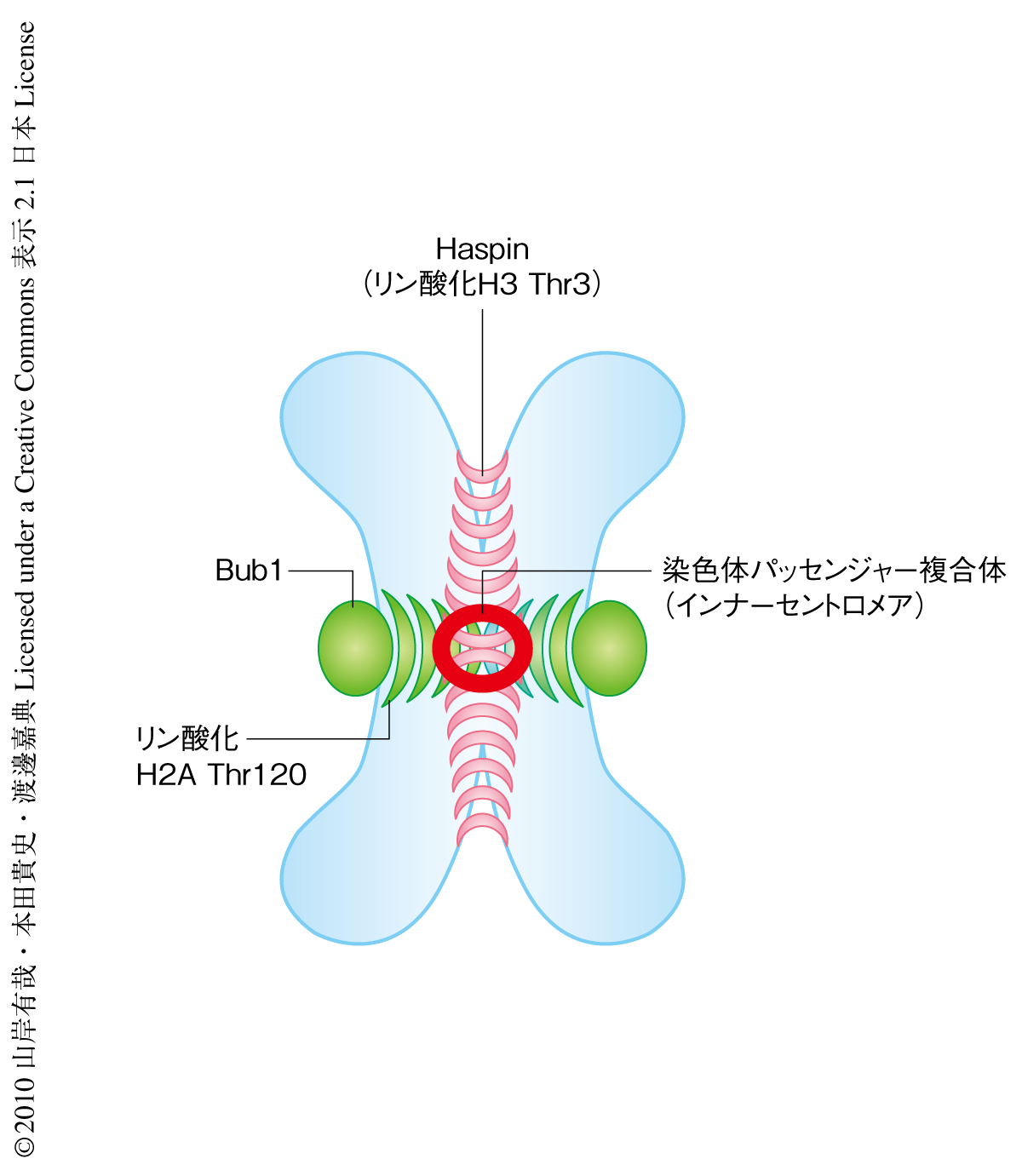
動原体に局在するBub1によるヒストンH2Aの120番目のThr残基(分裂酵母の121番目のSer残基に相当)のリン酸化と,コヒーシン複合体(Pds5)とともに姉妹染色分体のあいだに局在するHaspinによるヒストンH3の3番目のThr残基のリン酸化とが協調的にはたらくことで,インナーセントロメアが規定されている.では,互いに異なる局在を示すキナーゼによる2つのヒストンのリン酸化修飾は,実際の染色体において空間的にはどのような位置関係にあるのだろうか? また,これらのリン酸化はいかにしてインナーセントロメアを規定しているのだろうか? この疑問に答えるため,分裂期のHeLa細胞の染色体における2つのヒストンのリン酸化修飾の部位と染色体パッセンジャー複合体の局在位置とを詳細に観察した.その結果,ヒストンH2Aの120番目のThr残基のリン酸化が姉妹動原体ペアをつなぐように伸びたシグナルとして観察されたのに対し,ヒストンH3の3番目のThr残基のリン酸化はヒストンH2Aの120番目のThr残基のリン酸化と直交するように姉妹染色分体のあいだに観察された.興味深いことに,染色体パッセンジャー複合体は両者が交差する領域に局在していた(図2).この結果から,インナーセントロメアが動原体とコヒーシン複合体とに依存した2つのヒストンのリン酸化修飾が交わる部分として空間的に規定されていることがヒトの細胞においても明らかになった.
今回の研究によって,これまで不明であったHaspinの分子機能が明らかになるとともに,最近,筆者らのグループが明らかにした染色体パッセンジャー複合体の時期特異的なセントロメアへの局在化機構とあわせて9)(新着論文レビュー でも掲載),染色体パッセンジャー複合体のインナーセントロメアへの局在化機構のほぼ全容が明らかになったといえる.このHaspinとBub1という2つのキナーゼによる2つのヒストンリン酸化を介した染色体パッセンジャー複合体の局在化機構は分裂酵母からヒトにまで高度に保存された機構であり,ヒストンという染色体の根本をなすタンパク質のリン酸化修飾を介して制御されている点で非常に興味深い.さらに,今回の研究は,いままではっきりとしていなかった染色体のインナーセントロメアという領域がヒストンH3とヒストンH2Aの2つのヒストンのリン酸化の交わりとして明確に定義できることを提唱することができたという点においても,今後の研究の基盤をなすものであると考えている.
略歴:東京大学大学院理学系研究科博士課程 在籍中.
研究テーマ:セントロメアに局在するタンパク質の機能および局在化機構の解析.
抱負:分裂酵母とヒトという一見まったく異なる生き物における染色体分配機構のあまりにきれいな進化的保存性に魅せられながら研究を行っている.これからも,このような進化的に保存された機構を分裂酵母の遺伝学をとっかかりとして明らかにしていけたらと考えている.
渡邊 嘉典(Yoshinori Watanabe)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/watanabe-lab/
© 2010 山岸有哉・本田貴史・渡邊嘉典 Licensed under CC 表示 2.1 日本
(東京大学分子細胞生物学研究所 染色体動態研究分野)
email:山岸有哉
DOI: 10.7875/first.author.2010.052
Two histone marks establish the inner centromere and chromosome bi-orientation.
Yuya Yamagishi, Takashi Honda, Yuji Tanno, Yoshinori Watanabe
Science, 330, 239-243 (2010)
要 約
細胞が分裂する際,複製された姉妹染色分体は動原体が両極から伸びるスピンドル微小管によりそれぞれ反対方向からとらえられることで正確に娘細胞へと分配される.染色体パッセンジャー複合体は姉妹動原体のあいだのインナーセントロメアとよばれる領域に局在し,スピンドル微小管と動原体とのあいだの誤った結合を特異的に不安定化することによって染色体の正しい2方向性結合の確立に必須の役割を担っている.しかし,インナーセントロメアを規定する分子機構は不明であり,染色体パッセンジャー複合体のインナーセントロメアへの局在化機構の詳細もよくわかっていなかった.今回,筆者らは,保存されたキナーゼであるHaspinによるヒストンH3のリン酸化と,同じく保存されたキナーゼであるBub1によるヒストンH2Aのリン酸化とが協調してはたらくことで,染色体パッセンジャー複合体をインナーセントロメアへと局在させていることを明らかにした.さらに,この2つのヒストンリン酸化修飾の交差する部分がインナーセントロメアを規定していることを提唱した.
はじめに
細胞分裂の際に姉妹染色分体を娘細胞に正確に分配することは生物の増殖や発生に必須であり,染色体分配にミスが起こると,体細胞においては細胞死や細胞のがん化をひき起こし,生殖細胞においては先天性異常や流産の原因となる.そのため,細胞は正確に姉妹染色体を分配するためにさまざまな機構を備えている,そのひとつが,染色体パッセンジャー複合体(chromosomal passenger complex:CPC)による動原体とスピンドル微小管とのあいだの誤った結合の修正である.染色体パッセンジャー複合体はAurora B,Survivin,Borealin,INCENPという進化的に保存された4つのタンパク質からなる複合体であり,分裂前中期から分裂中期にかけて姉妹動原体のあいだのインナーセントロメアに局在し,分裂期に頻繁に生じる動原体とスピンドル微小管とのあいだの誤った結合を特異的に不安定化することによりこれを修正して2方向性結合の確立を促す1,2).染色体パッセンジャー複合体がこの機能を行うためにはインナーセントロメアに局在することが必須である.その局在化については,以前の筆者らのグループによる研究から,Shugoshin(Sgo)とよばれるタンパク質がBub1によるヒストンH2Aのリン酸化に依存してインナーセントロメアに局在し,染色体パッセンジャー複合体の構成タンパク質と直接に結合することでインナーセントロメアへと局在させる,という機構が明らかになっていた3,4).しかし,Shugoshinに依存しない機構の存在することもわかっており,染色体パッセンジャー複合体のインナーセントロメアへの局在化機構については未解明の部分が多かった.さらに,インナーセントロメアはShugoshinや染色体パッセンジャー複合体など染色体分配に必須の役割をなすタンパク質が局在する領域であるが,その領域を規定する分子機構についてはわかっていなかった.今回,筆者らは,分裂酵母とヒト培養細胞を用いてこれらの機構の一端を明らかにした.
1.HaspinによるヒストンH3の3番目のThr残基のリン酸化は染色体パッセンジャー複合体のセントロメアへの局在を促進する
Haspinは酵母からヒトにまで保存されたキナーゼであり,ヒト培養細胞においてヒストンH3の3番目のThr残基をリン酸化することが知られていた5).さらに,ヒト培養細胞におけるノックダウン実験からHaspinは正確な染色体分配に必要であることがわかっていたが,その分子機構はよくわかっていなかった.そこで,分裂酵母のHaspinホモログHrk1の解析をとおしてHaspinの分子機能の解明を試みた.はじめに,hrk1遺伝子破壊株を作製したところ染色体分配のミスを起こし,さらに,染色体パッセンジャー複合体のセントロメアへの局在を促進するsgo2遺伝子との二重破壊株は増殖に著しい欠損を示した.その原因を探るため,hrk1遺伝子破壊株における染色体パッセンジャー複合体のセントロメアへの局在を観察したところその局在は減少しており,sgo2遺伝子との二重破壊株においては染色体パッセンジャー複合体のセントロメアへの局在はほぼ完全に消失していた.これらの結果から,分裂酵母のHaspinホモログHrk1は染色体パッセンジャー複合体のセントロメアへの局在を促進する機能をもつことが明らかになった.
また,ヒト培養細胞においてもHaspinをRNAiによりノックダウンすると染色体パッセンジャー複合体のセントロメアへの局在が失われたことから,Haspinによる染色体パッセンジャー複合体の局在制御は種をこえて保存されているものと考えられた.
つぎに,Hrk1によるヒストンH3の3番目のThr残基のリン酸化がこの機能に必要であるかどうかを調べるため,分裂酵母に3つ存在するヒストンH3の遺伝子について3番目のスレオニン残基がすべて非リン酸化型のアラニン残基に置換されるようにした変異株h3-TA株を作製した.このh3-TA株ではhrk1遺伝子破壊株と同様に染色体分配に異常を生じ染色体パッセンジャー複合体のセントロメアへの局在が減少していた.さらに,sgo2遺伝子破壊株との二重変異株では染色体パッセンジャー複合体のセントロメアへの局在はほぼ完全に消失し著しい生育欠損を示した.以上のことから,Hrk1はヒストンH3の3番目のThr残基をリン酸化することによって,Sgo2とは独立に染色体パッセンジャー複合体のセントロメアへの局在を制御していることが示唆された.
2.SurvivinはHaspinによりリン酸化されたヒストンH3に結合する
ヒストンH3の3番目のThr残基のリン酸化はどのような分子機構で染色体パッセンジャー複合体をセントロメアへと局在化させるのだろうか? ヒト培養細胞においてこのリン酸化は染色体パッセンジャー複合体が局在するセントロメア領域に観察されることから,染色体パッセンジャー複合体とリン酸化ヒストンH3とが直接に結合する可能性が考えられた.これを確かめるため,in vitroプルダウンアッセイによりヒストンH3と染色体パッセンジャー複合体の構成タンパク質との相互作用を検討したところ,HaspinによるヒストンH3のリン酸化がSurvivinとヒストンH3との結合を促進することがわかった.また,この相互作用は染色体パッセンジャー複合体のセントロメアへの局在に機能することが知られるSurvivinのBIRドメインに変異を導入することで失われたことから,SurvivinはBIRドメインを介してリン酸化ヒストンH3と結合するものと考えられた.さらに重要なことに,リン酸化ヒストンH3との結合能を失ったSurvivinはHeLa細胞においてセントロメアに局在できなかった.これらの結果から,HaspinによるヒストンH3の3番目のThr残基のリン酸化はSurvivinとヒストンH3との相互作用を促進することにより染色体パッセンジャー複合体をセントロメアに局在させているものと考えられた.
3.Hrk1はPds5との相互作用を介してセントロメア領域に局在する
Haspinによってリン酸化されたヒストンH3がSurvivinと直接に相互作用することにより染色体パッセンジャー複合体がインナーセントロメアへと局在化することから,HaspinによるヒストンH3のリン酸化はインナーセントロメアにおいて特異的に起こっている可能性が考えられた.これを確かめるため,クロマチン免疫沈降法により分裂酵母の染色体のどの部分でヒストンH3の3番目のThr残基のリン酸化が起こっているかを調べたところ,インナーセントロメアにあたる部分だけではなく分裂酵母の染色体に3つ存在するヘテロクロマチン領域においてこのリン酸化が起こっていることが明らかになった.さらに,このリン酸化はヘテロクロマチンタンパク質Swi6に依存して起こっていることもわかった.つづいて,Hrk1の染色体における局在を調べたところ,Hrk1はSwi6に依存してヘテロクロマチン領域に局在していた.これらのことから,Hrk1はヘテロクロマチンタンパク質Swi6に依存してインナーセントロメアを含むヘテロクロマチン領域に局在しヒストンH3をリン酸化していることが明らかになった.
分裂酵母においては複製した姉妹染色分体をつなぐ役割をはたすコヒーシン複合体が,Swi6に依存してヘテロクロマチン領域に濃縮することが知られている6).さらに,いくつかのモデル生物においてこのコヒーシン複合体が染色体パッセンジャー複合体のセントロメアへの局在に必要であることもわかっていた7,8).そこで,このコヒーシン複合体の濃縮がHrk1のヘテロクロマチン領域への局在化に必要である可能性を考え,コヒーシン複合体およびコヒーシン複合体と相互作用するタンパク質とHrk1との相互作用を酵母ツーハイブリッド法により調べたところ,コヒーシン複合体と相互作用するタンパク質Pds5がHrk1と結合することがわかった.興味深いことに,pds5遺伝子破壊株ではHrk1の染色体への局在,および,ヒストンH3の3番目のThr残基のリン酸化が完全に消失していた.これらの解析から,Hrk1はPds5との相互作用を介してインナーセントロメア部分を含む染色体に局在していることが明らかになった(図1).
4.2つのヒストンリン酸化修飾が染色体パッセンジャー複合体のセントロメアへの局在を規定する
Swi6-Pds5-Hrk1-ヒストンH3という経路が,以前の研究で明らかになっていたBub1-ヒストンH2A-Sgo2という経路とは独立に染色体パッセンジャー複合体のセントロメアへの局在を促進するとすれば(図1),染色体パッセンジャー複合体のセントロメアへの局在は,HaspinによるヒストンH3のリン酸化と,Bub1によるヒストンH2Aのリン酸化という2つのヒストンリン酸化修飾によって制御されていることになる.このモデルと一致することとして,すべてのヒストンH3を非リン酸化型とした変異株h3-TA株と,すべてのヒストンH2Aを非リン酸化型とした変異株h2a-SA株とを組み合わせた二重変異株h3-TA h2a-SA株においては,染色体パッセンジャー複合体のセントロメアへの局在はほぼ完全に消失し細胞は著しい染色体分配の異常を示した.もし,この異常が染色体パッセンジャー複合体のセントロメアへの局在が失われたことによってひき起こされているとすれば,このh3-TA h2a-SA株において染色体パッセンジャー複合体を人為的にセントロメアへ局在化させれば異常が抑圧されるものと考えられる.実際,染色体パッセンジャー複合体の構成タンパク質のひとつBir1(分裂酵母Survivinホモログ)にクロモドメイン(ヘテロクロマチン領域に結合するドメイン)を融合させたタンパク質をh3-TA h2a-SA株に発現させると染色体分配の異常が抑圧された.
つぎに,クロマチン免疫沈降法を用いて,染色体におけるヒストンH3の3番目のThr残基のリン酸化部位とヒストンH2Aの121番目のSer残基のリン酸化部位,そして,染色体パッセンジャー複合体の局在部位を詳細に検討した.その結果,ヒストンH3の3番目のThr残基のリン酸化はインナーセントロメアを含む3つのヘテロクロマチン領域において,ヒストンH2Aの121番目のSer残基のリン酸化は動原体の形成領域およびインナーセントロメア領域において起こっており,染色体パッセンジャー複合体はこの2つのヒストンリン酸化修飾がともに起こっているインナーセントロメア領域に濃縮して局在していることが示された.
5.ヒト染色体における染色体パッセンジャー複合体と2つのヒストンリン酸化修飾との空間配置
動原体に局在するBub1によるヒストンH2Aの120番目のThr残基(分裂酵母の121番目のSer残基に相当)のリン酸化と,コヒーシン複合体(Pds5)とともに姉妹染色分体のあいだに局在するHaspinによるヒストンH3の3番目のThr残基のリン酸化とが協調的にはたらくことで,インナーセントロメアが規定されている.では,互いに異なる局在を示すキナーゼによる2つのヒストンのリン酸化修飾は,実際の染色体において空間的にはどのような位置関係にあるのだろうか? また,これらのリン酸化はいかにしてインナーセントロメアを規定しているのだろうか? この疑問に答えるため,分裂期のHeLa細胞の染色体における2つのヒストンのリン酸化修飾の部位と染色体パッセンジャー複合体の局在位置とを詳細に観察した.その結果,ヒストンH2Aの120番目のThr残基のリン酸化が姉妹動原体ペアをつなぐように伸びたシグナルとして観察されたのに対し,ヒストンH3の3番目のThr残基のリン酸化はヒストンH2Aの120番目のThr残基のリン酸化と直交するように姉妹染色分体のあいだに観察された.興味深いことに,染色体パッセンジャー複合体は両者が交差する領域に局在していた(図2).この結果から,インナーセントロメアが動原体とコヒーシン複合体とに依存した2つのヒストンのリン酸化修飾が交わる部分として空間的に規定されていることがヒトの細胞においても明らかになった.
おわりに
今回の研究によって,これまで不明であったHaspinの分子機能が明らかになるとともに,最近,筆者らのグループが明らかにした染色体パッセンジャー複合体の時期特異的なセントロメアへの局在化機構とあわせて9)(新着論文レビュー でも掲載),染色体パッセンジャー複合体のインナーセントロメアへの局在化機構のほぼ全容が明らかになったといえる.このHaspinとBub1という2つのキナーゼによる2つのヒストンリン酸化を介した染色体パッセンジャー複合体の局在化機構は分裂酵母からヒトにまで高度に保存された機構であり,ヒストンという染色体の根本をなすタンパク質のリン酸化修飾を介して制御されている点で非常に興味深い.さらに,今回の研究は,いままではっきりとしていなかった染色体のインナーセントロメアという領域がヒストンH3とヒストンH2Aの2つのヒストンのリン酸化の交わりとして明確に定義できることを提唱することができたという点においても,今後の研究の基盤をなすものであると考えている.
文 献
- Ruchaud, S., Carmena, M. & Earnshaw, W. C.: Chromosomal passengers:conducting cell division. Nat. Rev. Mol. Cell Biol., 8, 798-812 (2007)[PubMed]
- Liu, D., Vader, G., Vromans, M. J. et al.: Sensing chromosome bi-orientation by spatial separation of aurora B kinase from kinetochore substrates. Science, 323, 1350-1353 (2009)[PubMed]
- Kawashima, S. A., Tsukahara, T., Langegger, M. et al.: Shugoshin enables tension-generating attachment of kinetochores by loading Aurora to centromeres. Genes Dev., 21, 420-435 (2007)[PubMed]
- Kawashima, S. A., Yamagishi, Y., Honda, T. et al.: Phosphorylation of H2A by Bub1 prevents chromosomal instability through localizing shugoshin. Science, 327, 172-177 (2010)[PubMed]
- Dai, J., Sultan, S., Taylor, S. S. et al.: The kinase haspin is required for mitotic histone H3 Thr 3 phosphorylation and normal metaphase chromosome alignment. Genes Dev., 19, 472-488 (2005)[PubMed]
- Nonaka, N., Kitajima, T., Yokobayashi, S. et al.: Recruitment of cohesin to heterochromatic regions by Swi6/HP1 in fission yeast. Nat. Cell Biol., 4, 89-93 (2002)[PubMed]
- Sonoda, E., Matsusaka, T., Morrison, C. et al.: Scc1/Rad21/Mcd1 is required for sister chromatid cohesion and kinetochore function in vertebrate cells. Dev. Cell., 1, 759-770 (2001)[PubMed]
- Morishita, J., Matsusaka, T., Goshima, G. et al.: Bir1/Cut17 moving from chromosome to spindle upon the loss of cohesion is required for condensation, spindle elongation and repair. Genes Cells, 6, 743-763 (2001)[PubMed]
- Tsukahara, T., Tanno, Y. & Watanabe, Y.: Phosphorylation of the CPC by Cdk1 promotes chromosome bi-orientation. Nature, 467, 719-723 (2010)[PubMed] [新着論文レビュー]
著者プロフィール
略歴:東京大学大学院理学系研究科博士課程 在籍中.
研究テーマ:セントロメアに局在するタンパク質の機能および局在化機構の解析.
抱負:分裂酵母とヒトという一見まったく異なる生き物における染色体分配機構のあまりにきれいな進化的保存性に魅せられながら研究を行っている.これからも,このような進化的に保存された機構を分裂酵母の遺伝学をとっかかりとして明らかにしていけたらと考えている.
渡邊 嘉典(Yoshinori Watanabe)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/watanabe-lab/
© 2010 山岸有哉・本田貴史・渡邊嘉典 Licensed under CC 表示 2.1 日本