急性骨髄性白血病におけるCD98を介した接着シグナルの役割
小沼 貴晶
(米国California大学San Diego校School of Medicine,Department of Pharmacology)
email:小沼貴晶
DOI: 10.7875/first.author.2016.117
CD98-mediated adhesive signaling enables the establishment and propagation of acute myelogenous leukemia.
Jeevisha Bajaj, Takaaki Konuma, Nikki K. Lytle, Hyog Young Kwon, Jailal N. Ablack, Joseph M. Cantor, David Rizzieri, Charles Chuah, Vivian G. Oehler, Elizabeth H. Broome, Edward D. Ball, Edward H. van der Horst, Mark H. Ginsberg, Tannishtha Reya
Cancer Cell, 30, 792-805 (2016)
正常な造血幹細胞と同様に,白血病幹細胞においてもそれを支持するニッチとの接着シグナルがその維持に重要であると考えられているが,その分子機構についてはいまだ不明な点が多い.筆者らは,細胞表面抗原であるCD98のコンディショナルノックアウトマウスを解析することにより,ニッチを構成する細胞のひとつとされる血管内皮細胞とのCD98を介した接着シグナルが白血病幹細胞の発生,進展,維持において重要であることを明らかにした.さらに,ヒトの急性骨髄性白血病細胞においてCD98のノックダウンあるいはヒト化抗CD98モノクローナル抗体の投与によりコロニー形成能およびヒトの臍帯静脈内皮細胞との接着が障害され,また,免疫不全マウスへの異種移植実験による再構築能が抑制された.正常な造血幹細胞に対する影響は小さかったことから,CD98を介したニッチとの接着シグナルが急性骨髄性白血病の新規の治療法の標的になる可能性が示された.
血液の組織幹細胞である造血幹細胞は周囲のニッチ(微小環境)からの接着シグナルや分泌タンパク質などにより自己複製,分化,増殖などが制御される1).一方,がん細胞の周囲を構成するニッチはがん細胞の増殖や進展において重要な役割をはたすと考えられている.多くの固形がんにおいてニッチにおける足場の存在ががん細胞の増殖や進展に機能することが明らかにされているが,白血病におけるニッチの役割やその分子機構についてはあまり明らかにされていない.
CD98はジスルフィド結合した重鎖と軽鎖のヘテロ二量体から構成される細胞表面抗原である.重鎖はインテグリンβ鎖と結合しておりインテグリンシグナルの増幅において重要である.一方,軽鎖はアミノ酸トランスポーターとして機能する.重鎖および軽鎖の機能によりCD98は細胞の増殖,生存,遊走,接着などを制御しており2)(図1),血球系においてはB細胞やT細胞のクローン増殖に必須であることが報告されている3,4).一方,多くのがん細胞においてCD98の過剰な発現は転移や予後不良と関連することが示されており2),がん細胞のクローンの拡大においても重要な役割をはたすと考えられている.
成体のマウスの骨髄造血細胞におけるCD98の発現をタンパク質レベルおよび遺伝子レベルでみたところ,造血幹細胞および造血前駆細胞を含むすべての造血細胞の画分においてCD98が発現していた.CD98の成体の造血細胞における機能について解析するため,CD98重鎖のコンディショナルノックアウトマウスを作製した5).成体のマウスにおけるCD98の欠損は,骨髄細胞の数や長期骨髄再構築能をもつ造血幹細胞の数には影響しなかったが,造血幹細胞よりやや分化した多能性前駆細胞の減少,B細胞およびT細胞の増加が認められた.CD98の欠損の細胞における内在的な効果について評価するため,CD98コンディショナルノックアウトマウスより採取した造血幹細胞を野生型のマウスに移植した.再構築の確認された移植から2カ月のちにCD98を欠損させたところ,対照と比べ末梢血キメリズムが20%ほど低下した.CD98を欠損した造血幹細胞を野生型のマウスに移植したところ,対照においては末梢血キメリズムが上昇したのに対し,末梢血キメリズムは低下していった.これらの結果から,CD98の欠損は樹立された造血幹細胞および造血前駆細胞にはあまり影響をおよぼさないが,造血幹細胞および造血前駆細胞の増殖および再構築能には顕著に影響することが示された.
急性骨髄性白血病におけるCD98の役割について明らかにするため,CD98のコンディショナルノックアウトマウスの造血幹前駆細胞の画分に白血病をひき起こす融合遺伝子の発現を誘導させた急性骨髄性白血病マウスモデルを用いた.移植ののち早期にCD98を欠損させることにより,対照と比べ生存率は有意に改善した.このことから,急性骨髄性白血病の発症においてCD98が重要であることが示唆された.急性骨髄性白血病細胞の増殖にCD98が必要かどうかを検証するため白血病幹細胞の画分を評価した6).CD98の欠損によりin vitroにおけるコロニー形成能は著明に低下し,対照と比較してCD98を欠損した白血病マウスの生存期間は改善された.連続移植においては,CD98を欠損した白血病幹細胞の自己複製の障害が示唆される生存率の著明な改善が認められた.さらに,より臨床の状況に近づけて,白血病を発症したのちCD98を欠損させても生存率は著明に改善された.これらの生存率の改善の効果は複数の急性骨髄性白血病マウスモデルにおいて同様に認められた.これらの結果から,CD98は白血病の発症,維持,増殖に必須であることが示された.
白血病におけるCD98の欠損を細胞レベルにおいて検証するため,白血病細胞の増殖,アポトーシス,分化について評価した.対照と比較して,CD98の欠損により細胞増殖が低下しアポトーシスが亢進した.CD98の欠損によりアポトーシス関連遺伝子であるCasp1遺伝子の発現の亢進,および,抗アポトーシス関連遺伝子であるBcl2L1遺伝子およびAkt1遺伝子の発現の抑制が認められた.アポトーシスの制御遺伝子がCD98シグナルの下流において機能することを検証するため,CD98を欠損した白血病細胞にBcl2L1,あるいは,PI3Kシグナルを恒常的に活性化させるミリストイル化AKT1変異体を強制発現させ,その効果をコロニー形成能により評価した.Bcl2L1の発現のみではコロニー形成能が18%改善し,Bcl2L1およびミリストイル化AKT1の発現によりコロニー形成能は50%改善した.このことから,白血病細胞においてCD98シグナルの下流は一部でアポトーシスを制御することが示された.白血病細胞の分化能を評価するため白血病幹細胞について解析した.白血病幹細胞においてはCD98が高発現しており,CD98を欠損した白血病マウスにおいては対照と比べ白血病幹細胞が減少していた.これは連続移植をすることによっても同様に認められた.これらの結果から,CD98は白血病幹細胞の生存や維持に必須であることが示された.
CD98はインテグリンシグナルの増幅およびアミノ酸トランスポーターとして機能することが知られているが,白血病細胞の増殖においてどちらが重要であるかを知るため,CD98を欠損した白血病幹細胞にヒトのCD98の全長,インテグリン結合領域,アミノ酸トランスポーター領域とヒトのCD69とのキメラタンパク質を発現させコロニー形成能が回復するかどうか調べた4).ヒトのCD98の全長の発現によりコロニー形成能は完全に回復したが,インテグリン結合領域の発現では50%ほどの回復,アミノ酸トランスポーター領域の発現ではコロニー形成能は認められなかった.しかしながら,インテグリン結合領域とアミノ酸トランスポーター領域の共発現によりコロニー形成能はほぼ完全に回復した.これらの結果から,インテグリンシグナルは白血病細胞の増殖に必須であるが,アミノ酸トランスポーターも協調して機能する可能性が示唆された.
白血病細胞においてインテグリンシグナルはニッチとの接着を仲介することから,CD98を欠損した白血病細胞のニッチとの結合をin vivoにおいてリアルタイムで解析した.対照においては25分間以上にわたり骨髄の血管内皮細胞に白血病細胞が25%ほど接着していたが,CD98を欠損した白血病細胞においては血管内皮細胞に接着している細胞はその半分に減少した.白血病細胞と血管内皮細胞との接着は白血病幹細胞の維持において重要であるかどうかを検証するため,ヒトの臍帯静脈内皮細胞を用いて白血病幹細胞の接着能を評価したところ,CD98を欠損した白血病幹細胞においては対照と比べ40%ほど接着能が低下した.これまで,血管内皮細胞に発現するVCAM-1と急性骨髄性白血病細胞に発現するインテグリンα4/β1(VLA-4)とが接着すると報告されていたことから7),CD98による白血病幹細胞の血管内皮細胞への接着はVCAM-1とインテグリンα4/β1との接着と関連があるかどうか検証したところ,白血病幹細胞の臍帯静脈内皮細胞への接着は抗VCAM-1抗体により抑制された.CD98を欠損した白血病幹細胞は抗VCAM-1抗体により影響されなかったことから,CD98はVCAM-1とインテグリンα4/β1とを介した血管内皮細胞と白血病細胞との接着に必須であることが示された.さらに,抗VCAM-1抗体は白血病幹細胞のアポトーシスを誘導してその割合を低下させたことから,CD98とインテグリンを介した白血病幹細胞と血管内皮細胞との接着は白血病幹細胞の生存および維持に重要であることが示された.
マウスにおいて得られた急性骨髄性白血病におけるCD98についての知見が,ヒトの急性骨髄性白血病においても同様であるかどうか検証するため,ヒトの正常な造血幹前駆細胞および急性骨髄性白血病幹前駆細胞におけるCD98の発現をタンパク質レベルで調べたところ,急性骨髄性白血病幹前駆細胞においては正常な造血幹前駆細胞の3倍,また,CD34陰性の急性骨髄性白血病細胞の1.8倍も発現していた.急性骨髄性白血病の細胞株および患者に由来する急性骨髄性白血病細胞においてshRNAによりCD98をノックダウンしたところ,マウスと同様に,コロニー形成能および臍帯静脈内皮細胞への接着能が低下した.これらの効果は異なる遺伝子の異常に起因する白血病においても同様に認められた.
CD98は細胞表面抗原であることから,急性骨髄性白血病の抗体療法において標的になりうるかどうか検討した.ヒト化抗CD98モノクローナル抗体IGN523 8) の投与は,CD98のノックダウンと同様に,急性骨髄性白血病の細胞株および患者に由来する急性骨髄性白血病細胞においてコロニー形成能および臍帯静脈内皮細胞への接着能を低下させた.患者に由来する急性骨髄性白血病細胞を免疫不全マウスに移植することによりCD98が白血病の治療の標的になりうるかどうか検証した.移植ののち早期に抗CD98抗体を投与すると白血病細胞の生着は完全に抑制された.白血病細胞が増殖した移植から2~3週間のちに抗CD98抗体を投与したところ,末梢血および骨髄において白血病細胞が減少した.正常な造血幹前駆細胞の移植においてはコロニー形成能および移植ののちの生着は抑制されなかったことから,抗CD98抗体の投与はヒト急性骨髄性白血病の治療法として有効である可能性が示唆された.
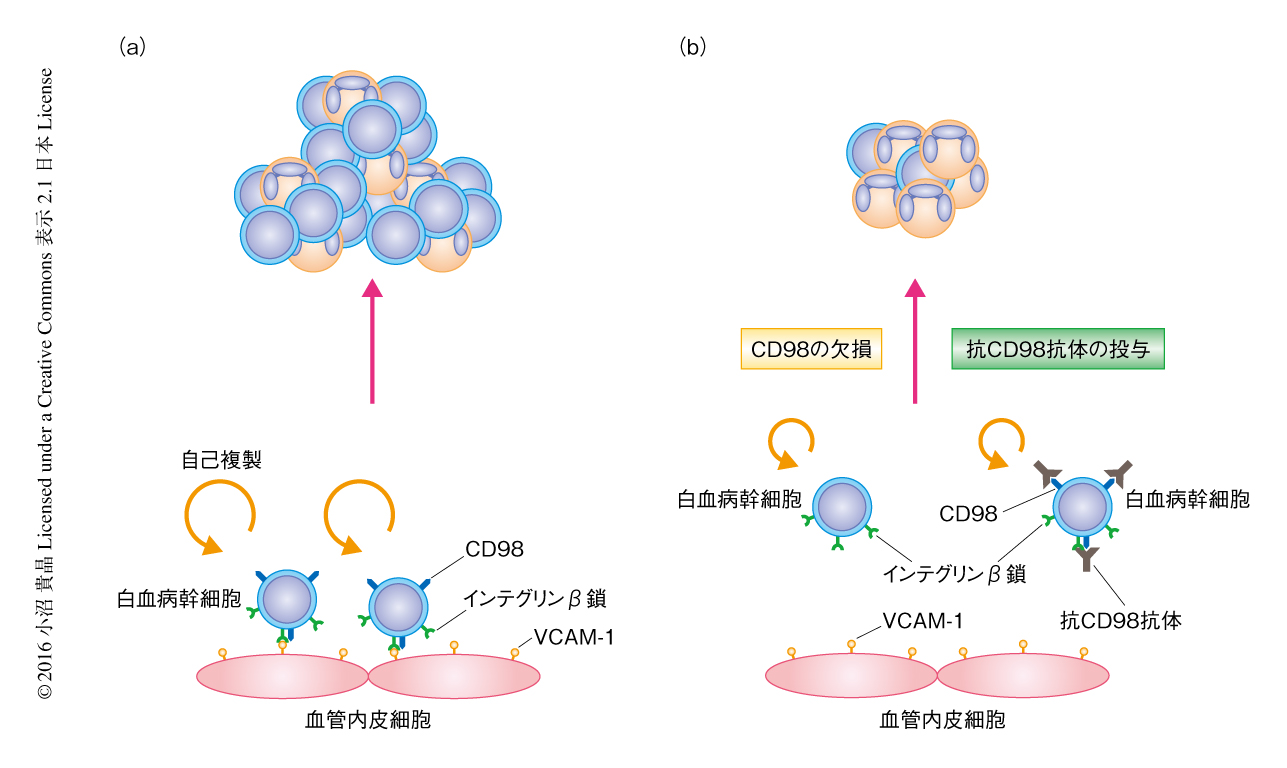
今回の研究により,細胞表面抗原であるCD98はニッチとの接着シグナルによる白血病幹細胞の維持において重要であることが明らかにされた(図2).CD98による造血幹細胞の維持において,正常な造血幹細胞と白血病幹細胞とではその反応が異なっていたことから,CD98は白血病の治療の標的になりうることが示された.この研究において用いたヒト化CD98モノクローナル抗体IGN523は,現在,米国において,再発難治性の急性骨髄性白血病の症例に対する抗体療法として第1相試験が行われている9).今後も,組織幹細胞とは異なるがん幹細胞に特有のニッチに依存性のシグナルを標的にした,新たな治療法の開発が期待される.
略歴:2011年 千葉大学大学院医学研究院博士課程 修了,同年 米国California大学San Diego校School of Medicine博士研究員を経て,2013年より東京大学医科学研究所 助教.
研究テーマ:造血器腫瘍,造血細胞移植.
抱負:造血器腫瘍の根治的な治療法の確立に貢献したい.
© 2016 小沼 貴晶 Licensed under CC 表示 2.1 日本
(米国California大学San Diego校School of Medicine,Department of Pharmacology)
email:小沼貴晶
DOI: 10.7875/first.author.2016.117
CD98-mediated adhesive signaling enables the establishment and propagation of acute myelogenous leukemia.
Jeevisha Bajaj, Takaaki Konuma, Nikki K. Lytle, Hyog Young Kwon, Jailal N. Ablack, Joseph M. Cantor, David Rizzieri, Charles Chuah, Vivian G. Oehler, Elizabeth H. Broome, Edward D. Ball, Edward H. van der Horst, Mark H. Ginsberg, Tannishtha Reya
Cancer Cell, 30, 792-805 (2016)
要 約
正常な造血幹細胞と同様に,白血病幹細胞においてもそれを支持するニッチとの接着シグナルがその維持に重要であると考えられているが,その分子機構についてはいまだ不明な点が多い.筆者らは,細胞表面抗原であるCD98のコンディショナルノックアウトマウスを解析することにより,ニッチを構成する細胞のひとつとされる血管内皮細胞とのCD98を介した接着シグナルが白血病幹細胞の発生,進展,維持において重要であることを明らかにした.さらに,ヒトの急性骨髄性白血病細胞においてCD98のノックダウンあるいはヒト化抗CD98モノクローナル抗体の投与によりコロニー形成能およびヒトの臍帯静脈内皮細胞との接着が障害され,また,免疫不全マウスへの異種移植実験による再構築能が抑制された.正常な造血幹細胞に対する影響は小さかったことから,CD98を介したニッチとの接着シグナルが急性骨髄性白血病の新規の治療法の標的になる可能性が示された.
はじめに
血液の組織幹細胞である造血幹細胞は周囲のニッチ(微小環境)からの接着シグナルや分泌タンパク質などにより自己複製,分化,増殖などが制御される1).一方,がん細胞の周囲を構成するニッチはがん細胞の増殖や進展において重要な役割をはたすと考えられている.多くの固形がんにおいてニッチにおける足場の存在ががん細胞の増殖や進展に機能することが明らかにされているが,白血病におけるニッチの役割やその分子機構についてはあまり明らかにされていない.
CD98はジスルフィド結合した重鎖と軽鎖のヘテロ二量体から構成される細胞表面抗原である.重鎖はインテグリンβ鎖と結合しておりインテグリンシグナルの増幅において重要である.一方,軽鎖はアミノ酸トランスポーターとして機能する.重鎖および軽鎖の機能によりCD98は細胞の増殖,生存,遊走,接着などを制御しており2)(図1),血球系においてはB細胞やT細胞のクローン増殖に必須であることが報告されている3,4).一方,多くのがん細胞においてCD98の過剰な発現は転移や予後不良と関連することが示されており2),がん細胞のクローンの拡大においても重要な役割をはたすと考えられている.
1.CD98の欠損は正常な造血幹細胞および造血前駆細胞の増殖および再構築能を障害する
成体のマウスの骨髄造血細胞におけるCD98の発現をタンパク質レベルおよび遺伝子レベルでみたところ,造血幹細胞および造血前駆細胞を含むすべての造血細胞の画分においてCD98が発現していた.CD98の成体の造血細胞における機能について解析するため,CD98重鎖のコンディショナルノックアウトマウスを作製した5).成体のマウスにおけるCD98の欠損は,骨髄細胞の数や長期骨髄再構築能をもつ造血幹細胞の数には影響しなかったが,造血幹細胞よりやや分化した多能性前駆細胞の減少,B細胞およびT細胞の増加が認められた.CD98の欠損の細胞における内在的な効果について評価するため,CD98コンディショナルノックアウトマウスより採取した造血幹細胞を野生型のマウスに移植した.再構築の確認された移植から2カ月のちにCD98を欠損させたところ,対照と比べ末梢血キメリズムが20%ほど低下した.CD98を欠損した造血幹細胞を野生型のマウスに移植したところ,対照においては末梢血キメリズムが上昇したのに対し,末梢血キメリズムは低下していった.これらの結果から,CD98の欠損は樹立された造血幹細胞および造血前駆細胞にはあまり影響をおよぼさないが,造血幹細胞および造血前駆細胞の増殖および再構築能には顕著に影響することが示された.
2.CD98は急性骨髄性白血病の発症,維持,増殖に必須である
急性骨髄性白血病におけるCD98の役割について明らかにするため,CD98のコンディショナルノックアウトマウスの造血幹前駆細胞の画分に白血病をひき起こす融合遺伝子の発現を誘導させた急性骨髄性白血病マウスモデルを用いた.移植ののち早期にCD98を欠損させることにより,対照と比べ生存率は有意に改善した.このことから,急性骨髄性白血病の発症においてCD98が重要であることが示唆された.急性骨髄性白血病細胞の増殖にCD98が必要かどうかを検証するため白血病幹細胞の画分を評価した6).CD98の欠損によりin vitroにおけるコロニー形成能は著明に低下し,対照と比較してCD98を欠損した白血病マウスの生存期間は改善された.連続移植においては,CD98を欠損した白血病幹細胞の自己複製の障害が示唆される生存率の著明な改善が認められた.さらに,より臨床の状況に近づけて,白血病を発症したのちCD98を欠損させても生存率は著明に改善された.これらの生存率の改善の効果は複数の急性骨髄性白血病マウスモデルにおいて同様に認められた.これらの結果から,CD98は白血病の発症,維持,増殖に必須であることが示された.
3.CD98の欠損は白血病幹細胞の生存を抑制し枯渇させる
白血病におけるCD98の欠損を細胞レベルにおいて検証するため,白血病細胞の増殖,アポトーシス,分化について評価した.対照と比較して,CD98の欠損により細胞増殖が低下しアポトーシスが亢進した.CD98の欠損によりアポトーシス関連遺伝子であるCasp1遺伝子の発現の亢進,および,抗アポトーシス関連遺伝子であるBcl2L1遺伝子およびAkt1遺伝子の発現の抑制が認められた.アポトーシスの制御遺伝子がCD98シグナルの下流において機能することを検証するため,CD98を欠損した白血病細胞にBcl2L1,あるいは,PI3Kシグナルを恒常的に活性化させるミリストイル化AKT1変異体を強制発現させ,その効果をコロニー形成能により評価した.Bcl2L1の発現のみではコロニー形成能が18%改善し,Bcl2L1およびミリストイル化AKT1の発現によりコロニー形成能は50%改善した.このことから,白血病細胞においてCD98シグナルの下流は一部でアポトーシスを制御することが示された.白血病細胞の分化能を評価するため白血病幹細胞について解析した.白血病幹細胞においてはCD98が高発現しており,CD98を欠損した白血病マウスにおいては対照と比べ白血病幹細胞が減少していた.これは連続移植をすることによっても同様に認められた.これらの結果から,CD98は白血病幹細胞の生存や維持に必須であることが示された.
4.CD98を介したインテグリンシグナルが白血病細胞の増殖に必須である
CD98はインテグリンシグナルの増幅およびアミノ酸トランスポーターとして機能することが知られているが,白血病細胞の増殖においてどちらが重要であるかを知るため,CD98を欠損した白血病幹細胞にヒトのCD98の全長,インテグリン結合領域,アミノ酸トランスポーター領域とヒトのCD69とのキメラタンパク質を発現させコロニー形成能が回復するかどうか調べた4).ヒトのCD98の全長の発現によりコロニー形成能は完全に回復したが,インテグリン結合領域の発現では50%ほどの回復,アミノ酸トランスポーター領域の発現ではコロニー形成能は認められなかった.しかしながら,インテグリン結合領域とアミノ酸トランスポーター領域の共発現によりコロニー形成能はほぼ完全に回復した.これらの結果から,インテグリンシグナルは白血病細胞の増殖に必須であるが,アミノ酸トランスポーターも協調して機能する可能性が示唆された.
白血病細胞においてインテグリンシグナルはニッチとの接着を仲介することから,CD98を欠損した白血病細胞のニッチとの結合をin vivoにおいてリアルタイムで解析した.対照においては25分間以上にわたり骨髄の血管内皮細胞に白血病細胞が25%ほど接着していたが,CD98を欠損した白血病細胞においては血管内皮細胞に接着している細胞はその半分に減少した.白血病細胞と血管内皮細胞との接着は白血病幹細胞の維持において重要であるかどうかを検証するため,ヒトの臍帯静脈内皮細胞を用いて白血病幹細胞の接着能を評価したところ,CD98を欠損した白血病幹細胞においては対照と比べ40%ほど接着能が低下した.これまで,血管内皮細胞に発現するVCAM-1と急性骨髄性白血病細胞に発現するインテグリンα4/β1(VLA-4)とが接着すると報告されていたことから7),CD98による白血病幹細胞の血管内皮細胞への接着はVCAM-1とインテグリンα4/β1との接着と関連があるかどうか検証したところ,白血病幹細胞の臍帯静脈内皮細胞への接着は抗VCAM-1抗体により抑制された.CD98を欠損した白血病幹細胞は抗VCAM-1抗体により影響されなかったことから,CD98はVCAM-1とインテグリンα4/β1とを介した血管内皮細胞と白血病細胞との接着に必須であることが示された.さらに,抗VCAM-1抗体は白血病幹細胞のアポトーシスを誘導してその割合を低下させたことから,CD98とインテグリンを介した白血病幹細胞と血管内皮細胞との接着は白血病幹細胞の生存および維持に重要であることが示された.
5.CD98はヒトの急性骨髄性白血病細胞の増殖においても必須である
マウスにおいて得られた急性骨髄性白血病におけるCD98についての知見が,ヒトの急性骨髄性白血病においても同様であるかどうか検証するため,ヒトの正常な造血幹前駆細胞および急性骨髄性白血病幹前駆細胞におけるCD98の発現をタンパク質レベルで調べたところ,急性骨髄性白血病幹前駆細胞においては正常な造血幹前駆細胞の3倍,また,CD34陰性の急性骨髄性白血病細胞の1.8倍も発現していた.急性骨髄性白血病の細胞株および患者に由来する急性骨髄性白血病細胞においてshRNAによりCD98をノックダウンしたところ,マウスと同様に,コロニー形成能および臍帯静脈内皮細胞への接着能が低下した.これらの効果は異なる遺伝子の異常に起因する白血病においても同様に認められた.
CD98は細胞表面抗原であることから,急性骨髄性白血病の抗体療法において標的になりうるかどうか検討した.ヒト化抗CD98モノクローナル抗体IGN523 8) の投与は,CD98のノックダウンと同様に,急性骨髄性白血病の細胞株および患者に由来する急性骨髄性白血病細胞においてコロニー形成能および臍帯静脈内皮細胞への接着能を低下させた.患者に由来する急性骨髄性白血病細胞を免疫不全マウスに移植することによりCD98が白血病の治療の標的になりうるかどうか検証した.移植ののち早期に抗CD98抗体を投与すると白血病細胞の生着は完全に抑制された.白血病細胞が増殖した移植から2~3週間のちに抗CD98抗体を投与したところ,末梢血および骨髄において白血病細胞が減少した.正常な造血幹前駆細胞の移植においてはコロニー形成能および移植ののちの生着は抑制されなかったことから,抗CD98抗体の投与はヒト急性骨髄性白血病の治療法として有効である可能性が示唆された.
おわりに
今回の研究により,細胞表面抗原であるCD98はニッチとの接着シグナルによる白血病幹細胞の維持において重要であることが明らかにされた(図2).CD98による造血幹細胞の維持において,正常な造血幹細胞と白血病幹細胞とではその反応が異なっていたことから,CD98は白血病の治療の標的になりうることが示された.この研究において用いたヒト化CD98モノクローナル抗体IGN523は,現在,米国において,再発難治性の急性骨髄性白血病の症例に対する抗体療法として第1相試験が行われている9).今後も,組織幹細胞とは異なるがん幹細胞に特有のニッチに依存性のシグナルを標的にした,新たな治療法の開発が期待される.
文 献
- Calvi, L. M. & Link, D. C.: The hematopoietic stem cell niche in homeostasis and disease. Blood, 126, 2443-2451 (2015)[PubMed]
- Cantor, J. M. & Ginsberg, M. H.: CD98 at the crossroads of adaptive immunity and cancer. J. Cell Sci., 125, 1373-1382 (2012)[PubMed]
- Cantor, J., Slepak, M., Ege, N. et al.: Loss of T cell CD98 H chain specifically ablates T cell clonal expansion and protects from autoimmunity. J. Immunol., 187, 851-860 (2011)[PubMed]
- Cantor, J., Browne, C. D., Ruppert, R. et al.: CD98hc facilitates B cell proliferation and adaptive humoral immunity. Nat. Immunol., 10, 412-419 (2009)[PubMed]
- Feral, C. C., Zijlstra, A., Tkachenko, E. et al.: CD98hc (SLC3A2) participates in fibronectin matrix assembly by mediating integrin signaling. J. Cell Biol., 178, 701-711 (2007)[PubMed]
- Somervaille, T. C. & Cleary, M. L.: Identification and characterization of leukemia stem cells in murine MLL-AF9 acute myeloid leukemia. Cancer Cell, 10, 257-268 (2006)[PubMed]
- Matsunaga, T., Takemoto, N., Sato, T. et al.: Interaction between leukemic-cell VLA-4 and stromal fibronectin is a decisive factor for minimal residual disease of acute myelogenous leukemia. Nat. Med., 9, 1158-1165 (2003)[PubMed]
- Hayes, G. M., Chinn, L., Cantor, J. M. et al.: Antitumor activity of an anti-CD98 antibody. Int. J. Cancer, 137,710-720 (2015)[PubMed]
- Bixby, D., Wieduwilt, M. J., Akard, L. P. et al.: A phase I study of IGN523, a novel anti-CD98 monoclonal antibody in patients with relapsed or refractory acute myeloid leukemia (AML). Blood, 126, 3809 (2015)
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2011年 千葉大学大学院医学研究院博士課程 修了,同年 米国California大学San Diego校School of Medicine博士研究員を経て,2013年より東京大学医科学研究所 助教.
研究テーマ:造血器腫瘍,造血細胞移植.
抱負:造血器腫瘍の根治的な治療法の確立に貢献したい.
© 2016 小沼 貴晶 Licensed under CC 表示 2.1 日本