濾胞性ヘルパーT細胞に依存しないインフルエンザ中和抗体の産生機構
宮内浩典・久保允人
(理化学研究所統合生命医科学研究センター サイトカイン制御研究チーム)
email:宮内浩典,久保允人
DOI: 10.7875/first.author.2016.115
Protective neutralizing influenza antibody response in the absence of T follicular helper cells.
Kosuke Miyauchi, Akiko Sugimoto-Ishige, Yasuyo Harada, Yu Adachi, Yoshiko Usami, Tomohiro Kaji, Kentaro Inoue, Hideki Hasegawa, Takashi Watanabe, Atsushi Hijikata, Satoshi Fukuyama, Tadashi Maemura, Mariko Okada-Hatakeyama, Osamu Ohara, Yoshihiro Kawaoka, Yoshimasa Takahashi, Toshitada Takemori, Masato Kubo
Nature Immunology, 17, 1447-1458 (2016)
毎年のように新しく出現するインフルエンザウイルスに対抗するため,低侵襲かつ防御効率の高いワクチンが望まれている.ところが,ウイルスに対し中和活性をもつ抗体がどのように産生されるかについてはあまりわかっていない.これまでの常識として,T細胞とB細胞が協調してはたらき抗体を産生する場はリンパ節の胚中心であるといわれてきたが,胚中心のない状況でも中和活性をもつ免疫グロブリンG2が存在することから,これまでに知られていない抗体の産生機構があると思われた.この研究において,Th1細胞を活性化することにより,低親和性にもかかわらず中和活性の高い抗体の産生が誘導されることが明らかにされた.同様の機構は高病原性のトリインフルエンザにおいても認められたことから,今後,インフルエンザウイルスに対抗する新しいワクチン戦術として,Th1細胞を効率よく活性化するワクチンの開発が有効と考えられる.
インフルエンザウイルスへの感染は公衆衛生において深刻な問題であり,とくに,強毒性トリインフルエンザウイルスに代表される強毒性の変異株によるパンデミックへの備えは喫緊の課題である1).現行のインフルエンザワクチンは季節性のインフルエンザウイルスに対する感染防御には一定の効果を示すものの変異株には効果が薄く,より広範なウイルス株に対応が可能なワクチンの開発がもとめられている.しかしながら,どのようにウイルス中和抗体の産生が誘導されるのかについては不明な点が多い.一般に,ウイルス中和抗体のように抗原に対し高親和性が必要とされる抗体は,ヘルパーT細胞のサポートをうけたB細胞により産生されることが知られている2).
ヘルパーT細胞にはいくつかのサブセットがあり,その分化はそれぞれのサブセットに特異的な転写因子により制御される3).近年になり急速に研究が進み,抗体を産生するB細胞のサポートにおいて主要な役割をもつと考えられるようになったヘルパーT細胞が,濾胞性ヘルパーT細胞である.抗体の親和性の向上には2次リンパ組織の胚中心とよばれる特定の場で濾胞性ヘルパーT細胞と抗体を産生するB細胞とが協調してはたらき,より高親和性の抗体を産生するB細胞を選択する過程が必要であると考えられている.一方,ウイルスの感染やウイルス抗原の免疫により分化が強力に誘導されるヘルパーT細胞がTh1細胞である.Th1細胞は転写因子T-betにより分化が制御され,活性化するとおもにインターフェロンγを産生する3).
血清に分泌される中和抗体の本体である免疫グロブリンGには,マウスにおいて免疫グロブリンG1,免疫グロブリンG2,免疫グロブリンG3のサブクラスがあるが,ウイルスの感染においておもに産生されるのは免疫グロブリンG2である4).また,免疫グロブリンG2は免疫グロブリンG1と比較してウイルスの中和の効果が高いこと4),免疫グロブリンG2の産生にはインターフェロンγが必要であることなどが知られている5).一般に抗体の産生にかかわると考えられているのは濾胞性ヘルパーT細胞であるが,濾胞性ヘルパーT細胞や胚中心が形成されていないマウスにおいても免疫グロブリンG2の産生は認められており,免疫グロブリンG2の産生を誘導するヘルパーT細胞やその産生の機序については不明であった.この研究においては,ウイルスの中和において主要な役割をはたす免疫グロブリンG2の産生機構の解明を目的として,濾胞性ヘルパーT細胞およびTh1細胞の機能に焦点をあてた.
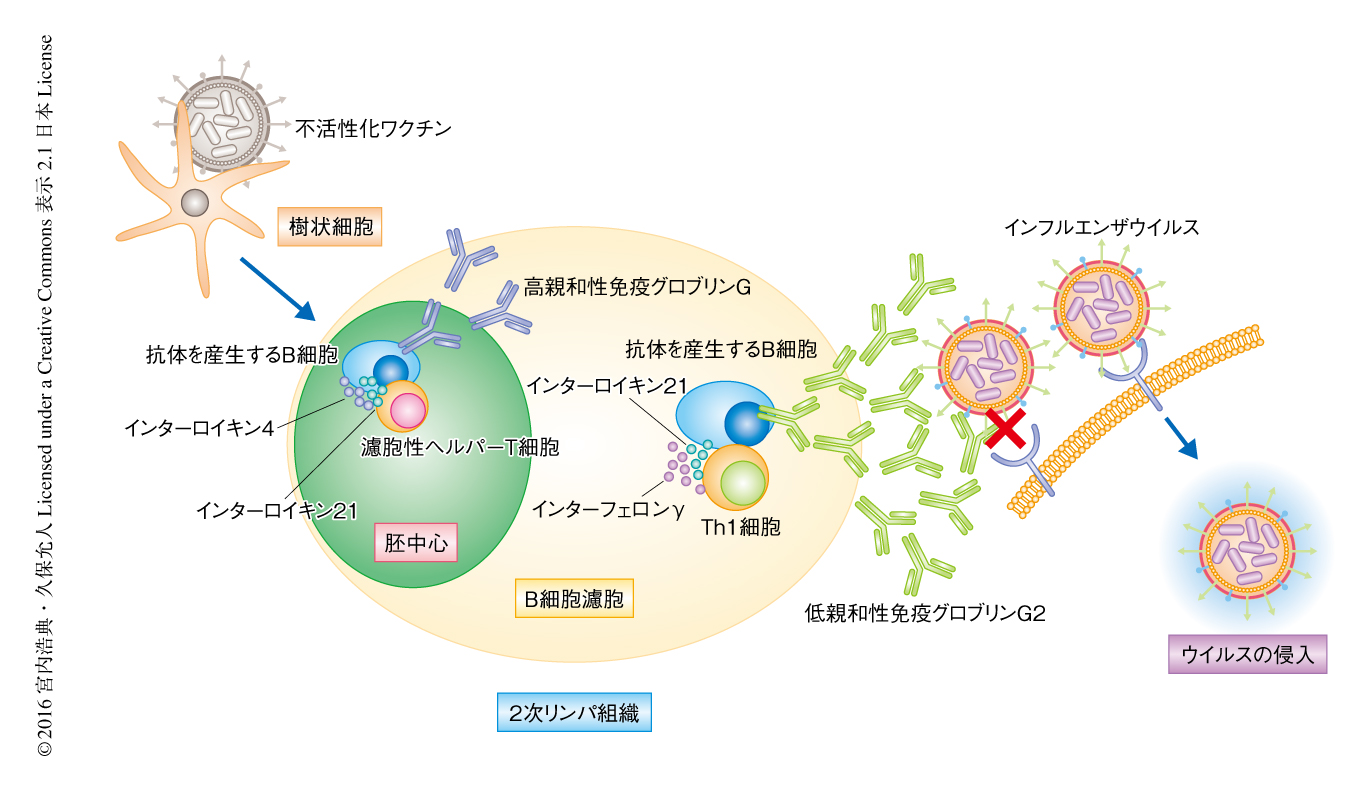
ワクチンの接種により生体にもたらされたウイルス抗原は,樹状細胞により捕捉され2次リンパ組織へと輸送される.2次リンパ組織のT細胞領域に存在する抗原に特異的なT細胞は,抗原を輸送してきた樹状細胞により活性化され,T細胞領域とB細胞濾胞との境界の領域へと移動する6).境界の領域に到達したヘルパーT細胞は,抗原に特異的なB細胞と相互作用し,B細胞濾胞へと移動する6).この過程において転写因子であるBcl6が発現することにより,ヘルパーT細胞は濾胞性ヘルパーT細胞へと分化する7).B細胞濾胞の内部に侵入した濾胞性ヘルパーT細胞は,抗原に特異的なB細胞と相互作用することにより胚中心を形成する7).T細胞およびB細胞に特異的なBcl6ノックアウトマウスにおいては濾胞性ヘルパーT細胞が分化しないため胚中心が形成されない.不活化ワクチンを接種したT細胞およびB細胞に特異的なBcl6ノックアウトマウスにおいて,抗ウイルス免疫グロブリンG1の産生は低下したが,抗ウイルス免疫グロブリンG2は野生型のマウスと同じくらい存在した.T細胞およびB細胞に特異的なBcl6ノックアウトマウスにおいて産生された抗ウイルス免疫グロブリンG2を移入したマウスは,致死量のウイルスの感染から防御された.これらの結果から,濾胞性ヘルパーT細胞や胚中心が存在しなくともウイルスの中和活性をもつ免疫グロブリンG2が産生されることが示された.
免疫グロブリンG2の産生においてはインターフェロンγが必要であることが知られている5).また,ウイルスに感染したときにはTh1細胞が活性化し大量のインターフェロンγを産生する.インターフェロンγレポーターマウスを用いた解析において,ワクチンを接種したマウスの2次リンパ組織においてインターフェロンγを産生するヘルパーT細胞のほとんどはTh1細胞であった.さらに,これらインターフェロンγを産生するヘルパーT細胞を分離しトランスクリプトーム解析によりその遺伝子の発現パターンを解析したところ,Th1細胞に特徴的な遺伝子の発現パターンが認められた.これらのことから,濾胞性ヘルパーT細胞をもたないT細胞およびB細胞に特異的なBcl6ノックアウトマウスにおいては,インターフェロンγを産生するTh1細胞がウイルスの中和活性をもつ免疫グロブリンG2の産生を誘導することが明らかにされた.ナイーブT細胞から濾胞性ヘルパーT細胞あるいはTh1細胞への分化は,Bcl6およびBlimpとよばれる転写因子の発現のバランスにより決定されると考えられている8).しかしながら,T細胞およびB細胞に特異的なBcl6ノックアウトマウスから分離されたTh1細胞において,Th1細胞に特徴的な遺伝子の発現パターンは保持されており,Bcl6の欠損がTh1細胞の分化におよぼす影響は限定的であった.
ワクチンを接種したマウスから分離されたTh1細胞の移入によりウイルスの中和活性をもつ免疫グロブリンG2の抗体価は上昇し,さらに,このマウスの血清の移入はワクチンを接種していないマウスを致死量のウイルスから防御したことから,ウイルスの防御に十分な免疫グロブリンG2の産生がTh1細胞により誘導されることが示された.同様の結果は,ウイルスワクチンを接種した場合のみならず,卵白アルブミンを抗原として認識するインターフェロンγを産生するTh1細胞を移入したマウスに卵白アルブミンを投与した際にも卵白アルブミンに特異的な免疫グロブリンG2の産生が認められた.これらの結果より,Th1細胞がウイルスの中和活性をもつ免疫グロブリンG2の産生を誘導することが明らかにされた.
濾胞性ヘルパーT細胞がB細胞と相互作用して免疫グロブリンGの産生を誘導する場は胚中心であるが,濾胞性ヘルパーT細胞に依存しない免疫グロブリンGの産生はおもにB細胞濾胞の外で起こると考えられてきた9).インターフェロンγレポーターマウスを用いた解析において,インターフェロンγを産生するTh1細胞は,B細胞濾胞の外のみならずB細胞濾胞の内部にも認められた.また,T細胞をもたない遺伝子改変マウスにTh1細胞を移入した際にも,移入されたTh1細胞は脾臓のB細胞濾胞の内部に到達した.これらのことから,インターフェロンγを産生するTh1細胞は活性化したのちB細胞濾胞へと移動し,ウイルス抗原に特異的なB細胞と相互作用することによりウイルスの中和活性をもつ免疫グロブリンG2の産生を誘導することが示唆された.
サイトカインであるインターロイキン21は濾胞性ヘルパーT細胞から分泌され,胚中心における免疫グロブリンGの産生に重要な役割を担うことが知られている10).T細胞に特異的にインターロイキン21を欠損させたマウスにおいてはウイルスに特異的な免疫グロブリンG1および免疫グロブリンG2いずれの抗体価も減少したことから,T細胞からの分泌されるインターロイキン21がウイルスの中和活性をもつ免疫グロブリンG2の産生にも必要であることが示唆された.さらに,インターフェロンγおよびインターロイキン21の二重レポーターマウスを用いた解析により,ウイルスワクチンの接種によりインターフェロンγおよびインターロイキン21を産生するTh1細胞の分化が誘導されることが示された.このインターロイキン21を産生するTh1細胞を移入したマウスにおいては,ウイルスの中和活性をもつ免疫グロブリンG2の産生が増強したことから,Th1細胞によるウイルスの中和活性をもつ免疫グロブリンG2の産生の誘導にはインターロイキン21が関与することが明らかにされた.
近年の濾胞性ヘルパーT細胞についての研究の進展にともない,免疫グロブリンGの産生はおもに胚中心において濾胞性ヘルパーT細胞に依存的に起こるという考えが主流になっている.そのため,新型ワクチンの開発においても濾胞性ヘルパーT細胞の活性化が目標のひとつとされる11).しかしながら,この研究により,胚中心や濾胞性ヘルパーT細胞に依存せずにウイルスの中和活性をもつ免疫グロブリンG2の産生が誘導されることが明らかにされた(図1).濾胞性ヘルパーT細胞による胚中心における高親和性の免疫グロブリンGの産生においては,濾胞性ヘルパーT細胞と胚中心B細胞とがくり返し相互作用することによるB細胞の選択が必要なため,相応の時間がかかる.また,1種類のウイルス株に対し親和性が高いことは,ウイルスが変異した際に対応できる可能性が低くなることが考えられる.これらの点において,Th1細胞により産生の誘導された免疫グロブリンG2は,低親和性であるものの十分なウイルス中和活性をもち,広範な変異ウイルスに迅速に対応できると考えられる.また,Th1細胞の移入のみで,ウイルスが感染した際にすみやかな中和活性をもつ免疫グロブリンG2の産生が誘導されたことは,抗原の立体構造に左右されるB細胞の誘導に依存する通常のワクチンを補完する,Th1細胞を標的としたユニバーサルワクチンに道を開く成果である.
略歴:2006年 大阪大学大学院薬学研究科にて博士号取得,同年 米国Maryland大学Research Associate,2009年 国立感染症研究所 研究員を経て,2011年より理化学研究所免疫アレルギー研究センター(現 統合生命医科学研究センター)研究員.
研究テーマ:ウイルスの感染に対する免疫応答.
久保 允人(Masato Kubo)
東京理科大学生命医科学研究所 教授.
研究室URL:http://www.rs.noda.tus.ac.jp/~ribsjm/kubolab/index.html
© 2016 宮内浩典・久保允人 Licensed under CC 表示 2.1 日本
(理化学研究所統合生命医科学研究センター サイトカイン制御研究チーム)
email:宮内浩典,久保允人
DOI: 10.7875/first.author.2016.115
Protective neutralizing influenza antibody response in the absence of T follicular helper cells.
Kosuke Miyauchi, Akiko Sugimoto-Ishige, Yasuyo Harada, Yu Adachi, Yoshiko Usami, Tomohiro Kaji, Kentaro Inoue, Hideki Hasegawa, Takashi Watanabe, Atsushi Hijikata, Satoshi Fukuyama, Tadashi Maemura, Mariko Okada-Hatakeyama, Osamu Ohara, Yoshihiro Kawaoka, Yoshimasa Takahashi, Toshitada Takemori, Masato Kubo
Nature Immunology, 17, 1447-1458 (2016)
要 約
毎年のように新しく出現するインフルエンザウイルスに対抗するため,低侵襲かつ防御効率の高いワクチンが望まれている.ところが,ウイルスに対し中和活性をもつ抗体がどのように産生されるかについてはあまりわかっていない.これまでの常識として,T細胞とB細胞が協調してはたらき抗体を産生する場はリンパ節の胚中心であるといわれてきたが,胚中心のない状況でも中和活性をもつ免疫グロブリンG2が存在することから,これまでに知られていない抗体の産生機構があると思われた.この研究において,Th1細胞を活性化することにより,低親和性にもかかわらず中和活性の高い抗体の産生が誘導されることが明らかにされた.同様の機構は高病原性のトリインフルエンザにおいても認められたことから,今後,インフルエンザウイルスに対抗する新しいワクチン戦術として,Th1細胞を効率よく活性化するワクチンの開発が有効と考えられる.
はじめに
インフルエンザウイルスへの感染は公衆衛生において深刻な問題であり,とくに,強毒性トリインフルエンザウイルスに代表される強毒性の変異株によるパンデミックへの備えは喫緊の課題である1).現行のインフルエンザワクチンは季節性のインフルエンザウイルスに対する感染防御には一定の効果を示すものの変異株には効果が薄く,より広範なウイルス株に対応が可能なワクチンの開発がもとめられている.しかしながら,どのようにウイルス中和抗体の産生が誘導されるのかについては不明な点が多い.一般に,ウイルス中和抗体のように抗原に対し高親和性が必要とされる抗体は,ヘルパーT細胞のサポートをうけたB細胞により産生されることが知られている2).
ヘルパーT細胞にはいくつかのサブセットがあり,その分化はそれぞれのサブセットに特異的な転写因子により制御される3).近年になり急速に研究が進み,抗体を産生するB細胞のサポートにおいて主要な役割をもつと考えられるようになったヘルパーT細胞が,濾胞性ヘルパーT細胞である.抗体の親和性の向上には2次リンパ組織の胚中心とよばれる特定の場で濾胞性ヘルパーT細胞と抗体を産生するB細胞とが協調してはたらき,より高親和性の抗体を産生するB細胞を選択する過程が必要であると考えられている.一方,ウイルスの感染やウイルス抗原の免疫により分化が強力に誘導されるヘルパーT細胞がTh1細胞である.Th1細胞は転写因子T-betにより分化が制御され,活性化するとおもにインターフェロンγを産生する3).
血清に分泌される中和抗体の本体である免疫グロブリンGには,マウスにおいて免疫グロブリンG1,免疫グロブリンG2,免疫グロブリンG3のサブクラスがあるが,ウイルスの感染においておもに産生されるのは免疫グロブリンG2である4).また,免疫グロブリンG2は免疫グロブリンG1と比較してウイルスの中和の効果が高いこと4),免疫グロブリンG2の産生にはインターフェロンγが必要であることなどが知られている5).一般に抗体の産生にかかわると考えられているのは濾胞性ヘルパーT細胞であるが,濾胞性ヘルパーT細胞や胚中心が形成されていないマウスにおいても免疫グロブリンG2の産生は認められており,免疫グロブリンG2の産生を誘導するヘルパーT細胞やその産生の機序については不明であった.この研究においては,ウイルスの中和において主要な役割をはたす免疫グロブリンG2の産生機構の解明を目的として,濾胞性ヘルパーT細胞およびTh1細胞の機能に焦点をあてた.
1.ワクチンの接種により濾胞性ヘルパーT細胞に非依存的に産生された免疫グロブリンG2はウイルスの感染を防御する
ワクチンの接種により生体にもたらされたウイルス抗原は,樹状細胞により捕捉され2次リンパ組織へと輸送される.2次リンパ組織のT細胞領域に存在する抗原に特異的なT細胞は,抗原を輸送してきた樹状細胞により活性化され,T細胞領域とB細胞濾胞との境界の領域へと移動する6).境界の領域に到達したヘルパーT細胞は,抗原に特異的なB細胞と相互作用し,B細胞濾胞へと移動する6).この過程において転写因子であるBcl6が発現することにより,ヘルパーT細胞は濾胞性ヘルパーT細胞へと分化する7).B細胞濾胞の内部に侵入した濾胞性ヘルパーT細胞は,抗原に特異的なB細胞と相互作用することにより胚中心を形成する7).T細胞およびB細胞に特異的なBcl6ノックアウトマウスにおいては濾胞性ヘルパーT細胞が分化しないため胚中心が形成されない.不活化ワクチンを接種したT細胞およびB細胞に特異的なBcl6ノックアウトマウスにおいて,抗ウイルス免疫グロブリンG1の産生は低下したが,抗ウイルス免疫グロブリンG2は野生型のマウスと同じくらい存在した.T細胞およびB細胞に特異的なBcl6ノックアウトマウスにおいて産生された抗ウイルス免疫グロブリンG2を移入したマウスは,致死量のウイルスの感染から防御された.これらの結果から,濾胞性ヘルパーT細胞や胚中心が存在しなくともウイルスの中和活性をもつ免疫グロブリンG2が産生されることが示された.
2.Th1細胞はウイルスの中和活性をもつ免疫グロブリンG2の産生を誘導する
免疫グロブリンG2の産生においてはインターフェロンγが必要であることが知られている5).また,ウイルスに感染したときにはTh1細胞が活性化し大量のインターフェロンγを産生する.インターフェロンγレポーターマウスを用いた解析において,ワクチンを接種したマウスの2次リンパ組織においてインターフェロンγを産生するヘルパーT細胞のほとんどはTh1細胞であった.さらに,これらインターフェロンγを産生するヘルパーT細胞を分離しトランスクリプトーム解析によりその遺伝子の発現パターンを解析したところ,Th1細胞に特徴的な遺伝子の発現パターンが認められた.これらのことから,濾胞性ヘルパーT細胞をもたないT細胞およびB細胞に特異的なBcl6ノックアウトマウスにおいては,インターフェロンγを産生するTh1細胞がウイルスの中和活性をもつ免疫グロブリンG2の産生を誘導することが明らかにされた.ナイーブT細胞から濾胞性ヘルパーT細胞あるいはTh1細胞への分化は,Bcl6およびBlimpとよばれる転写因子の発現のバランスにより決定されると考えられている8).しかしながら,T細胞およびB細胞に特異的なBcl6ノックアウトマウスから分離されたTh1細胞において,Th1細胞に特徴的な遺伝子の発現パターンは保持されており,Bcl6の欠損がTh1細胞の分化におよぼす影響は限定的であった.
ワクチンを接種したマウスから分離されたTh1細胞の移入によりウイルスの中和活性をもつ免疫グロブリンG2の抗体価は上昇し,さらに,このマウスの血清の移入はワクチンを接種していないマウスを致死量のウイルスから防御したことから,ウイルスの防御に十分な免疫グロブリンG2の産生がTh1細胞により誘導されることが示された.同様の結果は,ウイルスワクチンを接種した場合のみならず,卵白アルブミンを抗原として認識するインターフェロンγを産生するTh1細胞を移入したマウスに卵白アルブミンを投与した際にも卵白アルブミンに特異的な免疫グロブリンG2の産生が認められた.これらの結果より,Th1細胞がウイルスの中和活性をもつ免疫グロブリンG2の産生を誘導することが明らかにされた.
3.ウイルスの中和活性をもつ免疫グロブリンG2の産生を誘導するTh1細胞はB細胞濾胞に存在する
濾胞性ヘルパーT細胞がB細胞と相互作用して免疫グロブリンGの産生を誘導する場は胚中心であるが,濾胞性ヘルパーT細胞に依存しない免疫グロブリンGの産生はおもにB細胞濾胞の外で起こると考えられてきた9).インターフェロンγレポーターマウスを用いた解析において,インターフェロンγを産生するTh1細胞は,B細胞濾胞の外のみならずB細胞濾胞の内部にも認められた.また,T細胞をもたない遺伝子改変マウスにTh1細胞を移入した際にも,移入されたTh1細胞は脾臓のB細胞濾胞の内部に到達した.これらのことから,インターフェロンγを産生するTh1細胞は活性化したのちB細胞濾胞へと移動し,ウイルス抗原に特異的なB細胞と相互作用することによりウイルスの中和活性をもつ免疫グロブリンG2の産生を誘導することが示唆された.
4.ウイルスの中和活性をもつ免疫グロブリンG2の産生においてTh1細胞から分泌されるインターロイキン21が関与する
サイトカインであるインターロイキン21は濾胞性ヘルパーT細胞から分泌され,胚中心における免疫グロブリンGの産生に重要な役割を担うことが知られている10).T細胞に特異的にインターロイキン21を欠損させたマウスにおいてはウイルスに特異的な免疫グロブリンG1および免疫グロブリンG2いずれの抗体価も減少したことから,T細胞からの分泌されるインターロイキン21がウイルスの中和活性をもつ免疫グロブリンG2の産生にも必要であることが示唆された.さらに,インターフェロンγおよびインターロイキン21の二重レポーターマウスを用いた解析により,ウイルスワクチンの接種によりインターフェロンγおよびインターロイキン21を産生するTh1細胞の分化が誘導されることが示された.このインターロイキン21を産生するTh1細胞を移入したマウスにおいては,ウイルスの中和活性をもつ免疫グロブリンG2の産生が増強したことから,Th1細胞によるウイルスの中和活性をもつ免疫グロブリンG2の産生の誘導にはインターロイキン21が関与することが明らかにされた.
おわりに
近年の濾胞性ヘルパーT細胞についての研究の進展にともない,免疫グロブリンGの産生はおもに胚中心において濾胞性ヘルパーT細胞に依存的に起こるという考えが主流になっている.そのため,新型ワクチンの開発においても濾胞性ヘルパーT細胞の活性化が目標のひとつとされる11).しかしながら,この研究により,胚中心や濾胞性ヘルパーT細胞に依存せずにウイルスの中和活性をもつ免疫グロブリンG2の産生が誘導されることが明らかにされた(図1).濾胞性ヘルパーT細胞による胚中心における高親和性の免疫グロブリンGの産生においては,濾胞性ヘルパーT細胞と胚中心B細胞とがくり返し相互作用することによるB細胞の選択が必要なため,相応の時間がかかる.また,1種類のウイルス株に対し親和性が高いことは,ウイルスが変異した際に対応できる可能性が低くなることが考えられる.これらの点において,Th1細胞により産生の誘導された免疫グロブリンG2は,低親和性であるものの十分なウイルス中和活性をもち,広範な変異ウイルスに迅速に対応できると考えられる.また,Th1細胞の移入のみで,ウイルスが感染した際にすみやかな中和活性をもつ免疫グロブリンG2の産生が誘導されたことは,抗原の立体構造に左右されるB細胞の誘導に依存する通常のワクチンを補完する,Th1細胞を標的としたユニバーサルワクチンに道を開く成果である.
文 献
- Neumann, G., Noda, T., Kawaoka, Y. et al.: Emergence and pandemic potential of swine-origin H1N1 influenza virus. Nature, 459, 931-939 (2009)[PubMed]
- Swain, S. L., McKinstry, K. K. & Strutt, T. M.: Expanding roles for CD4+ T cells in immunity to viruses. Nat. Rev. Immunol., 12, 136-148 (2012)[PubMed]
- Zhu, J., Yamane, H. & Paul, W. E.: Differentiation of effector CD4 T cell populations. Annu. Rev. Immunol., 28, 445-489 (2010)[PubMed]
- Huber, V. C., McKeon R. M., McCullers. J. A. et al.: Distinct contributions of vaccine-induced immunoglobulin G1 (IgG1) and IgG2a antibodies to protective immunity against influenza. Clin. Vaccine Immunol., 13, 981-990 (2006)[PubMed]
- Snapper, C. M. & Paul, W. E.: Interferon-gamma and B cell stimulatory factor-1 reciprocally regulate Ig isotype production. Science, 236, 944-947 (1987)[PubMed]
- De Silva, N. S. & Klein, U.: Dynamics of B cells in germinal centres. Nat. Rev. Immunol., 15, 137-148 (2015)[PubMed]
- Nurieva, R. I., Chung, Y., Dong, C. et al.: Bcl6 mediates the development of T follicular helper cells. Science, 325, 1001-1005 (2009)[PubMed]
- Johnston, R. J., Poholek, A. C., Crotty, S. et al.: Bcl6 and Blimp-1 are reciprocal and antagonistic regulators of T follicular helper cell differentiation. Science, 325, 1006-1010 (2009)[PubMed]
- Cunningham, A. F., Gaspal, F., MacLennan, I. C. M. et al.: Salmonella induces a switched antibody response without germinal centers that impedes the extracellular spread of infection. J. Immunol., 178, 6200-6207 (2007)[PubMed]
- Ozaki, K., Spolski, R., Leonard, W. J. et al.: A critical role for IL-21 in regulating immunoglobulin production. Science, 298, 1630-1634 (2002)[PubMed]
- Crotty, S.: T follicular helper cell differentiation, function, and roles in disease. Immunity, 41, 529-542 (2014)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2006年 大阪大学大学院薬学研究科にて博士号取得,同年 米国Maryland大学Research Associate,2009年 国立感染症研究所 研究員を経て,2011年より理化学研究所免疫アレルギー研究センター(現 統合生命医科学研究センター)研究員.
研究テーマ:ウイルスの感染に対する免疫応答.
久保 允人(Masato Kubo)
東京理科大学生命医科学研究所 教授.
研究室URL:http://www.rs.noda.tus.ac.jp/~ribsjm/kubolab/index.html
© 2016 宮内浩典・久保允人 Licensed under CC 表示 2.1 日本