K48/K63分岐型のユビキチン鎖はNF-κBシグナルを制御する
大竹史明・佐伯 泰・田中啓二
(東京都医学総合研究所生体分子先端研究分野 蛋白質代謝研究室)
email:田中啓二
DOI: 10.7875/first.author.2016.109
The K48-K63 branched ubiquitin chain regulates NF-κB signaling.
Fumiaki Ohtake, Yasushi Saeki, Satoshi Ishido, Jun Kanno, Keiji Tanaka
Molecular Cell, 64, 251-266 (2016)
タンパク質のユビキチン化はプロテアソームに依存したタンパク質分解にくわえ,シグナル伝達やDNA損傷応答など多彩な細胞機能に関与する.こうしたユビキチン化の多様な機能は,異なる形状のユビキチン鎖により担われる.たとえば,Lys48において連結したユビキチン鎖(K48鎖)はタンパク質分解を,Lys63において連結したユビキチン鎖(K63鎖)はシグナル伝達などを制御する.しかし,異なる形状のユビキチン鎖の混在した複雑なユビキチン化の意義についてはよくわかっていなかった.筆者らは,この研究において,質量分析法を用いたユビキチン鎖の定量法を応用し,K48鎖とK63鎖が枝分かれをしたK48/K63分岐鎖を発見し,その定量法を構築した.その結果,K48/K63分岐型のユビキチン鎖は細胞に豊富に存在すること,さらに,炎症応答をつかさどるNF-κBシグナルを正に制御することが見い出された.これらの知見から,タンパク質のユビキチン化のさらなる多様性が明らかにされた.
ユビキチンは76アミノ酸残基からなる,真核生物において進化的に保存された低分子量のタンパク質であり,そのC末端が標的となるタンパク質のLysに付加する.この反応はユビキチン活性化酵素,ユビキチン連結酵素,ユビキチンリガーゼという一連の酵素により触媒される1).タンパク質のユビキチン化は可逆的であり,脱ユビキチン化酵素により脱ユビキチン化される.ユビキチンは7つのLysをもつため,標的となるタンパク質のユビキチン化と同様に,ユビキチンそれ自体にもユビキチンが付加し,ユビキチンどうしが連結してユビキチン鎖が形成される2).また,ユビキチンのN末端にもユビキチンのC末端が付加しうる3).したがって,ユビキチン鎖の連結の様式はあわせて8種類ある.
ユビキチンのもっともよく知られた機能は,プロテアソームに依存的なタンパク質分解の目印になることである.しかし,近年の研究により,ユビキチンはエンドサイトーシス,遺伝子の発現,DNA損傷応答,細胞内シグナル伝達など,タンパク質分解にとどまらない多彩な機能をもつことが明らかにされた.このようなユビキチンの多様な機能は,異なる形状のユビキチン鎖により特異的に制御される.Lys48において連結したユビキチン鎖(K48鎖)はプロテアソームに依存的なタンパク質分解を促進する一方,Lys63において連結したユビキチン鎖(K63鎖)はNF-κBシグナルなどのシグナル伝達,DNA損傷応答,エンドサイトーシスなどを制御する.また,N末端において連結したユビキチン鎖(M1鎖)もNF-κBシグナル伝達を仲介する.これらの機能は,特異的なユビキチン鎖を形成するユビキチン連結酵素やユビキチンリガーゼ,ユビキチン鎖の形状を特異的に認識して下流のシグナルを活性化する解読タンパク質,特異的なユビキチン鎖を切断してシグナルを不活性化する脱ユビキチン化酵素により緻密に制御される4).
近年,単一の様式により連結したユビキチン鎖だけでなく,連結の様式が混在した複雑な形状をもつユビキチン鎖も存在することが明らかにされた.そのひとつが,ひとつのユビキチン分子において2つのLysが連結に使われる“分岐型ユビキチン鎖”である.しかし,分岐型ユビキチン鎖に関する知見は少なく,これまでに,in vitroにおいて非特異的に形成された分岐型ユビキチン鎖はプロテアソームに依存的なタンパク質分解を阻害すること5),反対に,哺乳類の培養細胞においてK11鎖とK48鎖の分岐型ユビキチン鎖がタンパク質分解を促進することが報告された6).しかし,実際に分岐型ユビキチン鎖が細胞にどのくらい存在するのかは不明であった.くわえて,分岐型ユビキチン鎖に機能的な意義があるのか,あるいは,不要な副産物なのかについても見解は一致していない.
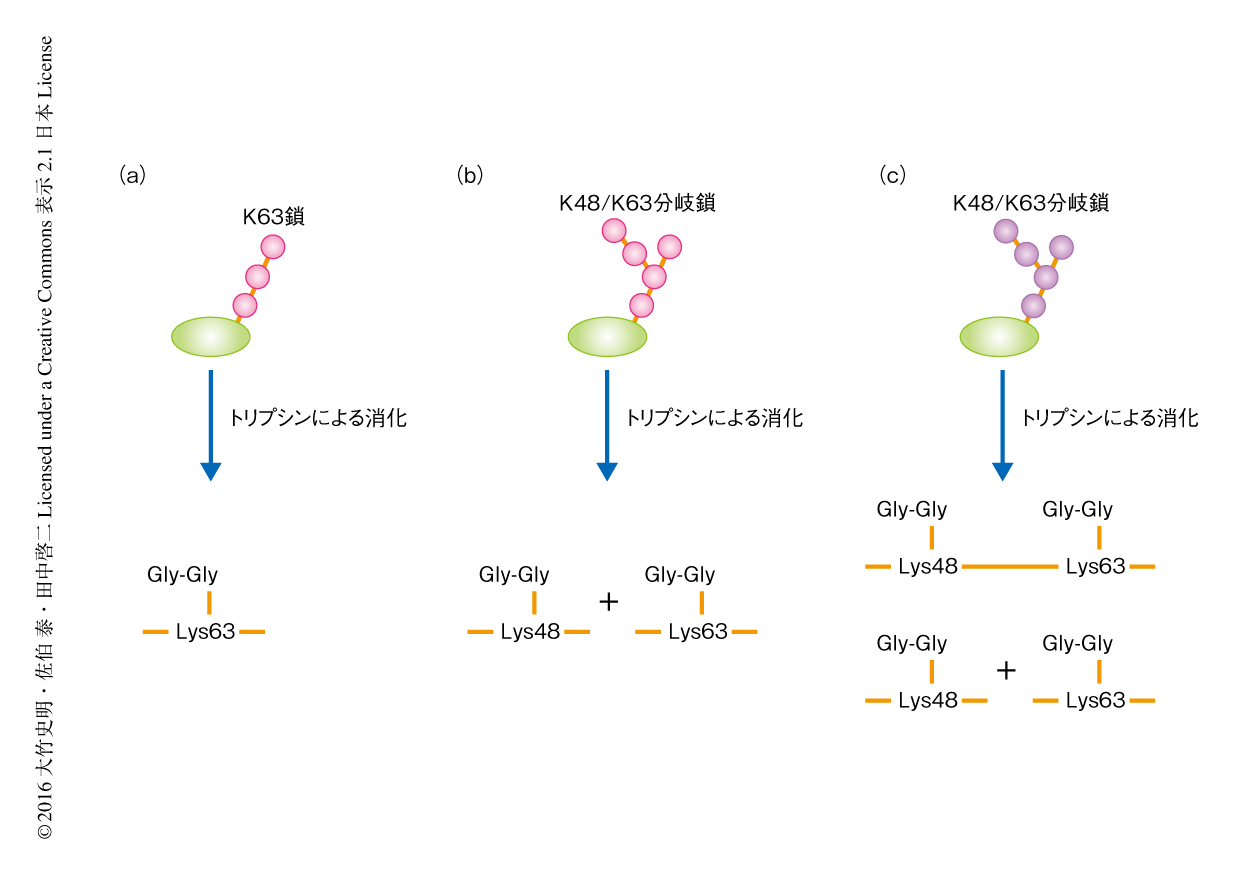
分岐型ユビキチン鎖に関する研究がこれまで進まなかった理由として,その識別の困難さがあげられる.ユビキチン鎖の形状のもっとも厳密な識別法は質量分析法によるものである.ユビキチン鎖をトリプシンにより消化すると,標的になるLysに付加されたユビキチンのC末端の配列が残存するため特徴的なペプチド断片が産生され,これを質量分析法により検出し定量することができる(図1a).しかし,トリプシンにより標的となるLys以外のLysおよびArgも切断されることにより高次構造に関する情報は失われる.仮に,ユビキチン鎖が分岐していたとしても,トリプシンにより消化されたペプチド断片からは2種類のユビキチン鎖が検出され,それが同一のユビキチン分子において生じた分岐によるものなのか,2種類のユビキチン鎖は別々に存在していたのかを識別することはできない(図1b).そのため,分岐型ユビキチン鎖は“invisible linkage”ともいわれていた7).
分岐型ユビキチン鎖の解析にあたり,量的にも機能的にももっとも主要なユビキチン鎖であるK48鎖およびK63鎖に着目した.K48鎖とK63鎖が枝分かれをしたK48/K63分岐鎖を質量分析法に供した場合,トリプシンによりArg54において切断されるためK48鎖とK63鎖は別々に検出される.ここで,Arg54に変異を導入すれば,Lys48およびLys63においてユビキチンと連結した単一のペプチド断片が検出できる可能性に着目した(図1c).そこで,Arg54をAlaに置換したユビキチンの変異体を細胞に発現させ質量分析法に供したところ,K48/K63分岐鎖に由来するペプチド断片が検出され,細胞にはK48/K63分岐型のユビキチン鎖の存在することが判明した.
細胞におけるK48/K63分岐鎖の定量法の構築を試みた.ドキシサイクリンにより発現を誘導することのできるshRNAにより内在性のユビキチンをノックダウンすることにより,細胞に存在するユビキチンをArg54をAlaに置換した変異体に置換した.また,質量分析法による絶対定量のため,安定同位体により標識した合成ペプチドを内部標準とした.この系を用いたところ,ドキシサイクリンに依存的に内在性のユビキチンはArg54をAlaに置換した変異体に置換された.このとき,Lys48およびLys63においてユビキチンと連結したペプチド断片は,Lys63においてユビキチンと連結したすべてのペプチド断片の約20%をしめ,K63鎖のうちかなりの割合がK48/K63分岐鎖として存在することが推察された.さらに,プロテアソーム阻害剤の存在のもとでは,Lys63においてユビキチンと連結したペプチド断片の半数近くがLys48およびLys63においてユビキチンと連結したペプチド断片であった.以上の結果から,K48/K63分岐鎖は細胞に豊富に存在することが示唆された.
K48/K63分岐鎖の細胞における機能について,K63鎖の機能がK48/K63分岐鎖により影響される可能性について検討した結果,炎症性サイトカインであるインターロイキン1βのシグナルに依存的にK63鎖を形成してNF-κBシグナルを活性化するユビキチンリガーゼTRAF6との関連が見い出された.TRAF6はインターロイキン1βの刺激により自己ユビキチン化されるが,そのユビキチン鎖を定量解析したところ,K48/K63分岐鎖が含まれ,また,その形成はインターロイキン1βの刺激に依存的であった.
TRAF6はK63鎖を形成するため,未知の酵素がTRAF6あるいはK63鎖と相互作用してLys48における分岐を形成することが推察された.そこで,活性化型のTRAF6と相互作用するタンパク質を探索したところ,ユビキチンリガーゼHUWE1が同定された.HUWE1は約490 kDaの巨大なタンパク質であり,ユビキチンリガーゼ活性をもつHECTドメインおよびユビキチン結合ドメインであるUBA-UIMドメインをもつ8).Arg54をAlaに置換したユビキチンの組換え体を用いてin vitroにおいて解析した結果,HUWE1はUBA-UIMドメインを介してTRAF6により修飾されたK63鎖と相互作用し,そこにLys48における分岐を挿入することによりK48/K63分岐鎖を形成するというモデルが示唆された(図2).
NF-κBシグナル伝達系におけるK48/K63分岐鎖の機能的な意義について検討するため,HUWE1をノックダウンしたところ,K48/K63分岐鎖の減少にくわえ,NF-κBの活性およびNF-κBの標的となる遺伝子の発現の低下がみられた.この結果から,HUWE1によるK48/K63分岐鎖の形成はNF-κBシグナルを正に制御することが示唆された.それでは,K48/K63分岐鎖はどのような機構によりNF-κBシグナルを増強するのだろうか? TRAF6により形成されたK63鎖は脱ユビキチン化酵素CYLDにより切断されシグナルが遮断されることが知られている.そこで,CYLDの活性への影響について検討したところ,CYLDによるK63鎖の切断はLys48における分岐により阻害された.したがって,K48/K63分岐鎖の作用点のひとつはCYLDの阻害によるシグナルの増強であると考えられた.この結果から,K48/K63分岐鎖がK48鎖あるいはK63鎖とは異なる固有の役割をもつことが示された.
この研究により,機能的なユビキチン鎖はこれまで詳細に解析されてきた8種類のみではなく,異なる形状のユビキチン鎖が分岐により組み合わさることにより新たな連結の様式をもつユビキチン鎖として機能することが明らかにされた.定量解析の結果から,分岐型ユビキチン鎖は決して例外的な事象ではなく,むしろ,細胞においてありふれた事象である可能性が示唆された.この研究によりNF-κBシグナルにおけるK48/K63分岐鎖の役割が明らかにされたが,分岐型ユビキチン鎖の関与する細胞機能のさらなる解析,その形成酵素や解読タンパク質の同定は今後の課題である.
略歴:東京都医学総合研究所生体分子先端研究分野 主席研究員.
佐伯 泰(Yasushi Saeki)
東京都医学総合研究所生体分子先端研究分野 副参事研究員.
田中 啓二(Keiji Tanaka)
東京都医学総合研究所 所長.
研究室URL:http://www.igakuken.or.jp/pro-meta/index.html
© 2016 大竹史明・佐伯 泰・田中啓二 Licensed under CC 表示 2.1 日本
(東京都医学総合研究所生体分子先端研究分野 蛋白質代謝研究室)
email:田中啓二
DOI: 10.7875/first.author.2016.109
The K48-K63 branched ubiquitin chain regulates NF-κB signaling.
Fumiaki Ohtake, Yasushi Saeki, Satoshi Ishido, Jun Kanno, Keiji Tanaka
Molecular Cell, 64, 251-266 (2016)
要 約
タンパク質のユビキチン化はプロテアソームに依存したタンパク質分解にくわえ,シグナル伝達やDNA損傷応答など多彩な細胞機能に関与する.こうしたユビキチン化の多様な機能は,異なる形状のユビキチン鎖により担われる.たとえば,Lys48において連結したユビキチン鎖(K48鎖)はタンパク質分解を,Lys63において連結したユビキチン鎖(K63鎖)はシグナル伝達などを制御する.しかし,異なる形状のユビキチン鎖の混在した複雑なユビキチン化の意義についてはよくわかっていなかった.筆者らは,この研究において,質量分析法を用いたユビキチン鎖の定量法を応用し,K48鎖とK63鎖が枝分かれをしたK48/K63分岐鎖を発見し,その定量法を構築した.その結果,K48/K63分岐型のユビキチン鎖は細胞に豊富に存在すること,さらに,炎症応答をつかさどるNF-κBシグナルを正に制御することが見い出された.これらの知見から,タンパク質のユビキチン化のさらなる多様性が明らかにされた.
はじめに
ユビキチンは76アミノ酸残基からなる,真核生物において進化的に保存された低分子量のタンパク質であり,そのC末端が標的となるタンパク質のLysに付加する.この反応はユビキチン活性化酵素,ユビキチン連結酵素,ユビキチンリガーゼという一連の酵素により触媒される1).タンパク質のユビキチン化は可逆的であり,脱ユビキチン化酵素により脱ユビキチン化される.ユビキチンは7つのLysをもつため,標的となるタンパク質のユビキチン化と同様に,ユビキチンそれ自体にもユビキチンが付加し,ユビキチンどうしが連結してユビキチン鎖が形成される2).また,ユビキチンのN末端にもユビキチンのC末端が付加しうる3).したがって,ユビキチン鎖の連結の様式はあわせて8種類ある.
ユビキチンのもっともよく知られた機能は,プロテアソームに依存的なタンパク質分解の目印になることである.しかし,近年の研究により,ユビキチンはエンドサイトーシス,遺伝子の発現,DNA損傷応答,細胞内シグナル伝達など,タンパク質分解にとどまらない多彩な機能をもつことが明らかにされた.このようなユビキチンの多様な機能は,異なる形状のユビキチン鎖により特異的に制御される.Lys48において連結したユビキチン鎖(K48鎖)はプロテアソームに依存的なタンパク質分解を促進する一方,Lys63において連結したユビキチン鎖(K63鎖)はNF-κBシグナルなどのシグナル伝達,DNA損傷応答,エンドサイトーシスなどを制御する.また,N末端において連結したユビキチン鎖(M1鎖)もNF-κBシグナル伝達を仲介する.これらの機能は,特異的なユビキチン鎖を形成するユビキチン連結酵素やユビキチンリガーゼ,ユビキチン鎖の形状を特異的に認識して下流のシグナルを活性化する解読タンパク質,特異的なユビキチン鎖を切断してシグナルを不活性化する脱ユビキチン化酵素により緻密に制御される4).
近年,単一の様式により連結したユビキチン鎖だけでなく,連結の様式が混在した複雑な形状をもつユビキチン鎖も存在することが明らかにされた.そのひとつが,ひとつのユビキチン分子において2つのLysが連結に使われる“分岐型ユビキチン鎖”である.しかし,分岐型ユビキチン鎖に関する知見は少なく,これまでに,in vitroにおいて非特異的に形成された分岐型ユビキチン鎖はプロテアソームに依存的なタンパク質分解を阻害すること5),反対に,哺乳類の培養細胞においてK11鎖とK48鎖の分岐型ユビキチン鎖がタンパク質分解を促進することが報告された6).しかし,実際に分岐型ユビキチン鎖が細胞にどのくらい存在するのかは不明であった.くわえて,分岐型ユビキチン鎖に機能的な意義があるのか,あるいは,不要な副産物なのかについても見解は一致していない.
分岐型ユビキチン鎖に関する研究がこれまで進まなかった理由として,その識別の困難さがあげられる.ユビキチン鎖の形状のもっとも厳密な識別法は質量分析法によるものである.ユビキチン鎖をトリプシンにより消化すると,標的になるLysに付加されたユビキチンのC末端の配列が残存するため特徴的なペプチド断片が産生され,これを質量分析法により検出し定量することができる(図1a).しかし,トリプシンにより標的となるLys以外のLysおよびArgも切断されることにより高次構造に関する情報は失われる.仮に,ユビキチン鎖が分岐していたとしても,トリプシンにより消化されたペプチド断片からは2種類のユビキチン鎖が検出され,それが同一のユビキチン分子において生じた分岐によるものなのか,2種類のユビキチン鎖は別々に存在していたのかを識別することはできない(図1b).そのため,分岐型ユビキチン鎖は“invisible linkage”ともいわれていた7).
1.K48/K63分岐型のユビキチン鎖の同定
分岐型ユビキチン鎖の解析にあたり,量的にも機能的にももっとも主要なユビキチン鎖であるK48鎖およびK63鎖に着目した.K48鎖とK63鎖が枝分かれをしたK48/K63分岐鎖を質量分析法に供した場合,トリプシンによりArg54において切断されるためK48鎖とK63鎖は別々に検出される.ここで,Arg54に変異を導入すれば,Lys48およびLys63においてユビキチンと連結した単一のペプチド断片が検出できる可能性に着目した(図1c).そこで,Arg54をAlaに置換したユビキチンの変異体を細胞に発現させ質量分析法に供したところ,K48/K63分岐鎖に由来するペプチド断片が検出され,細胞にはK48/K63分岐型のユビキチン鎖の存在することが判明した.
2.K48/K63分岐鎖の定量法の構築
細胞におけるK48/K63分岐鎖の定量法の構築を試みた.ドキシサイクリンにより発現を誘導することのできるshRNAにより内在性のユビキチンをノックダウンすることにより,細胞に存在するユビキチンをArg54をAlaに置換した変異体に置換した.また,質量分析法による絶対定量のため,安定同位体により標識した合成ペプチドを内部標準とした.この系を用いたところ,ドキシサイクリンに依存的に内在性のユビキチンはArg54をAlaに置換した変異体に置換された.このとき,Lys48およびLys63においてユビキチンと連結したペプチド断片は,Lys63においてユビキチンと連結したすべてのペプチド断片の約20%をしめ,K63鎖のうちかなりの割合がK48/K63分岐鎖として存在することが推察された.さらに,プロテアソーム阻害剤の存在のもとでは,Lys63においてユビキチンと連結したペプチド断片の半数近くがLys48およびLys63においてユビキチンと連結したペプチド断片であった.以上の結果から,K48/K63分岐鎖は細胞に豊富に存在することが示唆された.
3.K48/K63分岐鎖の形成酵素
K48/K63分岐鎖の細胞における機能について,K63鎖の機能がK48/K63分岐鎖により影響される可能性について検討した結果,炎症性サイトカインであるインターロイキン1βのシグナルに依存的にK63鎖を形成してNF-κBシグナルを活性化するユビキチンリガーゼTRAF6との関連が見い出された.TRAF6はインターロイキン1βの刺激により自己ユビキチン化されるが,そのユビキチン鎖を定量解析したところ,K48/K63分岐鎖が含まれ,また,その形成はインターロイキン1βの刺激に依存的であった.
TRAF6はK63鎖を形成するため,未知の酵素がTRAF6あるいはK63鎖と相互作用してLys48における分岐を形成することが推察された.そこで,活性化型のTRAF6と相互作用するタンパク質を探索したところ,ユビキチンリガーゼHUWE1が同定された.HUWE1は約490 kDaの巨大なタンパク質であり,ユビキチンリガーゼ活性をもつHECTドメインおよびユビキチン結合ドメインであるUBA-UIMドメインをもつ8).Arg54をAlaに置換したユビキチンの組換え体を用いてin vitroにおいて解析した結果,HUWE1はUBA-UIMドメインを介してTRAF6により修飾されたK63鎖と相互作用し,そこにLys48における分岐を挿入することによりK48/K63分岐鎖を形成するというモデルが示唆された(図2).
4.K48/K63分岐鎖の細胞における機能
NF-κBシグナル伝達系におけるK48/K63分岐鎖の機能的な意義について検討するため,HUWE1をノックダウンしたところ,K48/K63分岐鎖の減少にくわえ,NF-κBの活性およびNF-κBの標的となる遺伝子の発現の低下がみられた.この結果から,HUWE1によるK48/K63分岐鎖の形成はNF-κBシグナルを正に制御することが示唆された.それでは,K48/K63分岐鎖はどのような機構によりNF-κBシグナルを増強するのだろうか? TRAF6により形成されたK63鎖は脱ユビキチン化酵素CYLDにより切断されシグナルが遮断されることが知られている.そこで,CYLDの活性への影響について検討したところ,CYLDによるK63鎖の切断はLys48における分岐により阻害された.したがって,K48/K63分岐鎖の作用点のひとつはCYLDの阻害によるシグナルの増強であると考えられた.この結果から,K48/K63分岐鎖がK48鎖あるいはK63鎖とは異なる固有の役割をもつことが示された.
おわりに
この研究により,機能的なユビキチン鎖はこれまで詳細に解析されてきた8種類のみではなく,異なる形状のユビキチン鎖が分岐により組み合わさることにより新たな連結の様式をもつユビキチン鎖として機能することが明らかにされた.定量解析の結果から,分岐型ユビキチン鎖は決して例外的な事象ではなく,むしろ,細胞においてありふれた事象である可能性が示唆された.この研究によりNF-κBシグナルにおけるK48/K63分岐鎖の役割が明らかにされたが,分岐型ユビキチン鎖の関与する細胞機能のさらなる解析,その形成酵素や解読タンパク質の同定は今後の課題である.
文 献
- Hershko, A. & Ciechanover, A.: The ubiquitin system. Annu. Rev. Biochem., 67, 425-479 (1998)[PubMed]
- Komander, D. & Rape, M.: The ubiquitin code. Annu. Rev. Biochem., 81, 203-229 (2012)[PubMed]
- Iwai, K., Fujita, H. & Sasaki, Y.: Linear ubiquitin chains: NF-κB signalling, cell death and beyond. Nat. Rev. Mol. Cell Biol., 15, 503-508 (2014)[PubMed]
- Husnjak, K. & Dikic, I.: Ubiquitin-binding proteins: decoders of ubiquitin-mediated cellular functions. Annu. Rev. Biochem., 81, 291-322 (2012)[PubMed]
- Kim, H. T., Kim, K. P., Lledias, F. et al.: Certain pairs of ubiquitin-conjugating enzymes (E2s) and ubiquitin-protein ligases (E3s) synthesize nondegradable forked ubiquitin chains containing all possible isopeptide linkages. J. Biol. Chem., 282, 17375-17386 (2007)[PubMed]
- Meyer, H. J. & Rape, M.: Enhanced protein degradation by branched ubiquitin chains. Cell, 157, 910-921 (2014)[PubMed]
- Swatek, K. N. & Komander, D.: Ubiquitin modifications. Cell Res.,26, 399-422 (2016)[PubMed]
- Adhikary, S., Marinoni, F., Hock, A. et al.: The ubiquitin ligase HectH9 regulates transcriptional activation by Myc and is essential for tumor cell proliferation. Cell, 123, 409-421 (2005)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:東京都医学総合研究所生体分子先端研究分野 主席研究員.
佐伯 泰(Yasushi Saeki)
東京都医学総合研究所生体分子先端研究分野 副参事研究員.
田中 啓二(Keiji Tanaka)
東京都医学総合研究所 所長.
研究室URL:http://www.igakuken.or.jp/pro-meta/index.html
© 2016 大竹史明・佐伯 泰・田中啓二 Licensed under CC 表示 2.1 日本