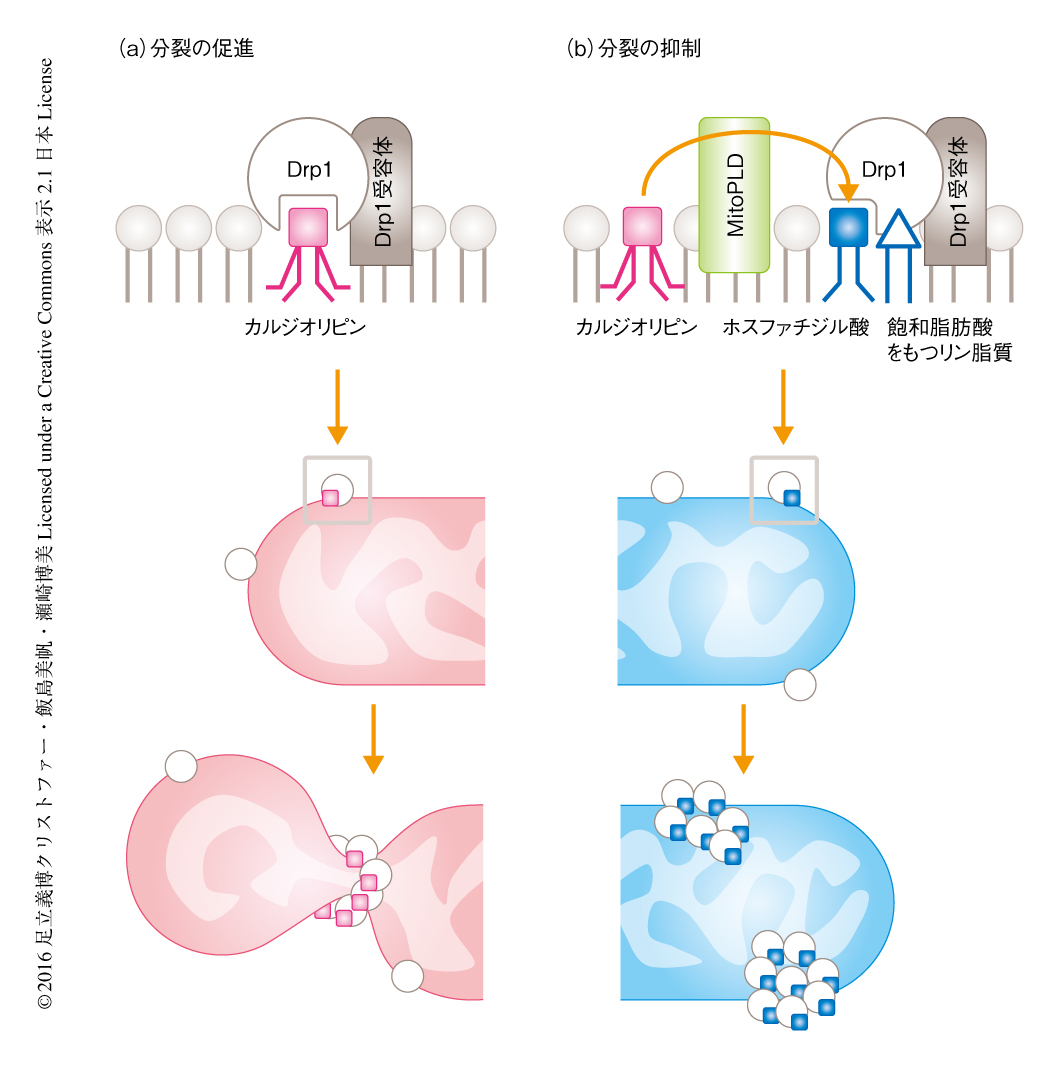
ホスファチジン酸および飽和脂肪酸をもつリン脂質はDrp1を介したミトコンドリアの分裂を抑制する
足立義博クリストファー・飯島美帆・瀬崎博美
(米国Johns Hopkins大学School of Medicine,Department of Cell Biology)
email:足立義博クリストファー,飯島美帆,瀬崎博美
DOI: 10.7875/first.author.2016.102
Coincident phosphatidic acid interaction restrains Drp1 in mitochondrial division.
Yoshihiro Adachi, Kie Itoh, Tatsuya Yamada, Kara L. Cerveny, Takamichi L. Suzuki, Patrick Macdonald, Michael A. Frohman, Rajesh Ramachandran, Miho Iijima, Hiromi Sesaki
Molecular Cell, 63, 1034-1043 (2016)
ミトコンドリアは分裂と融合をくり返すことにより細胞における形態および分布を制御する.ミトコンドリアの分裂を仲介するGTPaseであるDrp1は,ミトコンドリア外膜に存在する結合タンパク質によりミトコンドリアにリクルートされ重合体を形成する.ミトコンドリアにらせん状に巻きついたDrp1重合体はGTPの加水分解をエネルギー源としてミトコンドリアを分裂させると考えられる.今回,筆者らは,Drp1がリン脂質の親水性の頭部および疎水性の脂肪酸の両方を認識することにより,ミトコンドリアの分裂を制御する分子機構を発見した.Drp1はホスファチジン酸の頭部および飽和脂肪酸と特異的に結合したが,この結合はホスファチジン酸の頭部および飽和脂肪酸が同一のリン脂質分子にあることを必要としなかった.このリン脂質とのユニークな結合は,ミトコンドリアにおいてDrp1重合体の活性を抑制しミトコンドリアの分裂を阻害した.さらに,ミトコンドリアにおいてホスファチジン酸を産生する酵素であるMitoPLDは,Drp1と直接に結合したことからDrp1重合体の機能を制御するミクロな脂質の環境をミトコンドリアにおいて形成するはたらきを担うと考えられた.
ミトコンドリアは恒常的な分裂および融合を介して形態および機能を維持しており,その異常は多くの神経性疾患および代謝性疾患にかかわることが知られている1).ミトコンドリアの分裂にかかわる主要なタンパク質であるDrp1の機能的な欠損によりミトコンドリアは肥大あるいは伸長する.Drp1によるミトコンドリアの分裂は,マイトファジーとよばれるオートファジーを介した選択的なミトコンドリアの分解に必要であることから,Drp1の欠損は結果として損傷をうけたミトコンドリアの蓄積をひき起こす2,3).これまでに,Drp1の組織に特異的なノックアウトマウスは細胞に異常なミトコンドリアが蓄積することにより神経変性あるいは重大な心不全を示すことが報告されている4-6).
Drp1によるミトコンドリアの分裂は,1)受容体を介したミトコンドリア外膜への局在,2)GTPとの結合により促進される重合,3)GTPの加水分解による重合体の収縮,の3つの段階をへて起こるとされ1),おもに受容体との結合の段階および重合の段階において制御されると考えられたが,Drp1重合体の多くはミトコンドリアの分裂を開始しないことから,おそらく,最終の段階である重合体の収縮を制御する分子機構のあることが予想された.しかし,その機構はまったく未知であった.
エンドサイトーシスの際に細胞膜から小胞をしぼり切るはたらきをするダイナミンはホスファチジルイノシトールビスリン酸と結合するPHドメインを介して機能することが知られていた7).しかし,ダイナミンスーパーファミリーのひとつであるDrp1は既知の脂質結合ドメインをもたず,ミトコンドリアの分裂におけるリン脂質の機能はよくわかっていなかった.これまで,in vitroの実験系において,ミトコンドリアに固有のリン脂質であるカルジオリピンはDrp1と結合しそのGTPase活性を促進することが示されていた.しかしながら,Drp1とカルジオリピンとの結合はミトコンドリアからのシトクロムcの放出を介してアポトーシスを促進するが,ミトコンドリアの分裂にはかかわらないことも同時に報告され8,9),Drp1とリン脂質との結合の役割は未解明であった.そこで,精製したDrp1を用いてミトコンドリアの主要なリン脂質との結合について網羅的に解析した.その結果,Drp1はカルジオリピンにくわえ,ホスファチジン酸と特異的に結合した.さらに,Drp1とホスファチジン酸との結合を詳細に調べたところ,Drp1はホスファチジン酸の親水性の頭部だけでなく,脂肪酸の飽和の状態,脂肪酸の長さ,脂肪酸の数を認識し,飽和脂肪酸をもつホスファチジン酸と特異的に結合することが明らかにされた.
飽和脂肪酸をもつリン脂質と不飽和脂肪酸をもつリン脂質とを組み合わせたリポソームを作製し,Drp1とホスファチジン酸との結合についてさらに解析した.その結果,Drp1は飽和脂肪酸をもつホスファチジルコリン85%-不飽和脂肪酸をもつホスファチジン酸15%のリポソームと非常に強く結合し,対照として用いた飽和脂肪酸をもつホスファチジルコリンのみのリポソーム,あるいは,不飽和脂肪酸をもつホスファチジルコリン85%-不飽和脂肪酸をもつホスファチジン酸15%のリポソームとはわずかしか結合しなかった.この結果から,Drp1はホスファチジン酸の頭部,および,となりあったホスファチジルコリンの飽和脂肪酸を認識し,2つのリン脂質と同時に結合することにより実験に用いたリポソームと,そしておそらく,細胞においてはミトコンドリア外膜と結合する活性のあることが示された.いい換えれば,この2つの脂質を介したユニークな結合から,Drp1がホスファチジン酸の頭部および脂肪酸の飽和の状態という2つのシグナルにより制御されるという新しい制御機構が示唆された.さらに,Drp1は脂肪酸の飽和の状態を認識したことから,その一部が脂質二重層の内部にある疎水性の部位に入り込むと考えられた.Drp1のどのドメインが飽和脂肪酸をもつホスファチジン酸と結合するのかを明らかにするため,大腸菌を用いてDrp1のおのおののドメインを精製し脂質との結合について調べた.その結果,Drp1のストークドメインおよび可変ドメインがそれぞれ独立に飽和脂肪酸をもつホスファチジン酸と結合した.このことから,Drp1は2つの別々のドメインにより同じリン脂質を重複して認識する可能性が示された.
ホスファチジン酸がミトコンドリアに対しどのような機能をもつのかを理解するため,マウス胎仔線維芽細胞においてホスファチジン酸の量を減少あるいは増加させミトコンドリアの分裂にどのような影響をおよぼすのか解析した.マウス胎仔線維芽細胞においてホスファチジン酸の量を減少させるため,ホスファチジン酸をジアシルグリセロールに変換する酵素であるLipin1bを過剰に発現させたところミトコンドリアの断片化が観察され,ミトコンドリアの分裂の促進が示唆された.逆に,マウス胎仔線維芽細胞においてホスファチジン酸の量を増加させるため,カルジオリピンをホスファチジン酸に変換する酵素であるMitoPLDを過剰に発現させたところミトコンドリアは長く伸長し,ミトコンドリアの分裂が阻害された可能性が示された.この可能性をさらに検証するため,Drp1によるミトコンドリアの分裂をひき起こすミトコンドリア膜電位の阻害剤であるFCCP,あるいは,Ca2+イオノフォアである4Br-A23187を培地に添加してミトコンドリアを観察した.その結果,FCCPおよび4Br-A23187は対照となるマウス胎仔線維芽細胞に対しミトコンドリアの分裂をひき起こしたが,MitoPLDを過剰に発現したマウス胎仔線維芽細胞に対しては伸長したミトコンドリアに分裂をひき起こさなかった.このことから,MitoPLDの過剰な発現によるホスファチジン酸の増加はDrp1の機能を阻害しミトコンドリアの分裂を抑制することが示唆された.この結論をさらに支持する結果として,MitoPLDと同時にLipin1bを発現させて増加したホスファチジン酸をジアシルグリセロールに変換すると,ミトコンドリアの分裂の阻害が消失した.
ミトコンドリアに存在するカルジオリピンは不飽和脂肪酸をおもにもつことから,ミトコンドリアにおいてMitoPLDにより産生されるホスファチジン酸のほとんどは不飽和脂肪酸をもつと考えられた.したがって,リポソームを用いたin vitroにおける実験により示唆された,Drp1が不飽和脂肪酸をもつホスファチジン酸の頭部および隣接したほかのリン脂質の飽和脂肪酸を同時に認識し結合する分子機構は,ミトコンドリア外膜においても重要な役割をはたすと推測された.
脂肪酸の飽和の状態がミトコンドリアの分裂におよぼす影響について調べた.マウス胎仔線維芽細胞においてリン脂質の脂肪酸を飽和脂肪酸から不飽和脂肪酸へと変換する酵素であるSCD1を過剰に発現させ不飽和脂肪酸の割合を上昇させるとミトコンドリアの断片化がみられた.さらに,SCD1の阻害剤を用いて飽和脂肪酸から不飽和脂肪酸への変換を抑制するとミトコンドリアの分裂が阻害されミトコンドリアの伸長が観察された.これらの結果から,飽和脂肪酸はDrp1によるミトコンドリアの分裂を抑制すると考えられ,ホスファチジン酸と飽和脂肪酸の両方が細胞においてDrp1によるミトコンドリアの分裂を抑制することが明らかにされた.
ミトコンドリア外膜においてホスファチジン酸は微量であることが知られており10),また,どのような分布を示すのかもわかっていない.これらのことから,ミトコンドリアにおいてホスファチジン酸がDrp1と相互作用する機会を高める分子機構の存在する必要性あるいは可能性が想定された.そこで,ホスファチジン酸はミトコンドリア外膜のDrp1重合体の近傍においてMitoPLDにより産生されるという仮説をたてた.MitoPLD-GFP融合タンパク質をHEK293T細胞において過剰に発現し免疫沈降させた結果,Drp1が共沈降された.さらに,マウスの精巣を用い過剰発現系を用いない内在性の相互作用を抗MitoPLD抗体による免疫沈降により調べたところ,同様にMitoPLDとDrp1との結合が観察された.さらに,この相互作用が直接的な結合によるのかどうかを検討するため,膜貫通ドメインを欠損させたMitoPLDおよびDrp1を精製し,これらを用いて同様に免疫沈降した結果,MitoPLDとDrp1は直接に結合することが明らかにされた.これらのことから,MitoPLDはDrp1と結合しその近傍に局所的に高濃度のホスファチジン酸が存在する環境を形成し,その結果,ミトコンドリアの分裂を抑制すると考えられた.さらに,MitoPLDはDrp1だけでなくミトコンドリアの融合にかかわる主要なタンパク質であるmitofusin 1あるいはOpa1とも相互作用した.このことから,MitoPLDおよびホスファチジン酸がミトコンドリアの分裂および融合を同時に制御する可能性が示唆された.
ホスファチジン酸がどのような分子機構によりミトコンドリアの分裂を抑制するのかを知るため,飽和脂肪酸をもつホスファチジン酸がDrp1のGTPase活性におよぼす影響について,カルジオリピンあるいはホスファチジン酸を含むリポソームを用いて検証した.これまで報告されていたように,カルジオリピンはDrp1重合体の形成を促進しGTPase活性を上昇させた.一方,ホスファチジン酸はDrp1重合体が形成されたのちGTPase活性を亢進しなかった.この結果から,ホスファチジン酸がミトコンドリアの分裂において最終の段階であるDrp1重合体の収縮を阻害する可能性を考えた.細胞においてミトコンドリア外膜のホスファチジン酸を増加させるあるいは飽和脂肪酸をもつリン脂質を増加させることによりミトコンドリアの分裂を阻害した条件において,Drp1重合体の状態を定量的に解析した.その結果,ミトコンドリア外膜においてDrp1重合体の大きさが増加した.したがって,ホスファチジン酸および飽和脂肪酸をもつリン脂質はDrp1重合体が形成されたのちGTPase活性を抑制し,その結果,ミトコンドリアにおいてDrp1重合体の過剰な成長がひき起こされることが明らかにされた.
この研究により,Drp1とホスファチジン酸との結合によるミトコンドリアの分裂の制御における新しい分子機構が明らかにされた.Drp1とホスファチジン酸との結合はDrp1重合体が形成されたのちミトコンドリアを分裂させる最終の段階に必要なGTPase活性を阻害することによりミトコンドリアの分裂を抑制すると考えられた.さらに,MitoPLDはDrp1と直接に結合し,Drp1重合体の近傍にホスファチジン酸を多く含むミトコンドリアの分裂の抑制のためのミクロな脂質の環境を形成し,ミトコンドリアの分裂を制御することが示唆された(図1).これまで,ホスファチジン酸はmitofusinによるミトコンドリアの融合を促進と報告されている.今回,MitoPLDがDrp1だけでなくミトコンドリアの融合に必要なmitofusin1およびOpa1とも相互作用することが示された.このことから,MitoPLDはミトコンドリアの分裂および融合を協調して制御することが示唆される.ミトコンドリアの分裂および飽和脂肪酸をもつリン脂質は多くの疾患に関与しており,今回の発見がそれらの疾患の機序を理解することにより治療に結びつくことを期待する.
略歴:2010年 高知大学大学院医学系研究科博士課程 修了,2011年 北海道大学遺伝子病制御研究所 博士研究員を経て,2013年より米国Johns Hopkins大学School of Medicine博士研究員.
研究テーマ:ミトコンドリアの動態の制御機構.
関心事:2016年アメリカ合衆国大統領選挙.
飯島 美帆(Miho Iijima)
米国Johns Hopkins大学School of Medicine准教授.
研究室URL:http://cellbio.jhmi.edu/people/faculty/miho-iijima-phd
瀬崎 博美(Hiromi Sesaki)
米国Johns Hopkins大学School of Medicine准教授.
研究室URL:http://cellbio.jhmi.edu/people/faculty/hiromi-sesaki-phd
© 2016 足立義博クリストファー・飯島美帆・瀬崎博美 Licensed under CC 表示 2.1 日本
(米国Johns Hopkins大学School of Medicine,Department of Cell Biology)
email:足立義博クリストファー,飯島美帆,瀬崎博美
DOI: 10.7875/first.author.2016.102
Coincident phosphatidic acid interaction restrains Drp1 in mitochondrial division.
Yoshihiro Adachi, Kie Itoh, Tatsuya Yamada, Kara L. Cerveny, Takamichi L. Suzuki, Patrick Macdonald, Michael A. Frohman, Rajesh Ramachandran, Miho Iijima, Hiromi Sesaki
Molecular Cell, 63, 1034-1043 (2016)
要 約
ミトコンドリアは分裂と融合をくり返すことにより細胞における形態および分布を制御する.ミトコンドリアの分裂を仲介するGTPaseであるDrp1は,ミトコンドリア外膜に存在する結合タンパク質によりミトコンドリアにリクルートされ重合体を形成する.ミトコンドリアにらせん状に巻きついたDrp1重合体はGTPの加水分解をエネルギー源としてミトコンドリアを分裂させると考えられる.今回,筆者らは,Drp1がリン脂質の親水性の頭部および疎水性の脂肪酸の両方を認識することにより,ミトコンドリアの分裂を制御する分子機構を発見した.Drp1はホスファチジン酸の頭部および飽和脂肪酸と特異的に結合したが,この結合はホスファチジン酸の頭部および飽和脂肪酸が同一のリン脂質分子にあることを必要としなかった.このリン脂質とのユニークな結合は,ミトコンドリアにおいてDrp1重合体の活性を抑制しミトコンドリアの分裂を阻害した.さらに,ミトコンドリアにおいてホスファチジン酸を産生する酵素であるMitoPLDは,Drp1と直接に結合したことからDrp1重合体の機能を制御するミクロな脂質の環境をミトコンドリアにおいて形成するはたらきを担うと考えられた.
はじめに
ミトコンドリアは恒常的な分裂および融合を介して形態および機能を維持しており,その異常は多くの神経性疾患および代謝性疾患にかかわることが知られている1).ミトコンドリアの分裂にかかわる主要なタンパク質であるDrp1の機能的な欠損によりミトコンドリアは肥大あるいは伸長する.Drp1によるミトコンドリアの分裂は,マイトファジーとよばれるオートファジーを介した選択的なミトコンドリアの分解に必要であることから,Drp1の欠損は結果として損傷をうけたミトコンドリアの蓄積をひき起こす2,3).これまでに,Drp1の組織に特異的なノックアウトマウスは細胞に異常なミトコンドリアが蓄積することにより神経変性あるいは重大な心不全を示すことが報告されている4-6).
Drp1によるミトコンドリアの分裂は,1)受容体を介したミトコンドリア外膜への局在,2)GTPとの結合により促進される重合,3)GTPの加水分解による重合体の収縮,の3つの段階をへて起こるとされ1),おもに受容体との結合の段階および重合の段階において制御されると考えられたが,Drp1重合体の多くはミトコンドリアの分裂を開始しないことから,おそらく,最終の段階である重合体の収縮を制御する分子機構のあることが予想された.しかし,その機構はまったく未知であった.
1.Drp1は飽和脂肪酸をもつホスファチジン酸と結合する
エンドサイトーシスの際に細胞膜から小胞をしぼり切るはたらきをするダイナミンはホスファチジルイノシトールビスリン酸と結合するPHドメインを介して機能することが知られていた7).しかし,ダイナミンスーパーファミリーのひとつであるDrp1は既知の脂質結合ドメインをもたず,ミトコンドリアの分裂におけるリン脂質の機能はよくわかっていなかった.これまで,in vitroの実験系において,ミトコンドリアに固有のリン脂質であるカルジオリピンはDrp1と結合しそのGTPase活性を促進することが示されていた.しかしながら,Drp1とカルジオリピンとの結合はミトコンドリアからのシトクロムcの放出を介してアポトーシスを促進するが,ミトコンドリアの分裂にはかかわらないことも同時に報告され8,9),Drp1とリン脂質との結合の役割は未解明であった.そこで,精製したDrp1を用いてミトコンドリアの主要なリン脂質との結合について網羅的に解析した.その結果,Drp1はカルジオリピンにくわえ,ホスファチジン酸と特異的に結合した.さらに,Drp1とホスファチジン酸との結合を詳細に調べたところ,Drp1はホスファチジン酸の親水性の頭部だけでなく,脂肪酸の飽和の状態,脂肪酸の長さ,脂肪酸の数を認識し,飽和脂肪酸をもつホスファチジン酸と特異的に結合することが明らかにされた.
2.Drp1は2つのリン脂質分子のもつ頭部および脂肪酸を同時に認識し結合する
飽和脂肪酸をもつリン脂質と不飽和脂肪酸をもつリン脂質とを組み合わせたリポソームを作製し,Drp1とホスファチジン酸との結合についてさらに解析した.その結果,Drp1は飽和脂肪酸をもつホスファチジルコリン85%-不飽和脂肪酸をもつホスファチジン酸15%のリポソームと非常に強く結合し,対照として用いた飽和脂肪酸をもつホスファチジルコリンのみのリポソーム,あるいは,不飽和脂肪酸をもつホスファチジルコリン85%-不飽和脂肪酸をもつホスファチジン酸15%のリポソームとはわずかしか結合しなかった.この結果から,Drp1はホスファチジン酸の頭部,および,となりあったホスファチジルコリンの飽和脂肪酸を認識し,2つのリン脂質と同時に結合することにより実験に用いたリポソームと,そしておそらく,細胞においてはミトコンドリア外膜と結合する活性のあることが示された.いい換えれば,この2つの脂質を介したユニークな結合から,Drp1がホスファチジン酸の頭部および脂肪酸の飽和の状態という2つのシグナルにより制御されるという新しい制御機構が示唆された.さらに,Drp1は脂肪酸の飽和の状態を認識したことから,その一部が脂質二重層の内部にある疎水性の部位に入り込むと考えられた.Drp1のどのドメインが飽和脂肪酸をもつホスファチジン酸と結合するのかを明らかにするため,大腸菌を用いてDrp1のおのおののドメインを精製し脂質との結合について調べた.その結果,Drp1のストークドメインおよび可変ドメインがそれぞれ独立に飽和脂肪酸をもつホスファチジン酸と結合した.このことから,Drp1は2つの別々のドメインにより同じリン脂質を重複して認識する可能性が示された.
3.ホスファチジン酸はミトコンドリアの分裂を抑制する
ホスファチジン酸がミトコンドリアに対しどのような機能をもつのかを理解するため,マウス胎仔線維芽細胞においてホスファチジン酸の量を減少あるいは増加させミトコンドリアの分裂にどのような影響をおよぼすのか解析した.マウス胎仔線維芽細胞においてホスファチジン酸の量を減少させるため,ホスファチジン酸をジアシルグリセロールに変換する酵素であるLipin1bを過剰に発現させたところミトコンドリアの断片化が観察され,ミトコンドリアの分裂の促進が示唆された.逆に,マウス胎仔線維芽細胞においてホスファチジン酸の量を増加させるため,カルジオリピンをホスファチジン酸に変換する酵素であるMitoPLDを過剰に発現させたところミトコンドリアは長く伸長し,ミトコンドリアの分裂が阻害された可能性が示された.この可能性をさらに検証するため,Drp1によるミトコンドリアの分裂をひき起こすミトコンドリア膜電位の阻害剤であるFCCP,あるいは,Ca2+イオノフォアである4Br-A23187を培地に添加してミトコンドリアを観察した.その結果,FCCPおよび4Br-A23187は対照となるマウス胎仔線維芽細胞に対しミトコンドリアの分裂をひき起こしたが,MitoPLDを過剰に発現したマウス胎仔線維芽細胞に対しては伸長したミトコンドリアに分裂をひき起こさなかった.このことから,MitoPLDの過剰な発現によるホスファチジン酸の増加はDrp1の機能を阻害しミトコンドリアの分裂を抑制することが示唆された.この結論をさらに支持する結果として,MitoPLDと同時にLipin1bを発現させて増加したホスファチジン酸をジアシルグリセロールに変換すると,ミトコンドリアの分裂の阻害が消失した.
ミトコンドリアに存在するカルジオリピンは不飽和脂肪酸をおもにもつことから,ミトコンドリアにおいてMitoPLDにより産生されるホスファチジン酸のほとんどは不飽和脂肪酸をもつと考えられた.したがって,リポソームを用いたin vitroにおける実験により示唆された,Drp1が不飽和脂肪酸をもつホスファチジン酸の頭部および隣接したほかのリン脂質の飽和脂肪酸を同時に認識し結合する分子機構は,ミトコンドリア外膜においても重要な役割をはたすと推測された.
4.飽和脂肪酸はDrp1によるミトコンドリアの分裂を抑制する
脂肪酸の飽和の状態がミトコンドリアの分裂におよぼす影響について調べた.マウス胎仔線維芽細胞においてリン脂質の脂肪酸を飽和脂肪酸から不飽和脂肪酸へと変換する酵素であるSCD1を過剰に発現させ不飽和脂肪酸の割合を上昇させるとミトコンドリアの断片化がみられた.さらに,SCD1の阻害剤を用いて飽和脂肪酸から不飽和脂肪酸への変換を抑制するとミトコンドリアの分裂が阻害されミトコンドリアの伸長が観察された.これらの結果から,飽和脂肪酸はDrp1によるミトコンドリアの分裂を抑制すると考えられ,ホスファチジン酸と飽和脂肪酸の両方が細胞においてDrp1によるミトコンドリアの分裂を抑制することが明らかにされた.
5.MitoPLDはDrp1とミトコンドリアにおいて直接に結合する
ミトコンドリア外膜においてホスファチジン酸は微量であることが知られており10),また,どのような分布を示すのかもわかっていない.これらのことから,ミトコンドリアにおいてホスファチジン酸がDrp1と相互作用する機会を高める分子機構の存在する必要性あるいは可能性が想定された.そこで,ホスファチジン酸はミトコンドリア外膜のDrp1重合体の近傍においてMitoPLDにより産生されるという仮説をたてた.MitoPLD-GFP融合タンパク質をHEK293T細胞において過剰に発現し免疫沈降させた結果,Drp1が共沈降された.さらに,マウスの精巣を用い過剰発現系を用いない内在性の相互作用を抗MitoPLD抗体による免疫沈降により調べたところ,同様にMitoPLDとDrp1との結合が観察された.さらに,この相互作用が直接的な結合によるのかどうかを検討するため,膜貫通ドメインを欠損させたMitoPLDおよびDrp1を精製し,これらを用いて同様に免疫沈降した結果,MitoPLDとDrp1は直接に結合することが明らかにされた.これらのことから,MitoPLDはDrp1と結合しその近傍に局所的に高濃度のホスファチジン酸が存在する環境を形成し,その結果,ミトコンドリアの分裂を抑制すると考えられた.さらに,MitoPLDはDrp1だけでなくミトコンドリアの融合にかかわる主要なタンパク質であるmitofusin 1あるいはOpa1とも相互作用した.このことから,MitoPLDおよびホスファチジン酸がミトコンドリアの分裂および融合を同時に制御する可能性が示唆された.
6.飽和脂肪酸をもつホスファチジン酸はDrp1重合体の収縮を阻害する
ホスファチジン酸がどのような分子機構によりミトコンドリアの分裂を抑制するのかを知るため,飽和脂肪酸をもつホスファチジン酸がDrp1のGTPase活性におよぼす影響について,カルジオリピンあるいはホスファチジン酸を含むリポソームを用いて検証した.これまで報告されていたように,カルジオリピンはDrp1重合体の形成を促進しGTPase活性を上昇させた.一方,ホスファチジン酸はDrp1重合体が形成されたのちGTPase活性を亢進しなかった.この結果から,ホスファチジン酸がミトコンドリアの分裂において最終の段階であるDrp1重合体の収縮を阻害する可能性を考えた.細胞においてミトコンドリア外膜のホスファチジン酸を増加させるあるいは飽和脂肪酸をもつリン脂質を増加させることによりミトコンドリアの分裂を阻害した条件において,Drp1重合体の状態を定量的に解析した.その結果,ミトコンドリア外膜においてDrp1重合体の大きさが増加した.したがって,ホスファチジン酸および飽和脂肪酸をもつリン脂質はDrp1重合体が形成されたのちGTPase活性を抑制し,その結果,ミトコンドリアにおいてDrp1重合体の過剰な成長がひき起こされることが明らかにされた.
おわりに
この研究により,Drp1とホスファチジン酸との結合によるミトコンドリアの分裂の制御における新しい分子機構が明らかにされた.Drp1とホスファチジン酸との結合はDrp1重合体が形成されたのちミトコンドリアを分裂させる最終の段階に必要なGTPase活性を阻害することによりミトコンドリアの分裂を抑制すると考えられた.さらに,MitoPLDはDrp1と直接に結合し,Drp1重合体の近傍にホスファチジン酸を多く含むミトコンドリアの分裂の抑制のためのミクロな脂質の環境を形成し,ミトコンドリアの分裂を制御することが示唆された(図1).これまで,ホスファチジン酸はmitofusinによるミトコンドリアの融合を促進と報告されている.今回,MitoPLDがDrp1だけでなくミトコンドリアの融合に必要なmitofusin1およびOpa1とも相互作用することが示された.このことから,MitoPLDはミトコンドリアの分裂および融合を協調して制御することが示唆される.ミトコンドリアの分裂および飽和脂肪酸をもつリン脂質は多くの疾患に関与しており,今回の発見がそれらの疾患の機序を理解することにより治療に結びつくことを期待する.
文 献
- Roy, M., Reddy, P. H., Iijima, M. et al.: Mitochondrial division and fusion in metabolism. Curr. Opin. Cell Biol., 33, 111-118 (2015)[PubMed]
- Tanaka, A., Cleland, M. M., Xu, S. et al.: Proteasome and p97 mediate mitophagy and degradation of mitofusins induced by Parkin. J. Cell Biol., 191, 1367-1380 (2010)[PubMed]
- Twig, G., Elorza, A., Molina, A. J. et al.: Fission and selective fusion govern mitochondrial segregation and elimination by autophagy. EMBO J., 27, 433-446 (2008)[PubMed]
- Ishihara, T., Ban-Ishihara, R., Maeda, M. et al.: Dynamics of mtDNA nucleoids regulated by mitochondrial fission is essential for maintenance of homogeneously active mitochondria during neonatal heart development. Mol. Cell. Biol., 35, 211-223 (2015)[PubMed]
- Kageyama, Y., Zhang, Z., Roda, R. et al.: Mitochondrial division ensures the survival of postmitotic neurons by suppressing oxidative damage. J. Cell Biol., 197, 535-551 (2012)[PubMed]
- Kageyama, Y., Hoshijima, M., Seo, K. et al.: Parkin-independent mitophagy requires Drp1 and maintains the integrity of mammalian heart and brain. EMBO J., 33, 2798-2813 (2014)[PubMed]
- Ramachandran, R.: Vesicle scission: dynamin. Semin. Cell Dev. Biol., 22, 10-17 (2011)[PubMed]
- Stepanyants, N., Macdonald, P. J., Francy, C. A. et al.: Cardiolipin’s propensity for phase transition and its reorganization by dynamin-related protein 1 form a basis for mitochondrial membrane fission. Mol. Biol. Cell, 26, 3104-3116 (2015)[PubMed]
- Montessuit, S., Somasekharan, S. P., Terrones, O. et al.: Membrane remodeling induced by the dynamin-related protein Drp1 stimulates Bax oligomerization. Cell, 142, 889-901 (2010)[PubMed]
- Zinser, E., Sperka-Gottlieb, C. D., Fasch, E. V. et al.: Phospholipid synthesis and lipid composition of subcellular membranes in the unicellular eukaryote Saccharomyces cerevisiae. J. Bacteriol., 173, 2026-2034 (1991)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2010年 高知大学大学院医学系研究科博士課程 修了,2011年 北海道大学遺伝子病制御研究所 博士研究員を経て,2013年より米国Johns Hopkins大学School of Medicine博士研究員.
研究テーマ:ミトコンドリアの動態の制御機構.
関心事:2016年アメリカ合衆国大統領選挙.
飯島 美帆(Miho Iijima)
米国Johns Hopkins大学School of Medicine准教授.
研究室URL:http://cellbio.jhmi.edu/people/faculty/miho-iijima-phd
瀬崎 博美(Hiromi Sesaki)
米国Johns Hopkins大学School of Medicine准教授.
研究室URL:http://cellbio.jhmi.edu/people/faculty/hiromi-sesaki-phd
© 2016 足立義博クリストファー・飯島美帆・瀬崎博美 Licensed under CC 表示 2.1 日本