新規のコンディショナルプロテオミクス法による細胞においてZn2+の近傍に存在するタンパク質の同定
西川雄貴・浜地 格
(京都大学大学院工学研究科 合成・生物化学専攻生物有機化学分野)
email:西川雄貴,浜地 格
DOI: 10.7875/first.author.2016.100
A conditional proteomics approach to identify proteins involved in zinc homeostasis.
Takayuki Miki, Masashi Awa, Yuki Nishikawa, Shigeki Kiyonaka, Masaki Wakabayashi, Yasushi Ishihama, Itaru Hamachi
Nature Methods, 13, 931-937 (2016)
Zn2+によるシグナル伝達はさまざまな生理応答や疾患において重要な役割を担う.Zn2+の生理機能を詳細に理解するためには,細胞においてZn2+の近傍に存在するタンパク質を網羅的に解析することが重要である.筆者らは,Zn2+により活性化されるラベル化剤と最先端の質量分析法とを組み合わせることにより細胞においてZn2+の近傍に存在するタンパク質を同定する,新規のコンディショナルプロテオミクス法を開発した.この方法を用いることにより,グリオーマ細胞においてNOの刺激によるZn2+の時間的および空間的な変動と,それにともなうZn2+の近傍に存在するタンパク質の変化を追跡した.さらに,同定されたタンパク質から,いったん細胞質に放出されたZn2+を濃縮する未知の小胞は,ゴルジ体と粗面小胞体とのあいだを行き来する中間ベシクルであることが明らかにされた.
亜鉛はすべての生物にとり必須の金属であり,ヒトを含めた多くの生物の個体においてZn2+として大きく分けて2つのかたちで存在する.ひとつは,タンパク質と強く結合し,遺伝子の発現の制御や血液のpHの調整,アルコールなどの物質の代謝といった生命活動の維持に重要な役割をはたすものである.もうひとつは,特定の結合担体をもたない遊離の状態で発生や神経の活動などを制御するシグナル分子として機能するものである1).実際に,脳虚血や脳障害,てんかんやアルツハイマー病の患者の脳の組織において,Zn2+の濃度が大きく上昇することが知られている.
これまでに,Zn2+自体を可視化する技術はさかんに開発され,生きた組織あるいは細胞における濃度や分布の変動が直接に観察されるようになってきた2).しかし,細胞において時間や場所により変動するZn2+の近傍に存在しさまざまな生命活動を直接的あるいは間接的に制御するタンパク質を網羅的に調べる技術は開発されていなかった.そのため,Zn2+により制御される生命現象の全体像の理解は不十分なままであった.
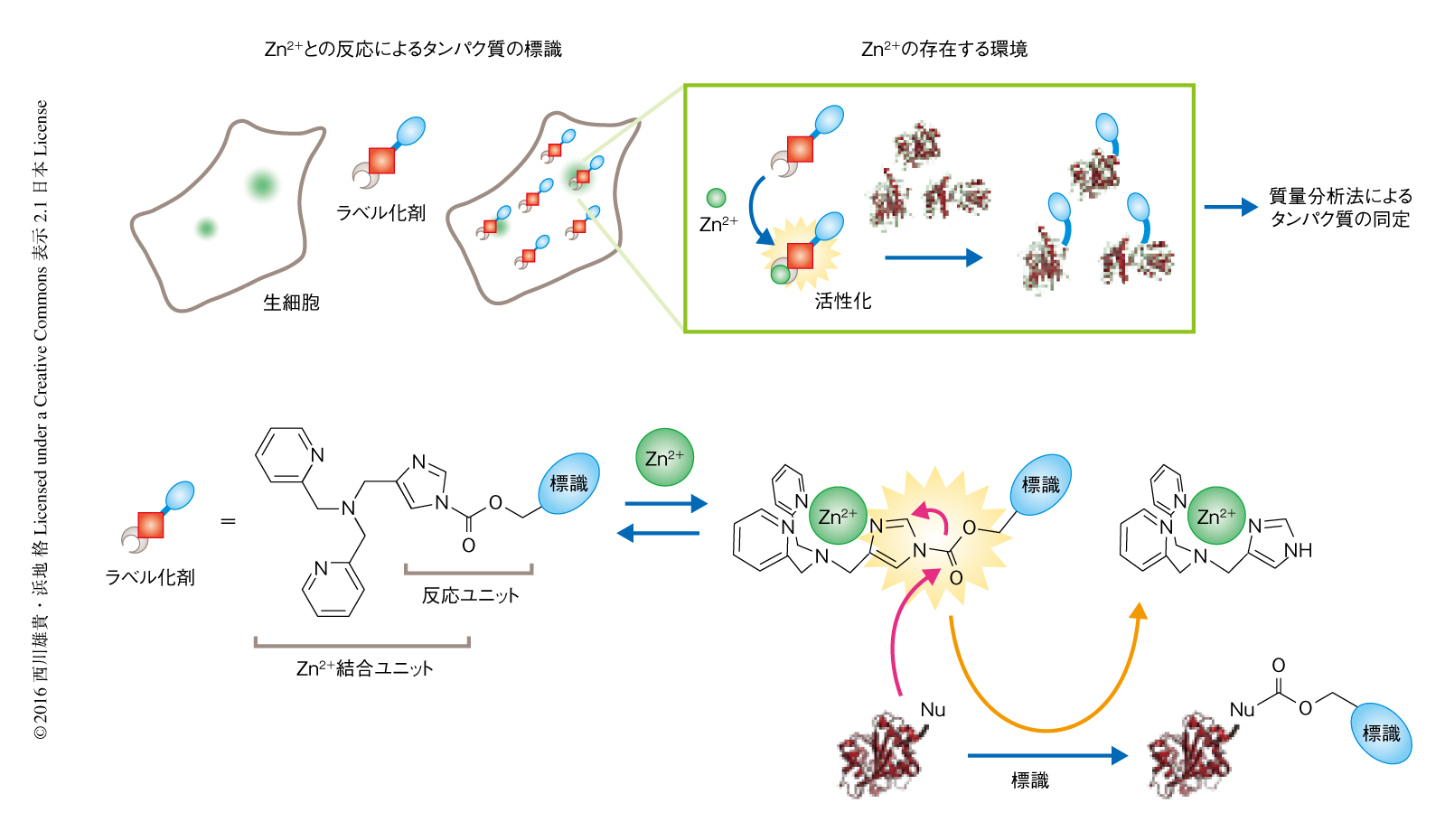
Zn2+と選択的に結合することによりタンパク質との反応性が大幅に向上する新しいラベル化剤を開発した.さらに,このラベル化剤を用いてZn2+の近傍に存在するタンパク質を標識し,この標識を手がかりとして,スナップショットのようにある時刻においてZn2+の近傍に存在するタンパク質を一括して同定する手法を考案した.具体的には,Zn2+と強く結合するユニット(ジピコリルアミン)と,タンパク質を標識するユニット(アシルイミダゾール)とを連結し3),タンパク質を標識するユニットがZn2+との結合により活性化するラベル化剤を設計し,これを最先端の質量分析法と組み合わせた(図1).
設計したZn2+により活性化されるラベル化剤の特性をin vitroにおいて細胞破砕液を用いて評価したところ,Zn2+と共存することにより多くのタンパク質が標識されることが確認された.さらに,この活性化はZn2+に選択的であり,細胞の内外に高濃度に存在するCa2+やMg2+などほかの金属イオンにより活性化しなかった.また,このZn2+により活性化されるラベル化剤を細胞の内部へ透過するよう標識の部分を改変したところ,生細胞に添加するだけで約15分のうちに細胞の全体に均一に分布し,外部からのZn2+の添加により細胞においてタンパク質が標識されることが確かめられた.
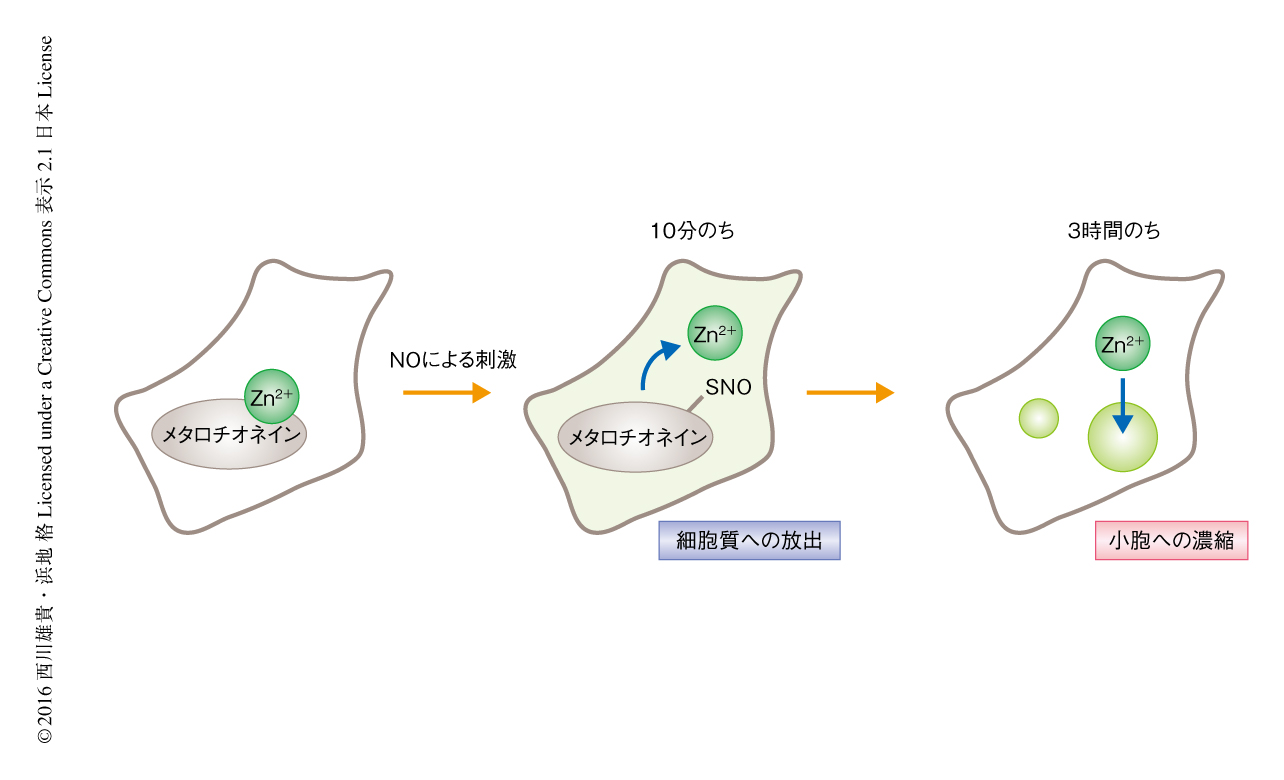
この細胞への透過性をもつZn2+により活性化されるラベル化剤を用いて,細胞においてZn2+の近傍に存在するタンパク質の標識および同定を試みた.具体的には,脳虚血のモデルとしてC6グリオーマ細胞にNOによる酸化ストレスをあたえ,細胞におけるZn2+の時間的および空間的な変動と,それにともなうZn2+の近傍に存在するタンパク質の変化を追跡した.これまでの報告によると,細胞においてZn2+の多くはメタロチオネインとよばれる金属結合タンパク質と強く結合しているが,そのCysのチオール基がNOによりS-ニトロシル化されてZn2+との結合能を失い遊離のZn2+が増加する4).さらに,細胞質に放出された多量のZn2+が解糖系やミトコンドリアの機能に障害をおよぼしアポトーシスの誘導につながると考えられている5,6).一方で,C6グリオーマ細胞において過剰のZn2+を小胞に一時的にプールすることによりZn2+の毒性を最小限に抑制しているとの報告もある7,8).
細胞におけるZn2+の時間的および空間的な局在の変化を確認するため,NOにより刺激したのちのZn2+の分布を蛍光プローブを用いて観察した.すると,Zn2+の濃度が細胞の全体において約10分のちに一時的に上昇し,それが3時間くらいかけてある特定の小さな小胞へと濃縮されるようすが観察された.つぎに,NOによる刺激ののち10分および3時間の細胞にZn2+により活性化されるラベル化剤を添加し,標識されたタンパク質を抗体により捕捉し同定した.同定された約300のタンパク質を解析したところ,刺激ののち10分においては細胞質や核に分布するタンパク質がおもに標識されたが,刺激ののち3時間においてそれらは減少し,新たに粗面小胞体や小胞に分布するタンパク質が多く同定された(図2).この結果は,蛍光プローブを用いて観察した細胞におけるZn2+の局在の変化と一致し,また,同定されたタンパク質を蛍光タンパク質との融合タンパク質として細胞における局在を評価したところ,Zn2+の局在とおおよその一致を示した.以上の結果から,Zn2+により活性化されるラベル化剤と質量分析法とを組み合わせた新規のコンディショナルプロテオミクス法により,時間的および空間的に変動するZn2+の近傍に存在する一連のタンパク質をスナップショットのように同定できることが実証された.
NOによる刺激ののち3時間において同定されたタンパク質を詳細に解析したところ,Zn2+が最終的に濃縮された小胞は,ゴルジ体と粗面小胞体とのあいだを行き来するCOPやERGICなどの中間ベシクルであることが明らかにされた.NOにより刺激された細胞においては,大量に放出された高濃度のZn2+の毒性を抑制するため,これらの小胞にZn2+が一時的に貯蔵されることが示唆された.
この研究において開発されたZn2+により活性化されるラベル化剤を用いた細胞においてZn2+の近傍に存在するタンパク質の解析法は,受精の際あるいは神経活動において報告のあるものの,その正体があいまいなままであった高濃度のZn2+を含むさまざまな小胞の同定に対し応用され,Zn2+のシグナル分子としての機能の解明に大きく貢献すると期待される.また,この研究において提案された,環境に応答性のラベル化剤と質量分析法との組合せによるコンディショナルプロテオミクスという,世界ではじめての斬新なコンセプトは,鉄や銅などの金属,酸性度,光など,さまざまな環境の変動に関与する一連のタンパク質を探索し同定する一般的な方法論へと拡張されることが期待される.
略歴:京都大学大学院工学研究科博士課程 在学中.
研究テーマ:細胞機能の理解にむけた分子技術の開発.
抱負:誰もが驚くような独創的な研究を行っていきたい.
浜地 格(Itaru Hamachi)
京都大学大学院工学研究科 教授.
研究室URL:http://www.sbchem.kyoto-u.ac.jp/hamachi-lab/
© 2016 西川雄貴・浜地 格 Licensed under CC 表示 2.1 日本
(京都大学大学院工学研究科 合成・生物化学専攻生物有機化学分野)
email:西川雄貴,浜地 格
DOI: 10.7875/first.author.2016.100
A conditional proteomics approach to identify proteins involved in zinc homeostasis.
Takayuki Miki, Masashi Awa, Yuki Nishikawa, Shigeki Kiyonaka, Masaki Wakabayashi, Yasushi Ishihama, Itaru Hamachi
Nature Methods, 13, 931-937 (2016)
要 約
Zn2+によるシグナル伝達はさまざまな生理応答や疾患において重要な役割を担う.Zn2+の生理機能を詳細に理解するためには,細胞においてZn2+の近傍に存在するタンパク質を網羅的に解析することが重要である.筆者らは,Zn2+により活性化されるラベル化剤と最先端の質量分析法とを組み合わせることにより細胞においてZn2+の近傍に存在するタンパク質を同定する,新規のコンディショナルプロテオミクス法を開発した.この方法を用いることにより,グリオーマ細胞においてNOの刺激によるZn2+の時間的および空間的な変動と,それにともなうZn2+の近傍に存在するタンパク質の変化を追跡した.さらに,同定されたタンパク質から,いったん細胞質に放出されたZn2+を濃縮する未知の小胞は,ゴルジ体と粗面小胞体とのあいだを行き来する中間ベシクルであることが明らかにされた.
はじめに
亜鉛はすべての生物にとり必須の金属であり,ヒトを含めた多くの生物の個体においてZn2+として大きく分けて2つのかたちで存在する.ひとつは,タンパク質と強く結合し,遺伝子の発現の制御や血液のpHの調整,アルコールなどの物質の代謝といった生命活動の維持に重要な役割をはたすものである.もうひとつは,特定の結合担体をもたない遊離の状態で発生や神経の活動などを制御するシグナル分子として機能するものである1).実際に,脳虚血や脳障害,てんかんやアルツハイマー病の患者の脳の組織において,Zn2+の濃度が大きく上昇することが知られている.
これまでに,Zn2+自体を可視化する技術はさかんに開発され,生きた組織あるいは細胞における濃度や分布の変動が直接に観察されるようになってきた2).しかし,細胞において時間や場所により変動するZn2+の近傍に存在しさまざまな生命活動を直接的あるいは間接的に制御するタンパク質を網羅的に調べる技術は開発されていなかった.そのため,Zn2+により制御される生命現象の全体像の理解は不十分なままであった.
1.Zn2+により活性化されるラベル化剤の開発
Zn2+と選択的に結合することによりタンパク質との反応性が大幅に向上する新しいラベル化剤を開発した.さらに,このラベル化剤を用いてZn2+の近傍に存在するタンパク質を標識し,この標識を手がかりとして,スナップショットのようにある時刻においてZn2+の近傍に存在するタンパク質を一括して同定する手法を考案した.具体的には,Zn2+と強く結合するユニット(ジピコリルアミン)と,タンパク質を標識するユニット(アシルイミダゾール)とを連結し3),タンパク質を標識するユニットがZn2+との結合により活性化するラベル化剤を設計し,これを最先端の質量分析法と組み合わせた(図1).
設計したZn2+により活性化されるラベル化剤の特性をin vitroにおいて細胞破砕液を用いて評価したところ,Zn2+と共存することにより多くのタンパク質が標識されることが確認された.さらに,この活性化はZn2+に選択的であり,細胞の内外に高濃度に存在するCa2+やMg2+などほかの金属イオンにより活性化しなかった.また,このZn2+により活性化されるラベル化剤を細胞の内部へ透過するよう標識の部分を改変したところ,生細胞に添加するだけで約15分のうちに細胞の全体に均一に分布し,外部からのZn2+の添加により細胞においてタンパク質が標識されることが確かめられた.
2.NOにより刺激された細胞におけるZn2+の近傍に存在するタンパク質の同定
この細胞への透過性をもつZn2+により活性化されるラベル化剤を用いて,細胞においてZn2+の近傍に存在するタンパク質の標識および同定を試みた.具体的には,脳虚血のモデルとしてC6グリオーマ細胞にNOによる酸化ストレスをあたえ,細胞におけるZn2+の時間的および空間的な変動と,それにともなうZn2+の近傍に存在するタンパク質の変化を追跡した.これまでの報告によると,細胞においてZn2+の多くはメタロチオネインとよばれる金属結合タンパク質と強く結合しているが,そのCysのチオール基がNOによりS-ニトロシル化されてZn2+との結合能を失い遊離のZn2+が増加する4).さらに,細胞質に放出された多量のZn2+が解糖系やミトコンドリアの機能に障害をおよぼしアポトーシスの誘導につながると考えられている5,6).一方で,C6グリオーマ細胞において過剰のZn2+を小胞に一時的にプールすることによりZn2+の毒性を最小限に抑制しているとの報告もある7,8).
細胞におけるZn2+の時間的および空間的な局在の変化を確認するため,NOにより刺激したのちのZn2+の分布を蛍光プローブを用いて観察した.すると,Zn2+の濃度が細胞の全体において約10分のちに一時的に上昇し,それが3時間くらいかけてある特定の小さな小胞へと濃縮されるようすが観察された.つぎに,NOによる刺激ののち10分および3時間の細胞にZn2+により活性化されるラベル化剤を添加し,標識されたタンパク質を抗体により捕捉し同定した.同定された約300のタンパク質を解析したところ,刺激ののち10分においては細胞質や核に分布するタンパク質がおもに標識されたが,刺激ののち3時間においてそれらは減少し,新たに粗面小胞体や小胞に分布するタンパク質が多く同定された(図2).この結果は,蛍光プローブを用いて観察した細胞におけるZn2+の局在の変化と一致し,また,同定されたタンパク質を蛍光タンパク質との融合タンパク質として細胞における局在を評価したところ,Zn2+の局在とおおよその一致を示した.以上の結果から,Zn2+により活性化されるラベル化剤と質量分析法とを組み合わせた新規のコンディショナルプロテオミクス法により,時間的および空間的に変動するZn2+の近傍に存在する一連のタンパク質をスナップショットのように同定できることが実証された.
3.Zn2+を濃縮する小胞の同定
NOによる刺激ののち3時間において同定されたタンパク質を詳細に解析したところ,Zn2+が最終的に濃縮された小胞は,ゴルジ体と粗面小胞体とのあいだを行き来するCOPやERGICなどの中間ベシクルであることが明らかにされた.NOにより刺激された細胞においては,大量に放出された高濃度のZn2+の毒性を抑制するため,これらの小胞にZn2+が一時的に貯蔵されることが示唆された.
おわりに
この研究において開発されたZn2+により活性化されるラベル化剤を用いた細胞においてZn2+の近傍に存在するタンパク質の解析法は,受精の際あるいは神経活動において報告のあるものの,その正体があいまいなままであった高濃度のZn2+を含むさまざまな小胞の同定に対し応用され,Zn2+のシグナル分子としての機能の解明に大きく貢献すると期待される.また,この研究において提案された,環境に応答性のラベル化剤と質量分析法との組合せによるコンディショナルプロテオミクスという,世界ではじめての斬新なコンセプトは,鉄や銅などの金属,酸性度,光など,さまざまな環境の変動に関与する一連のタンパク質を探索し同定する一般的な方法論へと拡張されることが期待される.
文 献
- Frederickson, C. J., Koh, J. & Bush, A. I.: The neurobiology of zinc in health and disease. Nat. Rev. Neurosci., 6, 449-462 (2005)[PubMed]
- Domaille, D. W., Que, E. L. & Chang, C. J.: Synthetic fluorescent sensors for studying the cell biology of metals. Nat. Chem. Biol., 4, 168-175 (2008)[PubMed]
- Fujishima, S., Yasui, R., Miki, T. et al.: Ligand-directed acyl imidazole chemistry for labeling of membrane-bound proteins on live cells. J. Am. Chem. Soc., 134, 3961-3964 (2012)[PubMed]
- Colvin, R. A., Holmes, W. R., Fontaine, C. P. et al.: Cytosolic zinc buffering and muffling: Their role in intracellular zinc homeostasis. Metallomics, 2, 306-317 (2010)[PubMed]
- Sensi, S. L., Ton-That, D., Sullivan, P. G. et al.: Modulation of mitochondrial function by endogenous Zn2+ pools. Proc. Natl. Acad. Sci. USA, 100, 6157-6162 (2003)[PubMed]
- Bossy-Wetzel, E., Talantova, M. V., Lee, W. D. et al.: Crosstalk between nitric oxide and zinc pathways to neuronal cell death involving mitochondrial dysfunction and p38-activated K+ channels. Neuron, 41, 351-365 (2004)[PubMed]
- Haase, H. & Beyersmann, D.: Intracellular zinc distribution and transport in C6 rat glioma cells. Biochem. Biophys. Res. Commun., 296, 923-928 (2002)[PubMed]
- Haase, H. & Beyersmann, D.: Uptake and intracellular distribution of labile and total Zn(II) in C6 rat glioma cells investigated with fluorescent probes and atomic absorption. Biometals, 12, 247-254 (1999)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:京都大学大学院工学研究科博士課程 在学中.
研究テーマ:細胞機能の理解にむけた分子技術の開発.
抱負:誰もが驚くような独創的な研究を行っていきたい.
浜地 格(Itaru Hamachi)
京都大学大学院工学研究科 教授.
研究室URL:http://www.sbchem.kyoto-u.ac.jp/hamachi-lab/
© 2016 西川雄貴・浜地 格 Licensed under CC 表示 2.1 日本