シナプスの形成抑制タンパク質MDGA2のヘミ欠損は自閉症スペクトラム様の異常をもたらす
山本 融
(香川大学医学部 分子神経生物学)
email:山本 融
DOI: 10.7875/first.author.2016.098
Altered cortical dynamics and cognitive function upon haploinsufficiency of the autism-linked excitatory synaptic suppressor MDGA2.
Steven A. Connor, Ina Ammendrup-Johnsen, Allen W. Chan, Yasushi Kishimoto, Chiaki Murayama, Naokazu Kurihara, Atsushi Tada, Yuan Ge, Hong Lu, Ryan Yan, Jeffrey M. LeDue, Hirotaka Matsumoto, Hiroshi Kiyonari, Yutaka Kirino, Fumio Matsuzaki, Toshiharu Suzuki, Timothy H. Murphy, Yu Tian Wang, Tohru Yamamoto, Ann Marie Craig
Neuron, 91, 1052-1068 (2016)
MDGA2は免疫グロブリンスーパーファミリーに属するGPIアンカー型の細胞外タンパク質であり,脳においてその発現が広く認められる.筆者らは,MDGAファミリータンパク質がNeuroliginファミリータンパク質と相互作用し,その機能を抑制することによりシナプスの形成を負に制御することを見い出し,ノックアウトマウスを作製してその大脳皮質における神経ネットワークの形成および維持の機構,また,認知および行動に及ぼす影響について調べた.その結果,MDGA2はNeuroligin-1と相互作用して興奮性シナプスの形成を負に制御しており,MDGA2ヘテロノックアウトマウスにおいては,興奮性シナプスの過形成,微小興奮性シナプス後電流の増強,長期増強の異常,大脳の全体における自発的な興奮性および皮質間の連絡の亢進,自閉症スペクトラム様の常同行動の増加,認知行動および社会性行動の異常が観察された.これらの結果から,MDGA2の減少はシナプスの形成における興奮と抑制のバランスを興奮の側へとシフトさせ,自閉症スペクトラム様の異常をひき起こすことが示された.
われわれの認知,思考,行動はシナプスを介した神経ネットワークにその基盤がある.シナプスは興奮性の入力をつかさどる興奮性シナプスと抑制性の入力をつかさどる抑制性シナプスとに大別され,そのバランスを適切に保つことが高次の脳機能を正常に発現させるうえで重要な事象のひとつである1).社会性の減退,常同行動,認知障害を主徴とする高次の脳機能の異常である自閉症スペクトラムの分子病態においても,シナプスの形成あるいは伝達の制御に関与するタンパク質の役割が注目されており2),その異常によりひき起こされる興奮と抑制のバランスのかたよりが自閉症スペクトラムの発症の要因になると考えられている3).自閉症スペクトラムはその約2割にてんかんの併発が認められることから4),シナプスの形成における興奮と抑制のバランスの興奮の側へのシフトが要因のひとつとされる.しかしながら,シナプスの成熟および維持の機構において中心的な役割をはたし,非症候性の自閉症スペクトラムの約1%において変異のみられるNeurexin-Neuroligin-Shank経路にかかわる遺伝子の変異マウスにおいては,自閉症スペクトラム様の異常とともに,シナプスの形成における興奮と抑制のバランスについては抑制の側へのシフトのみが観察されており,興奮の側へのシフトは認められていなかった.
筆者らは,神経ネットワークの形成機構を探る過程で見い出されたMDGAファミリータンパク質に着目した.MDGAファミリータンパク質は免疫グロブリンスーパーファミリーに属するGPIアンカー型の細胞外タンパク質であり,発現パターンの異なるMDGA1およびMDGA2からなる.これまでに,MDGA1はNeuroligin-2と選択的に相互作用することにより抑制性シナプスの形成を負に制御することを明らかにしたが5,6),この研究においては,自閉症との連関が指摘されている7) MDGA2に着目した.
おもに興奮性シナプスの構築にかかわるNeuroligin-1あるいはおもに抑制性シナプスの構築にかかわるNeuroligin-2とMDGA2との相互作用を免疫沈降法により確認したところ,MDGA1とは異なり,MDGA2はNeuroligin-1およびNeuroligin-2の両方と結合することがわかった.また,Cos7細胞に発現させたNeuroligin-1あるいはNeiroligin-2は海馬初代培養ニューロンにおいて前シナプスの形成を誘導するが,この機能はMDGA2との共発現により抑制された.さらに,Cos7細胞に発現させたNeuroligin-1あるいはNeiroligin-2とそのリガンドであるNeurexin-1βとの結合はMDGA2との共発現により抑制された.これらのことから,MDGA2はNeuroligin-1あるいはNeiroligin-2と結合してそのNeurexinとの相互作用を阻害し,シナプスの形成能を抑制することが示唆された.そこで,海馬初代培養ニューロンにおいて観察されるシナプスの形成がMDGA2の過剰な発現により抑制されるかどうか確認したところ,興奮性シナプスおよび抑制性シナプスの形成が抑制された.これらの結果から,MDGA2はNeuroligin-1およびNeuroligin-2と結合しそのシナプスの形成能を抑制しうることが明らかにされた(図1).
MDGA2の個体における機能を明らかにするためノックアウトマウスを作製した.MDGA2ホモノックアウトマウスは戻し交配ののち生後致死になったため,MDGA2ヘテロノックアウトマウスを用いて以後の解析を進めた.MDGA2ヘテロノックアウトマウスにおいて,MDGA2は生後14日目において脳のほぼ全体に発現が認められ,成体においてもひきつづき発現が確認された.
電子顕微鏡の像をもとにMDGA2ヘテロノックアウトマウスの海馬CA1領域における興奮性シナプスおよび抑制性シナプスの数を調べたところ,放線状層において興奮性シナプスの有意な増加が認められた.また,海馬および前頭前野において興奮性シナプス後膜および抑制性シナプス後膜における裏打ちタンパク質の量を調べたところ,Neuroligin-1と相互作用するPSD-95ファミリータンパク質のメンバーであるMAGUKの有意な増加が観察された.これに対して,抑制性シナプスの数およびGephyrinの量に変化は認められなかった.これらのことから,in vitroにおける解析からの予測と異なり,MDGA2の減少は興奮性シナプスにおいて選択的に過形成をもたらすことが明らかにされた.
MDGA2の減少が抑制性シナプスの形成に影響しなかった理由のひとつとして,MDGA1など抑制性シナプスの形成抑制タンパク質の発現による相補が考えられた.事実,MDGA1は海馬や大脳新皮質の上層における強い発現が認められている8).この可能性を検証するため,MDGA2ヘテロノックアウトマウスから調製した初代培養海馬ニューロンにおいてMDGA1をノックダウンしたところ,抑制性シナプスへの入力の増加が認められた.このことから,MDGA2の減少により起こるべき抑制性シナプスの過形成は,同時に発現するMDGA1によりふせがれていることが示唆された.
MDGA2ヘテロノックアウトマウスにおいてシナプスの機能がどのように変化しているかを調べるため,海馬CA1領域のニューロンを電気生理学的に解析した.その結果,解剖学的な解析から予測されたとおり,微小抑制性シナプス後電流の頻度および強度に差違は認められず,微小興奮性シナプス後電流に選択的にその頻度および強度が増加した.誘発応答について調べるためSchaffer側枝を刺激して放線状層の興奮性シナプス後場電位を測定したところ,その応答は有意に増強されていることが明らかにされた.また,MDGA2ヘテロノックアウトマウスおよび野生型マウスからそれぞれ調製した初代培養海馬ニューロンにおいて表面に露出するGluA1のシナプスごとの存在量および興奮性の神経終末に局在するVGluT1陽性のPSD95シグナル数を調べたところ,それぞれ有意に増加しており,興奮性シナプスの質および数がともに増強されていることが示唆された.
こうした興奮性シナプスの応答性の変化がシナプス可塑性にもたらす影響について調べるため長期増強の差違を解析したところ,MDGA2ヘテロノックアウトマウスにおいて早期の長期増強の有意な増強が認められた.一方,長期持続性の長期増強は有意に減弱していた.
ここまで,海馬における興奮性の入力の亢進および興奮の増強が確認されたが,脳の全体における興奮性の変化について調べるため,電位感受性の色素を用いてイメージング解析を試みた.大脳の右半球背側の全体を観察できるよう大きく開けたウィンドウからのイメージングにより安静時の自発的な活動を観察したところ,その興奮性は全体的に亢進しており,なかでも2次運動野後部,脳梁膨大後部皮質,1次運動野の一部の興奮性が有意に亢進していた.
右半球における皮質間の連絡について解析したところ,2次体性感覚野および1次聴覚野の存在する側頭部との連絡がもっとも強く亢進されていた一方,15%以上も低下した皮質間の連絡は認められなかった.これらのことから,MDGA2の減少は脳の興奮性を全体的に増加させること,また,通常時においては,そのなかでも感覚情報の処理にかかわる皮質間の連絡を負に制御することが示唆された.
以上の解析から,MDGA2の減少によりシナプスの形成における興奮と抑制のバランスが興奮の側にシフトして脳の興奮性が亢進することが明らかにされた.自閉症スペクトラムはその約2割にてんかんの併発が認められることから4),シナプスの形成における興奮と抑制のバランスの興奮の側へのシフトがその原因のひとつと考えられており,また,MDGA2遺伝子におけるエキソンの欠失が自閉症と連関するとの報告もある7).そこで,MDGA2ヘテロノックアウトマウスにおいて自閉症スペクトラム様の異常が認められるかどうか解析した.その結果,運動およびその制御機能などに明白な差違は認められず,ホームケージにおける動態にも顕著な差違は認められなかった.しかしながら,自閉症スペクトラムにおける常同行動に相当する反復跳躍の頻度が有意に上昇した.さらに,自閉症スペクトラムに特徴的な症状である社会性行動の異常について調べたところ,新奇のマウスに対する関心の薄さが2つの異なる実験系において確認された.ついで,この関心の薄さが社会的な文脈に選択的なのかどうかを検証するため,非生物である新奇物体に対する関心を比較した.その結果,新奇物体に対する関心は野生型のマウスよりもむしろ亢進していた.
自閉症スペクトラムにおいては突出した知性の認められることも少なくないが,一般的な知力の減退もしばしば観察される事象であり,社会性行動および認知の双方に関与するシナプス制御系の異常により生じるものと推測されている2).さらに,海馬における長期増強の異常が観察されたことから,MDGA2ヘテロノックアウトマウスにおいて学習能力あるいは記憶能力に異常が認められるかどうか検証した.水迷路試験において空間認知能力,学習能力,記憶能力について解析したところ,野生型のマウスと比べて学習能力および記憶能力に差違が認められたが,空間認知能力および運動機能には異常はなかった.また,学習能力および記憶能力の減退は文脈的な恐怖条件づけ試験においても確認された.さらに,よりストレスの少ない新奇物体の認識試験においても同様の減退が観察された.
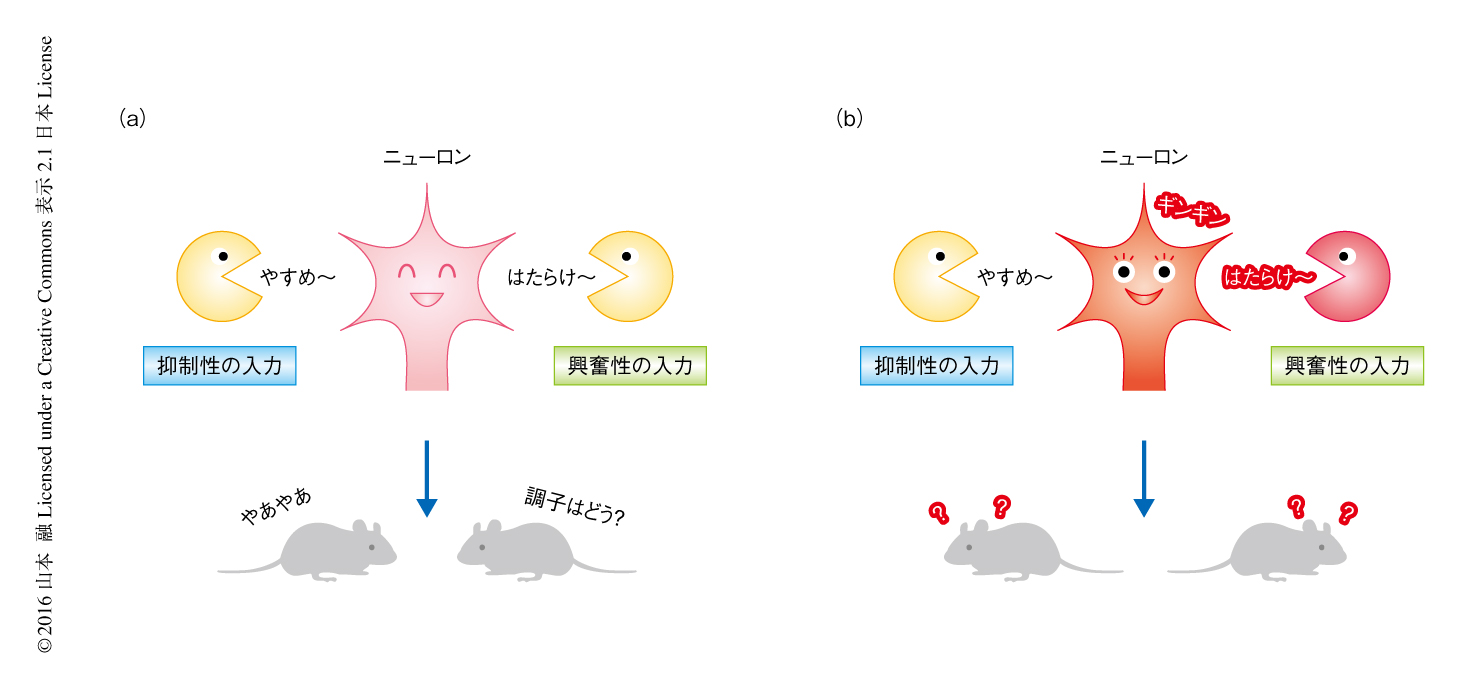
これらの結果から,MDGA2ヘテロノックアウトマウスにおいては興奮性シナプスが選択的に過多となることによりシナプスの形成における興奮と抑制のバランスが興奮の側へとシフトし,脳の全体における興奮性および皮質間の連絡の亢進とともに,自閉症スペクトラム様の異常がもたらされることが明らかにされた(図2).
MDGA2はシナプスの形成においてNeurexin-Neuroligin-Shank経路を負に制御することによりそのゆきすぎを抑えていることが明らかにされた.Neurexin-Neuroligin-Shank経路と直接に相互作用して興奮性シナプスの形成を抑制するタンパク質はこれまで哺乳類においては知られておらず,MDGA2はこの点でもユニークである.Neurexin-Neuroligin-Shank経路にかかわるタンパク質は自閉症スペクトラムとの遺伝学的な連関が示され多くの解析がなされてきているが,これらを欠損したマウスにおいては自閉症スペクトラム様の異常は認められるものの,機能的な重要性に比して表現型は軽微であるとともに,シナプスの形成における興奮と抑制のバランスは抑制の側にふれていた.今回,筆者らは,MDGA2がNeuroligin-1と相互作用して興奮性シナプスの形成を抑制し,その発現量の減少が興奮と抑制のバランスを興奮の側へとシフトさせ自閉症スペクトラム様の異常をひき起こすことを明らかにしたが,このことは,自閉症スペクトラムがシナプスの形成のバランスの興奮あるいは抑制のどちらへのかたよりによってもひき起こされうることをあらためて示すとともに,自閉症スペクトラムの病態の多様性についての喚起をうながすものである.また,完全な欠損ではなく,生理的に起こりうる程度の発現量の減少がこうした顕著な異常をひき起こしうることから,MDGA2の機能修飾により興奮と抑制のバランスのかたよりを人為的にチューニングしうることが想定される.したがって,MDGA2とNeuroligin-1との相互作用を修飾する分子が探索されれば,自閉症スペクトラムや統合失調症などシナプスの形成における興奮と抑制のバランスのかたよりがその病態に認められる精神神経疾患において,さまざまな要因により生じたバランスのかたよりを整える根本的な治療薬のリード化合物になりうると考えている.
なお,これら高次の脳機能の異常は,本人もしくは本人の属するコミュニティが異常と認識しなければ“個性”の範疇にとどまる.最近,MDGA2遺伝子のイントロンが神経幹細胞あるいは神経前駆細胞において2本鎖DNA切断をうけやすい27のクラスターのうちのひとつであることが報告された9).2本鎖DNA切断ののち別の染色体と融合するとMDGA2遺伝子の機能は失われてヘミ欠失体となるが,こうしたニューロンにおいてはシナプスの異形成の生じることが推測される.われわれの脳を構成するニューロンの一部はすでにMDGA2遺伝子のヘミ欠失体となっており,どこのニューロンがどのくらいそうなっているかは個々人で違っているのではないだろうか.われわれの“個性”を後天的かつ確率論的に修飾することにより人類の思考および行動の多様性を確保する機構の一端にもMDGA2は関与するのかもしれない.
略歴:1992年 東京大学大学院薬学系研究科博士課程 修了,1993年 東京大学分子細胞生物学研究所 助手,1999年 米国Columbia大学College of Physicians and Surgeons博士研究員,2000年 東北大学加齢医学研究所 助手,2003年 理化学研究所発生・再生科学総合研究センター 研究員,2006年 北海道大学大学院薬学研究院 准教授を経て,2013年より香川大学医学部 教授.
研究テーマ:脳の形成および維持と破綻の分子機構.
関心事:ヒトと文明はこのさきどこまでいっしょに歩んでいけるのか.
© 2016 山本 融 Licensed under CC 表示 2.1 日本
(香川大学医学部 分子神経生物学)
email:山本 融
DOI: 10.7875/first.author.2016.098
Altered cortical dynamics and cognitive function upon haploinsufficiency of the autism-linked excitatory synaptic suppressor MDGA2.
Steven A. Connor, Ina Ammendrup-Johnsen, Allen W. Chan, Yasushi Kishimoto, Chiaki Murayama, Naokazu Kurihara, Atsushi Tada, Yuan Ge, Hong Lu, Ryan Yan, Jeffrey M. LeDue, Hirotaka Matsumoto, Hiroshi Kiyonari, Yutaka Kirino, Fumio Matsuzaki, Toshiharu Suzuki, Timothy H. Murphy, Yu Tian Wang, Tohru Yamamoto, Ann Marie Craig
Neuron, 91, 1052-1068 (2016)
要 約
MDGA2は免疫グロブリンスーパーファミリーに属するGPIアンカー型の細胞外タンパク質であり,脳においてその発現が広く認められる.筆者らは,MDGAファミリータンパク質がNeuroliginファミリータンパク質と相互作用し,その機能を抑制することによりシナプスの形成を負に制御することを見い出し,ノックアウトマウスを作製してその大脳皮質における神経ネットワークの形成および維持の機構,また,認知および行動に及ぼす影響について調べた.その結果,MDGA2はNeuroligin-1と相互作用して興奮性シナプスの形成を負に制御しており,MDGA2ヘテロノックアウトマウスにおいては,興奮性シナプスの過形成,微小興奮性シナプス後電流の増強,長期増強の異常,大脳の全体における自発的な興奮性および皮質間の連絡の亢進,自閉症スペクトラム様の常同行動の増加,認知行動および社会性行動の異常が観察された.これらの結果から,MDGA2の減少はシナプスの形成における興奮と抑制のバランスを興奮の側へとシフトさせ,自閉症スペクトラム様の異常をひき起こすことが示された.
はじめに
われわれの認知,思考,行動はシナプスを介した神経ネットワークにその基盤がある.シナプスは興奮性の入力をつかさどる興奮性シナプスと抑制性の入力をつかさどる抑制性シナプスとに大別され,そのバランスを適切に保つことが高次の脳機能を正常に発現させるうえで重要な事象のひとつである1).社会性の減退,常同行動,認知障害を主徴とする高次の脳機能の異常である自閉症スペクトラムの分子病態においても,シナプスの形成あるいは伝達の制御に関与するタンパク質の役割が注目されており2),その異常によりひき起こされる興奮と抑制のバランスのかたよりが自閉症スペクトラムの発症の要因になると考えられている3).自閉症スペクトラムはその約2割にてんかんの併発が認められることから4),シナプスの形成における興奮と抑制のバランスの興奮の側へのシフトが要因のひとつとされる.しかしながら,シナプスの成熟および維持の機構において中心的な役割をはたし,非症候性の自閉症スペクトラムの約1%において変異のみられるNeurexin-Neuroligin-Shank経路にかかわる遺伝子の変異マウスにおいては,自閉症スペクトラム様の異常とともに,シナプスの形成における興奮と抑制のバランスについては抑制の側へのシフトのみが観察されており,興奮の側へのシフトは認められていなかった.
筆者らは,神経ネットワークの形成機構を探る過程で見い出されたMDGAファミリータンパク質に着目した.MDGAファミリータンパク質は免疫グロブリンスーパーファミリーに属するGPIアンカー型の細胞外タンパク質であり,発現パターンの異なるMDGA1およびMDGA2からなる.これまでに,MDGA1はNeuroligin-2と選択的に相互作用することにより抑制性シナプスの形成を負に制御することを明らかにしたが5,6),この研究においては,自閉症との連関が指摘されている7) MDGA2に着目した.
1.MDGA2はNeuroligin-1およびNeuroligin-2と結合しその機能を抑制する
おもに興奮性シナプスの構築にかかわるNeuroligin-1あるいはおもに抑制性シナプスの構築にかかわるNeuroligin-2とMDGA2との相互作用を免疫沈降法により確認したところ,MDGA1とは異なり,MDGA2はNeuroligin-1およびNeuroligin-2の両方と結合することがわかった.また,Cos7細胞に発現させたNeuroligin-1あるいはNeiroligin-2は海馬初代培養ニューロンにおいて前シナプスの形成を誘導するが,この機能はMDGA2との共発現により抑制された.さらに,Cos7細胞に発現させたNeuroligin-1あるいはNeiroligin-2とそのリガンドであるNeurexin-1βとの結合はMDGA2との共発現により抑制された.これらのことから,MDGA2はNeuroligin-1あるいはNeiroligin-2と結合してそのNeurexinとの相互作用を阻害し,シナプスの形成能を抑制することが示唆された.そこで,海馬初代培養ニューロンにおいて観察されるシナプスの形成がMDGA2の過剰な発現により抑制されるかどうか確認したところ,興奮性シナプスおよび抑制性シナプスの形成が抑制された.これらの結果から,MDGA2はNeuroligin-1およびNeuroligin-2と結合しそのシナプスの形成能を抑制しうることが明らかにされた(図1).
2.MDGA2ヘテロノックアウトマウスにおいて興奮性シナプスが過形成されるが抑制性シナプスの形成に変化はない
MDGA2の個体における機能を明らかにするためノックアウトマウスを作製した.MDGA2ホモノックアウトマウスは戻し交配ののち生後致死になったため,MDGA2ヘテロノックアウトマウスを用いて以後の解析を進めた.MDGA2ヘテロノックアウトマウスにおいて,MDGA2は生後14日目において脳のほぼ全体に発現が認められ,成体においてもひきつづき発現が確認された.
電子顕微鏡の像をもとにMDGA2ヘテロノックアウトマウスの海馬CA1領域における興奮性シナプスおよび抑制性シナプスの数を調べたところ,放線状層において興奮性シナプスの有意な増加が認められた.また,海馬および前頭前野において興奮性シナプス後膜および抑制性シナプス後膜における裏打ちタンパク質の量を調べたところ,Neuroligin-1と相互作用するPSD-95ファミリータンパク質のメンバーであるMAGUKの有意な増加が観察された.これに対して,抑制性シナプスの数およびGephyrinの量に変化は認められなかった.これらのことから,in vitroにおける解析からの予測と異なり,MDGA2の減少は興奮性シナプスにおいて選択的に過形成をもたらすことが明らかにされた.
MDGA2の減少が抑制性シナプスの形成に影響しなかった理由のひとつとして,MDGA1など抑制性シナプスの形成抑制タンパク質の発現による相補が考えられた.事実,MDGA1は海馬や大脳新皮質の上層における強い発現が認められている8).この可能性を検証するため,MDGA2ヘテロノックアウトマウスから調製した初代培養海馬ニューロンにおいてMDGA1をノックダウンしたところ,抑制性シナプスへの入力の増加が認められた.このことから,MDGA2の減少により起こるべき抑制性シナプスの過形成は,同時に発現するMDGA1によりふせがれていることが示唆された.
3.MDGA2ヘテロノックアウトマウスにおいて興奮性の入力の亢進および長期増強の異常が認められるが抑制性の入力に変化はない
MDGA2ヘテロノックアウトマウスにおいてシナプスの機能がどのように変化しているかを調べるため,海馬CA1領域のニューロンを電気生理学的に解析した.その結果,解剖学的な解析から予測されたとおり,微小抑制性シナプス後電流の頻度および強度に差違は認められず,微小興奮性シナプス後電流に選択的にその頻度および強度が増加した.誘発応答について調べるためSchaffer側枝を刺激して放線状層の興奮性シナプス後場電位を測定したところ,その応答は有意に増強されていることが明らかにされた.また,MDGA2ヘテロノックアウトマウスおよび野生型マウスからそれぞれ調製した初代培養海馬ニューロンにおいて表面に露出するGluA1のシナプスごとの存在量および興奮性の神経終末に局在するVGluT1陽性のPSD95シグナル数を調べたところ,それぞれ有意に増加しており,興奮性シナプスの質および数がともに増強されていることが示唆された.
こうした興奮性シナプスの応答性の変化がシナプス可塑性にもたらす影響について調べるため長期増強の差違を解析したところ,MDGA2ヘテロノックアウトマウスにおいて早期の長期増強の有意な増強が認められた.一方,長期持続性の長期増強は有意に減弱していた.
4.MDGA2ヘテロノックアウトマウスの脳において興奮性および皮質間の連絡が亢進する
ここまで,海馬における興奮性の入力の亢進および興奮の増強が確認されたが,脳の全体における興奮性の変化について調べるため,電位感受性の色素を用いてイメージング解析を試みた.大脳の右半球背側の全体を観察できるよう大きく開けたウィンドウからのイメージングにより安静時の自発的な活動を観察したところ,その興奮性は全体的に亢進しており,なかでも2次運動野後部,脳梁膨大後部皮質,1次運動野の一部の興奮性が有意に亢進していた.
右半球における皮質間の連絡について解析したところ,2次体性感覚野および1次聴覚野の存在する側頭部との連絡がもっとも強く亢進されていた一方,15%以上も低下した皮質間の連絡は認められなかった.これらのことから,MDGA2の減少は脳の興奮性を全体的に増加させること,また,通常時においては,そのなかでも感覚情報の処理にかかわる皮質間の連絡を負に制御することが示唆された.
5.MDGA2ヘテロノックアウトマウスにおいて自閉症スペクトラム様の異常が観察される
以上の解析から,MDGA2の減少によりシナプスの形成における興奮と抑制のバランスが興奮の側にシフトして脳の興奮性が亢進することが明らかにされた.自閉症スペクトラムはその約2割にてんかんの併発が認められることから4),シナプスの形成における興奮と抑制のバランスの興奮の側へのシフトがその原因のひとつと考えられており,また,MDGA2遺伝子におけるエキソンの欠失が自閉症と連関するとの報告もある7).そこで,MDGA2ヘテロノックアウトマウスにおいて自閉症スペクトラム様の異常が認められるかどうか解析した.その結果,運動およびその制御機能などに明白な差違は認められず,ホームケージにおける動態にも顕著な差違は認められなかった.しかしながら,自閉症スペクトラムにおける常同行動に相当する反復跳躍の頻度が有意に上昇した.さらに,自閉症スペクトラムに特徴的な症状である社会性行動の異常について調べたところ,新奇のマウスに対する関心の薄さが2つの異なる実験系において確認された.ついで,この関心の薄さが社会的な文脈に選択的なのかどうかを検証するため,非生物である新奇物体に対する関心を比較した.その結果,新奇物体に対する関心は野生型のマウスよりもむしろ亢進していた.
自閉症スペクトラムにおいては突出した知性の認められることも少なくないが,一般的な知力の減退もしばしば観察される事象であり,社会性行動および認知の双方に関与するシナプス制御系の異常により生じるものと推測されている2).さらに,海馬における長期増強の異常が観察されたことから,MDGA2ヘテロノックアウトマウスにおいて学習能力あるいは記憶能力に異常が認められるかどうか検証した.水迷路試験において空間認知能力,学習能力,記憶能力について解析したところ,野生型のマウスと比べて学習能力および記憶能力に差違が認められたが,空間認知能力および運動機能には異常はなかった.また,学習能力および記憶能力の減退は文脈的な恐怖条件づけ試験においても確認された.さらに,よりストレスの少ない新奇物体の認識試験においても同様の減退が観察された.
これらの結果から,MDGA2ヘテロノックアウトマウスにおいては興奮性シナプスが選択的に過多となることによりシナプスの形成における興奮と抑制のバランスが興奮の側へとシフトし,脳の全体における興奮性および皮質間の連絡の亢進とともに,自閉症スペクトラム様の異常がもたらされることが明らかにされた(図2).
おわりに
MDGA2はシナプスの形成においてNeurexin-Neuroligin-Shank経路を負に制御することによりそのゆきすぎを抑えていることが明らかにされた.Neurexin-Neuroligin-Shank経路と直接に相互作用して興奮性シナプスの形成を抑制するタンパク質はこれまで哺乳類においては知られておらず,MDGA2はこの点でもユニークである.Neurexin-Neuroligin-Shank経路にかかわるタンパク質は自閉症スペクトラムとの遺伝学的な連関が示され多くの解析がなされてきているが,これらを欠損したマウスにおいては自閉症スペクトラム様の異常は認められるものの,機能的な重要性に比して表現型は軽微であるとともに,シナプスの形成における興奮と抑制のバランスは抑制の側にふれていた.今回,筆者らは,MDGA2がNeuroligin-1と相互作用して興奮性シナプスの形成を抑制し,その発現量の減少が興奮と抑制のバランスを興奮の側へとシフトさせ自閉症スペクトラム様の異常をひき起こすことを明らかにしたが,このことは,自閉症スペクトラムがシナプスの形成のバランスの興奮あるいは抑制のどちらへのかたよりによってもひき起こされうることをあらためて示すとともに,自閉症スペクトラムの病態の多様性についての喚起をうながすものである.また,完全な欠損ではなく,生理的に起こりうる程度の発現量の減少がこうした顕著な異常をひき起こしうることから,MDGA2の機能修飾により興奮と抑制のバランスのかたよりを人為的にチューニングしうることが想定される.したがって,MDGA2とNeuroligin-1との相互作用を修飾する分子が探索されれば,自閉症スペクトラムや統合失調症などシナプスの形成における興奮と抑制のバランスのかたよりがその病態に認められる精神神経疾患において,さまざまな要因により生じたバランスのかたよりを整える根本的な治療薬のリード化合物になりうると考えている.
なお,これら高次の脳機能の異常は,本人もしくは本人の属するコミュニティが異常と認識しなければ“個性”の範疇にとどまる.最近,MDGA2遺伝子のイントロンが神経幹細胞あるいは神経前駆細胞において2本鎖DNA切断をうけやすい27のクラスターのうちのひとつであることが報告された9).2本鎖DNA切断ののち別の染色体と融合するとMDGA2遺伝子の機能は失われてヘミ欠失体となるが,こうしたニューロンにおいてはシナプスの異形成の生じることが推測される.われわれの脳を構成するニューロンの一部はすでにMDGA2遺伝子のヘミ欠失体となっており,どこのニューロンがどのくらいそうなっているかは個々人で違っているのではないだろうか.われわれの“個性”を後天的かつ確率論的に修飾することにより人類の思考および行動の多様性を確保する機構の一端にもMDGA2は関与するのかもしれない.
文 献
- Deneve, S. & Machens, C. K.: Efficient codes and balanced networks. Nat. Neurosci., 19, 375-382 (2016)[PubMed]
- Bourgeron, T.: From the genetic architecture to synaptic plasticity in autism spectrum disorder. Nat. Rev. Neurosci., 16, 551-563 (2015)[PubMed]
- Nelson, S. B. & Valakh, V.: Excitatory/inhibitory balance and circuit homeostasis in autism spectrum disorders. Neuron, 87, 684-698 (2015)[PubMed]
- Amiet, C., Gourfinkel-An, I., Bouzamondo, A. et al.: Epilepsy in autism is associated with intellectual disability and gender: evidence from a meta-analysis. Biol. Psychiatry, 64, 577-582 (2008)[PubMed]
- Pettem, K. L., Yokomaku, D., Takahashi, H. et al.: Interaction between autism-linked MDGAs and neuroligins suppresses inhibitory synapse development. J. Cell Biol., 200, 321-336 (2013)[PubMed]
- Lee, K., Kim, Y., Lee, S. J. et al.: MDGAs interact selectively with neuroligin-2 but not other neuroligins to regulate inhibitory synapse development. Proc. Natl. Acad. Sci. USA, 110, 336-341 (2013)[PubMed]
- Bucan, M., Abrahams, B. S., Wang, K. et al.: Genome-wide analyses of exonic copy number variants in a family-based study point to novel autism susceptibility genes. PLoS Genet., 5, e1000536 (2009)[PubMed]
- Ishikawa, T., Gotoh, N., Murayama, C. et al.: IgSF molecule MDGA1 is involved in radial migration and positioning of a subset of cortical upper-layer neurons. Dev. Dyn., 240, 96-107 (2011)[PubMed]
- Wei, P. -C., Chang, A. N., Kao, J. et al.: Long neural genes harbor recurrent DNA break clusters in neural stem/progenitor cells. Cell, 164, 644-655 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:1992年 東京大学大学院薬学系研究科博士課程 修了,1993年 東京大学分子細胞生物学研究所 助手,1999年 米国Columbia大学College of Physicians and Surgeons博士研究員,2000年 東北大学加齢医学研究所 助手,2003年 理化学研究所発生・再生科学総合研究センター 研究員,2006年 北海道大学大学院薬学研究院 准教授を経て,2013年より香川大学医学部 教授.
研究テーマ:脳の形成および維持と破綻の分子機構.
関心事:ヒトと文明はこのさきどこまでいっしょに歩んでいけるのか.
© 2016 山本 融 Licensed under CC 表示 2.1 日本