代謝型グルタミン酸受容体1型による経験に依存的な視覚系の神経回路の維持
鳴島 円1・宮田麻理子1・狩野方伸2
(1東京女子医科大学医学部 生理学(第一)講座,2東京大学大学院医学系研究科 神経生理学分野)
email:鳴島 円,宮田麻理子,狩野方伸
DOI: 10.7875/first.author.2016.094
The metabotropic glutamate receptor subtype 1 mediates experience-dependent maintenance of mature synaptic connectivity in the visual thalamus.
Madoka Narushima, Motokazu Uchigashima, Yuki Yagasaki, Takeshi Harada, Yasuyuki Nagumo, Naofumi Uesaka, Kouichi Hashimoto, Atsu Aiba, Masahiko Watanabe, Mariko Miyata, Masanobu Kano
Neuron, 91, 1097-1109 (2016)
網膜から外側膝状体へと視覚の情報を伝達する興奮性シナプスが成熟ののち正常に維持されるためには持続的な視覚の経験が必要であるが,その分子機構はほぼ未解明であった.代謝型グルタミン酸受容体1型は発達期の小脳における過剰なシナプスの刈り込みに必須であり,成熟ののち外側膝状体において強く発現する.この研究においては,外側膝状体における代謝型グルタミン酸受容体1型の機能に注目した.外側膝状体における代謝型グルタミン酸受容体1型の発現は開眼ののち網膜-外側膝状体シナプスが成熟する生後20日齢ごろにかけて急激に上昇した.代謝型グルタミン酸受容体1型ノックアウトマウスにおいて網膜-外側膝状体シナプスはいったん正常に成熟したが,視覚の経験を遮断した野生型のマウスと同様に,幼若型の神経回路に退行した.野生型マウスの外側膝状体においてシナプスの成熟ののち代謝型グルタミン酸受容体1型の機能を阻害すると,同様に幼若型の神経回路に退行した.視覚の経験を遮断しているときに外側膝状体において代謝型グルタミン酸受容体1型を活性化すると,成熟型のシナプス結合が維持された.以上の結果から,外側膝状体における代謝型グルタミン酸受容体1型の活性化が視覚の経験に依存的な成熟型の網膜-外側膝状体シナプスの維持に必要不可欠であることが示された.
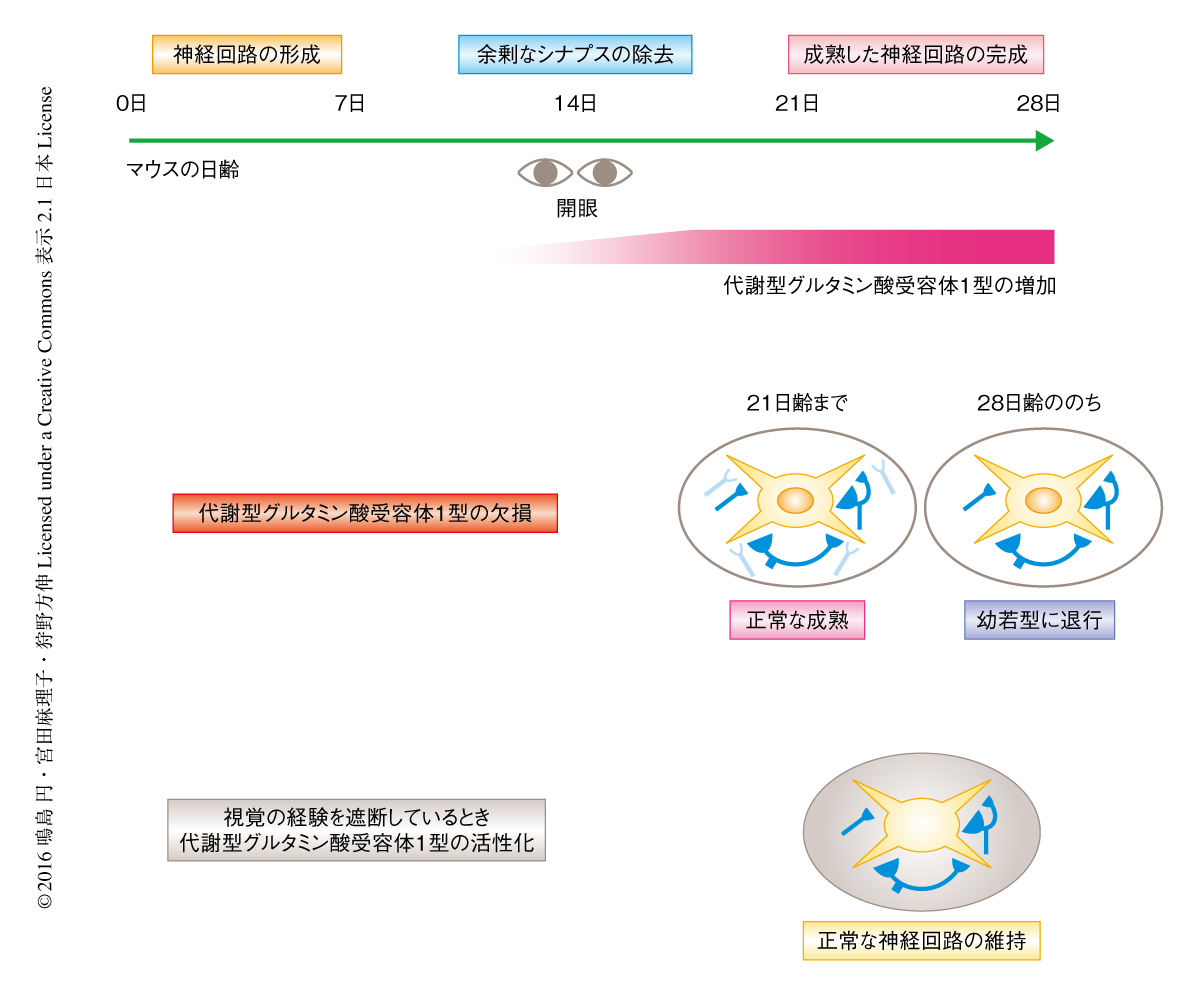
神経回路の形成の過程においては,発達の初期に過剰なシナプスが形成されたのち,不要なシナプスの除去および必要なシナプスの強化をへて精緻な神経回路ネットワークが完成する.これまで,いったん成熟した神経回路は可塑性が低く,入力を変化させても安定していると考えられていた.しかし近年,感覚系の神経回路において,いったん成熟した神経回路が正しく維持されるためには持続的な感覚の入力が必要であることが明らかにされた.たとえば,マウスの視覚系の網膜から外側膝状体へのシナプスにおいて,生後14日齢ごろの開眼のまえの幼若期には6本以上の網膜に由来する軸索が個々のニューロンにシナプス結合しているが,生後20日齢ごろまでにシナプスの除去をへて5本以下の軸索が結合する成熟型の神経回路が完成する1)(図1).しかし,生後20日齢よりのちに1週間にわたり暗室にて飼育することにより視覚の経験を遮断すると,成熟型のシナプス結合が維持されず,余剰なシナプスが再形成されて幼若型の神経回路に退行してしまう2).同様の退行は発達障害の一種であるRett症候群のモデルマウスにおいても報告され3),Rett症候群に特徴的な病態である発達の初期に正常に獲得された脳の機能が失われることとよく合致する.そのため,視覚の経験が成熟した神経回路を維持する機構はRett症候群をはじめとする自閉症の病態の解明につながる可能性があるとして注目されていたが,詳細な分子機構は明らかではなかった.
今回,筆者らは,成熟ののち外側膝状体において高く発現し4),発達期の小脳においては登上線維-プルキンエ細胞シナプスの刈り込みにかかわる5),代謝型グルタミン酸受容体1型に着目した.代謝型グルタミン酸受容体1型はGq/11タンパク質共役型受容体であり,外側膝状体へのもうひとつの興奮性の入力である大脳皮質第6層に由来する軸索の高頻度の刺激により活性化され,外側膝状体ニューロンの興奮性を制御することが知られていたが6),発達期における役割は明らかではなかった.そこで,代謝型グルタミン酸受容体1型のノックアウトマウス,また,薬理学的および分子生物学的な手法を用い,代謝型グルタミン酸受容体1型が視覚の経験に依存的な網膜-外側膝状体シナプスの維持にはたす役割について解析した.
生後の発達のいくつかの時期において,代謝型グルタミン酸受容体1型の免疫組織化学染色を行った.生後20日齢あるいは生後30日齢の成熟ののちの外側膝状体においては代謝型グルタミン酸受容体1型が高く発現していたのに対し,開眼のまえの生後10日齢においては発現が低かった.代謝型グルタミン酸受容体1型の発現は開眼ののち生後15日齢から網膜-外側膝状体シナプスが成熟する生後20日齢にかけて急激に上昇し,そののち,一定になることが明らかにされた.
発達期における代謝型グルタミン酸受容体1型の機能を明らかにするため,代謝型グルタミン酸受容体1型ノックアウトマウスから外側膝状体を含む切片を作製し,外側膝状体ニューロンからパッチクランプ法を用いて視索の刺激により誘発される網膜神経節細胞に由来する興奮性シナプス後電流を記録した.網膜-外側膝状体シナプスは神経伝達物質の放出の確率が高いため,網膜に由来する軸索の興奮性シナプス後電流は振幅のゆらぎが少なく軸索が刺激されると全か無かに発生する.複数の軸索がシナプス結合している場合,視索の刺激の強度を徐々に上げると興奮性シナプス後電流の振幅がステップ状に増加する.この性質を利用して,ひとつの外側膝状体ニューロンにシナプス結合する軸索の数を興奮性シナプス後電流のステップの数として概算することが可能である.
発達のおのおのの時期において網膜-外側膝状体シナプスの興奮性シナプス後電流を記録したところ,野生型のマウスおよび代謝型グルタミン酸受容体1型ノックアウトマウスは,ともに生後9~12日齢の開眼のまえにおいては,外側膝状体ニューロンが6本以上の網膜に由来する軸索に支配されていることがわかった.単一のニューロンあたり入力する線維の数はシナプスの除去により発達とともに減少し,生後22~24日齢では70%以上のニューロンで5本以下になった.また,成熟ののちには単一の線維あたりの興奮性シナプス後電流の振幅が増大し,シナプスが強化されていることが示唆された.つまり,代謝型グルタミン酸受容体1型ノックアウトマウスにおいても,網膜-外側膝状体シナプスの形成,強化,除去は正常であった.
一方,生後28日齢よりのちには,野生型のマウスの外側膝状体ニューロンの約80%が5本以下の線維から入力をうけていたのに対し,代謝型グルタミン酸受容体1型ノックアウトマウスにおいてはふたたび入力する線維の数が増加し,約60%の外側膝状体ニューロンが6本以上の網膜に由来する軸索に支配されていた.また,野生型マウスおよび生後22~24日齢のマウスと比較して,単一の線維あたりの興奮性シナプス後電流の振幅が減少していた.つまり,代謝型グルタミン酸受容体1型ノックアウトマウスにおいては網膜-外側膝状体シナプスが正常に発達したのち,生後28日齢よりのちには幼若型に退行しており,代謝型グルタミン酸受容体1型が成熟型の網膜-外側膝状体シナプスの維持にかかわる可能性が示唆された.
代謝型グルタミン酸受容体1型が視覚の経験に依存的な網膜-外側膝状体シナプスの維持にかかわるかどうかを調べるため,代謝型グルタミン酸受容体1型ノックアウトマウスを暗室において飼育した.野生型のマウスにおいては過去の報告のとおり2),生後21日齢から1週間にわたる暗室における飼育により網膜-外側膝状体シナプスが幼若型に退行した.一方,代謝型グルタミン酸受容体1型ノックアウトマウスにおいては,通常の飼育においても生後28日齢よりのちに網膜-外側膝状体シナプスの幼若型への退行がみられ,生後21日齢から暗室において飼育してもそれ以上の退行は起こらなかった.この結果から,代謝型グルタミン酸受容体1型の欠損と視覚の経験の遮断は相殺されたと考えられ,代謝型グルタミン酸受容体1型が視覚の経験に依存的な網膜-外側膝状体シナプスの維持にかかわることが示唆された.
代謝型グルタミン酸受容体1型の活動する部位および時期を明らかにするため,代謝型グルタミン酸受容体1型の外側膝状体および発達の時期に特異的な薬理学的な阻害,および,ノックダウンを行った.生後21日齢から7~10日間にわたり外側膝状体に代謝型グルタミン酸受容体1型の阻害薬を投与し,生後28日齢よりのちに網膜-外側膝状体シナプスの性質について解析した.その結果,外側膝状体において代謝型グルタミン酸受容体1型を阻害することにより,入力する線維の数の増加および単一の線維あたりの興奮性シナプス後電流の振幅の減少が起こり,幼若型のシナプス結合への退行がひき起こされた.また,生後14日齢から代謝型グルタミン酸受容体1型に対するmiRNAを外側膝状体ニューロンに導入しノックダウンしたところ,薬理学的な阻害と同様に,幼若型のシナプス結合への退行がみられた.一方,近傍の代謝型グルタミン酸受容体1型を発現するニューロンにおいては成熟型のシナプス結合が維持されていた.さらに,生後14日齢から代謝型グルタミン酸受容体1型ノックアウトマウスの外側膝状体において代謝型グルタミン酸受容体1型を強制発現したところ,入力する線維の数が野生型のマウスと同じ程度にまで回復し,成熟型のシナプス結合が維持されていた.以上の結果より,外側膝状体ニューロンにおいて代謝型グルタミン酸受容体1型が成熟型の網膜-外側膝状体シナプスの維持に必須であることが示された.
暗室にて飼育しているときに外側膝状体において代謝型グルタミン酸受容体1型を活性化することにより,代謝型グルタミン酸受容体1型の活性化が視覚の経験に依存的な成熟型の網膜-外側膝状体シナプスの維持において十分条件であるかどうか確かめた.代謝型グルタミン酸受容体1型の活性化薬を投与したマウスを暗室において7~10日間にわたり飼育し,生後28日齢よりのちに解析した.その結果,視覚の経験を遮断した状態においても,代謝型グルタミン酸受容体1型の活性化により成熟型のシナプス結合が維持されていた.したがって,外側膝状体において代謝型グルタミン酸受容体1型が網膜-外側膝状体シナプスの視覚の経験に依存的な維持の機構に中心的な役割をはたすことが示された.
これまでに,代謝型グルタミン酸受容体1型の活性化による遅い脱分極電位は大脳皮質に由来する入力線維を高頻度に刺激したときにのみ誘発されるため6),代謝型グルタミン酸受容体1型はおもに大脳皮質の神経活動を外側膝状体に伝達することが知られていた.また,小脳においては,発達期における登上線維-プルキンエ細胞シナプスの除去に,プルキンエ細胞へのもうひとつの興奮性の入力である平行線維シナプスの後部に発現する代謝型グルタミン酸受容体1型が異シナプス性に関与することが示唆されていた5).そこで,外側膝状体における代謝型グルタミン酸受容体1型の発現を単一のシナプスのレベルで解析するため,電子顕微鏡による免疫組織化学染色の解析および3次元での再構成を行った.その結果,代謝型グルタミン酸受容体1型は大脳皮質-外側膝状体シナプスの後部および網膜-外側膝状体シナプスの後部に発現するが,大脳皮質-外側膝状体シナプスの後部には2倍ほど高い密度で集積することが明らかとなり,大脳皮質に由来する入力が網膜-外側膝状体の成熟型の神経回路の維持に異シナプス性にかかわる可能性が示唆された.
この研究により,視覚の経験に依存的な成熟型の網膜-外側膝状体シナプスの維持に外側膝状体の代謝型グルタミン酸受容体1型が必要不可欠であることが明らかにされた(図2).これまで,網膜-外側膝状体シナプスの維持にかかわるタンパク質として,Rett症候群の原因となるMeCP2 3),および,AMPA型グルタミン酸受容体を制御するstargazin 7) が報告されていたが,特定のタンパク質の活性化により視覚の経験の遮断による退行をふせぐことに成功した報告ははじめてである.MeCP2は千種類以上のタンパク質の発現を制御する一方,神経活動の影響をうけて活性が変化することから8),今後,代謝型グルタミン酸受容体1型との関連性を明らかにすることは重要な課題のひとつである.
この研究においては,大脳皮質に由来する興奮性の入力による異シナプス性の制御について直接的な検証はできなかったが,この論文と同時にNeuron誌に発表された論文において,大脳皮質における神経活動が網膜-外側膝状体シナプスの維持の機構にかかわることを強く示唆する結果が報告された9).これら2つの研究により,外側膝状体における神経回路の維持に対する大脳皮質に由来する入力の役割およびその機構が明らかにされ,相互の結果を補完しあうものとなった.
代謝型グルタミン酸受容体1型,および,同じくGq/11タンパク質共役型受容体である代謝型グルタミン酸受容体5型は中枢神経系に広く分布するため,成熟型のシナプス結合の維持の機構は,中枢神経系のほかの領域においても精緻な神経回路ネットワークの機能を維持するために役だっている可能性があると考えられる.
略歴:2006年 金沢大学大学院医学系研究科博士課程 修了,同年 大阪大学大学院医学系研究科 研究員,2007年 ドイツTechnical University of Munich研究員,2010年 東京女子医科大学医学部 助教を経て,2012年より同 准講師.
研究テーマ:発達期における神経回路の活動に依存的な維持および改変の機構.
関心事:この研究中に出産を経験し,子供の発達に環境要因のおよぼす影響全般に興味をもつようになった.
宮田 麻理子(Mariko Miyata)
東京女子医科大学医学部 教授.
研究室URL:http://www.twmu.ac.jp/Basic/physiol1/
狩野 方伸(Masanobu Kano)
東京大学大学院医学系研究科 教授.
研究室URL:http://plaza.umin.ac.jp/~neurophy/Kano_Lab_j/
© 2016 鳴島 円・宮田麻理子・狩野方伸 Licensed under CC 表示 2.1 日本
(1東京女子医科大学医学部 生理学(第一)講座,2東京大学大学院医学系研究科 神経生理学分野)
email:鳴島 円,宮田麻理子,狩野方伸
DOI: 10.7875/first.author.2016.094
The metabotropic glutamate receptor subtype 1 mediates experience-dependent maintenance of mature synaptic connectivity in the visual thalamus.
Madoka Narushima, Motokazu Uchigashima, Yuki Yagasaki, Takeshi Harada, Yasuyuki Nagumo, Naofumi Uesaka, Kouichi Hashimoto, Atsu Aiba, Masahiko Watanabe, Mariko Miyata, Masanobu Kano
Neuron, 91, 1097-1109 (2016)
要 約
網膜から外側膝状体へと視覚の情報を伝達する興奮性シナプスが成熟ののち正常に維持されるためには持続的な視覚の経験が必要であるが,その分子機構はほぼ未解明であった.代謝型グルタミン酸受容体1型は発達期の小脳における過剰なシナプスの刈り込みに必須であり,成熟ののち外側膝状体において強く発現する.この研究においては,外側膝状体における代謝型グルタミン酸受容体1型の機能に注目した.外側膝状体における代謝型グルタミン酸受容体1型の発現は開眼ののち網膜-外側膝状体シナプスが成熟する生後20日齢ごろにかけて急激に上昇した.代謝型グルタミン酸受容体1型ノックアウトマウスにおいて網膜-外側膝状体シナプスはいったん正常に成熟したが,視覚の経験を遮断した野生型のマウスと同様に,幼若型の神経回路に退行した.野生型マウスの外側膝状体においてシナプスの成熟ののち代謝型グルタミン酸受容体1型の機能を阻害すると,同様に幼若型の神経回路に退行した.視覚の経験を遮断しているときに外側膝状体において代謝型グルタミン酸受容体1型を活性化すると,成熟型のシナプス結合が維持された.以上の結果から,外側膝状体における代謝型グルタミン酸受容体1型の活性化が視覚の経験に依存的な成熟型の網膜-外側膝状体シナプスの維持に必要不可欠であることが示された.
はじめに
神経回路の形成の過程においては,発達の初期に過剰なシナプスが形成されたのち,不要なシナプスの除去および必要なシナプスの強化をへて精緻な神経回路ネットワークが完成する.これまで,いったん成熟した神経回路は可塑性が低く,入力を変化させても安定していると考えられていた.しかし近年,感覚系の神経回路において,いったん成熟した神経回路が正しく維持されるためには持続的な感覚の入力が必要であることが明らかにされた.たとえば,マウスの視覚系の網膜から外側膝状体へのシナプスにおいて,生後14日齢ごろの開眼のまえの幼若期には6本以上の網膜に由来する軸索が個々のニューロンにシナプス結合しているが,生後20日齢ごろまでにシナプスの除去をへて5本以下の軸索が結合する成熟型の神経回路が完成する1)(図1).しかし,生後20日齢よりのちに1週間にわたり暗室にて飼育することにより視覚の経験を遮断すると,成熟型のシナプス結合が維持されず,余剰なシナプスが再形成されて幼若型の神経回路に退行してしまう2).同様の退行は発達障害の一種であるRett症候群のモデルマウスにおいても報告され3),Rett症候群に特徴的な病態である発達の初期に正常に獲得された脳の機能が失われることとよく合致する.そのため,視覚の経験が成熟した神経回路を維持する機構はRett症候群をはじめとする自閉症の病態の解明につながる可能性があるとして注目されていたが,詳細な分子機構は明らかではなかった.
今回,筆者らは,成熟ののち外側膝状体において高く発現し4),発達期の小脳においては登上線維-プルキンエ細胞シナプスの刈り込みにかかわる5),代謝型グルタミン酸受容体1型に着目した.代謝型グルタミン酸受容体1型はGq/11タンパク質共役型受容体であり,外側膝状体へのもうひとつの興奮性の入力である大脳皮質第6層に由来する軸索の高頻度の刺激により活性化され,外側膝状体ニューロンの興奮性を制御することが知られていたが6),発達期における役割は明らかではなかった.そこで,代謝型グルタミン酸受容体1型のノックアウトマウス,また,薬理学的および分子生物学的な手法を用い,代謝型グルタミン酸受容体1型が視覚の経験に依存的な網膜-外側膝状体シナプスの維持にはたす役割について解析した.
1.外側膝状体における代謝型グルタミン酸受容体1型の発現は開眼ののち上昇する
生後の発達のいくつかの時期において,代謝型グルタミン酸受容体1型の免疫組織化学染色を行った.生後20日齢あるいは生後30日齢の成熟ののちの外側膝状体においては代謝型グルタミン酸受容体1型が高く発現していたのに対し,開眼のまえの生後10日齢においては発現が低かった.代謝型グルタミン酸受容体1型の発現は開眼ののち生後15日齢から網膜-外側膝状体シナプスが成熟する生後20日齢にかけて急激に上昇し,そののち,一定になることが明らかにされた.
2.代謝型グルタミン酸受容体1型ノックアウトマウスの網膜-外側膝状体シナプスは正常な発達をへて幼若型に退行する
発達期における代謝型グルタミン酸受容体1型の機能を明らかにするため,代謝型グルタミン酸受容体1型ノックアウトマウスから外側膝状体を含む切片を作製し,外側膝状体ニューロンからパッチクランプ法を用いて視索の刺激により誘発される網膜神経節細胞に由来する興奮性シナプス後電流を記録した.網膜-外側膝状体シナプスは神経伝達物質の放出の確率が高いため,網膜に由来する軸索の興奮性シナプス後電流は振幅のゆらぎが少なく軸索が刺激されると全か無かに発生する.複数の軸索がシナプス結合している場合,視索の刺激の強度を徐々に上げると興奮性シナプス後電流の振幅がステップ状に増加する.この性質を利用して,ひとつの外側膝状体ニューロンにシナプス結合する軸索の数を興奮性シナプス後電流のステップの数として概算することが可能である.
発達のおのおのの時期において網膜-外側膝状体シナプスの興奮性シナプス後電流を記録したところ,野生型のマウスおよび代謝型グルタミン酸受容体1型ノックアウトマウスは,ともに生後9~12日齢の開眼のまえにおいては,外側膝状体ニューロンが6本以上の網膜に由来する軸索に支配されていることがわかった.単一のニューロンあたり入力する線維の数はシナプスの除去により発達とともに減少し,生後22~24日齢では70%以上のニューロンで5本以下になった.また,成熟ののちには単一の線維あたりの興奮性シナプス後電流の振幅が増大し,シナプスが強化されていることが示唆された.つまり,代謝型グルタミン酸受容体1型ノックアウトマウスにおいても,網膜-外側膝状体シナプスの形成,強化,除去は正常であった.
一方,生後28日齢よりのちには,野生型のマウスの外側膝状体ニューロンの約80%が5本以下の線維から入力をうけていたのに対し,代謝型グルタミン酸受容体1型ノックアウトマウスにおいてはふたたび入力する線維の数が増加し,約60%の外側膝状体ニューロンが6本以上の網膜に由来する軸索に支配されていた.また,野生型マウスおよび生後22~24日齢のマウスと比較して,単一の線維あたりの興奮性シナプス後電流の振幅が減少していた.つまり,代謝型グルタミン酸受容体1型ノックアウトマウスにおいては網膜-外側膝状体シナプスが正常に発達したのち,生後28日齢よりのちには幼若型に退行しており,代謝型グルタミン酸受容体1型が成熟型の網膜-外側膝状体シナプスの維持にかかわる可能性が示唆された.
3.代謝型グルタミン酸受容体1型の欠損と視覚の経験の遮断の効果は相殺する
代謝型グルタミン酸受容体1型が視覚の経験に依存的な網膜-外側膝状体シナプスの維持にかかわるかどうかを調べるため,代謝型グルタミン酸受容体1型ノックアウトマウスを暗室において飼育した.野生型のマウスにおいては過去の報告のとおり2),生後21日齢から1週間にわたる暗室における飼育により網膜-外側膝状体シナプスが幼若型に退行した.一方,代謝型グルタミン酸受容体1型ノックアウトマウスにおいては,通常の飼育においても生後28日齢よりのちに網膜-外側膝状体シナプスの幼若型への退行がみられ,生後21日齢から暗室において飼育してもそれ以上の退行は起こらなかった.この結果から,代謝型グルタミン酸受容体1型の欠損と視覚の経験の遮断は相殺されたと考えられ,代謝型グルタミン酸受容体1型が視覚の経験に依存的な網膜-外側膝状体シナプスの維持にかかわることが示唆された.
4.生後21日齢よりのちの外側膝状体における代謝型グルタミン酸受容体1型の活性化が成熟型のシナプス結合の維持に必要である
代謝型グルタミン酸受容体1型の活動する部位および時期を明らかにするため,代謝型グルタミン酸受容体1型の外側膝状体および発達の時期に特異的な薬理学的な阻害,および,ノックダウンを行った.生後21日齢から7~10日間にわたり外側膝状体に代謝型グルタミン酸受容体1型の阻害薬を投与し,生後28日齢よりのちに網膜-外側膝状体シナプスの性質について解析した.その結果,外側膝状体において代謝型グルタミン酸受容体1型を阻害することにより,入力する線維の数の増加および単一の線維あたりの興奮性シナプス後電流の振幅の減少が起こり,幼若型のシナプス結合への退行がひき起こされた.また,生後14日齢から代謝型グルタミン酸受容体1型に対するmiRNAを外側膝状体ニューロンに導入しノックダウンしたところ,薬理学的な阻害と同様に,幼若型のシナプス結合への退行がみられた.一方,近傍の代謝型グルタミン酸受容体1型を発現するニューロンにおいては成熟型のシナプス結合が維持されていた.さらに,生後14日齢から代謝型グルタミン酸受容体1型ノックアウトマウスの外側膝状体において代謝型グルタミン酸受容体1型を強制発現したところ,入力する線維の数が野生型のマウスと同じ程度にまで回復し,成熟型のシナプス結合が維持されていた.以上の結果より,外側膝状体ニューロンにおいて代謝型グルタミン酸受容体1型が成熟型の網膜-外側膝状体シナプスの維持に必須であることが示された.
5.代謝型グルタミン酸受容体1型は視覚の経験に依存的な成熟型の網膜-外側膝状体シナプスの維持にかかわる
暗室にて飼育しているときに外側膝状体において代謝型グルタミン酸受容体1型を活性化することにより,代謝型グルタミン酸受容体1型の活性化が視覚の経験に依存的な成熟型の網膜-外側膝状体シナプスの維持において十分条件であるかどうか確かめた.代謝型グルタミン酸受容体1型の活性化薬を投与したマウスを暗室において7~10日間にわたり飼育し,生後28日齢よりのちに解析した.その結果,視覚の経験を遮断した状態においても,代謝型グルタミン酸受容体1型の活性化により成熟型のシナプス結合が維持されていた.したがって,外側膝状体において代謝型グルタミン酸受容体1型が網膜-外側膝状体シナプスの視覚の経験に依存的な維持の機構に中心的な役割をはたすことが示された.
6.代謝型グルタミン酸受容体1型は大脳皮質-外側膝状体シナプスの後部に高く発現する
これまでに,代謝型グルタミン酸受容体1型の活性化による遅い脱分極電位は大脳皮質に由来する入力線維を高頻度に刺激したときにのみ誘発されるため6),代謝型グルタミン酸受容体1型はおもに大脳皮質の神経活動を外側膝状体に伝達することが知られていた.また,小脳においては,発達期における登上線維-プルキンエ細胞シナプスの除去に,プルキンエ細胞へのもうひとつの興奮性の入力である平行線維シナプスの後部に発現する代謝型グルタミン酸受容体1型が異シナプス性に関与することが示唆されていた5).そこで,外側膝状体における代謝型グルタミン酸受容体1型の発現を単一のシナプスのレベルで解析するため,電子顕微鏡による免疫組織化学染色の解析および3次元での再構成を行った.その結果,代謝型グルタミン酸受容体1型は大脳皮質-外側膝状体シナプスの後部および網膜-外側膝状体シナプスの後部に発現するが,大脳皮質-外側膝状体シナプスの後部には2倍ほど高い密度で集積することが明らかとなり,大脳皮質に由来する入力が網膜-外側膝状体の成熟型の神経回路の維持に異シナプス性にかかわる可能性が示唆された.
おわりに
この研究により,視覚の経験に依存的な成熟型の網膜-外側膝状体シナプスの維持に外側膝状体の代謝型グルタミン酸受容体1型が必要不可欠であることが明らかにされた(図2).これまで,網膜-外側膝状体シナプスの維持にかかわるタンパク質として,Rett症候群の原因となるMeCP2 3),および,AMPA型グルタミン酸受容体を制御するstargazin 7) が報告されていたが,特定のタンパク質の活性化により視覚の経験の遮断による退行をふせぐことに成功した報告ははじめてである.MeCP2は千種類以上のタンパク質の発現を制御する一方,神経活動の影響をうけて活性が変化することから8),今後,代謝型グルタミン酸受容体1型との関連性を明らかにすることは重要な課題のひとつである.
この研究においては,大脳皮質に由来する興奮性の入力による異シナプス性の制御について直接的な検証はできなかったが,この論文と同時にNeuron誌に発表された論文において,大脳皮質における神経活動が網膜-外側膝状体シナプスの維持の機構にかかわることを強く示唆する結果が報告された9).これら2つの研究により,外側膝状体における神経回路の維持に対する大脳皮質に由来する入力の役割およびその機構が明らかにされ,相互の結果を補完しあうものとなった.
代謝型グルタミン酸受容体1型,および,同じくGq/11タンパク質共役型受容体である代謝型グルタミン酸受容体5型は中枢神経系に広く分布するため,成熟型のシナプス結合の維持の機構は,中枢神経系のほかの領域においても精緻な神経回路ネットワークの機能を維持するために役だっている可能性があると考えられる.
文 献
- Chen, C. & Regehr, W. G.: Developmental remodeling of the retinogeniculate synapse. Neuron, 28, 955-966 (2000)[PubMed]
- Hooks, B. & Chen, C.: Distinct roles for spontaneous and visual activity in remodeling of the retinogeniculate synapse. Neuron, 52, 281-291 (2006)[PubMed]
- Noutel, J., Hong, Y. K., Leu, B. et al.: Experience-dependent retinogeniculate synapse remodeling is abnormal in MeCP2-deficient mice. Neuron, 70, 35-42 (2011)[PubMed]
- Vidnyanszky, Z., Gorcs, T. J., Negyessy, L. et al.: Immunocytochemical visualization of the mGluR1a metabotropic glutamate receptor at synapses of corticothalamic terminals originating from area 17 of the rat. Eur. J. Neurosci., 8, 1061-1071 (1996)[PubMed]
- Hashimoto, K. & Kano, M.: Synapse elimination in the developing cerebellum. Cell. Mol. Life Sci., 70, 4667-4680 (2013)[PubMed]
- McCormick, D. A., & von Krosigk, M.: Corticothalamic activation modulates thalamic firing through glutamate "metabotropic" receptors. Proc. Natl. Acad. Sci. USA, 89, 2774-2778 (1992)[PubMed]
- Louros, S. R., Hooks, B. M., Litvina, L. et al.: A role for stargazin in experience-dependent plasticity. Cell. Rep., 7, 1614-1625 (2014)[PubMed]
- Chahrour, M., Jung, S. Y., Shaw, C. et al.: MeCP2, a key contributor to neurological disease, activates and represses transcription. Science, 320, 1224-1229 (2008)[PubMed]
- Thompson, A. D., Picard, N., Min, L. et al.: Cortical feedback regulates feedforward retinogeniculate refinement. Neuron, 91, 1021-1033 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2006年 金沢大学大学院医学系研究科博士課程 修了,同年 大阪大学大学院医学系研究科 研究員,2007年 ドイツTechnical University of Munich研究員,2010年 東京女子医科大学医学部 助教を経て,2012年より同 准講師.
研究テーマ:発達期における神経回路の活動に依存的な維持および改変の機構.
関心事:この研究中に出産を経験し,子供の発達に環境要因のおよぼす影響全般に興味をもつようになった.
宮田 麻理子(Mariko Miyata)
東京女子医科大学医学部 教授.
研究室URL:http://www.twmu.ac.jp/Basic/physiol1/
狩野 方伸(Masanobu Kano)
東京大学大学院医学系研究科 教授.
研究室URL:http://plaza.umin.ac.jp/~neurophy/Kano_Lab_j/
© 2016 鳴島 円・宮田麻理子・狩野方伸 Licensed under CC 表示 2.1 日本