魚の鰭条と四足動物の指は共通の細胞系譜および発生の機構により形成される
中村哲也・Neil H. Shubin
(米国Chicago大学Department of Organismal Biology and Anatomy)
email:中村哲也
DOI: 10.7875/first.author.2016.093
Digits and fin rays share common developmental histories.
Tetsuya Nakamura, Andrew R. Gehrke, Justin Lemberg, Julie Szymaszek, Neil H. Shubin
Nature, 537, 225-228 (2016)
デボン紀の地層から出土する魚類および肉鰭類の化石記録は鰭が徐々に手足に進化するようすを示すが,発見される化石は不連続であるため,魚の鰭と四足動物の手足の構造を形態学的に対応づけることはきわめてむずかしい.また,化石として発見される種はすでに絶滅しているため,分子生物学によるアプローチも簡単ではない.これらの理由により,四足動物のもつ指の起源はつねに論争の的であった.指・手首は起源となる構造が魚の鰭には存在せず四足動物が進化の過程において新たに獲得したものであるとする説,また,鰭の基部にある小さな骨が指・手首に進化したという説もあった.マウスにおいては四肢の発生の機構は遺伝子レベルで比較的よく調べられているが,魚の鰭ではその発生の機構および細胞系譜に不明な点が多く,鰭と四肢を分子レベルで比較するのもむずかしい.そこで,筆者らは,四肢の発生に必須なHox遺伝子を利用したゼブラフィッシュにおける細胞系譜の追跡,および,Hox遺伝子を欠損したゼブラフィッシュの作製により,魚の鰭とマウスの指・手首との対応関係をさぐった.マウスにおいてはHoxA13遺伝子を発現する細胞系譜を追跡すると最終的に指・手首になることが知られていたが,ゼブラフィッシュにおいて同じく後期型のHox遺伝子の発現を制御するエンハンサーにより標識された細胞は鰭条を形成することがわかった.さらに,Hox13遺伝子を欠損したマウスにおいては指・手首は発生しないことが知られていたが,Hox13遺伝子を欠損したゼブラフィッシュにおいては鰭条の長さが大きく減少し軟骨内性骨の数が増加した.これらのことにより,魚の鰭条および四足動物の指・手首は後期型のHox遺伝子の発現により標識される細胞により形成されること,また,魚の鰭条および四足動物の指・手首の発生にはHox13遺伝子が必須であることが明らかにされた.そして,これらの結果から,魚の鰭条がその分化運命を変えて四足動物の指・手首へと進化したことが示唆された.
指・手首は四足動物が陸上で繁栄するのにきわめて重要な役割をはたしてきた.しかしながら,魚類が上陸をとげる過程において,鰭のどこが進化して,また,どのような分子機構により指・手首が獲得されたのかについてはよくわかっていない.解剖学的には,四足動物の手足は体幹から先端にむかって上腕,前腕,指・手首と,すべて軟骨内性骨からなる.一方,魚の鰭は根元に軟骨内性骨からなる射出骨をもつが,そのさきには皮骨である長い鰭条をもつ(図1).軟骨内性骨と皮骨の大きな違いは,構造だけでなくその発生にもある.軟骨内性骨の発生においては軟骨が形成されたのち硬骨へと置き換えられるが,皮骨は軟骨の形成を介さずに直接的に骨が発生する.
デボン紀に鰭が手足に進化した過程を順番に観察すると,ユーステノプテロン,ティクターリク,アカントステガと陸生動物に近づくにつれて徐々に鰭条が短くなり,それにつれ軟骨内性骨が遠位の方向へと伸びることにより,四足動物の四肢が獲得されたようにみえる(図1).では,このような進化はどのような機構により起こったのであろうか.軟骨内性骨と皮骨は発生の様式が違うことから鰭条の減少と軟骨内性骨の増加は互いに独立に変化したという考え方,また,鰭条と軟骨内性骨の割合は発生の過程において拮抗するというクロックモデルも有名であった1).
四足動物の四肢の発生機構の理解はマウスを用いて急速に進んでいる.四肢の発生においておのおのの骨の形態および位置を制御する遺伝子として,HoxA遺伝子クラスターおよびHoxD遺伝子クラスターがあげられる.マウスにおいてHox遺伝子クラスターはHox1遺伝子からHox13遺伝子までがゲノムにタンデムにならんでおり,その発現の制御機構についても興味深い.Hox遺伝子の肢芽における発現パターンは大きく分けて初期型と後期型の2つがある.初期の発現においては,Hox遺伝子クラスターの3’側にある複数のエンハンサーが発現を制御する.このとき,3’側に位置するHox遺伝子(Hox1遺伝子の側)が肢芽の後方から前側までもっともひろく発現し,5’側に位置するHox遺伝子(Hox13遺伝子の側)がもっともせまく後方に限局して発現することにより,全体として入れ子状の発現を示す2).しかし,後期の発現においてはこの入れ子状の発現パターンは逆になり,5’側に位置するHox遺伝子がもっともひろく発現する.後期型のHox遺伝子の発現は指・手首の発生に重要な役割をはたし,なかでもHox13遺伝子がもっともひろく,将来の指になる部分の全体に発現する.Hox13遺伝子を欠損したマウスにおいては指・手首が消失し3),Hox11遺伝子を欠損したマウスにおいては橈骨および尺骨が消失する2).このように,Hox遺伝子の発現パターンおよびその機能からHox遺伝子は四肢の発生においてきわめて重要であることが理解され,また,Hox遺伝子は解剖学的な構造のマーカーとしても利用される.
Hox遺伝子の発現パターンをマウスの肢芽と魚の鰭とで比較することにより四肢の進化の機構をさぐろうとするアプローチは,これまでにもいくつかあった.しかしながら,鰭の発生の機構についての知見はまだ少なく4-6),マウスと単純に比較するのはむずかしい状況であった.現在まで,指・手首の発生に必須である5’側に位置するHox遺伝子の発現パターンが,モデル生物であるゼブラフィッシュだけでなく非モデル生物を含む複数の種の魚において調べられてきた7-9).その結果,魚の鰭にも初期型および後期型のHox遺伝子の発現が存在することが徐々に明らかにされた.つまり,指・手首の発生に必要である後期型のHox遺伝子の発現は,四足動物の進化の過程において獲得されたものではなく,祖先型である魚がすでにもっていたことが示されている.
そこで,筆者らは,マウスにおいて指・手首の発生に必須であるHox13遺伝子に着目し,指・手首の進化的な起源をゼブラフィッシュにおいて遺伝子組換え技術を用いて明らかにすることにした.
魚におけるHox13遺伝子の発現パターンをゼブラフィッシュにおいて詳細に解析した.硬骨魚類には特異的に遺伝子の重複が起こったため,HoxA遺伝子クラスターとしてHoxAa遺伝子クラスターおよびHoxAb遺伝子クラスター,HoxD遺伝子クラスターとしてHoxDa遺伝子クラスターおよびHoxDb遺伝子クラスターの,あわせて4つをもつ.ゼブラフィッシュはHoxDb遺伝子クラスターを進化の過程において失ったと考えられ,Hox13遺伝子としてHoxa13a遺伝子,Hoxa13b遺伝子,Hoxd13a遺伝子の3つがゲノムに存在する.これら3つの遺伝子の発現パターンを経時的に調べたところ,受精後48時間では,Hoxa13a遺伝子およびHoxa13b遺伝子は鰭原基の遠位側において,Hoxd13a遺伝子は鰭原基の後方側において,その発現が観察された.しかし,受精後72~96時間になると,Hoxa13a遺伝子の発現は将来の鰭の皮骨に発生するひれ膜の近位側において観察され,Hoxd13a遺伝子の発現は鰭原基とともにひれ膜の近位側においてもみられるようになった.受精後120時間あたりからすべてのHox13遺伝子の発現は徐々に消失した.
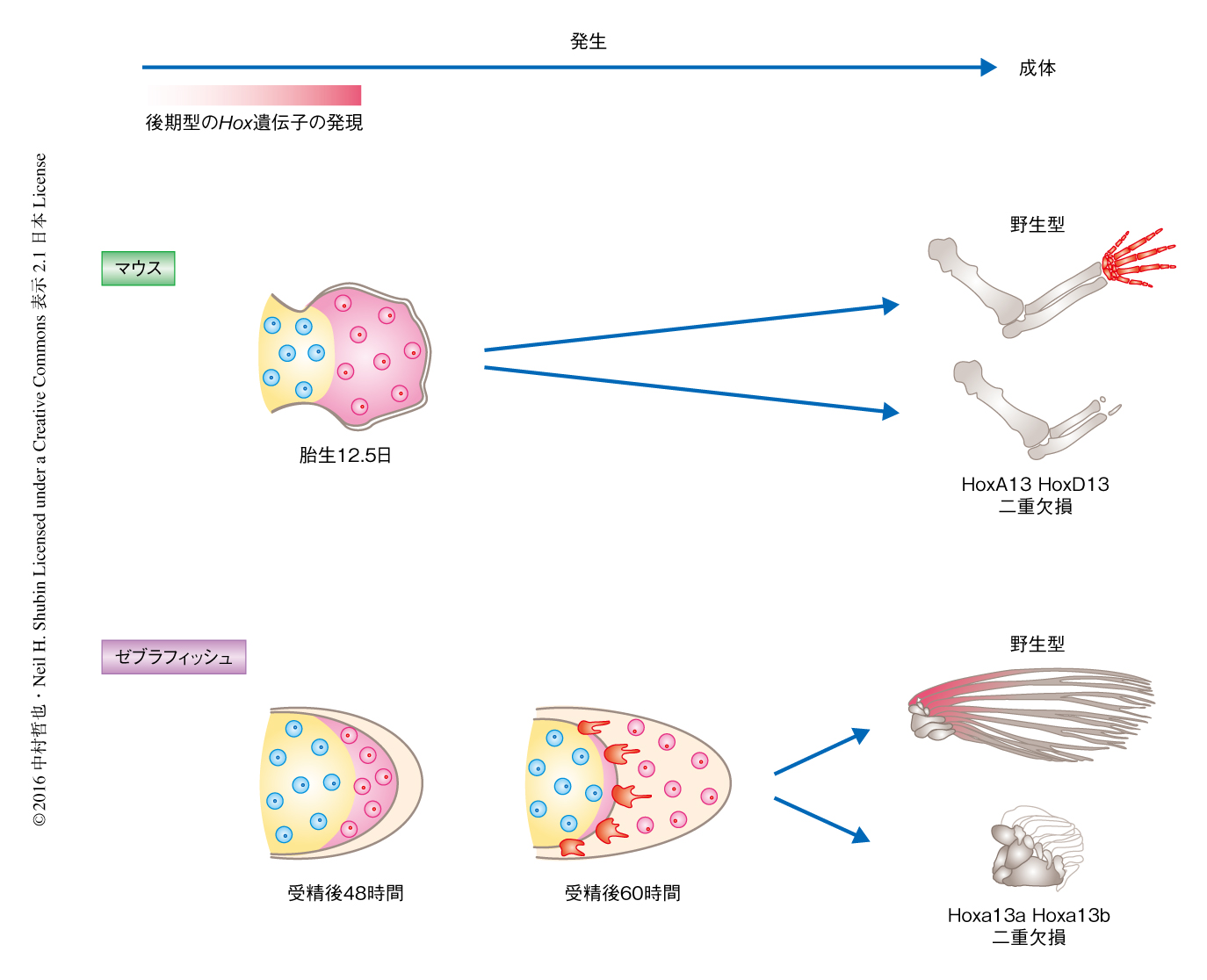
Hox13遺伝子の発現は受精後120時間あたりから消失したが,これらの細胞は最終的に鰭のどの部位の発生に寄与するのだろうか.マウスにおいては,後期型の発現を示すHoxA13遺伝子にCre遺伝子をノックインして細胞系譜を追跡すると,最終的に指・手首の発生に寄与することが明らかにされていた10).そこで,ゼブラフィッシュを用いて同様に細胞系譜を追跡した.HoxAa遺伝子クラスターから数百kbp離れたところにある,後期型のHox遺伝子の発現を制御するエンハンサーのひとつであるe16を,原始的な硬骨魚であるガーからクローニングし11),e16によりCre遺伝子が発現するトランスジェニックゼブラフィッシュを作製した.また,通常はGFPが発現しすべての細胞が緑色に光るが,Creの活性をもつ細胞においてはGFPに代わりRFPが発現し赤色に標識されるゼブラフィッシュを利用した12).これら2つのトランスジェニックゼブラフィッシュを交配させ,RFPの蛍光により標識された細胞の動きを追跡したところ,受精後48時間において遠位側にフィロポディア様の突起を伸ばし積極的に移動しているようすが観察された.そののち,6日,さらに,20日と時間がたつにつれ,RFPの蛍光を示す細胞は鰭原基から鰭条へと移動し,生後3か月では鰭条においてRFPの蛍光が観察された.後期型のHox遺伝子の発現により標識された細胞が,マウスにおいては指・手首の発生に寄与すること,魚においては鰭条の発生に寄与したことから,構造的かつ発生的に異なる2つの組織にはなんらかの関連のある可能性が高いと考えられた.
より直接的な実験により指・手首と鰭条との関係をさぐることにした.Hox13遺伝子はマウスにおいて指・手首の発生に必須であることが知られている3).HoxA13遺伝子およびHoxD13遺伝子を欠損したマウスは指・手首が発生しない.そこで魚のHox13ファミリー遺伝子であるHoxa13a遺伝子,Hoxa13b遺伝子,Hoxd13a遺伝子を欠損したゼブラフィッシュを作製し表現型を解析した.CRISPR-Cas9系によるゲノム編集技術を使用することにより,3つのHox13遺伝子それぞれを単独で欠損したゼブラフィッシュを作製した.これらのゼブラフィッシュにとくにきわだった表現型は観察されず,骨格のCTスキャニングとコンピューター解析の系を確立して鰭の全体像,また,鰭の根元にある軟骨内性骨の形態を詳細に観察したが,やはり野生型との大きな違いは観察されなかった.そこで,Hoxa13a遺伝子およびHoxa13b遺伝子をホモで欠損したゼブラフィッシュの成体において表現型を観察したところ,胸鰭,腹鰭,背びれ,尻びれの鰭条の長さが大きく減少し,外見からは,尾びれのほか,ほとんど鰭はないようにみえた.骨格のCTスキャニングにより詳細に解析したところ,鰭条が短くなったのとは反対に,鰭の根元の軟骨内性骨の数が増加していた.
ゼブラフィッシュにおける後期型のHox遺伝子の発現を示す細胞系譜の追跡,および,Hox13遺伝子を欠損したゼブラフィッシュの解析より,鰭条と指・手首は同じく後期型のHox遺伝子の発現をへた細胞からなり,さらに,鰭条および指・手首はHox13遺伝子により発生が制御されることがわかった.鰭条と指・手首は骨の発生の仕方および構造が違うにもかかわらず,細胞系譜および発生の機構が共通していたのである.さらに,Hox13遺伝子を欠損したゼブラフィッシュにおいて鰭条が短くなると同時に軟骨内性骨の数が増加したことから,進化の過程において鰭条の骨が徐々に軟骨内性骨へと転換した可能性が示唆された(図2).
今回の解析において,皮骨が軟骨内性骨へと徐々に進化した可能性が示されたが,どのようにして2つの細胞運命に転換が起こるのかについてはまったく不明である.今後は,この機構の分子レベルでの解析が期待される.また最近,別の研究グループにより,発生の過程において体節に由来する細胞が鰭へと侵入することにより,軟骨内性骨を形成するプログラムと皮骨を形成するプログラムとが切り替えられることが報告された13).筆者らの結果とあわせて,その詳細な機構の解明が期待される.
今回の解析においては,最新の遺伝子組換え技術および高出力のCTスキャニングを使用することにより,化石の記録にしか残っていない鰭から手足への進化の機構が解明された.技術の進歩を追い風に,“実験古生物学”は新しい局面に入りつつある.
略歴:2007年 大阪大学大学院生命機能研究科 修了,同年 同 特別研究員,2008年 同 助教を経て,2012年より米国Chicago大学Research Fellow.
研究テーマ:魚類の発生および進化の機構.
関心事:フライフィッシングで釣った魚の解剖.大物はうれしいが,解剖に時間がかかる.
Neil H. Shubin
米国Chicago大学Professor.
研究室URL:http://shubinlab.uchicago.edu/
© 2016 中村哲也・Neil H. Shubin Licensed under CC 表示 2.1 日本
(米国Chicago大学Department of Organismal Biology and Anatomy)
email:中村哲也
DOI: 10.7875/first.author.2016.093
Digits and fin rays share common developmental histories.
Tetsuya Nakamura, Andrew R. Gehrke, Justin Lemberg, Julie Szymaszek, Neil H. Shubin
Nature, 537, 225-228 (2016)
要 約
デボン紀の地層から出土する魚類および肉鰭類の化石記録は鰭が徐々に手足に進化するようすを示すが,発見される化石は不連続であるため,魚の鰭と四足動物の手足の構造を形態学的に対応づけることはきわめてむずかしい.また,化石として発見される種はすでに絶滅しているため,分子生物学によるアプローチも簡単ではない.これらの理由により,四足動物のもつ指の起源はつねに論争の的であった.指・手首は起源となる構造が魚の鰭には存在せず四足動物が進化の過程において新たに獲得したものであるとする説,また,鰭の基部にある小さな骨が指・手首に進化したという説もあった.マウスにおいては四肢の発生の機構は遺伝子レベルで比較的よく調べられているが,魚の鰭ではその発生の機構および細胞系譜に不明な点が多く,鰭と四肢を分子レベルで比較するのもむずかしい.そこで,筆者らは,四肢の発生に必須なHox遺伝子を利用したゼブラフィッシュにおける細胞系譜の追跡,および,Hox遺伝子を欠損したゼブラフィッシュの作製により,魚の鰭とマウスの指・手首との対応関係をさぐった.マウスにおいてはHoxA13遺伝子を発現する細胞系譜を追跡すると最終的に指・手首になることが知られていたが,ゼブラフィッシュにおいて同じく後期型のHox遺伝子の発現を制御するエンハンサーにより標識された細胞は鰭条を形成することがわかった.さらに,Hox13遺伝子を欠損したマウスにおいては指・手首は発生しないことが知られていたが,Hox13遺伝子を欠損したゼブラフィッシュにおいては鰭条の長さが大きく減少し軟骨内性骨の数が増加した.これらのことにより,魚の鰭条および四足動物の指・手首は後期型のHox遺伝子の発現により標識される細胞により形成されること,また,魚の鰭条および四足動物の指・手首の発生にはHox13遺伝子が必須であることが明らかにされた.そして,これらの結果から,魚の鰭条がその分化運命を変えて四足動物の指・手首へと進化したことが示唆された.
はじめに
指・手首は四足動物が陸上で繁栄するのにきわめて重要な役割をはたしてきた.しかしながら,魚類が上陸をとげる過程において,鰭のどこが進化して,また,どのような分子機構により指・手首が獲得されたのかについてはよくわかっていない.解剖学的には,四足動物の手足は体幹から先端にむかって上腕,前腕,指・手首と,すべて軟骨内性骨からなる.一方,魚の鰭は根元に軟骨内性骨からなる射出骨をもつが,そのさきには皮骨である長い鰭条をもつ(図1).軟骨内性骨と皮骨の大きな違いは,構造だけでなくその発生にもある.軟骨内性骨の発生においては軟骨が形成されたのち硬骨へと置き換えられるが,皮骨は軟骨の形成を介さずに直接的に骨が発生する.
デボン紀に鰭が手足に進化した過程を順番に観察すると,ユーステノプテロン,ティクターリク,アカントステガと陸生動物に近づくにつれて徐々に鰭条が短くなり,それにつれ軟骨内性骨が遠位の方向へと伸びることにより,四足動物の四肢が獲得されたようにみえる(図1).では,このような進化はどのような機構により起こったのであろうか.軟骨内性骨と皮骨は発生の様式が違うことから鰭条の減少と軟骨内性骨の増加は互いに独立に変化したという考え方,また,鰭条と軟骨内性骨の割合は発生の過程において拮抗するというクロックモデルも有名であった1).
四足動物の四肢の発生機構の理解はマウスを用いて急速に進んでいる.四肢の発生においておのおのの骨の形態および位置を制御する遺伝子として,HoxA遺伝子クラスターおよびHoxD遺伝子クラスターがあげられる.マウスにおいてHox遺伝子クラスターはHox1遺伝子からHox13遺伝子までがゲノムにタンデムにならんでおり,その発現の制御機構についても興味深い.Hox遺伝子の肢芽における発現パターンは大きく分けて初期型と後期型の2つがある.初期の発現においては,Hox遺伝子クラスターの3’側にある複数のエンハンサーが発現を制御する.このとき,3’側に位置するHox遺伝子(Hox1遺伝子の側)が肢芽の後方から前側までもっともひろく発現し,5’側に位置するHox遺伝子(Hox13遺伝子の側)がもっともせまく後方に限局して発現することにより,全体として入れ子状の発現を示す2).しかし,後期の発現においてはこの入れ子状の発現パターンは逆になり,5’側に位置するHox遺伝子がもっともひろく発現する.後期型のHox遺伝子の発現は指・手首の発生に重要な役割をはたし,なかでもHox13遺伝子がもっともひろく,将来の指になる部分の全体に発現する.Hox13遺伝子を欠損したマウスにおいては指・手首が消失し3),Hox11遺伝子を欠損したマウスにおいては橈骨および尺骨が消失する2).このように,Hox遺伝子の発現パターンおよびその機能からHox遺伝子は四肢の発生においてきわめて重要であることが理解され,また,Hox遺伝子は解剖学的な構造のマーカーとしても利用される.
Hox遺伝子の発現パターンをマウスの肢芽と魚の鰭とで比較することにより四肢の進化の機構をさぐろうとするアプローチは,これまでにもいくつかあった.しかしながら,鰭の発生の機構についての知見はまだ少なく4-6),マウスと単純に比較するのはむずかしい状況であった.現在まで,指・手首の発生に必須である5’側に位置するHox遺伝子の発現パターンが,モデル生物であるゼブラフィッシュだけでなく非モデル生物を含む複数の種の魚において調べられてきた7-9).その結果,魚の鰭にも初期型および後期型のHox遺伝子の発現が存在することが徐々に明らかにされた.つまり,指・手首の発生に必要である後期型のHox遺伝子の発現は,四足動物の進化の過程において獲得されたものではなく,祖先型である魚がすでにもっていたことが示されている.
そこで,筆者らは,マウスにおいて指・手首の発生に必須であるHox13遺伝子に着目し,指・手首の進化的な起源をゼブラフィッシュにおいて遺伝子組換え技術を用いて明らかにすることにした.
1.魚のHox13遺伝子は発生の過程の鰭原基において発現する
魚におけるHox13遺伝子の発現パターンをゼブラフィッシュにおいて詳細に解析した.硬骨魚類には特異的に遺伝子の重複が起こったため,HoxA遺伝子クラスターとしてHoxAa遺伝子クラスターおよびHoxAb遺伝子クラスター,HoxD遺伝子クラスターとしてHoxDa遺伝子クラスターおよびHoxDb遺伝子クラスターの,あわせて4つをもつ.ゼブラフィッシュはHoxDb遺伝子クラスターを進化の過程において失ったと考えられ,Hox13遺伝子としてHoxa13a遺伝子,Hoxa13b遺伝子,Hoxd13a遺伝子の3つがゲノムに存在する.これら3つの遺伝子の発現パターンを経時的に調べたところ,受精後48時間では,Hoxa13a遺伝子およびHoxa13b遺伝子は鰭原基の遠位側において,Hoxd13a遺伝子は鰭原基の後方側において,その発現が観察された.しかし,受精後72~96時間になると,Hoxa13a遺伝子の発現は将来の鰭の皮骨に発生するひれ膜の近位側において観察され,Hoxd13a遺伝子の発現は鰭原基とともにひれ膜の近位側においてもみられるようになった.受精後120時間あたりからすべてのHox13遺伝子の発現は徐々に消失した.
2.後期型のHox遺伝子の発現により標識された細胞は鰭条になる
Hox13遺伝子の発現は受精後120時間あたりから消失したが,これらの細胞は最終的に鰭のどの部位の発生に寄与するのだろうか.マウスにおいては,後期型の発現を示すHoxA13遺伝子にCre遺伝子をノックインして細胞系譜を追跡すると,最終的に指・手首の発生に寄与することが明らかにされていた10).そこで,ゼブラフィッシュを用いて同様に細胞系譜を追跡した.HoxAa遺伝子クラスターから数百kbp離れたところにある,後期型のHox遺伝子の発現を制御するエンハンサーのひとつであるe16を,原始的な硬骨魚であるガーからクローニングし11),e16によりCre遺伝子が発現するトランスジェニックゼブラフィッシュを作製した.また,通常はGFPが発現しすべての細胞が緑色に光るが,Creの活性をもつ細胞においてはGFPに代わりRFPが発現し赤色に標識されるゼブラフィッシュを利用した12).これら2つのトランスジェニックゼブラフィッシュを交配させ,RFPの蛍光により標識された細胞の動きを追跡したところ,受精後48時間において遠位側にフィロポディア様の突起を伸ばし積極的に移動しているようすが観察された.そののち,6日,さらに,20日と時間がたつにつれ,RFPの蛍光を示す細胞は鰭原基から鰭条へと移動し,生後3か月では鰭条においてRFPの蛍光が観察された.後期型のHox遺伝子の発現により標識された細胞が,マウスにおいては指・手首の発生に寄与すること,魚においては鰭条の発生に寄与したことから,構造的かつ発生的に異なる2つの組織にはなんらかの関連のある可能性が高いと考えられた.
3.Hox13遺伝子を欠損したゼブラフィッシュは鰭条が消失し軟骨内性骨の数が増加する
より直接的な実験により指・手首と鰭条との関係をさぐることにした.Hox13遺伝子はマウスにおいて指・手首の発生に必須であることが知られている3).HoxA13遺伝子およびHoxD13遺伝子を欠損したマウスは指・手首が発生しない.そこで魚のHox13ファミリー遺伝子であるHoxa13a遺伝子,Hoxa13b遺伝子,Hoxd13a遺伝子を欠損したゼブラフィッシュを作製し表現型を解析した.CRISPR-Cas9系によるゲノム編集技術を使用することにより,3つのHox13遺伝子それぞれを単独で欠損したゼブラフィッシュを作製した.これらのゼブラフィッシュにとくにきわだった表現型は観察されず,骨格のCTスキャニングとコンピューター解析の系を確立して鰭の全体像,また,鰭の根元にある軟骨内性骨の形態を詳細に観察したが,やはり野生型との大きな違いは観察されなかった.そこで,Hoxa13a遺伝子およびHoxa13b遺伝子をホモで欠損したゼブラフィッシュの成体において表現型を観察したところ,胸鰭,腹鰭,背びれ,尻びれの鰭条の長さが大きく減少し,外見からは,尾びれのほか,ほとんど鰭はないようにみえた.骨格のCTスキャニングにより詳細に解析したところ,鰭条が短くなったのとは反対に,鰭の根元の軟骨内性骨の数が増加していた.
おわりに
ゼブラフィッシュにおける後期型のHox遺伝子の発現を示す細胞系譜の追跡,および,Hox13遺伝子を欠損したゼブラフィッシュの解析より,鰭条と指・手首は同じく後期型のHox遺伝子の発現をへた細胞からなり,さらに,鰭条および指・手首はHox13遺伝子により発生が制御されることがわかった.鰭条と指・手首は骨の発生の仕方および構造が違うにもかかわらず,細胞系譜および発生の機構が共通していたのである.さらに,Hox13遺伝子を欠損したゼブラフィッシュにおいて鰭条が短くなると同時に軟骨内性骨の数が増加したことから,進化の過程において鰭条の骨が徐々に軟骨内性骨へと転換した可能性が示唆された(図2).
今回の解析において,皮骨が軟骨内性骨へと徐々に進化した可能性が示されたが,どのようにして2つの細胞運命に転換が起こるのかについてはまったく不明である.今後は,この機構の分子レベルでの解析が期待される.また最近,別の研究グループにより,発生の過程において体節に由来する細胞が鰭へと侵入することにより,軟骨内性骨を形成するプログラムと皮骨を形成するプログラムとが切り替えられることが報告された13).筆者らの結果とあわせて,その詳細な機構の解明が期待される.
今回の解析においては,最新の遺伝子組換え技術および高出力のCTスキャニングを使用することにより,化石の記録にしか残っていない鰭から手足への進化の機構が解明された.技術の進歩を追い風に,“実験古生物学”は新しい局面に入りつつある.
文 献
- Thorogood, P.: The development of the teleost fin and implications for our understanding of tetrapod limb evolution. in Developmental Patterning of the Vertebrate Limb (Hinchliffe, J. R., Hurle, J. M. & Summerbell, D. eds.), pp. 347-354, Plenum Press, New York (1991)
- Zakany, J. & Duboule, D.: The role of Hox genes during vertebrate limb development. Curr. Opin. Genet. Dev., 17, 359-366 (2007)[PubMed]
- Fromental-Ramain, C., Warot, X., Messadecq, N. et al.: Hoxa-13 and Hoxd-13 play a crucial role in the patterning of the limb autopod. Development, 122, 2997-3011 (1996)[PubMed]
- Shimada, A., Kawanishi, T., Kaneko, T. et al.: Trunk exoskeleton in teleosts is mesodermal in origin. Nat. Commun., 4, 1639 (2013)[PubMed]
- Grandel, H. & Schulte-Merker, S.: The development of the paired fins in the Zebrafish (Danio rerio). Mech. Dev., 79, 99-120 (1998)[PubMed]
- Yano, T., Abe, G., Yokoyama, H. et al.: Mechanism of pectoral fin outgrowth in zebrafish development. Development, 139, 2916-2925 (2012)[PubMed]
- Davis, M. C., Dahn, R. D. & Shubin, N. H.: An autopodial-like pattern of Hox expression in the fins of a basal actinopterygian fish. Nature, 447, 473-476 (2007)[PubMed]
- Freitas, R., Zhang, G. & Cohn, M. J.: Biphasic Hoxd gene expression in shark paired fins reveals an ancient origin of the distal limb domain. PLoS One, 2, e754 (2007)[PubMed]
- Tulenko, F. J., Augustus, G. J., Massey, J. L. et al.: HoxD expression in the fin-fold compartment of basal gnathostomes and implications for paired appendage evolution. Sci. Rep., 6, 22720 (2016)[PubMed]
- Scotti, M., Kherdjemil, Y., Roux, M. et al.: A Hoxa13:Cre mouse strain for conditional gene manipulation in developing limb, hindgut, and urogenital system. Genesis, 53, 366-376 (2015)[PubMed]
- Gehrke, A. R., Schneider, I., de la Calle-Mustienes, E. et al.: Deep conservation of wrist and digit enhancers in fish. Proc. Natl. Acad. Sci. USA, 112, 803-808 (2015)[PubMed]
- Mosimann, C., Kaufman, C. K., Li, P. et al.: Ubiquitous transgene expression and Cre-based recombination driven by the ubiquitin promoter in zebrafish. Development, 138, 169-177 (2011)[PubMed]
- Masselink, W., Cole, N. J., Fenyes, F. et al.: A somitic contribution to the apical ectodermal ridge is essential for fin formation. Nature, 535, 542-546 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2007年 大阪大学大学院生命機能研究科 修了,同年 同 特別研究員,2008年 同 助教を経て,2012年より米国Chicago大学Research Fellow.
研究テーマ:魚類の発生および進化の機構.
関心事:フライフィッシングで釣った魚の解剖.大物はうれしいが,解剖に時間がかかる.
Neil H. Shubin
米国Chicago大学Professor.
研究室URL:http://shubinlab.uchicago.edu/
© 2016 中村哲也・Neil H. Shubin Licensed under CC 表示 2.1 日本