プレキシン受容体を介したセマフォリンシグナル伝達機構の構造的な基盤
禾 晃和・高木淳一
(大阪大学蛋白質研究所 プロテオミクス総合研究センタープロテオーム物質創製研究系)
email:禾 晃和,高木淳一
DOI: 10.7875/first.author.2010.047
Structural basis for semaphorin signalling through the plexin receptor.
Terukazu Nogi, Norihisa Yasui, Emiko Mihara, Yukiko Matsunaga, Masanori Noda, Naoya Yamashita, Toshihiko Toyofuku, Susumu Uchiyama, Yoshio Goshima, Atsushi Kumanogoh, Junichi Takagi
Nature, 467, 1123-1127 (2010)
セマフォリンは神経軸索の伸長などの細胞移動を制御するガイダンス因子であり,ガイドする標的細胞の受容体であるプレキシンと相互作用することによってシグナルを伝達する.今回,筆者らは,セマフォリン6AとプレキシンA2のリガンド-受容体ペアをとりあげ,これらの細胞外領域の結晶構造をそれぞれ明らかにし,さらに,それらの複合体の構造を決定することにも成功した.そして,結晶構造から,プレキシン受容体はシグナルを伝達するまえの状態ではホモ2量体構造を形成して不活性な状態にあるが,セマフォリンと遭遇することによってホモ2量体構造が解離して活性化されるという可能性が示された.この研究の成果は,プレキシン受容体の活性化の分子機構を解明していくうえで構造的な基盤をあたえるものであるといえる.
セマフォリン(semaphorin)は神経軸索の伸長のガイダンス因子として同定されたのち,免疫応答,器官形成,血管新生など,さまざまな生命現象への関与が明らかにされている1-3).また,がんの転移やアトピー性皮膚炎などにも関与していることが報告されており4,5),セマフォリンの作用機序を明らかにすることは創薬の観点からも重要だといえる.セマフォリンには,分泌型,膜貫通型,GPIアンカー型など,さまざまなクラスが同定されていて,神経細胞や免疫細胞などの標的細胞に発現するプレキシン(plexin)とよばれる細胞表面受容体に作用する.一方,プレキシンはI型膜タンパク質として標的細胞に発現しており,細胞内領域にGAPドメイン(GAP:GTPase-activating protein,GTP活性化タンパク質)をもつユニークな膜受容体である6).セマフォリンとプレキシンはリガンドと受容体の関係にあるが,細胞外領域にSemaドメインとよばれる共通したモジュール構造をもっており,受容体の活性化するときにはたがいにこのSemaドメインを介して結合するものと考えられている.セマフォリンファミリーに関してはセマフォリン3A(Sema3A)とセマフォリン4D(Sema4D)についてSemaドメインを含む細胞外領域の構造解析が報告されているが7,8),プレキシンファミリーに関しては細胞外領域の構造解析は一例も報告されておらず,当然ながら,セマフォリンとプレキシンとの複合体の形成に関する構造情報はまったく得られていなかった.そのような状況のなか,筆者らは,セマフォリン6A(Sema6A)とプレキシンA2(PlxnA2)というペアをとりあげ,これら単独での細胞外領域の構造決定と,シグナル伝達複合体の構造決定に取り組むこととした.
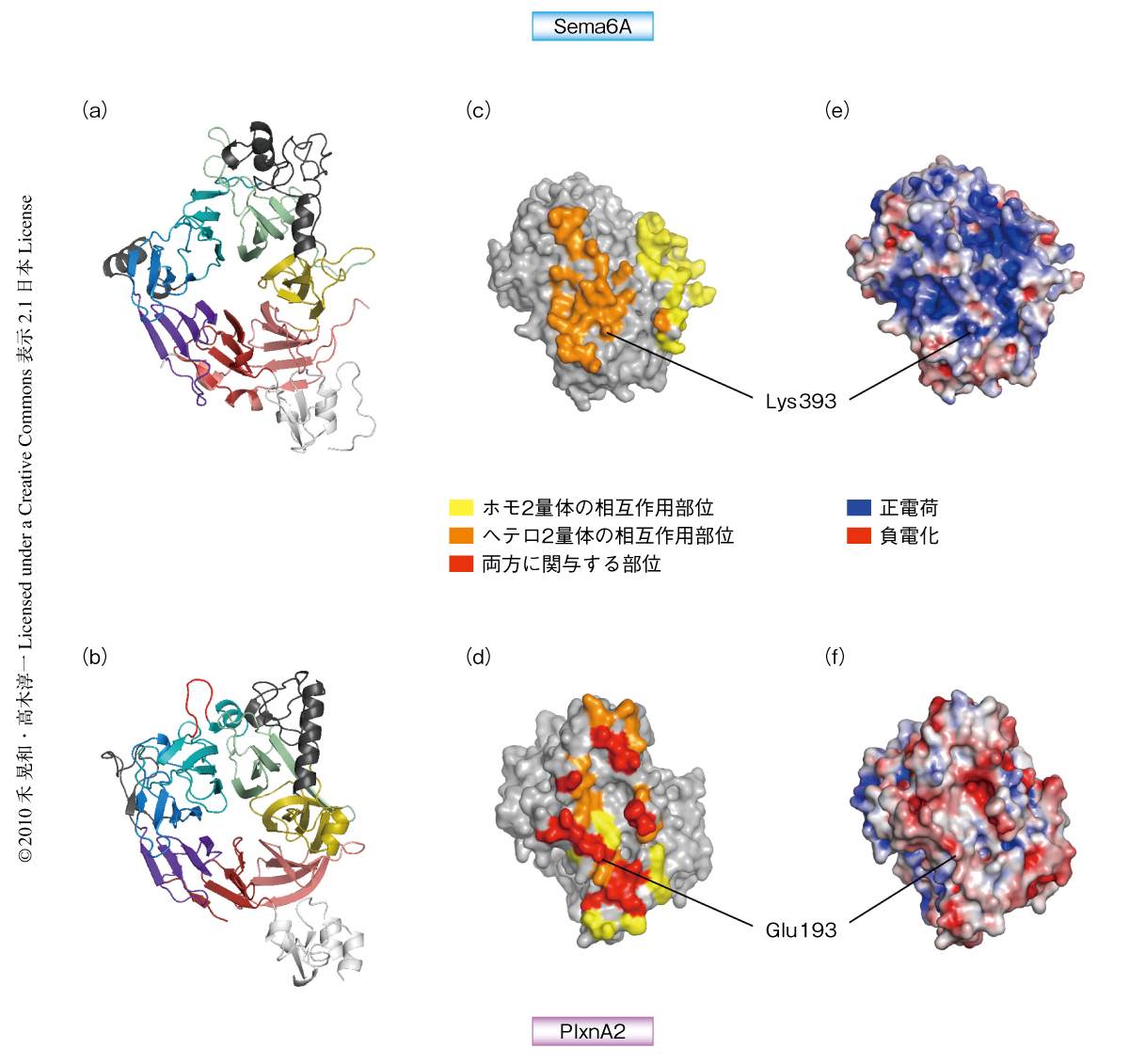
Sema6AとPlxnA2はN末端領域にSemaドメインとPSIドメイン(PSI:plexin-semaphorin-integrin)とよばれる領域を共通してもっており,この研究では,これら2つのドメインを含む領域を可溶性断片として発現させた(以下,結晶化に用いたこれらの断片をそれぞれSema6ASP,PlxnA2SPとよぶ).動物細胞発現系から精製したタンパク質試料を用いて結晶解析を行ったところ,Sema6ASP,PlxnA2SPそれぞれについて2.5Å分解能(PDB ID:3AFC),2.1Å分解能(PDB ID:3AL9)で構造を決定することができた.Sema6ASPとPlxnA2SPのSemaドメインはいずれも7枚の羽根からなるβプロペラ構造をとっており,PSIドメインは3つのS-S結合によって固く結びつけられたコンパクトな構造をとってβプロペラ構造の側面に位置していた(図1 a,b).このように基本的なフォールドは共通している一方で,Semaドメインのβプロペラ構造から突き出たループ領域の構造はSema6ASPとPlxnA2SPとのあいだで大きく異なっていた.とくに,1枚目と2枚目の羽根のあいだ,そして,5枚目の羽根にある長い挿入配列に関しては1次構造だけでなくコンフォメーションもまったく異なり,この領域がSema6AとPlxnA2とを特徴づけているかのようにみえた(以下,それぞれの挿入配列をExtrusion1領域,Extrusion2領域とよぶ).さらに,PlxnA2の3枚目の羽根には外側にむけて突き出た特徴的なループ構造もみつかった(以下,この領域をBulge領域とよぶ).
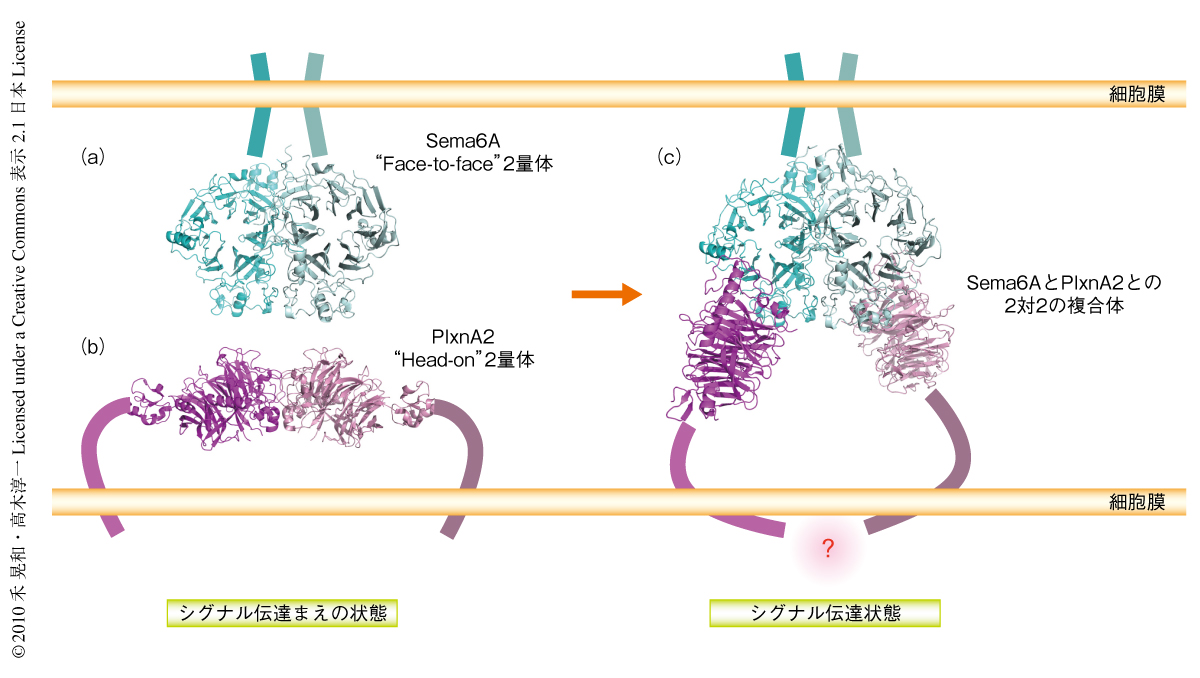
Sema6ASPの主鎖構造はすでに報告されているSema3AやSema4Dのそれと非常によく似ていたが,もうひとつの共通した構造的な特徴としてSemaドメインを介したホモ2量体化があげられた.Sema3AやSema4Dはβプロペラ構造の面と面とを向い合わせにした“Face-to-face”型のホモ2量体構造をとることが報告されていたが,この研究で解析したSema6ASPも非常によく似た“Face-to-face”型のホモ2量体構造を形成していた(図2a).ホモ2量体化にかかわる領域のアミノ酸配列はまったくといっていいくらい保存されていないにもかかわらず3つのセマフォリンが同様のコンフォメーションをとることから,セマフォリンが機能を発現するうえで“Face-to-face”型のホモ2量体構造が重要なコンフォメーションであることが示唆された.一方,予想外なことに,PlxnA2SPも結晶でホモ2量体構造を形成していることがわかったが,その相互作用様式はセマフォリンとは大きく異なり,βプロペラ構造が側面と側面とを突き合わせた“Head-on”型の相互作用によって2量体が形成されていた(図2b).相互作用部位はExtrusion1領域,Extrusion2領域,そして,Bulge領域などより形成されており,相互作用にかかわるアミノ酸残基はA型プレキシンのあいだでよく保存されていた.
Sem6AとPlxnA2の細胞外領域の構造を単独で決定したのち,同様にして調製したタンパク質試料を混合して結晶化を行い構造解析に取り組んだ.最終的に3.6Å分解能でこれらの複合体の結晶構造を決定することに成功し(PDB ID:3AL8),Sema6ASPとPlxnA2SPとは結晶において2対2のヘテロ4量体を形成していることが明らかになった(図2c).このヘテロ4量体構造において,Sema6ASPは単独の状態と同じ“Face-to-face”型のホモ2量体構造を形成していたが,PlxnA2SPの“Head-on”型のホモ2量体構造は解消されて1分子ずつがSema6ASPの2量体にドッキングしていた.また,PlxnA2SPの相互作用部位はPlxnA2SPの単独の構造にみられたホモ2量体の相互作用部位とほぼ完全に重なっていることもわかった(図1 c,d).このことは,PlxnA2はホモフィリックな(同じタンパク質どうしの)相互作用からヘテロフィリックな(別のタンパク質との)相互作用へと“パートナーエクスチェンジ”を起こして複合体を形成していることを意味した.さきに述べたように,このPlxnA2SPの相互作用部位はExtrusion1領域,Extrusion2領域,Bulge領域などより形成されているが,興味深いことに,Sema6ASPの側の相互作用部位も1次構造アラインメントでほぼ同じ領域にマッピングされた.このような知見からも,これらのβプロペラ構造から突き出たループ領域がセマフォリンとプレキシンそれぞれの特徴をひき出す領域であり,これらの領域によって特異的な分子認識が制御されていることが考えられた.また,これらの領域は膜貫通領域へとつながるPSIドメインとは反対側に位置しており,Sema6AとPlxnA2とが向い合った別々の細胞から提示され(トランスに)相互作用することとも合致していた(図1 a,b,図2c).
結晶で見い出されたSema6ASPとPlxnA2SPとの2対2のヘテロ4量体には2種類のタンパク質間相互作用部位が存在した.ひとつはSema6ASPとPlxnA2SPとのあいだに形成されたヘテロフィリックな相互作用部位であり,もうひとつはSema6ASPの2分子のあいだで形成されたホモフィリックな相互作用部位である.結晶内に見い出されたこれらの相互作用が細胞膜でのシグナル伝達複合体のすがたを反映したものであるかどうかを検証するため,細胞を用いた結合実験や活性測定を行った.
まず,ヘテロフィリックな相互作用部位の検証のため,PlxnA2発現細胞に対してSema6ASPを結合させる実験を行った.複合体の構造分析からSema6AとPlxnA2とのあいだに多くの塩橋の形成されていることがわかったので(図1 e,f),それらの塩橋を形成する残基に変異を導入してSema6ASPの結合量の変化を調べることにした.その結果,塩橋を破壊するような変異を導入したものでは期待どおり結合がみられなくなった.また,Sema6Aの393番目のLys残基とPlxnA2の193番目のAsp残基とが形成する塩橋についてはおもしろい知見が得られた.この塩橋を破壊することを目的として,Sema6Aの393番目のLys残基をGlu残基とした変異体とPlxnA2野生型,そして,Sema6A野生型とPlxnA2の193番目のAsp残基をLys残基とした変異体の組合せで結合実験を行ったところ,いずれについても結合がみられなくなった.それに対し,この2つの変異体どうしを組み合わせるとSema6AとPlxnA2との結合が回復することがわかったのである.これは,“二重否定は肯定”であるかのように2つの変異を組み合わせることで同じ部位で塩橋がふたたび形成された結果であると考えられた.この変異体の解析の結果から,Sema6AとPlxnA2とは細胞膜においても結晶にみられたSema6ASPとPlxnA2SPとのヘテロフィリックな相互作用部位を介して結合していることが確かめられた.また,おもに静電的な相互作用を駆動力として結合していることも示唆された.
複合体の結晶のSema6ASPの断片は単独で結晶化した際にみられたものとまったく同じ“Face-to-face”型の2量体構造をとっていた.しかし,このホモ2量体の形成はあくまで結晶化によるアーティファクトであって,細胞膜で相互作用する場合にはSema6Aも単量体に解離して1対1の複合体をつくることでシグナルを伝達する,という可能性も考えられた.そこで,Sema6ASPの“Face-to-face”型の2量体を固定する変異体を作製してプレキシンの活性化能を評価した.
Sema6Aの415番目のMet残基はSema6ASPの2量体の相互作用面においてたがいに近接して存在しており,これをCys残基に置換することで2量体をつなぐS-S結合を形成することができる.このようなSema6ASP変異体のプレキシン活性化能をSema6ASP野生型と比較したところ,野生型では終濃度がμMオーダーでなければ受容体の活性化を検出できなかったところが,変異体では2桁以上も低い濃度で活性化が検出されることがわかった.また,分析超遠心を用いた解析からSema6ASP野生型の2量体の解離定数は約3.5μMと見積もられており,これは今回の実験で明らかになった受容体の活性化のために必要な濃度と高い相関がみられた.これらの結果は,PlxnA2を活性化するためにはSema6Aが2量体構造を保持している必要があり,2量体構造が固定された変異体は低濃度でも活性を示す一方で,野生型は自発的に2量体構造を形成できるようなμMオーダー以上の高濃度の条件でのみ高い活性を示したことを意味するものと考えられた.さきに述べたように,構造の既知のすべてのセマフォリンが同じ“Face-to-face”型の2量体を形成していたことからも,このホモ2量体構造がセマフォリンファミリーに共通したプレキシン受容体の活性化のために必須のコンフォメーションであることが強く示唆された.
この論文で報告した3つの結晶構造から,シグナルを伝達するまえの状態では“Head-on”型のホモ2量体構造を形成するプレキシンは,“Face-to-face”型のホモ2量体構造をとるセマフォリンと遭遇することによって単量体に解離し,2対2のヘテロ4量体を形成する,という仮説がたてられた(図2).プレキシンの細胞外領域にはSemaドメインにつづいて700アミノ酸残基にも及ぶ長いストーク(茎)様の領域があり,細胞膜を隔てた細胞の内側にはGタンパク質の調節領域であるGAPドメインが直結している.もし仮に,ストーク様の領域が非常に硬い構造をとっているとするならば,細胞外におけるSemaドメインの会合状態の変化は細胞内のGAPドメインどうしの配置を直接的に変化させる可能性がある.つまり,セマフォリンとの結合によってある配置をとったときのみ,プレキシンのGAPドメインは活性化状態になり,シグナルは細胞内へと伝達される,という仮説をたてることができる.この仮説を検証しプレキシン受容体の活性化の作用機序を本質的に理解するためには,ストーク様の領域を含めたプレキシン受容体の細胞外領域全体の構造情報を得ることが重要であると考えられ,今後は,そのような解析にも取り組んでいきたい.
略歴:2001年 京都大学大学院理学研究科博士課程 修了,同年 高エネルギー加速器研究機構物質構造科学研究所 博士研究員,2002年 ドイツMax Planck Institute of Biophysics博士研究員を経て,2004年より大阪大学蛋白質研究所 助手(現 助教).
研究テーマ:膜上でのシグナル伝達にかかわるタンパク質を対象とした構造生物学.
抱負:膜受容体の活性化やシグナル伝達を制御する,弱いながらも特異的なタンパク質間相互作用のすがたをX線結晶解析によって明らかにしていきたい.
高木 淳一(Junichi Takagi)
大阪大学蛋白質研究所 教授.
研究室URL:http://www.protein.osaka-u.ac.jp/rcsfp/synthesis/
© 2010 禾 晃和・高木淳一 Licensed under CC 表示 2.1 日本
(大阪大学蛋白質研究所 プロテオミクス総合研究センタープロテオーム物質創製研究系)
email:禾 晃和,高木淳一
DOI: 10.7875/first.author.2010.047
Structural basis for semaphorin signalling through the plexin receptor.
Terukazu Nogi, Norihisa Yasui, Emiko Mihara, Yukiko Matsunaga, Masanori Noda, Naoya Yamashita, Toshihiko Toyofuku, Susumu Uchiyama, Yoshio Goshima, Atsushi Kumanogoh, Junichi Takagi
Nature, 467, 1123-1127 (2010)
要 約
セマフォリンは神経軸索の伸長などの細胞移動を制御するガイダンス因子であり,ガイドする標的細胞の受容体であるプレキシンと相互作用することによってシグナルを伝達する.今回,筆者らは,セマフォリン6AとプレキシンA2のリガンド-受容体ペアをとりあげ,これらの細胞外領域の結晶構造をそれぞれ明らかにし,さらに,それらの複合体の構造を決定することにも成功した.そして,結晶構造から,プレキシン受容体はシグナルを伝達するまえの状態ではホモ2量体構造を形成して不活性な状態にあるが,セマフォリンと遭遇することによってホモ2量体構造が解離して活性化されるという可能性が示された.この研究の成果は,プレキシン受容体の活性化の分子機構を解明していくうえで構造的な基盤をあたえるものであるといえる.
はじめに
セマフォリン(semaphorin)は神経軸索の伸長のガイダンス因子として同定されたのち,免疫応答,器官形成,血管新生など,さまざまな生命現象への関与が明らかにされている1-3).また,がんの転移やアトピー性皮膚炎などにも関与していることが報告されており4,5),セマフォリンの作用機序を明らかにすることは創薬の観点からも重要だといえる.セマフォリンには,分泌型,膜貫通型,GPIアンカー型など,さまざまなクラスが同定されていて,神経細胞や免疫細胞などの標的細胞に発現するプレキシン(plexin)とよばれる細胞表面受容体に作用する.一方,プレキシンはI型膜タンパク質として標的細胞に発現しており,細胞内領域にGAPドメイン(GAP:GTPase-activating protein,GTP活性化タンパク質)をもつユニークな膜受容体である6).セマフォリンとプレキシンはリガンドと受容体の関係にあるが,細胞外領域にSemaドメインとよばれる共通したモジュール構造をもっており,受容体の活性化するときにはたがいにこのSemaドメインを介して結合するものと考えられている.セマフォリンファミリーに関してはセマフォリン3A(Sema3A)とセマフォリン4D(Sema4D)についてSemaドメインを含む細胞外領域の構造解析が報告されているが7,8),プレキシンファミリーに関しては細胞外領域の構造解析は一例も報告されておらず,当然ながら,セマフォリンとプレキシンとの複合体の形成に関する構造情報はまったく得られていなかった.そのような状況のなか,筆者らは,セマフォリン6A(Sema6A)とプレキシンA2(PlxnA2)というペアをとりあげ,これら単独での細胞外領域の構造決定と,シグナル伝達複合体の構造決定に取り組むこととした.
1.Sema6AとPlxnA2はまったく異なる配向でホモ2量体構造を形成する
Sema6AとPlxnA2はN末端領域にSemaドメインとPSIドメイン(PSI:plexin-semaphorin-integrin)とよばれる領域を共通してもっており,この研究では,これら2つのドメインを含む領域を可溶性断片として発現させた(以下,結晶化に用いたこれらの断片をそれぞれSema6ASP,PlxnA2SPとよぶ).動物細胞発現系から精製したタンパク質試料を用いて結晶解析を行ったところ,Sema6ASP,PlxnA2SPそれぞれについて2.5Å分解能(PDB ID:3AFC),2.1Å分解能(PDB ID:3AL9)で構造を決定することができた.Sema6ASPとPlxnA2SPのSemaドメインはいずれも7枚の羽根からなるβプロペラ構造をとっており,PSIドメインは3つのS-S結合によって固く結びつけられたコンパクトな構造をとってβプロペラ構造の側面に位置していた(図1 a,b).このように基本的なフォールドは共通している一方で,Semaドメインのβプロペラ構造から突き出たループ領域の構造はSema6ASPとPlxnA2SPとのあいだで大きく異なっていた.とくに,1枚目と2枚目の羽根のあいだ,そして,5枚目の羽根にある長い挿入配列に関しては1次構造だけでなくコンフォメーションもまったく異なり,この領域がSema6AとPlxnA2とを特徴づけているかのようにみえた(以下,それぞれの挿入配列をExtrusion1領域,Extrusion2領域とよぶ).さらに,PlxnA2の3枚目の羽根には外側にむけて突き出た特徴的なループ構造もみつかった(以下,この領域をBulge領域とよぶ).
Sema6ASPの主鎖構造はすでに報告されているSema3AやSema4Dのそれと非常によく似ていたが,もうひとつの共通した構造的な特徴としてSemaドメインを介したホモ2量体化があげられた.Sema3AやSema4Dはβプロペラ構造の面と面とを向い合わせにした“Face-to-face”型のホモ2量体構造をとることが報告されていたが,この研究で解析したSema6ASPも非常によく似た“Face-to-face”型のホモ2量体構造を形成していた(図2a).ホモ2量体化にかかわる領域のアミノ酸配列はまったくといっていいくらい保存されていないにもかかわらず3つのセマフォリンが同様のコンフォメーションをとることから,セマフォリンが機能を発現するうえで“Face-to-face”型のホモ2量体構造が重要なコンフォメーションであることが示唆された.一方,予想外なことに,PlxnA2SPも結晶でホモ2量体構造を形成していることがわかったが,その相互作用様式はセマフォリンとは大きく異なり,βプロペラ構造が側面と側面とを突き合わせた“Head-on”型の相互作用によって2量体が形成されていた(図2b).相互作用部位はExtrusion1領域,Extrusion2領域,そして,Bulge領域などより形成されており,相互作用にかかわるアミノ酸残基はA型プレキシンのあいだでよく保存されていた.
2.Sema6AとPlxnA2は2対2のヘテロ4量体を形成する
Sem6AとPlxnA2の細胞外領域の構造を単独で決定したのち,同様にして調製したタンパク質試料を混合して結晶化を行い構造解析に取り組んだ.最終的に3.6Å分解能でこれらの複合体の結晶構造を決定することに成功し(PDB ID:3AL8),Sema6ASPとPlxnA2SPとは結晶において2対2のヘテロ4量体を形成していることが明らかになった(図2c).このヘテロ4量体構造において,Sema6ASPは単独の状態と同じ“Face-to-face”型のホモ2量体構造を形成していたが,PlxnA2SPの“Head-on”型のホモ2量体構造は解消されて1分子ずつがSema6ASPの2量体にドッキングしていた.また,PlxnA2SPの相互作用部位はPlxnA2SPの単独の構造にみられたホモ2量体の相互作用部位とほぼ完全に重なっていることもわかった(図1 c,d).このことは,PlxnA2はホモフィリックな(同じタンパク質どうしの)相互作用からヘテロフィリックな(別のタンパク質との)相互作用へと“パートナーエクスチェンジ”を起こして複合体を形成していることを意味した.さきに述べたように,このPlxnA2SPの相互作用部位はExtrusion1領域,Extrusion2領域,Bulge領域などより形成されているが,興味深いことに,Sema6ASPの側の相互作用部位も1次構造アラインメントでほぼ同じ領域にマッピングされた.このような知見からも,これらのβプロペラ構造から突き出たループ領域がセマフォリンとプレキシンそれぞれの特徴をひき出す領域であり,これらの領域によって特異的な分子認識が制御されていることが考えられた.また,これらの領域は膜貫通領域へとつながるPSIドメインとは反対側に位置しており,Sema6AとPlxnA2とが向い合った別々の細胞から提示され(トランスに)相互作用することとも合致していた(図1 a,b,図2c).
3.Sema6AとPlxnA2は静電的な相互作用により特異的に結合する
結晶で見い出されたSema6ASPとPlxnA2SPとの2対2のヘテロ4量体には2種類のタンパク質間相互作用部位が存在した.ひとつはSema6ASPとPlxnA2SPとのあいだに形成されたヘテロフィリックな相互作用部位であり,もうひとつはSema6ASPの2分子のあいだで形成されたホモフィリックな相互作用部位である.結晶内に見い出されたこれらの相互作用が細胞膜でのシグナル伝達複合体のすがたを反映したものであるかどうかを検証するため,細胞を用いた結合実験や活性測定を行った.
まず,ヘテロフィリックな相互作用部位の検証のため,PlxnA2発現細胞に対してSema6ASPを結合させる実験を行った.複合体の構造分析からSema6AとPlxnA2とのあいだに多くの塩橋の形成されていることがわかったので(図1 e,f),それらの塩橋を形成する残基に変異を導入してSema6ASPの結合量の変化を調べることにした.その結果,塩橋を破壊するような変異を導入したものでは期待どおり結合がみられなくなった.また,Sema6Aの393番目のLys残基とPlxnA2の193番目のAsp残基とが形成する塩橋についてはおもしろい知見が得られた.この塩橋を破壊することを目的として,Sema6Aの393番目のLys残基をGlu残基とした変異体とPlxnA2野生型,そして,Sema6A野生型とPlxnA2の193番目のAsp残基をLys残基とした変異体の組合せで結合実験を行ったところ,いずれについても結合がみられなくなった.それに対し,この2つの変異体どうしを組み合わせるとSema6AとPlxnA2との結合が回復することがわかったのである.これは,“二重否定は肯定”であるかのように2つの変異を組み合わせることで同じ部位で塩橋がふたたび形成された結果であると考えられた.この変異体の解析の結果から,Sema6AとPlxnA2とは細胞膜においても結晶にみられたSema6ASPとPlxnA2SPとのヘテロフィリックな相互作用部位を介して結合していることが確かめられた.また,おもに静電的な相互作用を駆動力として結合していることも示唆された.
4.“Face-to-face”型の2量体構造をとったSema6AがPlxnA2を活性化する
複合体の結晶のSema6ASPの断片は単独で結晶化した際にみられたものとまったく同じ“Face-to-face”型の2量体構造をとっていた.しかし,このホモ2量体の形成はあくまで結晶化によるアーティファクトであって,細胞膜で相互作用する場合にはSema6Aも単量体に解離して1対1の複合体をつくることでシグナルを伝達する,という可能性も考えられた.そこで,Sema6ASPの“Face-to-face”型の2量体を固定する変異体を作製してプレキシンの活性化能を評価した.
Sema6Aの415番目のMet残基はSema6ASPの2量体の相互作用面においてたがいに近接して存在しており,これをCys残基に置換することで2量体をつなぐS-S結合を形成することができる.このようなSema6ASP変異体のプレキシン活性化能をSema6ASP野生型と比較したところ,野生型では終濃度がμMオーダーでなければ受容体の活性化を検出できなかったところが,変異体では2桁以上も低い濃度で活性化が検出されることがわかった.また,分析超遠心を用いた解析からSema6ASP野生型の2量体の解離定数は約3.5μMと見積もられており,これは今回の実験で明らかになった受容体の活性化のために必要な濃度と高い相関がみられた.これらの結果は,PlxnA2を活性化するためにはSema6Aが2量体構造を保持している必要があり,2量体構造が固定された変異体は低濃度でも活性を示す一方で,野生型は自発的に2量体構造を形成できるようなμMオーダー以上の高濃度の条件でのみ高い活性を示したことを意味するものと考えられた.さきに述べたように,構造の既知のすべてのセマフォリンが同じ“Face-to-face”型の2量体を形成していたことからも,このホモ2量体構造がセマフォリンファミリーに共通したプレキシン受容体の活性化のために必須のコンフォメーションであることが強く示唆された.
おわりに
この論文で報告した3つの結晶構造から,シグナルを伝達するまえの状態では“Head-on”型のホモ2量体構造を形成するプレキシンは,“Face-to-face”型のホモ2量体構造をとるセマフォリンと遭遇することによって単量体に解離し,2対2のヘテロ4量体を形成する,という仮説がたてられた(図2).プレキシンの細胞外領域にはSemaドメインにつづいて700アミノ酸残基にも及ぶ長いストーク(茎)様の領域があり,細胞膜を隔てた細胞の内側にはGタンパク質の調節領域であるGAPドメインが直結している.もし仮に,ストーク様の領域が非常に硬い構造をとっているとするならば,細胞外におけるSemaドメインの会合状態の変化は細胞内のGAPドメインどうしの配置を直接的に変化させる可能性がある.つまり,セマフォリンとの結合によってある配置をとったときのみ,プレキシンのGAPドメインは活性化状態になり,シグナルは細胞内へと伝達される,という仮説をたてることができる.この仮説を検証しプレキシン受容体の活性化の作用機序を本質的に理解するためには,ストーク様の領域を含めたプレキシン受容体の細胞外領域全体の構造情報を得ることが重要であると考えられ,今後は,そのような解析にも取り組んでいきたい.
文 献
- Tamagnone, L. & Comoglio, P. M.: To move or not to move? Semaphorin signalling in cell migration. EMBO Rep., 5, 356-361 (2004)[PubMed]
- Zhou, Y., Gunput, R. A. & Pasterkamp, R. J.: Semaphorin signaling: progress made and promises ahead. Trends Biochem. Sci., 33, 161-170 (2008)[PubMed]
- Suzuki, K., Kumanogoh, A. & Kikutani, H.: Semaphorins and their receptors in immune cell interactions. Nat. Immunol., 9, 17-23 (2008)[PubMed]
- Neufeld, G. & Kessler, O.: The semaphorins: versatile regulators of tumour progression and tumour angiogenesis. Nat. Rev. Cancer, 8, 632-645 (2008)[PubMed]
- Yamaguchi, J., Nakamura, F., Aihara, M. et al.: Semaphorin3A alleviates skin lesions and scratching behavior in NC/Nga mice, an atopic dermatitis model. J. Invest. Dermatol., 128, 2842-2849 (2008)[PubMed]
- Pasterkamp, R. J.: R-Ras fills another GAP in semaphorin signalling. Trends Cell Biol., 15, 61-64 (2005)[PubMed]
- Antipenko, A., Himanen, J. P., van Leyen, K. et al.: Structure of the semaphorin-3A receptor binding module. Neuron, 39, 589-598 (2003)[PubMed]
- Love, C. A., Harlos, K., Mavaddat, N. et al.: The ligand-binding face of the semaphorins revealed by the high-resolution crystal structure of SEMA4D. Nat. Struct. Biol., 10, 843-848 (2003)[PubMed]
著者プロフィール
略歴:2001年 京都大学大学院理学研究科博士課程 修了,同年 高エネルギー加速器研究機構物質構造科学研究所 博士研究員,2002年 ドイツMax Planck Institute of Biophysics博士研究員を経て,2004年より大阪大学蛋白質研究所 助手(現 助教).
研究テーマ:膜上でのシグナル伝達にかかわるタンパク質を対象とした構造生物学.
抱負:膜受容体の活性化やシグナル伝達を制御する,弱いながらも特異的なタンパク質間相互作用のすがたをX線結晶解析によって明らかにしていきたい.
高木 淳一(Junichi Takagi)
大阪大学蛋白質研究所 教授.
研究室URL:http://www.protein.osaka-u.ac.jp/rcsfp/synthesis/
© 2010 禾 晃和・高木淳一 Licensed under CC 表示 2.1 日本