APC/CCDC20と紡錘体チェックポイント複合体との複合体による相互的なユビキチン化の機構
山口雅也・Brenda A. Schulman
(米国St. Jude Children’s Research Hospital,Department of Structural Biology)
email:山口雅也
DOI: 10.7875/first.author.2016.088
Cryo-EM of mitotic checkpoint complex-bound APC/C reveals reciprocal and conformational regulation of ubiquitin ligation.
Masaya Yamaguchi, Ryan VanderLinden, Florian Weissmann, Renping Qiao, Prakash Dube, Nicholas G. Brown, David Haselbach, Wei Zhang, Sachdev S. Sidhu, Jan-Michael Peters, Holger Stark, Brenda A. Schulman
Molecular Cell, 63, 593-607 (2016)
APC/Cは基質となるタンパク質のユビキチン化を介し細胞周期を制御するユビキチンリガーゼ複合体である.M期において染色体の整列に乱れが生じると,紡錘体チェックポイント複合体はAPC/CによるサイクリンBやセキュリンなどのユビキチン化をさまたげる.今回,APC/CCDC20と紡錘体チェックポイント複合体との複合体をクライオ電子顕微鏡により解析したところ,クローズ型とオープン型の2つのコンフォメーションをとることが明らかにされた.さらに,得られた立体構造の情報をもとにした生化学的な解析により,2つのコンフォメーションの役割について詳細な知見が得られた.今回の結果により,姉妹染色体の正確な分離を制御する機構の一部として,APC/CCDC20と紡錘体チェックポイント複合体との複合体のコンフォメーションのダイナミクスがユビキチン結合酵素の活性やユビキチン化の対象を制御することが示唆された.
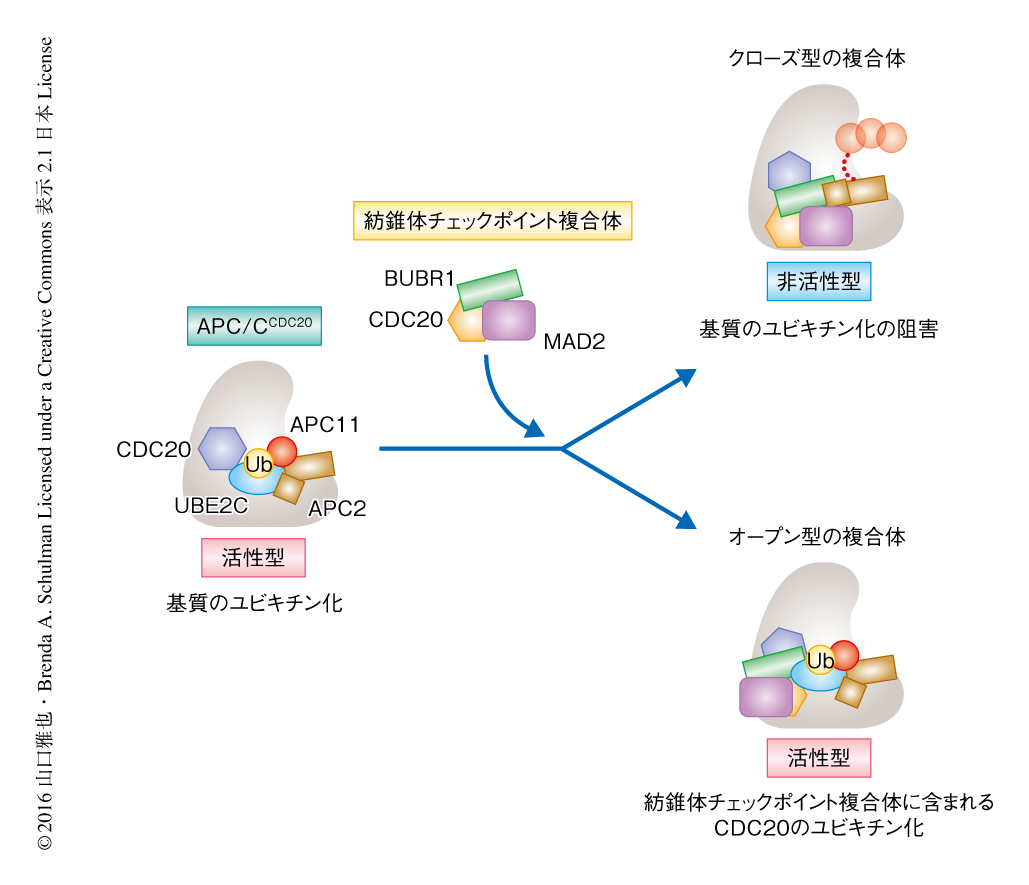
ユビキチンリガーゼ複合体であるAPC/Cは,分裂後期の阻害タンパク質であるセキュリンや細胞分裂の制御タンパク質であるサイクリンなどのユビキチン化を介し細胞周期を制御する.APC/Cは分裂前期においてリン酸化により活性化され,これにより活性補助タンパク質であるCDC20との結合が可能になる1-3).CDC20との結合によりAPC/Cは基質となるタンパク質との結合が可能になり,触媒サブユニットであるAPC2およびAPC11がアロステリックに活性化される(図1).APC/CはUBE2CおよびUBE2Sという2つのユビキチン結合酵素と協調してはたらき,それぞれのユビキチン結合酵素と異なる立体構造をとることにより基質をポリユビキチン化する4).UBE2Cは基質に対し直接的にユビキチンを結合する役割を担い,UBE2Sは基質と結合したユビキチンにさらにユビキチンを結合してポリユビキチン化する.
M期における染色体の整列は有糸分裂チェックポイント複合体により監視されており,染色体の整列に乱れが生じると紡錘体チェックポイント複合体が形成され,セキュリンやサイクリンBなどのユビキチン化がAPC/CCDC20に依存して阻害されることにより細胞周期が停止する.細胞分裂におけるAPC/CCDC20の活性は,CDC20の合成および分解,紡錘体チェックポイント複合体との会合および解離,APC/CCDC20と紡錘体チェックポイント複合体との複合体の会合および解離などにより複雑に制御される.紡錘体チェックポイント複合体は進化的に保存されており,CDC20,MAD2,BUBR1/MAD3,BUB3の4つのタンパク質から構成される.紡錘体チェックポイント複合体はすでにAPC/Cと結合しているCDC20との結合を介してAPC/CCDC20を阻害する5).APC/CCDC20と紡錘体チェックポイント複合体との複合体の制御において特徴的なのは,紡錘体チェックポイント複合体がAPC/CCDC20の阻害にはたらく一方,状態によりCDC20がユビキチン化される点である.しかしながら,CDC20はきわめて短命なタンパク質であるため,CDC20のユビキチン化とのちの現象との因果関係についてはより議論が必要であった.また,APC/CのサブユニットのひとつであるAPC15の欠損によりCDC20が安定化され紡錘体チェックポイント複合体がAPC/Cから解離しないことが報告されていた6-8).APC/CCDC20の活性におけるAPC15の欠損による唯一の影響は,CDC20のユビキチン化を強く抑制する点であった6,8).
今回,筆者らは,クライオ電子顕微鏡による解析および生化学な解析を複合的に行うことにより,ユビキチン化を介したAPC/CCDC20および紡錘体チェックポイント複合体の制御機構について詳細に調べた.
M期に特異的なのべ100個のSer/Thrリン酸化残基をGluと置換したAPC/Cを用いることにより,APC/CCDC20と紡錘体チェックポイント複合体との複合体の解析が可能になった2).このリン酸化模倣APC/CはCDC20,UBE2C,UBE2Sと協同して基質となるタンパク質をユビキチン化し,また,紡錘体チェックポイント複合体による阻害をうけた.このAPC/CCDC20と紡錘体チェックポイント複合体との複合体をクライオ電子顕微鏡により解析した結果,2つの明確なコンフォメーションの存在が明らかにされ,クローズ型およびオープン型とした(EMDB ID:4023,4024).既知の分裂酵母の紡錘体チェックポイント複合体の結晶構造とAPC/CCDC20の立体構造を電子密度にあてはめたところ,CDC20には,APC/CCDC20と結合しているCDC20と,紡錘体チェックポイント複合体に含まれるCDC20の2つが存在し,紡錘体チェックポイント複合体の結晶構造もよくフィットした.クローズ型あるいはオープン型の複合体において,APC/CCDC20と結合しているCDC20はAPC/Cに対し明確に異なるコンフォメーションをとっていた.しかしながら,APC/CCDC20と結合しているCDC20と紡錘体チェックポイント複合体の構造はクローズ型あるいはオープン型の複合体において変化していなかった.クローズ型の複合体においてはユビキチン結合酵素であるUBE2Cがユビキチン化のための中央のスペースをふさいでおり,オープン型の複合体においてはこのスペースはふさがれていなかった.クローズ型の複合体は,これまでに報告されていた内在性のAPC/CCDC20と紡錘体チェックポイント複合体との複合体と同じ構造をとっていた9).
得られたAPC/CCDC20と紡錘体チェックポイント複合体との複合体の構造を,これまで報告されていたリン酸化アポAPC/CおよびAPC/CCDC20と基質との複合体の構造と比較した結果,クローズ型の複合体においてはユビキチン結合酵素であるUBE2Cとの結合に必要なAPC/Cの触媒サブユニットであるAPC2は紡錘体チェックポイント複合体のサブユニットBUBR1により阻害されていた(図1).また,クローズ型およびオープン型の複合体において,APC/CCDC20と結合しているCDC20の基質との結合はBUBR1により阻害されていた.また,APC/CCDC20と結合しているCDC20とに対し紡錘体チェックポイント複合体に含まれるCDC20に由来する電子密度が相互作用していた.CDC20と基質との結合を阻害するモチーフを変異させたBUBR1を組み込んだ紡錘体チェックポイント複合体を発現させ,APC/CCDC20による基質のユビキチン化および紡錘体チェックポイント複合体によるユビキチン化の阻害を生化学的に検証した結果,変異をもつ紡錘体チェックポイント複合体はユビキチン化を阻害しなかった.
オープン型のAPC/CCDC20と紡錘体チェックポイント複合体との複合体において,ユビキチン結合酵素であるUBE2Cのための中央のスペースはふさがれていなかったことから,オープン型の複合体は紡錘体チェックポイント複合体に含まれるCDC20をユビキチン化するためのコンフォメーションであると推察された.APC/CCDC20と紡錘体チェックポイント複合体との複合体が紡錘体チェックポイント複合体に含まれるCDC20をユビキチン化している瞬間をトラップするため,架橋剤とSortase Aを用いてAPC/CCDC20,紡錘体チェックポイント複合体,UBE2Cからなる複合体を調製し電子顕微鏡により解析した.その結果,UBE2Cが中央のスペースをふさいでおり,APC/CCDC20の触媒サブユニットであるAPC2およびAPC11もUBE2Cと相互作用しているようすが確認された(図1).また,UBE2Cの活性残基であるCysは,紡錘体チェックポイント複合体に含まれるCDC20のユビキチン化部位の近傍に位置していた.
APC/CCDC20と紡錘体チェックポイント複合体との複合体がどのように制御されるのかをより理解するため,APC/CのサブユニットのひとつであるAPC15の欠損によるCDC20のユビキチン化の阻害について検討した6,8).APC15を欠損したAPC/Cと紡錘体チェックポイント複合体との複合体を精査した結果,APC15を欠損した複合体にはオープン型に対しクローズ型の割合が優位である傾向があった.これを検証するため,APC/CCDC20に依存するUBE2C-UBエステル中間体の分解について検証した結果,APC15を欠損した複合体はUBE2C-UBエステル中間体の分解を優位に阻害した.さらに,APC15を欠損した複合体においては紡錘体チェックポイント複合体に含まれるCDC20のユビキチン化は抑制されていた.
クローズ型の複合体にのみ特徴的にみられたBUBR1とAPC2との相互作用,および,紡錘体チェックポイント複合体に含まれるCDC20とAPC8との相互作用に着目し,これらの変異によりクローズ型からオープン型へのコンフォメーションのシフトがみられるかどうか検証した.その結果,変異によりこれらの相互作用が阻害された紡錘体チェックポイント複合体はAPC15を欠損した複合体によるUBE2C-UBエステル中間体の分解の阻害をレスキューし,また,紡錘体チェックポイント複合体に含まれるCDC20のユビキチン化の抑制も解消された.これらの結果から,クローズ型の複合体に特徴的な相互作用を抑制することによりクローズ型からオープン型へとコンフォメーションがシフトすることが強く示唆された.
紡錘体チェックポイント複合体はin vivoにおいてポリユビキチン鎖を伸長するユビキチン結合酵素であるUBE2Sを阻害しないことが示唆されていたため,これを検証するためAPC/CCDC20,紡錘体チェックポイント複合体,UBE2Sからなる複合体をクライオ電子顕微鏡および生化学的な手法により解析した10).その結果,クローズ型の複合体においてもUBE2SはAPC/CCDC20と紡錘体チェックポイント複合体との複合体の相互作用を阻害しておらず,これまでに報告されたAPC/CCDH1とUBE2Sとの複合体の構造と合致した4).また,生化学的な解析の結果からも,UBE2Sはクローズ型あるいはオープン型のコンフォメーションに左右されずユビキチン鎖を伸長することが明らかにされた.
今回の解析により,APC/CCDC20と紡錘体チェックポイント複合体がどのようにしてコンフォメーションに依存的に,また,相互的に制御されるのかが示された.クライオ電子顕微鏡による解析により,紡錘体チェックポイント複合体がAPC/CCDC20による基質のユビキチン化を阻害する分子機構がわかった.また,APC/CCDC20と結合しているCDC20,さらには,APC/CCDC20のサブユニットであるAPC2およびAPC11のコンフォメーションのダイナミクスにより,APC/CCDC20と紡錘体チェックポイント複合体との複合体は,クローズ型においてはユビキチン結合酵素であるUBE2Cを阻害するが,オープン型においてはUBE2Cを受け入れ紡錘体チェックポイント複合体に含まれるCDC20をユビキチン化するといったように,さまざまな機能をもつことが可能であることがわかった.さらに,紡錘体チェックポイント複合体はAPC/CCDC20とUBE2Sとの相互作用は阻害しないことがわかり,細胞において最初のユビキチンが紡錘体チェックポイント複合体に含まれるCDC20に付加されたことに応じてポリユビキチン鎖が伸長されることが推察された.今回の解析からは,APC/CCDC20と紡錘体チェックポイント複合体との複合体のコンフォメーションが細胞においてどのようにして制御されるのかについての理解にはいたらなかった.クローズ型の複合体に特徴的な相互作用を欠損させることによりオープン型へとシフトさせることが可能であったが,APC/CCDC20と紡錘体チェックポイント複合体との複合体へのUBE2Cのアクセスそれ自体が重要な鍵であると推察される.実際に,UBE2Cは紡錘体チェックポイントを制御するタンパク質であることが報告されている.
APC/CCDC20と紡錘体チェックポイント複合体との複合体の制御機構は複数の相互作用に依存することが示された.ひとつひとつの相互作用は弱いものの,それらが相乗的に組み合わさることにより明確な役割をはたしていた.この複数の相互作用による制御は,ほかの阻害タンパク質によるAPC/Cの活性の制御や,2つのユビキチン結合酵素によるポリユビキチン鎖の伸長の制御において報告されているように,APC/Cの制御に共通にみられる.また,同様の複数の相互作用による制御は,ほかのユビキチンリガーゼにもみられる.今後の研究により,ひとつのユビキチンリガーゼが相互作用やコンフォメーションの小さな違いにより阻害や活性化,ユビキチンの対象の変化などさまざまな機能をもち,細胞をダイナミックに制御するケースの見い出されることが期待される.
略歴:2011年 北海道大学大学院生命科学院博士課程 修了,同年 北海道大学大学院先端生命科学院 博士研究員を経て,2012年よりSt. Jude Children’s Research HospitalにてPostdoctoral Research Associate.
研究テーマ:ユビキチンおよびユビキチン様タンパク質の分子生物学.
抱負:No Pain, No Gain.
Brenda A. Schulman
St. Jude Children’s Research HospitalにてProfessor.
© 2016 山口雅也・Brenda A. Schulman Licensed under CC 表示 2.1 日本
(米国St. Jude Children’s Research Hospital,Department of Structural Biology)
email:山口雅也
DOI: 10.7875/first.author.2016.088
Cryo-EM of mitotic checkpoint complex-bound APC/C reveals reciprocal and conformational regulation of ubiquitin ligation.
Masaya Yamaguchi, Ryan VanderLinden, Florian Weissmann, Renping Qiao, Prakash Dube, Nicholas G. Brown, David Haselbach, Wei Zhang, Sachdev S. Sidhu, Jan-Michael Peters, Holger Stark, Brenda A. Schulman
Molecular Cell, 63, 593-607 (2016)
要 約
APC/Cは基質となるタンパク質のユビキチン化を介し細胞周期を制御するユビキチンリガーゼ複合体である.M期において染色体の整列に乱れが生じると,紡錘体チェックポイント複合体はAPC/CによるサイクリンBやセキュリンなどのユビキチン化をさまたげる.今回,APC/CCDC20と紡錘体チェックポイント複合体との複合体をクライオ電子顕微鏡により解析したところ,クローズ型とオープン型の2つのコンフォメーションをとることが明らかにされた.さらに,得られた立体構造の情報をもとにした生化学的な解析により,2つのコンフォメーションの役割について詳細な知見が得られた.今回の結果により,姉妹染色体の正確な分離を制御する機構の一部として,APC/CCDC20と紡錘体チェックポイント複合体との複合体のコンフォメーションのダイナミクスがユビキチン結合酵素の活性やユビキチン化の対象を制御することが示唆された.
はじめに
ユビキチンリガーゼ複合体であるAPC/Cは,分裂後期の阻害タンパク質であるセキュリンや細胞分裂の制御タンパク質であるサイクリンなどのユビキチン化を介し細胞周期を制御する.APC/Cは分裂前期においてリン酸化により活性化され,これにより活性補助タンパク質であるCDC20との結合が可能になる1-3).CDC20との結合によりAPC/Cは基質となるタンパク質との結合が可能になり,触媒サブユニットであるAPC2およびAPC11がアロステリックに活性化される(図1).APC/CはUBE2CおよびUBE2Sという2つのユビキチン結合酵素と協調してはたらき,それぞれのユビキチン結合酵素と異なる立体構造をとることにより基質をポリユビキチン化する4).UBE2Cは基質に対し直接的にユビキチンを結合する役割を担い,UBE2Sは基質と結合したユビキチンにさらにユビキチンを結合してポリユビキチン化する.
M期における染色体の整列は有糸分裂チェックポイント複合体により監視されており,染色体の整列に乱れが生じると紡錘体チェックポイント複合体が形成され,セキュリンやサイクリンBなどのユビキチン化がAPC/CCDC20に依存して阻害されることにより細胞周期が停止する.細胞分裂におけるAPC/CCDC20の活性は,CDC20の合成および分解,紡錘体チェックポイント複合体との会合および解離,APC/CCDC20と紡錘体チェックポイント複合体との複合体の会合および解離などにより複雑に制御される.紡錘体チェックポイント複合体は進化的に保存されており,CDC20,MAD2,BUBR1/MAD3,BUB3の4つのタンパク質から構成される.紡錘体チェックポイント複合体はすでにAPC/Cと結合しているCDC20との結合を介してAPC/CCDC20を阻害する5).APC/CCDC20と紡錘体チェックポイント複合体との複合体の制御において特徴的なのは,紡錘体チェックポイント複合体がAPC/CCDC20の阻害にはたらく一方,状態によりCDC20がユビキチン化される点である.しかしながら,CDC20はきわめて短命なタンパク質であるため,CDC20のユビキチン化とのちの現象との因果関係についてはより議論が必要であった.また,APC/CのサブユニットのひとつであるAPC15の欠損によりCDC20が安定化され紡錘体チェックポイント複合体がAPC/Cから解離しないことが報告されていた6-8).APC/CCDC20の活性におけるAPC15の欠損による唯一の影響は,CDC20のユビキチン化を強く抑制する点であった6,8).
今回,筆者らは,クライオ電子顕微鏡による解析および生化学な解析を複合的に行うことにより,ユビキチン化を介したAPC/CCDC20および紡錘体チェックポイント複合体の制御機構について詳細に調べた.
1.APC/CCDC20と紡錘体チェックポイント複合体との複合体は2つの特異的なコンフォメーションをとる
M期に特異的なのべ100個のSer/Thrリン酸化残基をGluと置換したAPC/Cを用いることにより,APC/CCDC20と紡錘体チェックポイント複合体との複合体の解析が可能になった2).このリン酸化模倣APC/CはCDC20,UBE2C,UBE2Sと協同して基質となるタンパク質をユビキチン化し,また,紡錘体チェックポイント複合体による阻害をうけた.このAPC/CCDC20と紡錘体チェックポイント複合体との複合体をクライオ電子顕微鏡により解析した結果,2つの明確なコンフォメーションの存在が明らかにされ,クローズ型およびオープン型とした(EMDB ID:4023,4024).既知の分裂酵母の紡錘体チェックポイント複合体の結晶構造とAPC/CCDC20の立体構造を電子密度にあてはめたところ,CDC20には,APC/CCDC20と結合しているCDC20と,紡錘体チェックポイント複合体に含まれるCDC20の2つが存在し,紡錘体チェックポイント複合体の結晶構造もよくフィットした.クローズ型あるいはオープン型の複合体において,APC/CCDC20と結合しているCDC20はAPC/Cに対し明確に異なるコンフォメーションをとっていた.しかしながら,APC/CCDC20と結合しているCDC20と紡錘体チェックポイント複合体の構造はクローズ型あるいはオープン型の複合体において変化していなかった.クローズ型の複合体においてはユビキチン結合酵素であるUBE2Cがユビキチン化のための中央のスペースをふさいでおり,オープン型の複合体においてはこのスペースはふさがれていなかった.クローズ型の複合体は,これまでに報告されていた内在性のAPC/CCDC20と紡錘体チェックポイント複合体との複合体と同じ構造をとっていた9).
2.紡錘体チェックポイント複合体による基質のユビキチン化の阻害の機構
得られたAPC/CCDC20と紡錘体チェックポイント複合体との複合体の構造を,これまで報告されていたリン酸化アポAPC/CおよびAPC/CCDC20と基質との複合体の構造と比較した結果,クローズ型の複合体においてはユビキチン結合酵素であるUBE2Cとの結合に必要なAPC/Cの触媒サブユニットであるAPC2は紡錘体チェックポイント複合体のサブユニットBUBR1により阻害されていた(図1).また,クローズ型およびオープン型の複合体において,APC/CCDC20と結合しているCDC20の基質との結合はBUBR1により阻害されていた.また,APC/CCDC20と結合しているCDC20とに対し紡錘体チェックポイント複合体に含まれるCDC20に由来する電子密度が相互作用していた.CDC20と基質との結合を阻害するモチーフを変異させたBUBR1を組み込んだ紡錘体チェックポイント複合体を発現させ,APC/CCDC20による基質のユビキチン化および紡錘体チェックポイント複合体によるユビキチン化の阻害を生化学的に検証した結果,変異をもつ紡錘体チェックポイント複合体はユビキチン化を阻害しなかった.
3.オープン型の複合体は紡錘体チェックポイント複合体に含まれるCDC20をユビキチン化する
オープン型のAPC/CCDC20と紡錘体チェックポイント複合体との複合体において,ユビキチン結合酵素であるUBE2Cのための中央のスペースはふさがれていなかったことから,オープン型の複合体は紡錘体チェックポイント複合体に含まれるCDC20をユビキチン化するためのコンフォメーションであると推察された.APC/CCDC20と紡錘体チェックポイント複合体との複合体が紡錘体チェックポイント複合体に含まれるCDC20をユビキチン化している瞬間をトラップするため,架橋剤とSortase Aを用いてAPC/CCDC20,紡錘体チェックポイント複合体,UBE2Cからなる複合体を調製し電子顕微鏡により解析した.その結果,UBE2Cが中央のスペースをふさいでおり,APC/CCDC20の触媒サブユニットであるAPC2およびAPC11もUBE2Cと相互作用しているようすが確認された(図1).また,UBE2Cの活性残基であるCysは,紡錘体チェックポイント複合体に含まれるCDC20のユビキチン化部位の近傍に位置していた.
4.APC15の欠損はAPC/CCDC20と紡錘体チェックポイント複合体との複合体のコンフォメーションをオープン型からクローズ型へとシフトする
APC/CCDC20と紡錘体チェックポイント複合体との複合体がどのように制御されるのかをより理解するため,APC/CのサブユニットのひとつであるAPC15の欠損によるCDC20のユビキチン化の阻害について検討した6,8).APC15を欠損したAPC/Cと紡錘体チェックポイント複合体との複合体を精査した結果,APC15を欠損した複合体にはオープン型に対しクローズ型の割合が優位である傾向があった.これを検証するため,APC/CCDC20に依存するUBE2C-UBエステル中間体の分解について検証した結果,APC15を欠損した複合体はUBE2C-UBエステル中間体の分解を優位に阻害した.さらに,APC15を欠損した複合体においては紡錘体チェックポイント複合体に含まれるCDC20のユビキチン化は抑制されていた.
クローズ型の複合体にのみ特徴的にみられたBUBR1とAPC2との相互作用,および,紡錘体チェックポイント複合体に含まれるCDC20とAPC8との相互作用に着目し,これらの変異によりクローズ型からオープン型へのコンフォメーションのシフトがみられるかどうか検証した.その結果,変異によりこれらの相互作用が阻害された紡錘体チェックポイント複合体はAPC15を欠損した複合体によるUBE2C-UBエステル中間体の分解の阻害をレスキューし,また,紡錘体チェックポイント複合体に含まれるCDC20のユビキチン化の抑制も解消された.これらの結果から,クローズ型の複合体に特徴的な相互作用を抑制することによりクローズ型からオープン型へとコンフォメーションがシフトすることが強く示唆された.
5.APC/CCDC20と紡錘体チェックポイント複合体との複合体はUBE2Sを阻害しない
紡錘体チェックポイント複合体はin vivoにおいてポリユビキチン鎖を伸長するユビキチン結合酵素であるUBE2Sを阻害しないことが示唆されていたため,これを検証するためAPC/CCDC20,紡錘体チェックポイント複合体,UBE2Sからなる複合体をクライオ電子顕微鏡および生化学的な手法により解析した10).その結果,クローズ型の複合体においてもUBE2SはAPC/CCDC20と紡錘体チェックポイント複合体との複合体の相互作用を阻害しておらず,これまでに報告されたAPC/CCDH1とUBE2Sとの複合体の構造と合致した4).また,生化学的な解析の結果からも,UBE2Sはクローズ型あるいはオープン型のコンフォメーションに左右されずユビキチン鎖を伸長することが明らかにされた.
おわりに
今回の解析により,APC/CCDC20と紡錘体チェックポイント複合体がどのようにしてコンフォメーションに依存的に,また,相互的に制御されるのかが示された.クライオ電子顕微鏡による解析により,紡錘体チェックポイント複合体がAPC/CCDC20による基質のユビキチン化を阻害する分子機構がわかった.また,APC/CCDC20と結合しているCDC20,さらには,APC/CCDC20のサブユニットであるAPC2およびAPC11のコンフォメーションのダイナミクスにより,APC/CCDC20と紡錘体チェックポイント複合体との複合体は,クローズ型においてはユビキチン結合酵素であるUBE2Cを阻害するが,オープン型においてはUBE2Cを受け入れ紡錘体チェックポイント複合体に含まれるCDC20をユビキチン化するといったように,さまざまな機能をもつことが可能であることがわかった.さらに,紡錘体チェックポイント複合体はAPC/CCDC20とUBE2Sとの相互作用は阻害しないことがわかり,細胞において最初のユビキチンが紡錘体チェックポイント複合体に含まれるCDC20に付加されたことに応じてポリユビキチン鎖が伸長されることが推察された.今回の解析からは,APC/CCDC20と紡錘体チェックポイント複合体との複合体のコンフォメーションが細胞においてどのようにして制御されるのかについての理解にはいたらなかった.クローズ型の複合体に特徴的な相互作用を欠損させることによりオープン型へとシフトさせることが可能であったが,APC/CCDC20と紡錘体チェックポイント複合体との複合体へのUBE2Cのアクセスそれ自体が重要な鍵であると推察される.実際に,UBE2Cは紡錘体チェックポイントを制御するタンパク質であることが報告されている.
APC/CCDC20と紡錘体チェックポイント複合体との複合体の制御機構は複数の相互作用に依存することが示された.ひとつひとつの相互作用は弱いものの,それらが相乗的に組み合わさることにより明確な役割をはたしていた.この複数の相互作用による制御は,ほかの阻害タンパク質によるAPC/Cの活性の制御や,2つのユビキチン結合酵素によるポリユビキチン鎖の伸長の制御において報告されているように,APC/Cの制御に共通にみられる.また,同様の複数の相互作用による制御は,ほかのユビキチンリガーゼにもみられる.今後の研究により,ひとつのユビキチンリガーゼが相互作用やコンフォメーションの小さな違いにより阻害や活性化,ユビキチンの対象の変化などさまざまな機能をもち,細胞をダイナミックに制御するケースの見い出されることが期待される.
文 献
- Fujimitsu, K., Grimaldi, M. & Yamano, H.: Cyclin-dependent kinase 1-dependent activation of APC/C ubiquitin ligase. Science, 352, 1121-1124 (2016)[PubMed]
- Qiao, R., Weissmann, F., Yamaguchi, M. et al.: Mechanism of APC/CCDC20 activation by mitotic phosphorylation. Proc. Natl. Acad. Sci. USA, 113, E2570-E2578 (2016)[PubMed]
- Zhang, S., Chang, L., Alfieri, C. et al.: Molecular mechanism of APC/C activation by mitotic phosphorylation. Nature, 533, 260-264 (2016)[PubMed]
- Brown, N. G., VanderLinden, R., Watson, E. R. et al.: Dual RING E3 architectures regulate multiubiquitination and ubiquitin chain elongation by APC/C. Cell, 165, 1440-1453 (2016)[PubMed]
- Izawa, D. & Pines, J.: The mitotic checkpoint complex binds a second CDC20 to inhibit active APC/C. Nature, 517, 631-634 (2015)[PubMed] [新着論文レビュー]
- Foster, S. A. & Morgan, D. O.: The APC/C subunit Mnd2/Apc15 promotes Cdc20 autoubiquitination and spindle assembly checkpoint inactivation. Mol. Cell, 47, 921-932 (2012)[PubMed]
- Mansfeld, J., Collin, P., Collins, M. O. et al.: APC15 drives the turnover of MCC-CDC20 to make the spindle assembly checkpoint responsive to kinetochore attachment. Nat. Cell Biol., 13, 1234-1243 (2011)[PubMed]
- Uzunova, K., Dye, B. T., Schutz, H. et al.: APC15 mediates CDC20 autoubiquitylation by APC/CMCC and disassembly of the mitotic checkpoint complex. Nat. Struct. Mol. Biol., 19, 1116-1123 (2012)[PubMed]
- Herzog, F., Primorac, I., Dube, P. et al.: Structure of the anaphase-promoting complex/cyclosome interacting with a mitotic checkpoint complex. Science, 323, 1477-1481 (2009)[PubMed]
- Kelly, A., Wickliffe, K. E., Song, L. et al.: Ubiquitin chain elongation requires E3-dependent tracking of the emerging conjugate. Mol. Cell, 56, 232-245 (2014)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2011年 北海道大学大学院生命科学院博士課程 修了,同年 北海道大学大学院先端生命科学院 博士研究員を経て,2012年よりSt. Jude Children’s Research HospitalにてPostdoctoral Research Associate.
研究テーマ:ユビキチンおよびユビキチン様タンパク質の分子生物学.
抱負:No Pain, No Gain.
Brenda A. Schulman
St. Jude Children’s Research HospitalにてProfessor.
© 2016 山口雅也・Brenda A. Schulman Licensed under CC 表示 2.1 日本