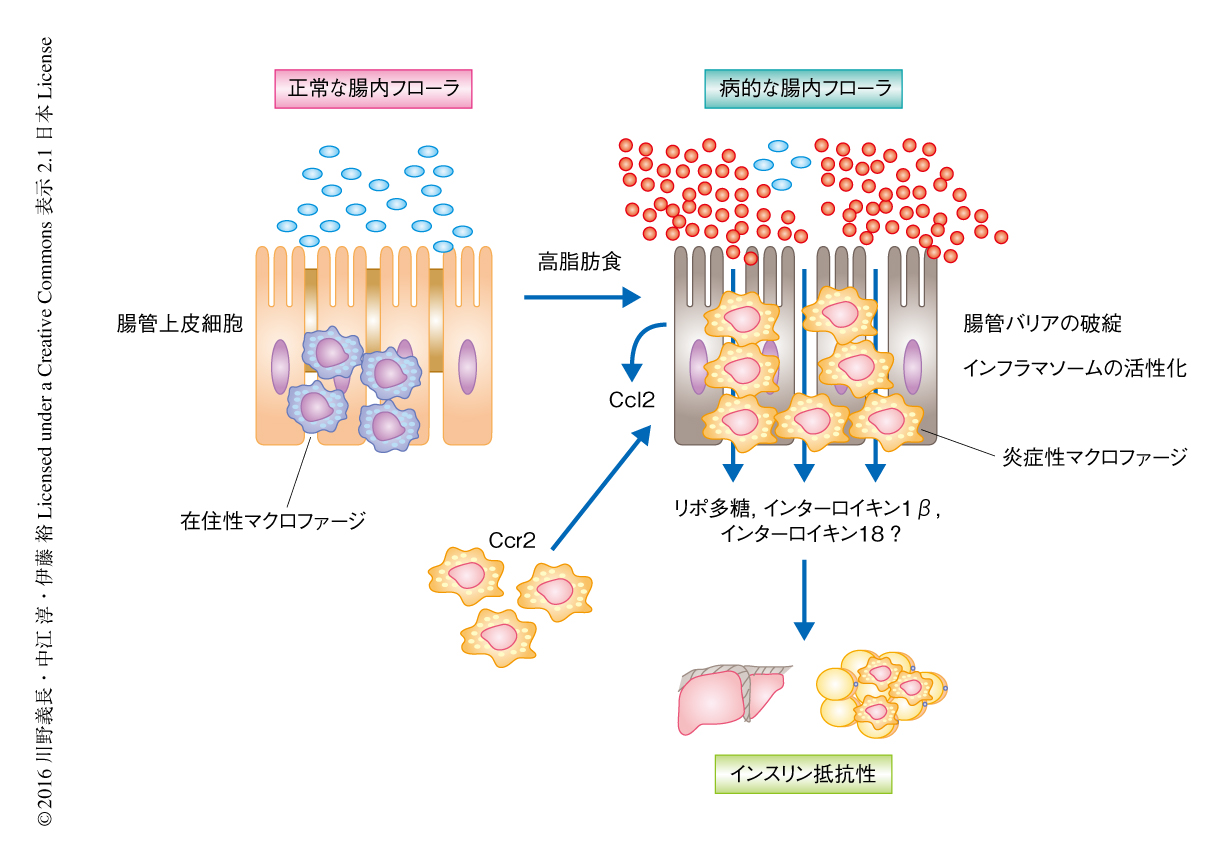
大腸の炎症性マクロファージはケモカインCcl2とその受容体Ccr2に依存して全身のインスリン感受性を制御する
川野義長・中江 淳・伊藤 裕
(慶應義塾大学医学部 内科学教室腎臓内分泌代謝内科)
email:中江 淳
DOI: 10.7875/first.author.2016.087
Colonic pro-inflammatory macrophages cause insulin resistance in an intestinal Ccl2/Ccr2-dependent manner.
Yoshinaga Kawano, Jun Nakae, Nobuyuki Watanabe, Tetsuhiro Kikuchi, Sanshiro Tateya, Yoshikazu Tamori, Mari Kaneko, Takaya Abe, Masafumi Onodera, Hiroshi Itoh
Cell Metabolism, 24, 295-310 (2016)
近年,高脂肪食の負荷や肥満にともなうインスリン抵抗性の発症の機序において,腸内フローラをはじめとする腸内環境の変化が注目されている.一方,人体における最大の免疫器官であり,宿主において高脂肪食と最初に接触する腸管における免疫,とくに,腸管マクロファージのインスリン抵抗性の発症における病態生理学的な意義に関しては不明であった.筆者らは,高脂肪食の負荷により炎症性マクロファージが大腸へと浸潤する病態生理学的な意義について検討するため,ケモカイン受容体Ccr2およびケモカインCcl2について,マクロファージに特異的なCcr2ノックアウトマウスおよび腸管上皮細胞に特異的なCcl2ノックアウトマウスを作製した.これらのノックアウトマウスにおいては肥満であるにもかかわらず,高脂肪食の負荷による耐糖能およびインスリン抵抗性が有意に改善した.さらに,炎症性マクロファージの大腸への浸潤が低下し,高脂肪食の負荷により発現の低下する腸管バリアタンパク質Claudin-1の発現が回復するとともに,インフラマソームの活性化を示唆するASCの活性化が有意に抑制された.これにともない,門脈において炎症性サイトカインであるインターロイキン1βおよびインターロイキン18,エンドトキシンであるリポ多糖の濃度が低下し,これらはインスリン抵抗性の改善に寄与すると考えられた.さらに,腸管上皮細胞に特異的なCcl2ノックアウトマウスの脂肪組織においては,脂肪の重量や脂肪細胞の大きさに差はない一方で,炎症性マクロファージの割合が有意に低下しておりこれはインスリン抵抗性の改善の一因と考えられた.以上の結果より,腸管上皮細胞におけるケモカインCcl2および腸管マクロファージにおけるケモカイン受容体Ccr2を介した炎症性マクロファージの大腸への浸潤が,高脂肪食の負荷にともなう脂肪組織などにおけるインスリン感受性を遠隔から制御する可能性が示唆された
2型糖尿病は患者の数が2000万人にものぼり国民の5人に1人は罹患する成人病で,網膜症や腎症といった合併症をひき起こし失明や透析の原因になるだけでなく,高血圧症および脂質異常症とともに心筋梗塞や脳梗塞などの動脈硬化性疾患を誘発し,健康寿命を短縮させる疾患である.2型糖尿病を発症する主たる原因のひとつは肥満や高脂肪食にともない脂肪組織,肝臓,骨格筋といった全身の臓器において生じるインスリン抵抗性である.一方,肥満によりインスリン抵抗性の生じる機序については未解明の点が多く,インスリン抵抗性の発症の機序の研究は医学的および社会的にもっとも重要な課題のひとつといえる.
従来の研究により,肥満によりインスリン抵抗性がひき起こされる機序として,脂肪組織の慢性炎症やアディポネクチンに代表される脂肪組織に由来するアディポカインが病態に重要であることが明らかにされてきた1).一方で,筆者らの研究によると,マウスに高脂肪食を負荷した際に脂肪組織に炎症性マクロファージが浸潤してくるのは負荷から12週のちであり,実際にインスリン抵抗性が惹起される時期よりはるかに遅い.したがって,インスリンに反応する臓器に炎症性マクロファージが浸潤するまえになんらかのイベントが起こり,インスリン抵抗性が惹起される可能性が考えられた.
近年,全身の肥満およびインスリン抵抗性に腸内細菌をはじめとした腸内環境が大きな影響を及ぼすことが報告されている.すなわち,高脂肪食の負荷にともない腸内フローラが変化し(dysbiosis),腸内細菌に由来する内毒素が血液に流入して,脂肪組織や肝臓などにおいて慢性炎症を起こしインスリン抵抗性をひき起こすという概念である2).腸管は外界の異物と最初に接触する臓器であり,免疫系のみならずさまざまな防御機構をもち,腸管においては宿主と腸内フローラとがバランスを保ちながら腸内環境を形成する.これまで,腸内フローラが全身のインスリン抵抗性に影響をおよぼすという報告の多いなか,宿主の腸管の免疫細胞も糖の代謝およびエネルギー代謝の制御に重要な役割を担うことが明らかにされてきた.
腸管のリンパ球が高脂肪食の負荷によるインスリン抵抗性の発症に重要であるという報告のあるなか3,4),マクロファージなど自然免疫を担当する腸管の免疫細胞の糖の代謝あるいはエネルギー代謝における役割を解析した報告はきわめて少ない.しかしながら,実際に,腸管マクロファージは哺乳動物の腸管においてもっとも多いリンパ球のひとつで,単核の貪食細胞としては最大の集団であり5),腸管の慢性炎症,全身のインスリン抵抗性への影響,2型糖尿病の発症といった観点からなんらかの役割を担うことが推測された.
高脂肪食の負荷における腸管マクロファージの病態生理学的な変化を検討するため,高脂肪食を負荷したマウスの腸管の検体を用いて腸管マクロファージの質的および量的な変化について検討した.高脂肪食の負荷4週という早期の段階において,炎症の指標である大腸の長さが肉眼的に有意に短縮し,リアルタイムPCR解析によりケモカイン受容体であるCcr2,ケモカインであるCcl2,インターロイキン1β,インターロイキン18の発現の上昇が確認され,FACS解析により炎症性マクロファージの浸潤による慢性炎症が認められた.一方で,脂肪組織における炎症性マクロファージの浸潤は大腸より後期の,高脂肪食の負荷12週において認められた.以上の結果より,高脂肪食の負荷にともなう大腸の慢性炎症は脂肪組織より早期に生じ,インスリン抵抗性の発症においてなんらかの役割をはたす可能性が示唆された.
高脂肪食の負荷により大腸へと浸潤する炎症性マクロファージの病態生理学的な意義について検討するため,高脂肪食の負荷により大腸において増加したマクロファージを炎症の部位へと誘導するのに重要なケモカイン受容体Ccr2に着目し,マクロファージに特異的なCcr2ノックアウトマウスを作製し解析した.このノックアウトマウスは高脂肪食の負荷12週において,対照となるマウスと比較して耐糖能およびインスリン抵抗性が有意に改善した.高脂肪食の負荷12週においてFACS解析により脂肪組織および肝臓における炎症性マクロファージに差は認められなかった一方で,炎症性マクロファージの大腸への浸潤は抑制されていた.これらの結果より,マクロファージにおいて特異的にCcr2を欠損することにより炎症性マクロファージの大腸への浸潤が抑制され,高脂肪食の負荷にともなうインスリン抵抗性が改善する可能性が示唆された.
高脂肪食の負荷4週および12週の大腸の腸管上皮細胞において発現の上昇したケモカインCcl2に着目し,タモキシフェンの投与によりCcl2を欠損する腸管上皮細胞に特異的なCcl2ノックアウトマウスを作製し解析した.このノックアウトマウスは高脂肪食の負荷12週において,対象となるマウスと比較してCcr2陽性の炎症性マクロファージの大腸への浸潤が抑制され,インスリン抵抗性および耐糖能が改善した.この結果より,腸管上皮細胞において特異的にCcl2を欠損することにより高脂肪食の負荷にともなう腸管マクロファージの浸潤が抑制され,全身のインスリン抵抗性が改善する可能性が示唆された.
腸管上皮細胞に特異的なCcl2ノックアウトマウスにおいて全身のインスリン抵抗性が改善した機序について検討するため,インスリン感受性三大臓器である脂肪組織,肝臓,骨格筋における表現型を検討したところ,脂肪組織において顕著な変化が認められた.このノックアウトマウスの脂肪組織においては,対照となるマウスと比較して脂肪の重量や脂肪細胞の大きさに差はなかった一方で,リアルタイムPCR解析においてCcl2およびインターロイキン1βの発現が有意に低下し,FACS解析においてM1マクロファージの割合が有意に減少しており,これら脂肪組織の表現型の改善がインスリン抵抗性の改善に寄与すると考えられた.以上の結果より,腸管上皮細胞においてCcl2を欠損させ高脂肪食の負荷にともなう炎症性マクロファージの浸潤を抑制することにより脂肪組織の慢性炎症が改善する可能性が示唆された.
腸管上皮細胞に特異的なCcl2ノックアウトマウスの腸管において炎症性マクロファージが減少したことにより全身のインスリン抵抗性が改善した機序について検討するため,腸管バリアの機能について評価した.高脂肪食の負荷にともなう腸内フローラの変化により腸管バリアに障害が起こり,腸管に存在するグラム陰性の桿菌に由来するリポ多糖が門脈および循環血液をめぐり,Toll様受容体を介して全身のインスリン感受性の臓器においてインスリン抵抗性や慢性炎症をひき起こすことが知られている2).腸管の炎症性マクロファージが腸管バリアの機能におよぼす影響について検討するため,腸管バリアタンパク質の代表であるClaudin-1の発現および門脈におけるリポ多糖の濃度について検討した.その結果,高脂肪食の負荷にともないClaudin-1の発現は有意に低下し,門脈におけるリポ多糖の濃度は有意に上昇しエンドトキシン中毒症をきたしたが,マクロファージに特異的なCcr2ノックアウトマウスおよび腸管上皮細胞に特異的なCcl2ノックアウトマウスの大腸においては,対照となるマウスと比較してClaudin-1の発現は有意に改善し,それにともない門脈におけるリポ多糖の濃度は有意に低下し,これはインスリン抵抗性の改善の一因と考えられた.
近年,高脂肪食の負荷による慢性炎症の発症の機序において,炎症シグナルを感知し伝達するためインフラマソームが重要であると認識されている.高脂肪食の負荷4週の大腸においてインフラマソームの活性化を示唆するASCがスペックルパターンを呈して活性した細胞の有意な増加が認められたが,マクロファージに特異的なCcr2ノックアウトマウスおよび腸管上皮細胞に特異的なCcl2ノックアウトマウスの大腸においてASCの活性化は有意に抑制された.また,インフラマソームに制御される代表的な炎症性サイトカインとしてインターロイキン1βおよびインターロイキン18が知られているが6),マクロファージに特異的なCcr2ノックアウトマウスおよび腸管上皮細胞に特異的なCcl2ノックアウトマウスの大腸において,対照となるマウスと比較してそれら炎症性サイトカインの発現は低下しており,それにともない門脈におけるインターロイキン18の濃度が有意に低下し,これがインスリン抵抗性の改善の一因になる可能性が考えられた.以上の結果から,高脂肪食を負荷したマウスの大腸においては腸管上皮細胞のCcl2およびマクロファージのCcr2を介する経路によりインフラマソームの活性化が制御されることが示唆された.
この研究により,高脂肪食の負荷により肥満したマウスにおいて,腸管のマクロファージが脂肪組織の慢性炎症を“遠隔制御”し,全身のインスリン感受性を制御することが明らかにされた(図1).これまでの研究においては,肥満によるインスリン抵抗性の発症の上流には脂肪組織の慢性炎症があり,その引き金として高脂肪食の負荷による腸内フローラの変化(dysbiosis)が重要であるといわれてきた.この研究においては,腸内フローラそのものではなく,宿主において腸内フローラや食事の内容の変化を最初に感知する臓器である腸管,とくにそこに存在する免疫細胞に着目し,なかでも大腸のマクロファージが高脂肪食および腸内フローラの変化をうけて比較的早期の段階で大腸に慢性炎症をひき起こし,その変化が門脈におけるインターロイキン1β,インターロイキン18,リポ多糖などを介して脂肪組織に伝達され,インスリン抵抗性をひき起こすことが明らかにされた.
以上の結果から,ケモカインの産生を抑制することが肥満による2型糖尿病の発症を抑制する戦略になりうると考えられる.高脂肪食を負荷したマウスにおいては腸管上皮細胞のCcl2が重要であることがわかったが,ほかにも高脂肪食の負荷により腸管上皮細胞において発現の上昇するケモカインは存在し,今後のさらなる検討が必要である.また,腸管マクロファージとしては骨髄の単球に由来する炎症性マクロファージだけでなく,もともと組織に存在して腸管における免疫寛容に寄与する常在性マクロファージがあり,腸管にはほかにも樹状細胞,自然リンパ球,抗体産生細胞などさまざまな種類の免疫細胞が存在し,高脂肪食の負荷や腸内フローラの変化をうけ,どのように抗原の情報が獲得免疫を伝達しインスリン抵抗性に寄与しうるのかについても興味深い.さらに,ヒト,とくに肥満症や糖尿病の患者の大腸におけるケモカインの同定,および,具体的なケモカインの産生の分子機構はまったく解明されておらず,腸管上皮細胞からのケモカインの産生あるいはケモカインの活性を抑制する化合物を同定することは今後の重要な課題である.
略歴:2013年 慶應義塾大学大学院医学研究科にて博士号取得,2014年より慶應義塾大学医学部 助教.
研究テーマ:インスリン抵抗性と腸管免疫.
中江 淳(Jun Nakae)
慶應義塾大学医学部 特任准教授.
伊藤 裕(Hiroshi Itoh)
慶應義塾大学医学部 教授.
研究室URL:http://www.keio-emn.jp/
© 2016 川野義長・中江 淳・伊藤 裕 Licensed under CC 表示 2.1 日本
(慶應義塾大学医学部 内科学教室腎臓内分泌代謝内科)
email:中江 淳
DOI: 10.7875/first.author.2016.087
Colonic pro-inflammatory macrophages cause insulin resistance in an intestinal Ccl2/Ccr2-dependent manner.
Yoshinaga Kawano, Jun Nakae, Nobuyuki Watanabe, Tetsuhiro Kikuchi, Sanshiro Tateya, Yoshikazu Tamori, Mari Kaneko, Takaya Abe, Masafumi Onodera, Hiroshi Itoh
Cell Metabolism, 24, 295-310 (2016)
要 約
近年,高脂肪食の負荷や肥満にともなうインスリン抵抗性の発症の機序において,腸内フローラをはじめとする腸内環境の変化が注目されている.一方,人体における最大の免疫器官であり,宿主において高脂肪食と最初に接触する腸管における免疫,とくに,腸管マクロファージのインスリン抵抗性の発症における病態生理学的な意義に関しては不明であった.筆者らは,高脂肪食の負荷により炎症性マクロファージが大腸へと浸潤する病態生理学的な意義について検討するため,ケモカイン受容体Ccr2およびケモカインCcl2について,マクロファージに特異的なCcr2ノックアウトマウスおよび腸管上皮細胞に特異的なCcl2ノックアウトマウスを作製した.これらのノックアウトマウスにおいては肥満であるにもかかわらず,高脂肪食の負荷による耐糖能およびインスリン抵抗性が有意に改善した.さらに,炎症性マクロファージの大腸への浸潤が低下し,高脂肪食の負荷により発現の低下する腸管バリアタンパク質Claudin-1の発現が回復するとともに,インフラマソームの活性化を示唆するASCの活性化が有意に抑制された.これにともない,門脈において炎症性サイトカインであるインターロイキン1βおよびインターロイキン18,エンドトキシンであるリポ多糖の濃度が低下し,これらはインスリン抵抗性の改善に寄与すると考えられた.さらに,腸管上皮細胞に特異的なCcl2ノックアウトマウスの脂肪組織においては,脂肪の重量や脂肪細胞の大きさに差はない一方で,炎症性マクロファージの割合が有意に低下しておりこれはインスリン抵抗性の改善の一因と考えられた.以上の結果より,腸管上皮細胞におけるケモカインCcl2および腸管マクロファージにおけるケモカイン受容体Ccr2を介した炎症性マクロファージの大腸への浸潤が,高脂肪食の負荷にともなう脂肪組織などにおけるインスリン感受性を遠隔から制御する可能性が示唆された
はじめに
2型糖尿病は患者の数が2000万人にものぼり国民の5人に1人は罹患する成人病で,網膜症や腎症といった合併症をひき起こし失明や透析の原因になるだけでなく,高血圧症および脂質異常症とともに心筋梗塞や脳梗塞などの動脈硬化性疾患を誘発し,健康寿命を短縮させる疾患である.2型糖尿病を発症する主たる原因のひとつは肥満や高脂肪食にともない脂肪組織,肝臓,骨格筋といった全身の臓器において生じるインスリン抵抗性である.一方,肥満によりインスリン抵抗性の生じる機序については未解明の点が多く,インスリン抵抗性の発症の機序の研究は医学的および社会的にもっとも重要な課題のひとつといえる.
従来の研究により,肥満によりインスリン抵抗性がひき起こされる機序として,脂肪組織の慢性炎症やアディポネクチンに代表される脂肪組織に由来するアディポカインが病態に重要であることが明らかにされてきた1).一方で,筆者らの研究によると,マウスに高脂肪食を負荷した際に脂肪組織に炎症性マクロファージが浸潤してくるのは負荷から12週のちであり,実際にインスリン抵抗性が惹起される時期よりはるかに遅い.したがって,インスリンに反応する臓器に炎症性マクロファージが浸潤するまえになんらかのイベントが起こり,インスリン抵抗性が惹起される可能性が考えられた.
近年,全身の肥満およびインスリン抵抗性に腸内細菌をはじめとした腸内環境が大きな影響を及ぼすことが報告されている.すなわち,高脂肪食の負荷にともない腸内フローラが変化し(dysbiosis),腸内細菌に由来する内毒素が血液に流入して,脂肪組織や肝臓などにおいて慢性炎症を起こしインスリン抵抗性をひき起こすという概念である2).腸管は外界の異物と最初に接触する臓器であり,免疫系のみならずさまざまな防御機構をもち,腸管においては宿主と腸内フローラとがバランスを保ちながら腸内環境を形成する.これまで,腸内フローラが全身のインスリン抵抗性に影響をおよぼすという報告の多いなか,宿主の腸管の免疫細胞も糖の代謝およびエネルギー代謝の制御に重要な役割を担うことが明らかにされてきた.
腸管のリンパ球が高脂肪食の負荷によるインスリン抵抗性の発症に重要であるという報告のあるなか3,4),マクロファージなど自然免疫を担当する腸管の免疫細胞の糖の代謝あるいはエネルギー代謝における役割を解析した報告はきわめて少ない.しかしながら,実際に,腸管マクロファージは哺乳動物の腸管においてもっとも多いリンパ球のひとつで,単核の貪食細胞としては最大の集団であり5),腸管の慢性炎症,全身のインスリン抵抗性への影響,2型糖尿病の発症といった観点からなんらかの役割を担うことが推測された.
1.高脂肪食の負荷による大腸の慢性炎症は脂肪組織より早期に生じる
高脂肪食の負荷における腸管マクロファージの病態生理学的な変化を検討するため,高脂肪食を負荷したマウスの腸管の検体を用いて腸管マクロファージの質的および量的な変化について検討した.高脂肪食の負荷4週という早期の段階において,炎症の指標である大腸の長さが肉眼的に有意に短縮し,リアルタイムPCR解析によりケモカイン受容体であるCcr2,ケモカインであるCcl2,インターロイキン1β,インターロイキン18の発現の上昇が確認され,FACS解析により炎症性マクロファージの浸潤による慢性炎症が認められた.一方で,脂肪組織における炎症性マクロファージの浸潤は大腸より後期の,高脂肪食の負荷12週において認められた.以上の結果より,高脂肪食の負荷にともなう大腸の慢性炎症は脂肪組織より早期に生じ,インスリン抵抗性の発症においてなんらかの役割をはたす可能性が示唆された.
2.マクロファージに特異的なCcr2の欠損によりマクロファージの大腸への浸潤が抑制されインスリン抵抗性が改善する
高脂肪食の負荷により大腸へと浸潤する炎症性マクロファージの病態生理学的な意義について検討するため,高脂肪食の負荷により大腸において増加したマクロファージを炎症の部位へと誘導するのに重要なケモカイン受容体Ccr2に着目し,マクロファージに特異的なCcr2ノックアウトマウスを作製し解析した.このノックアウトマウスは高脂肪食の負荷12週において,対照となるマウスと比較して耐糖能およびインスリン抵抗性が有意に改善した.高脂肪食の負荷12週においてFACS解析により脂肪組織および肝臓における炎症性マクロファージに差は認められなかった一方で,炎症性マクロファージの大腸への浸潤は抑制されていた.これらの結果より,マクロファージにおいて特異的にCcr2を欠損することにより炎症性マクロファージの大腸への浸潤が抑制され,高脂肪食の負荷にともなうインスリン抵抗性が改善する可能性が示唆された.
3.腸管上皮細胞に特異的なCcl2の欠損によりマクロファージの大腸への浸潤が抑制されインスリン抵抗性が改善する
高脂肪食の負荷4週および12週の大腸の腸管上皮細胞において発現の上昇したケモカインCcl2に着目し,タモキシフェンの投与によりCcl2を欠損する腸管上皮細胞に特異的なCcl2ノックアウトマウスを作製し解析した.このノックアウトマウスは高脂肪食の負荷12週において,対象となるマウスと比較してCcr2陽性の炎症性マクロファージの大腸への浸潤が抑制され,インスリン抵抗性および耐糖能が改善した.この結果より,腸管上皮細胞において特異的にCcl2を欠損することにより高脂肪食の負荷にともなう腸管マクロファージの浸潤が抑制され,全身のインスリン抵抗性が改善する可能性が示唆された.
4.腸管上皮細胞におけるCcl2の欠損により脂肪組織における慢性炎症が改善する
腸管上皮細胞に特異的なCcl2ノックアウトマウスにおいて全身のインスリン抵抗性が改善した機序について検討するため,インスリン感受性三大臓器である脂肪組織,肝臓,骨格筋における表現型を検討したところ,脂肪組織において顕著な変化が認められた.このノックアウトマウスの脂肪組織においては,対照となるマウスと比較して脂肪の重量や脂肪細胞の大きさに差はなかった一方で,リアルタイムPCR解析においてCcl2およびインターロイキン1βの発現が有意に低下し,FACS解析においてM1マクロファージの割合が有意に減少しており,これら脂肪組織の表現型の改善がインスリン抵抗性の改善に寄与すると考えられた.以上の結果より,腸管上皮細胞においてCcl2を欠損させ高脂肪食の負荷にともなう炎症性マクロファージの浸潤を抑制することにより脂肪組織の慢性炎症が改善する可能性が示唆された.
5.高脂肪食の負荷にともなう炎症性マクロファージの大腸への浸潤により腸管バリアに障害をきたす
腸管上皮細胞に特異的なCcl2ノックアウトマウスの腸管において炎症性マクロファージが減少したことにより全身のインスリン抵抗性が改善した機序について検討するため,腸管バリアの機能について評価した.高脂肪食の負荷にともなう腸内フローラの変化により腸管バリアに障害が起こり,腸管に存在するグラム陰性の桿菌に由来するリポ多糖が門脈および循環血液をめぐり,Toll様受容体を介して全身のインスリン感受性の臓器においてインスリン抵抗性や慢性炎症をひき起こすことが知られている2).腸管の炎症性マクロファージが腸管バリアの機能におよぼす影響について検討するため,腸管バリアタンパク質の代表であるClaudin-1の発現および門脈におけるリポ多糖の濃度について検討した.その結果,高脂肪食の負荷にともないClaudin-1の発現は有意に低下し,門脈におけるリポ多糖の濃度は有意に上昇しエンドトキシン中毒症をきたしたが,マクロファージに特異的なCcr2ノックアウトマウスおよび腸管上皮細胞に特異的なCcl2ノックアウトマウスの大腸においては,対照となるマウスと比較してClaudin-1の発現は有意に改善し,それにともない門脈におけるリポ多糖の濃度は有意に低下し,これはインスリン抵抗性の改善の一因と考えられた.
6.高脂肪食を負荷したマウスの大腸においてCcl2およびCcr2に依存してインフラマソームが活性化する
近年,高脂肪食の負荷による慢性炎症の発症の機序において,炎症シグナルを感知し伝達するためインフラマソームが重要であると認識されている.高脂肪食の負荷4週の大腸においてインフラマソームの活性化を示唆するASCがスペックルパターンを呈して活性した細胞の有意な増加が認められたが,マクロファージに特異的なCcr2ノックアウトマウスおよび腸管上皮細胞に特異的なCcl2ノックアウトマウスの大腸においてASCの活性化は有意に抑制された.また,インフラマソームに制御される代表的な炎症性サイトカインとしてインターロイキン1βおよびインターロイキン18が知られているが6),マクロファージに特異的なCcr2ノックアウトマウスおよび腸管上皮細胞に特異的なCcl2ノックアウトマウスの大腸において,対照となるマウスと比較してそれら炎症性サイトカインの発現は低下しており,それにともない門脈におけるインターロイキン18の濃度が有意に低下し,これがインスリン抵抗性の改善の一因になる可能性が考えられた.以上の結果から,高脂肪食を負荷したマウスの大腸においては腸管上皮細胞のCcl2およびマクロファージのCcr2を介する経路によりインフラマソームの活性化が制御されることが示唆された.
おわりに
この研究により,高脂肪食の負荷により肥満したマウスにおいて,腸管のマクロファージが脂肪組織の慢性炎症を“遠隔制御”し,全身のインスリン感受性を制御することが明らかにされた(図1).これまでの研究においては,肥満によるインスリン抵抗性の発症の上流には脂肪組織の慢性炎症があり,その引き金として高脂肪食の負荷による腸内フローラの変化(dysbiosis)が重要であるといわれてきた.この研究においては,腸内フローラそのものではなく,宿主において腸内フローラや食事の内容の変化を最初に感知する臓器である腸管,とくにそこに存在する免疫細胞に着目し,なかでも大腸のマクロファージが高脂肪食および腸内フローラの変化をうけて比較的早期の段階で大腸に慢性炎症をひき起こし,その変化が門脈におけるインターロイキン1β,インターロイキン18,リポ多糖などを介して脂肪組織に伝達され,インスリン抵抗性をひき起こすことが明らかにされた.
以上の結果から,ケモカインの産生を抑制することが肥満による2型糖尿病の発症を抑制する戦略になりうると考えられる.高脂肪食を負荷したマウスにおいては腸管上皮細胞のCcl2が重要であることがわかったが,ほかにも高脂肪食の負荷により腸管上皮細胞において発現の上昇するケモカインは存在し,今後のさらなる検討が必要である.また,腸管マクロファージとしては骨髄の単球に由来する炎症性マクロファージだけでなく,もともと組織に存在して腸管における免疫寛容に寄与する常在性マクロファージがあり,腸管にはほかにも樹状細胞,自然リンパ球,抗体産生細胞などさまざまな種類の免疫細胞が存在し,高脂肪食の負荷や腸内フローラの変化をうけ,どのように抗原の情報が獲得免疫を伝達しインスリン抵抗性に寄与しうるのかについても興味深い.さらに,ヒト,とくに肥満症や糖尿病の患者の大腸におけるケモカインの同定,および,具体的なケモカインの産生の分子機構はまったく解明されておらず,腸管上皮細胞からのケモカインの産生あるいはケモカインの活性を抑制する化合物を同定することは今後の重要な課題である.
文 献
- Lumeng, C. N., Bodzin, J. L. & Saltiel, A. R.: Obesity induces a phenotypic switch in adipose tissue macrophage polarization. J. Clin. Invest., 117, 175-184 (2007)[PubMed]
- Cani, P. D., Amar, J., Iglesias, M. A. et al.: Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes, 56, 1761-1772 (2007)[PubMed]
- Monteiro-Sepulveda, M., Touch, S., Mendes-Sa, C. et al.: Jejunal T cell inflammation in human obesity correlates with decreased enterocyte insulin signaling. Cell Metab., 22, 113-124 (2015)[PubMed]
- Garidou, L., Pomie, C., Klopp, P. et al.: The gut microbiota regulates intestinal CD4 T cells expressing RORγt and controls metabolic disease. Cell Metab., 22, 100-112 (2015)[PubMed]
- Hume, D. A.: The mononuclear phagocyte system. Curr. Opin. Immunol.,18, 49-53 (2006)[PubMed]
- Wen, H., Ting, J. P. & O'Neill, L. A.: A role for the NLRP3 inflammasome in metabolic diseases: did Warburg miss inflammation? Nat. Immunol., 13, 352-357 (2012)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2013年 慶應義塾大学大学院医学研究科にて博士号取得,2014年より慶應義塾大学医学部 助教.
研究テーマ:インスリン抵抗性と腸管免疫.
中江 淳(Jun Nakae)
慶應義塾大学医学部 特任准教授.
伊藤 裕(Hiroshi Itoh)
慶應義塾大学医学部 教授.
研究室URL:http://www.keio-emn.jp/
© 2016 川野義長・中江 淳・伊藤 裕 Licensed under CC 表示 2.1 日本