中心体をもたないシロイヌナズナにおける微小管とカタニンとに依存した表層微小管の形成機構
中村匡良・橋本 隆
(奈良先端科学技術大学院大学バイオサイエンス研究科 分子生物学専攻植物遺伝子機能学講座)
email:中村匡良,橋本 隆
DOI: 10.7875/first.author.2010.048
Microtubule and katanin-dependent dynamics of microtubule nucleation complexes in the acentrosomal Arabidopsis cortical array.
Masayoshi Nakamura, David W. Ehrhardt, Takashi Hashimoto
Nature Cell Biology, 12, 1064-1070 (2010)
植物の微小管形成中心は細胞表層に散在すると考えられている.新規の表層微小管は既存の微小管から角度をもって形成され,そのマイナス端で形成部位から切り離されてトレッドミルにより新しい部位へと運ばれる.この新規微小管の形成と切り離しは植物の表層微小管に特徴的な現象であり,表層微小管の構造の構築に寄与しているものと考えられている.しかしながら,この特徴的な微小管の形成機構には未解明な点が多い.この機構を理解するため,筆者らは,微小管重合核複合体の時間的・空間的な制御を明らかにすることをめざし,シロイヌナズナの野生株と微小管切断タンパク質であるカタニン変異株での微小管重合核複合体の動態解析を行った.この研究により,中心体に非依存的な微小管の形成機構において,微小管重合核複合体は親微小管にリクルートされると活性化されて,カタニン活性に依存的に微小管から離脱するという実体が明らかになった.
細胞骨格のひとつである微小管は細胞周期によりその構造を再構築し,有糸分裂,細胞の極性成長,タンパク質やmRNAの細胞内輸送など,生物の生存に必須の機能に寄与している.微小管はαチューブリンとβチューブリンとからなるタンパク質のポリマーで,その末端では重合と脱重合とをくり返している.微小管の構造の再構築には新規の微小管の形成が必要だと考えられており,この新規微小管の形成機構を理解するために微小管形成中心(microtubule-organizing center:MTOC)としての中心体に関する研究が多くなされている.間期において放射状の微小管構造を形成する中心体に依存した微小管の形成は多く報告されその説明は進んでいる一方で,高等植物や動物の間期における中心体を欠いた細胞での高度に組織された微小管の構造において,微小管が微小管形成中心に依存せずにどのように形成されその構造を構築するかに関しては知見が少ない.
酵母や動物とは異なり中心体や紡錘体極をもたない植物は,微小管が特定の微小管形成中心なしにどのように形成され特徴的な構造を構築するかを理解するためのすぐれた系であると考えられている.植物の間期細胞で微小管は細胞膜の内側に2次元ネットワークを形成する表層微小管を構築する.表層微小管束はその特徴的な構造を構築することで植物のかたちを規定するものと考えられている.特徴的な表層微小管の構造の構築システムを理解するためには微小管形成の分子装置を理解する必要がある.近年,高等植物の微小管の形態や動態がGFPなどのマーカーを用いて詳細に観察されるようになり,微小管の分布パターンの形成過程が時間をおって追跡できるようになった1).新規の娘微小管は既存の親微小管から約40度の角度をもって形成され,そのマイナス端で形成部位から切り離されトレッドミルによって新しい部位へと運ばれることが観察されている2,3).移動とそれによる個々の表層微小管どうしでの相互作用が微小管の構造の構築と編成に重要だと考えられている4).この新規微小管の形成と切り離しは植物の表層微小管に特徴的な現象であり,γチューブリンを含む微小管重合核と微小管切断タンパク質であるカタニンがこの現象の中心的な因子であると示唆されている.しかしながら,この特徴的な微小管の形成機構における微小管重合核複合体の時間的・空間的な制御機構についてはほとんどわかっていない.
この研究では,植物の間期細胞における表層微小管束での微小管の形成とトレッドミル微小管の誕生の機構を明らかにするため,シロイヌナズナの野生株と微小管切断活性の欠損株において生細胞で微小管重合核を標識し観察することで,新規微小管の“形成”と“切り離し”,微小管重合核の動態を定量化した.
動物,酵母,高等植物においてγチューブリンは2つの複合体,すなわち,γ-TuSC(γ-tubulin small complex,γチューブリン小複合体)と,このγ-TuSCを構成成分とするγ-TuRC(γ-tubulin ring complex,γチューブリン環複合体)として,微小管の形成の中心的な因子として機能しているものと考えられている.遺伝学的な研究により,植物の表層微小管の配向においてγチューブリン複合体が機能しているという実験的な証拠が報告されている5).また,免疫組織化学的な研究により,γチューブリンは細胞表層に散在しており微小管の枝分かれ部位に局在がみられている2).これらの報告は,植物の細胞表層,あるいは,既存の微小管の側面へのγチューブリン複合体の結合が表層微小管の重合や微小管の構造の編成に重要な過程であることを示唆する.
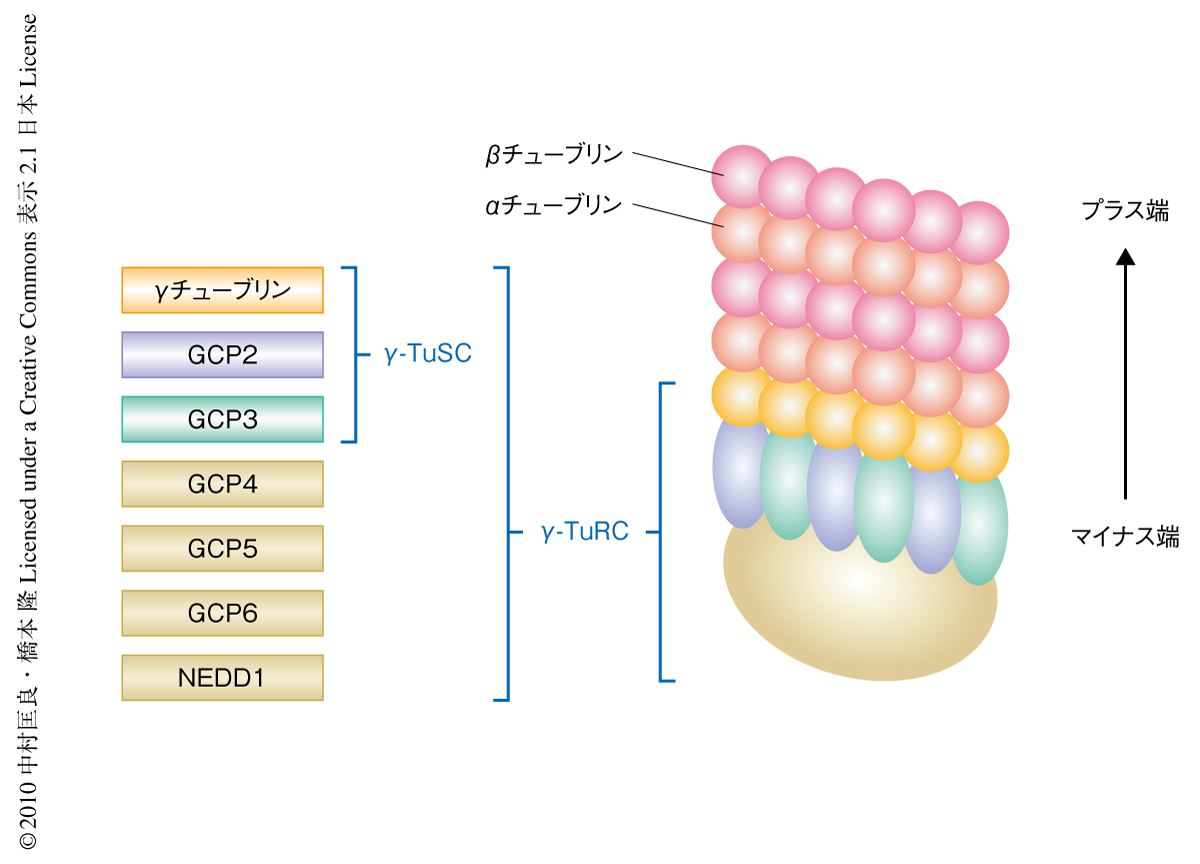
シロイヌナズナのγチューブリン複合体の標識を行うために,γ-TuSCの構成因子と考えられるGCP2とGCP3のゲノム領域を用い,そのC末端にGFPを付加することによって融合タンパク質を作製した.GCP2-GFP融合タンパク質はGCP2機能欠損株の配偶子致死の表現型を相補したため機能的な標識タンパク質であると考えられた.また,GFP抗体による免疫沈降法により,シロイヌナズナにおいてもGCP2とGCP3がγ-TuRCの構成因子であることを確かめた.GCP2とGCP3を含む複合体は,γチューブリン,GCP4,GCP5,GCP6,NEDD1を含む複合体として単離された.これらは動物で精製された複合体の組成と同じであり6),γ-TuSCの構成因子であるγチューブリンとGCP2,GCP3がもっとも多く含まれていて,γ-TuSC以外のγ-TuRCの構成因子であるGCP4,GCP5,GCP6がそれにつづいた(図1).また,γ-TuRCの細胞での局在制御にかかわると考えられるNEDD1も精製された複合体に含まれていた.これらの結果は,維管束植物においてもGCP2とGCP3がγチューブリン複合体の一部として機能していることを示していた.GCP2とGCP3の有糸分裂期の微小管と核表面への局在はこれまでに報告されているγチューブリンの免疫染色の結果と一致しており,紡錘体微小管の極の付近や隔膜形成体(フラグモプラスト)のマイナス端側に検出された.
間期の細胞表層ではγチューブリン複合体は細胞表層に現われては消える粒々として検出された.動画撮影にはスピニングディスク共焦点レーザー顕微鏡を用い5秒間隔で画像を取得した.細胞表層で複合体が会合するのか,細胞質で複合体が形成されて細胞質から運ばれるのか,の2通りのモデルが考えられたが,標識複合体をGFP抗体により生化学的に精製可能なことと,高い時間分解能(51~83ミリ秒)での動態観察から,複合体は細胞質から細胞表層へと運ばれている可能性が示された.細胞表層で検出される複合体の大多数(87%)は表層微小管へと運ばれており,報告されているin vitroの結果にみられたように2),γチューブリン複合体はin vivoにおいても表層微小管へと選択的に運ばれているようであった.新規の表層微小管は細胞表層で安定化したγチューブリン複合体から形成された.
γチューブリン複合体を介した微小管の形成は3種類に分けられた.すなわち,既存の微小管からの枝分かれ微小管の形成(65.4%),束化微小管の形成(33.2%),親微小管に依存しない細胞膜での微小管の形成(1.4%),である.重合核を介した枝分かれ微小管の形成はこれまでの報告と同じように狭い角度(39.6度±5.9)をもって行われていた.この40度という角度は適切な表層微小管の構造を構築するために重要であり,角度の調節には適切な微小管重合核が必要だと考えられている5).束化微小管も表層微小管の配向や機能において重要な構造だと考えられている7,8).親微小管にそって平行に形成される微小管は,微小管どうしの相互作用による微小管の束化とともに,束化微小管の形成と維持に必要とされることが示唆された.微小管に依存しない微小管の形成も観察され,細胞膜においても微小管重合核の活性化されることが考えられたが,この現象はごくまれであった.γチューブリン複合体による微小管の形成の頻度は親微小管の側面への結合に依存していた.
γチューブリン複合体の細胞表層での安定性は娘微小管の形成の有無に関連していた.娘微小管を形成しないものは一過的(7.4秒±9.1)にしか細胞表層に局在しなかった.一方で,親微小管に現われ娘微小管を形成したγチューブリン複合体は長期間(58.9秒±44.9)にわたり細胞表層に安定して局在した.微小管重合阻害剤による処理により親微小管を消失させ微小管の形成ができないようにした条件では,γチューブリン複合体は長期に安定化することなく細胞表層に一過的にのみ検出された(7.9秒±9.5).これらの結果から,微小管の形成はγチューブリン複合体の細胞表層での安定性を促進していることが示唆された.
微小管の形成により安定化した微小管重合核は,新規微小管のマイナス端の切断のあと,どのようにふるまうのだろうか? これまでの研究から,3つの可能性が考えられていた.ひとつは,微小管プラス端マーカーであるEB1-GFPの観察から,重合核は短縮するマイナス端に付随して移動するというもので9),これはin vitroの実験でγチューブリン複合体が微小管のマイナス端をキャップするという結果に支持されている10).2つ目は,微小管重合核は切断のあとも微小管を形成した部位に残り,ふたたび新しい微小管を重合させるかもしれないというものである.3つ目は,微小管重合核からマイナス端が切り離されることにより複合体が不安定になって表層から解離するという可能性である.解離した微小管重合核は新しい部位に運ばれて微小管を形成するかもしれない.
興味深いことに,形成部位から切り離された微小管のマイナス端の脱重合に付随して移動するγチューブリン複合体は観察されなかった.脱重合により短縮するマイナス端はγチューブリンによって守られることはなく,これはこれまでの報告とは異なる結果であった.植物の微小管の両端での重合と脱重合による動的不安定性はハイブリッドトレッドミルとよばれ,プラス端に比べマイナス端での遅い脱重合の存在が知られている1).マイナス端のゆっくりとした脱重合を可能にするためγチューブリン複合体以外の因子の寄与しているものと考えられる.
γチューブリン複合体の多くは娘微小管が切断されマイナス端から短縮するまえに細胞表層から消失した.マイナス端の切り離しのあとに消失する複合体もわずかに観察されたが,再度,同じ場所から微小管を形成するには短すぎる時間であった.γチューブリン複合体の挙動は微小管の切り離しが微小管重合核の解離に必要であることを示唆していた.
微小管を切断するカタニンは,ATP依存的に6量体を構築し切断活性をもつp60サブユニットと,活性の促進や局在性にかかわると考えられるp80サブユニットとで構成されている.カタニンは動物では既存の微小管を切断したり新しい微小管の成長の起点をつくったりすることにより中心体に非依存的な微小管の形成や編成において機能している.筆者らは,これまでの研究から,シロイヌナズナのカタニンp60サブユニット変異株における新規微小管ではマイナス端の切り離しが行われないことを観察し5),カタニンの活性がトレッドミル微小管の微小管の形成部位からの切り離しに必要であると推定していた.今回,はじめてカタニンp60サブユニットの動態観察に成功し,新規微小管の切り離しにカタニンの活性が必要不可欠であることを明らかにした.実際に,カタニンが局在した微小管の交差部位と微小管が形成された枝分かれ部位の微小管とが切断された.カタニンの活性にかかわるp60サブユニットの機能欠損は表層微小管の構造において適切な配向を失うことから11),カタニンの活性による短い微小管の新しい生産が表層微小管の構造の構築に重要であることが示唆された.
では,微小管の切断は微小管重合核の解離に必要とされるのか? カタニンp60サブユニットの機能欠損株においては,予想したとおり,新規の微小管は形成部位から切り離されず,γチューブリン複合体は細胞表層と表層微小管に現われ新規の微小管を形成した.切断されない新規微小管の枝分かれ部位のγチューブリン複合体は観察期間のあいだ消失することはなかった.おもしろいことに,娘微小管のプラス端からの完全な脱重合のあとではγチューブリン複合体は細胞表層から解離した.これらの結果,カタニンの活性に依存的な娘微小管の切断,もしくは,脱重合による娘細胞の消失がγチューブリン複合体の不安定性を誘導し,細胞質への解離を促すことが明らかになった.
微小管重合核の生細胞イメージングにより,高等植物の間期の表層微小管における中心体に依存しない微小管の形成装置が明らかになりはじめた(図2).細胞表層での親微小管へのγチューブリン複合体の移動と安定性や,各階層での活性と不活性の制御の存在が示唆された.微小管の形成には大きく分けて2種類あり,枝分かれの形成により動的な配向の変化を促すのか,束化微小管の形成により安定な構造を誘導するのか,細胞での選択は環境などに応じて調節されているものと推測されるが,それぞれの活性機構がほかの因子からのシグナルによるのか,アクチン重合核のように構造によるものなのか12),は不明である.今回,観察された微小管の形成部位でのカタニンによる切断現象をより深く理解するためには,微小管の切断の時間的・空間的な制御機構の解析が必要である.また,特徴的な微小管の構造の構築システムの理解には微小管重合核の局在の調節機構や活性化の機構を把握することが重要と考えられ,その際には,今回,作製した標識された微小管重合核が役に立つものと期待される.
略歴:2009年 奈良先端科学技術大学院大学バイオサイエンス研究科博士課程 修了,同年より同 博士研究員.
研究テーマ:高等植物における中心体に依存しない微小管の形成機構の解明.
関心事:植物は外界の環境変化を認識し適切に応答することで生存を可能にしている.植物の極性をもった成長がその応答のひとつであり,それには細胞膜の直下の表層微小管の構造が必要とされる.表層微小管がどのようにそのネットワークを構築するのか,そのシステムを時間的・空間的に理解したい.
橋本 隆(Takashi Hashimoto)
略歴:1985年 京都大学大学院農学研究科 修了,同年 同 助手,1994年 奈良先端科学技術大学院大学バイオサイエンス研究科 助教授を経て,2000年より同 教授.
研究テーマ:アルカロイド生合成の分子制御,植物の左右性,細胞伸長制御の分子遺伝学.
研究室URL:http://bsw3.naist.jp/hashimoto/hashimoto.html
© 2010 中村匡良・橋本 隆 Licensed under CC 表示 2.1 日本
(奈良先端科学技術大学院大学バイオサイエンス研究科 分子生物学専攻植物遺伝子機能学講座)
email:中村匡良,橋本 隆
DOI: 10.7875/first.author.2010.048
Microtubule and katanin-dependent dynamics of microtubule nucleation complexes in the acentrosomal Arabidopsis cortical array.
Masayoshi Nakamura, David W. Ehrhardt, Takashi Hashimoto
Nature Cell Biology, 12, 1064-1070 (2010)
要 約
植物の微小管形成中心は細胞表層に散在すると考えられている.新規の表層微小管は既存の微小管から角度をもって形成され,そのマイナス端で形成部位から切り離されてトレッドミルにより新しい部位へと運ばれる.この新規微小管の形成と切り離しは植物の表層微小管に特徴的な現象であり,表層微小管の構造の構築に寄与しているものと考えられている.しかしながら,この特徴的な微小管の形成機構には未解明な点が多い.この機構を理解するため,筆者らは,微小管重合核複合体の時間的・空間的な制御を明らかにすることをめざし,シロイヌナズナの野生株と微小管切断タンパク質であるカタニン変異株での微小管重合核複合体の動態解析を行った.この研究により,中心体に非依存的な微小管の形成機構において,微小管重合核複合体は親微小管にリクルートされると活性化されて,カタニン活性に依存的に微小管から離脱するという実体が明らかになった.
はじめに
細胞骨格のひとつである微小管は細胞周期によりその構造を再構築し,有糸分裂,細胞の極性成長,タンパク質やmRNAの細胞内輸送など,生物の生存に必須の機能に寄与している.微小管はαチューブリンとβチューブリンとからなるタンパク質のポリマーで,その末端では重合と脱重合とをくり返している.微小管の構造の再構築には新規の微小管の形成が必要だと考えられており,この新規微小管の形成機構を理解するために微小管形成中心(microtubule-organizing center:MTOC)としての中心体に関する研究が多くなされている.間期において放射状の微小管構造を形成する中心体に依存した微小管の形成は多く報告されその説明は進んでいる一方で,高等植物や動物の間期における中心体を欠いた細胞での高度に組織された微小管の構造において,微小管が微小管形成中心に依存せずにどのように形成されその構造を構築するかに関しては知見が少ない.
酵母や動物とは異なり中心体や紡錘体極をもたない植物は,微小管が特定の微小管形成中心なしにどのように形成され特徴的な構造を構築するかを理解するためのすぐれた系であると考えられている.植物の間期細胞で微小管は細胞膜の内側に2次元ネットワークを形成する表層微小管を構築する.表層微小管束はその特徴的な構造を構築することで植物のかたちを規定するものと考えられている.特徴的な表層微小管の構造の構築システムを理解するためには微小管形成の分子装置を理解する必要がある.近年,高等植物の微小管の形態や動態がGFPなどのマーカーを用いて詳細に観察されるようになり,微小管の分布パターンの形成過程が時間をおって追跡できるようになった1).新規の娘微小管は既存の親微小管から約40度の角度をもって形成され,そのマイナス端で形成部位から切り離されトレッドミルによって新しい部位へと運ばれることが観察されている2,3).移動とそれによる個々の表層微小管どうしでの相互作用が微小管の構造の構築と編成に重要だと考えられている4).この新規微小管の形成と切り離しは植物の表層微小管に特徴的な現象であり,γチューブリンを含む微小管重合核と微小管切断タンパク質であるカタニンがこの現象の中心的な因子であると示唆されている.しかしながら,この特徴的な微小管の形成機構における微小管重合核複合体の時間的・空間的な制御機構についてはほとんどわかっていない.
この研究では,植物の間期細胞における表層微小管束での微小管の形成とトレッドミル微小管の誕生の機構を明らかにするため,シロイヌナズナの野生株と微小管切断活性の欠損株において生細胞で微小管重合核を標識し観察することで,新規微小管の“形成”と“切り離し”,微小管重合核の動態を定量化した.
1.高等植物の微小管重合核複合体
動物,酵母,高等植物においてγチューブリンは2つの複合体,すなわち,γ-TuSC(γ-tubulin small complex,γチューブリン小複合体)と,このγ-TuSCを構成成分とするγ-TuRC(γ-tubulin ring complex,γチューブリン環複合体)として,微小管の形成の中心的な因子として機能しているものと考えられている.遺伝学的な研究により,植物の表層微小管の配向においてγチューブリン複合体が機能しているという実験的な証拠が報告されている5).また,免疫組織化学的な研究により,γチューブリンは細胞表層に散在しており微小管の枝分かれ部位に局在がみられている2).これらの報告は,植物の細胞表層,あるいは,既存の微小管の側面へのγチューブリン複合体の結合が表層微小管の重合や微小管の構造の編成に重要な過程であることを示唆する.
シロイヌナズナのγチューブリン複合体の標識を行うために,γ-TuSCの構成因子と考えられるGCP2とGCP3のゲノム領域を用い,そのC末端にGFPを付加することによって融合タンパク質を作製した.GCP2-GFP融合タンパク質はGCP2機能欠損株の配偶子致死の表現型を相補したため機能的な標識タンパク質であると考えられた.また,GFP抗体による免疫沈降法により,シロイヌナズナにおいてもGCP2とGCP3がγ-TuRCの構成因子であることを確かめた.GCP2とGCP3を含む複合体は,γチューブリン,GCP4,GCP5,GCP6,NEDD1を含む複合体として単離された.これらは動物で精製された複合体の組成と同じであり6),γ-TuSCの構成因子であるγチューブリンとGCP2,GCP3がもっとも多く含まれていて,γ-TuSC以外のγ-TuRCの構成因子であるGCP4,GCP5,GCP6がそれにつづいた(図1).また,γ-TuRCの細胞での局在制御にかかわると考えられるNEDD1も精製された複合体に含まれていた.これらの結果は,維管束植物においてもGCP2とGCP3がγチューブリン複合体の一部として機能していることを示していた.GCP2とGCP3の有糸分裂期の微小管と核表面への局在はこれまでに報告されているγチューブリンの免疫染色の結果と一致しており,紡錘体微小管の極の付近や隔膜形成体(フラグモプラスト)のマイナス端側に検出された.
間期の細胞表層ではγチューブリン複合体は細胞表層に現われては消える粒々として検出された.動画撮影にはスピニングディスク共焦点レーザー顕微鏡を用い5秒間隔で画像を取得した.細胞表層で複合体が会合するのか,細胞質で複合体が形成されて細胞質から運ばれるのか,の2通りのモデルが考えられたが,標識複合体をGFP抗体により生化学的に精製可能なことと,高い時間分解能(51~83ミリ秒)での動態観察から,複合体は細胞質から細胞表層へと運ばれている可能性が示された.細胞表層で検出される複合体の大多数(87%)は表層微小管へと運ばれており,報告されているin vitroの結果にみられたように2),γチューブリン複合体はin vivoにおいても表層微小管へと選択的に運ばれているようであった.新規の表層微小管は細胞表層で安定化したγチューブリン複合体から形成された.
2.γチューブリン複合体からの微小管の形成
γチューブリン複合体を介した微小管の形成は3種類に分けられた.すなわち,既存の微小管からの枝分かれ微小管の形成(65.4%),束化微小管の形成(33.2%),親微小管に依存しない細胞膜での微小管の形成(1.4%),である.重合核を介した枝分かれ微小管の形成はこれまでの報告と同じように狭い角度(39.6度±5.9)をもって行われていた.この40度という角度は適切な表層微小管の構造を構築するために重要であり,角度の調節には適切な微小管重合核が必要だと考えられている5).束化微小管も表層微小管の配向や機能において重要な構造だと考えられている7,8).親微小管にそって平行に形成される微小管は,微小管どうしの相互作用による微小管の束化とともに,束化微小管の形成と維持に必要とされることが示唆された.微小管に依存しない微小管の形成も観察され,細胞膜においても微小管重合核の活性化されることが考えられたが,この現象はごくまれであった.γチューブリン複合体による微小管の形成の頻度は親微小管の側面への結合に依存していた.
γチューブリン複合体の細胞表層での安定性は娘微小管の形成の有無に関連していた.娘微小管を形成しないものは一過的(7.4秒±9.1)にしか細胞表層に局在しなかった.一方で,親微小管に現われ娘微小管を形成したγチューブリン複合体は長期間(58.9秒±44.9)にわたり細胞表層に安定して局在した.微小管重合阻害剤による処理により親微小管を消失させ微小管の形成ができないようにした条件では,γチューブリン複合体は長期に安定化することなく細胞表層に一過的にのみ検出された(7.9秒±9.5).これらの結果から,微小管の形成はγチューブリン複合体の細胞表層での安定性を促進していることが示唆された.
3.新規微小管の切り離しとγチューブリン複合体
微小管の形成により安定化した微小管重合核は,新規微小管のマイナス端の切断のあと,どのようにふるまうのだろうか? これまでの研究から,3つの可能性が考えられていた.ひとつは,微小管プラス端マーカーであるEB1-GFPの観察から,重合核は短縮するマイナス端に付随して移動するというもので9),これはin vitroの実験でγチューブリン複合体が微小管のマイナス端をキャップするという結果に支持されている10).2つ目は,微小管重合核は切断のあとも微小管を形成した部位に残り,ふたたび新しい微小管を重合させるかもしれないというものである.3つ目は,微小管重合核からマイナス端が切り離されることにより複合体が不安定になって表層から解離するという可能性である.解離した微小管重合核は新しい部位に運ばれて微小管を形成するかもしれない.
興味深いことに,形成部位から切り離された微小管のマイナス端の脱重合に付随して移動するγチューブリン複合体は観察されなかった.脱重合により短縮するマイナス端はγチューブリンによって守られることはなく,これはこれまでの報告とは異なる結果であった.植物の微小管の両端での重合と脱重合による動的不安定性はハイブリッドトレッドミルとよばれ,プラス端に比べマイナス端での遅い脱重合の存在が知られている1).マイナス端のゆっくりとした脱重合を可能にするためγチューブリン複合体以外の因子の寄与しているものと考えられる.
γチューブリン複合体の多くは娘微小管が切断されマイナス端から短縮するまえに細胞表層から消失した.マイナス端の切り離しのあとに消失する複合体もわずかに観察されたが,再度,同じ場所から微小管を形成するには短すぎる時間であった.γチューブリン複合体の挙動は微小管の切り離しが微小管重合核の解離に必要であることを示唆していた.
4.カタニン活性による微小管の切断
微小管を切断するカタニンは,ATP依存的に6量体を構築し切断活性をもつp60サブユニットと,活性の促進や局在性にかかわると考えられるp80サブユニットとで構成されている.カタニンは動物では既存の微小管を切断したり新しい微小管の成長の起点をつくったりすることにより中心体に非依存的な微小管の形成や編成において機能している.筆者らは,これまでの研究から,シロイヌナズナのカタニンp60サブユニット変異株における新規微小管ではマイナス端の切り離しが行われないことを観察し5),カタニンの活性がトレッドミル微小管の微小管の形成部位からの切り離しに必要であると推定していた.今回,はじめてカタニンp60サブユニットの動態観察に成功し,新規微小管の切り離しにカタニンの活性が必要不可欠であることを明らかにした.実際に,カタニンが局在した微小管の交差部位と微小管が形成された枝分かれ部位の微小管とが切断された.カタニンの活性にかかわるp60サブユニットの機能欠損は表層微小管の構造において適切な配向を失うことから11),カタニンの活性による短い微小管の新しい生産が表層微小管の構造の構築に重要であることが示唆された.
では,微小管の切断は微小管重合核の解離に必要とされるのか? カタニンp60サブユニットの機能欠損株においては,予想したとおり,新規の微小管は形成部位から切り離されず,γチューブリン複合体は細胞表層と表層微小管に現われ新規の微小管を形成した.切断されない新規微小管の枝分かれ部位のγチューブリン複合体は観察期間のあいだ消失することはなかった.おもしろいことに,娘微小管のプラス端からの完全な脱重合のあとではγチューブリン複合体は細胞表層から解離した.これらの結果,カタニンの活性に依存的な娘微小管の切断,もしくは,脱重合による娘細胞の消失がγチューブリン複合体の不安定性を誘導し,細胞質への解離を促すことが明らかになった.
おわりに
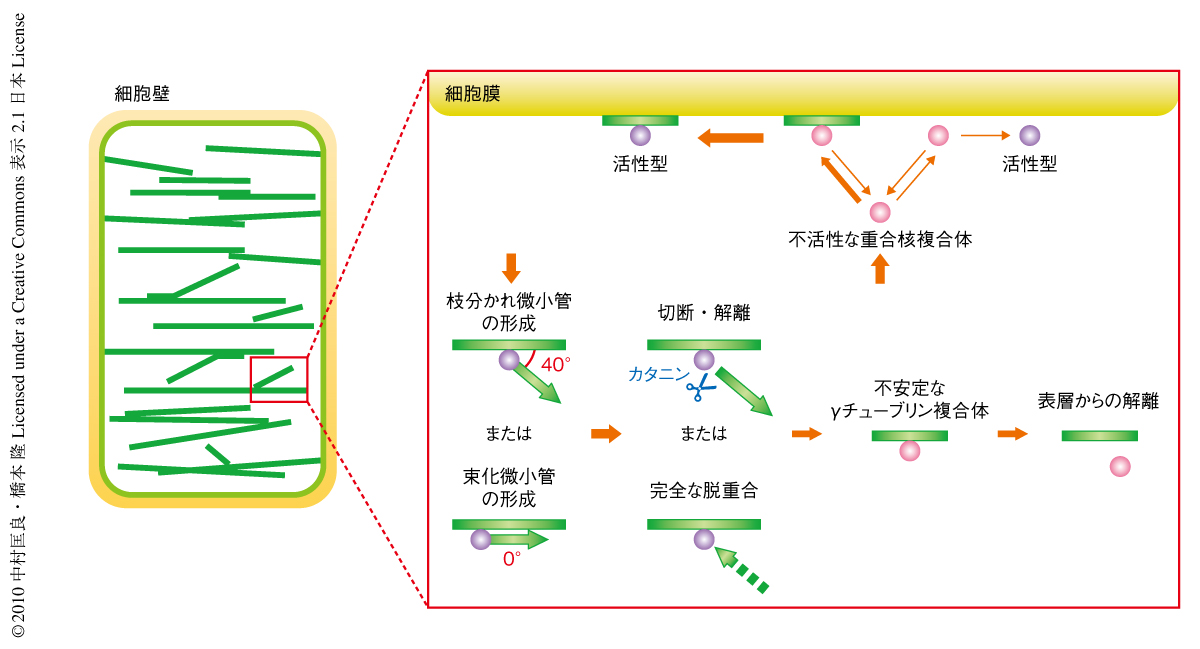
微小管重合核の生細胞イメージングにより,高等植物の間期の表層微小管における中心体に依存しない微小管の形成装置が明らかになりはじめた(図2).細胞表層での親微小管へのγチューブリン複合体の移動と安定性や,各階層での活性と不活性の制御の存在が示唆された.微小管の形成には大きく分けて2種類あり,枝分かれの形成により動的な配向の変化を促すのか,束化微小管の形成により安定な構造を誘導するのか,細胞での選択は環境などに応じて調節されているものと推測されるが,それぞれの活性機構がほかの因子からのシグナルによるのか,アクチン重合核のように構造によるものなのか12),は不明である.今回,観察された微小管の形成部位でのカタニンによる切断現象をより深く理解するためには,微小管の切断の時間的・空間的な制御機構の解析が必要である.また,特徴的な微小管の構造の構築システムの理解には微小管重合核の局在の調節機構や活性化の機構を把握することが重要と考えられ,その際には,今回,作製した標識された微小管重合核が役に立つものと期待される.
文 献
- Ehrhardt, D. W. & Shaw, S. L.: Microtubule dynamics and organization of the plant cortical array. Annu. Rev. Plant Biol., 57, 859-875 (2006)[PubMed]
- Murata, T., Sonobe, S., Baskin, T. I. et al.: Microtubule-dependent microtubule nucleation based on recruitment of γ-tubulin in higher plants. Nat. Cell Biol., 7, 961-968 (2005)[PubMed]
- Shaw, S., Kamyar, R. & Ehrhardt, D. W.: Sustained microtubule treadmilling in Arabidopsis cortical arrays. Science, 300, 1715-1718 (2003)[PubMed]
- Dixit, R. & Cyr, R.: Encounters between dynamic cortical microtubules promote ordering of the cortical array through angle-dependent modifications of microtubule behavior. Plant Cell, 16, 274-284 (2004)[PubMed]
- Nakamura, M. & Hashimoto, T.: A mutation in the Arabidopsis γ-tubulin-containing complex subunit causes helical growth and abnormal microtubule branching. J. Cell Sci., 122, 2208-2217 (2009)[PubMed]
- Wiese, C. & Zheng, Y.: Microtubule nucleation: γ-tubulin and beyond. J. Cell Sci., 119, 4143-4153 (2006)[PubMed]
- Chan, J., Sambade, A., Calder, G. et al.: Arabidopsis cortical microtubules are initiated along, as well as branching from, existing microtubules. Plant Cell, 21, 2298-2306 (2009)[PubMed]
- Paredez, A. R., Somerville, C. R. & Ehrhardt, D. W.: Visualization of cellulose synthase demonstrates functional association with microtubules. Science, 312, 1491-1495 (2006)[PubMed]
- Chan, J., Calder, G. M., Doonan, J. H. et al.: EB1 reveals mobile microtubule nucleation sites in Arabidopsis. Nat. Cell Biol., 5, 967-971 (2003)[PubMed]
- Wiese, C. & Zheng, Y.: A new function for the γ-tubulin ring complex as a microtubule minus-end cap. Nat. Cell Biol., 2, 358-364 (2000)[PubMed]
- Burk, D. H., Liu, B., Zhong, R. et al.: A katanin-like protein regulates normal cell wall biosynthesis and cell elongation. Plant Cell, 13, 807-827 (2001)[PubMed]
- Rouiller, I., Xu, X. P., Amann, K. J. et al.: The structural basis of actin filament branching by Arp2/3 complex. J. Cell Biol., 180, 887-895 (2008)[PubMed]
著者プロフィール
略歴:2009年 奈良先端科学技術大学院大学バイオサイエンス研究科博士課程 修了,同年より同 博士研究員.
研究テーマ:高等植物における中心体に依存しない微小管の形成機構の解明.
関心事:植物は外界の環境変化を認識し適切に応答することで生存を可能にしている.植物の極性をもった成長がその応答のひとつであり,それには細胞膜の直下の表層微小管の構造が必要とされる.表層微小管がどのようにそのネットワークを構築するのか,そのシステムを時間的・空間的に理解したい.
橋本 隆(Takashi Hashimoto)
略歴:1985年 京都大学大学院農学研究科 修了,同年 同 助手,1994年 奈良先端科学技術大学院大学バイオサイエンス研究科 助教授を経て,2000年より同 教授.
研究テーマ:アルカロイド生合成の分子制御,植物の左右性,細胞伸長制御の分子遺伝学.
研究室URL:http://bsw3.naist.jp/hashimoto/hashimoto.html
© 2010 中村匡良・橋本 隆 Licensed under CC 表示 2.1 日本