低温電子顕微鏡像の解析によりアクチン繊維の構造を6.6Å分解能で解明
藤井高志・難波啓一
(大阪大学大学院生命機能研究科 プロトニックナノマシン研究室)
email:難波啓一
DOI: 10.7875/first.author.2010.045
Direct visualization of secondary structures of F-actin by electron cryomicroscopy.
Takashi Fujii, Atsuko H. Iwane, Toshio Yanagida, Keiichi Namba
Nature, 467, 724-728 (2010)
アクチン繊維は筋細胞においてミオシン繊維と相互作用し力を発生して筋収縮をひき起こすだけでなく,細胞骨格としてあらゆる細胞の形態形成や運動に関与し,脳神経回路の形成にも重要な役割をはたしている.しかし,幅わずか10 nmときわめて細いリボン状の繊維構造をもち曲がりやすくねじれやすいため,その立体構造を高分解能で解析するのはたいへん困難であった.今回,急速凍結により立体構造を保持したまま低温電子顕微鏡で観察する方法を用い,その立体構造を6.6Å分解能で解明した.要した時間は電子顕微像の収集と解析計算を含めて5日間であった.さまざまな技術的くふうにより像質とコントラストとを大幅に改善し,画像収集と解析の効率化および高速化を進めた成果であった.この3次元密度マップにはαヘリックスやβ構造など2次構造のみならず,線維の形成に重要なループや外側に突き出したN末端などが観察され,繊維形成の際に起こるアクチン分子の構造変化や分子間相互作用など,繊維形成の分子機構が明らかになった.
アクチンは筋細胞の主要な構成成分として発見されたが,あらゆる真核細胞に存在し,しかも,もっとも大量に存在するタンパク質のひとつである.そのアミノ酸配列の種間での保存性の高さは驚くべきものであり,ヒトと酵母のあいだですら87%の相同性がある.このことは,アクチンがいかに重要な生命活動の基盤を担い,細胞での分子間相互作用ネットワークのハブとしてはたらいているか,そのわずかな変化がいかに大きな影響を及ぼすかという事実を物語っている.実際,アクチンはミオシンを代表とする150種類以上のタンパク質と相互作用し,細胞のさまざまな機能の基盤としてはたらいている.
単量体のアクチンはGアクチンとよばれ,細胞ではFアクチンとよばれるらせん状の重合体として繊維構造を形成してはたらく.筋細胞においてはミオシン繊維と相互作用して筋収縮力を発生する.また,あらゆる真核生物の細胞骨格としてはたらき,さまざまなタンパク質と相互作用して細胞の形態形成,運動や分裂を駆動する.アクチン繊維の両端では重合能が異なり,一端で重合しつつもう一端で解離することで,あたかもキャタピラーの接地面のようにみかけの移動推進力を生み出す過程はトレッドミルともよばれ,これが細胞の形態形成,運動や分裂を駆動する1).これらの機能特性はアクチン分子の立体構造とそのダイナミックな変化によるものであり,よって,その構造を知ることは,アクチン機能の発現機構を知るうえで欠かすことのできないものである.
アクチンの構造については,1990年に,DNase Iとの複合体としての結晶構造がX線解析により明らかにされて以来2),約25種類のさまざまな複合体として結晶構造が明らかにされてきたが,アクチン繊維の構造解明はあまり進まなかった.繊維状の重合体は長さに分布があるため結晶にならず,原子分解能での構造解析法としてもっとも強力なX線結晶解析法が適用できないためであった.アクチン繊維の構造はこれまで電子顕微鏡法とX線繊維回折法により解析されてきた.1990年には,結晶構造を解いたHolmesらにより,アクチン繊維の配向液晶からのX線繊維回折像の層線回折強度にあわせたモデル構造が提案され3),2009年には,Odaらが,電子顕微鏡法の助けも借りてより高分解能のX線繊維回折データにあわせたモデル構造を発表した4).しかしながら,これらのモデルは観測強度とモデル計算強度との一致度に依存しているため正しいモデルである保証がなくその信頼性に限界があった.分子構造の3次元密度分布を再構成するためにはその回折(フーリエ)データの強度(振幅)と位相とが必要であるが,強度データだけではいくとおりにも解釈が可能でその構造に一意性がない.
それに対して低温電子顕微鏡法では,画像を解析するため当然ながら位相情報も得られる.ただし,これまでに報告されたアクチン繊維構造の最高分解能は13Åで4,5),アクチン分子のかたちがぼんやりとみえる程度にとどまっていた.幅わずか10 nmときわめて細いリボン状の繊維構造であるため,無染色の凍結氷包埋試料では電子顕微鏡像のコントラストがきわめて低く,多くの像を整列して平均することで高分解能の解析を実現する画像解析法がうまくはたらかないためであった.曲がりやすくねじれやすい構造も高分解能の達成をさまたげていた.今回,筆者らは,長年にわたって開発してきた低温電子顕微鏡法の新しい技術をアクチン繊維の構造解析に応用し,2次構造がみえる6.6Å分解能でその3次元密度分布を明らかにし,信頼性の高い原子モデルを構築した.
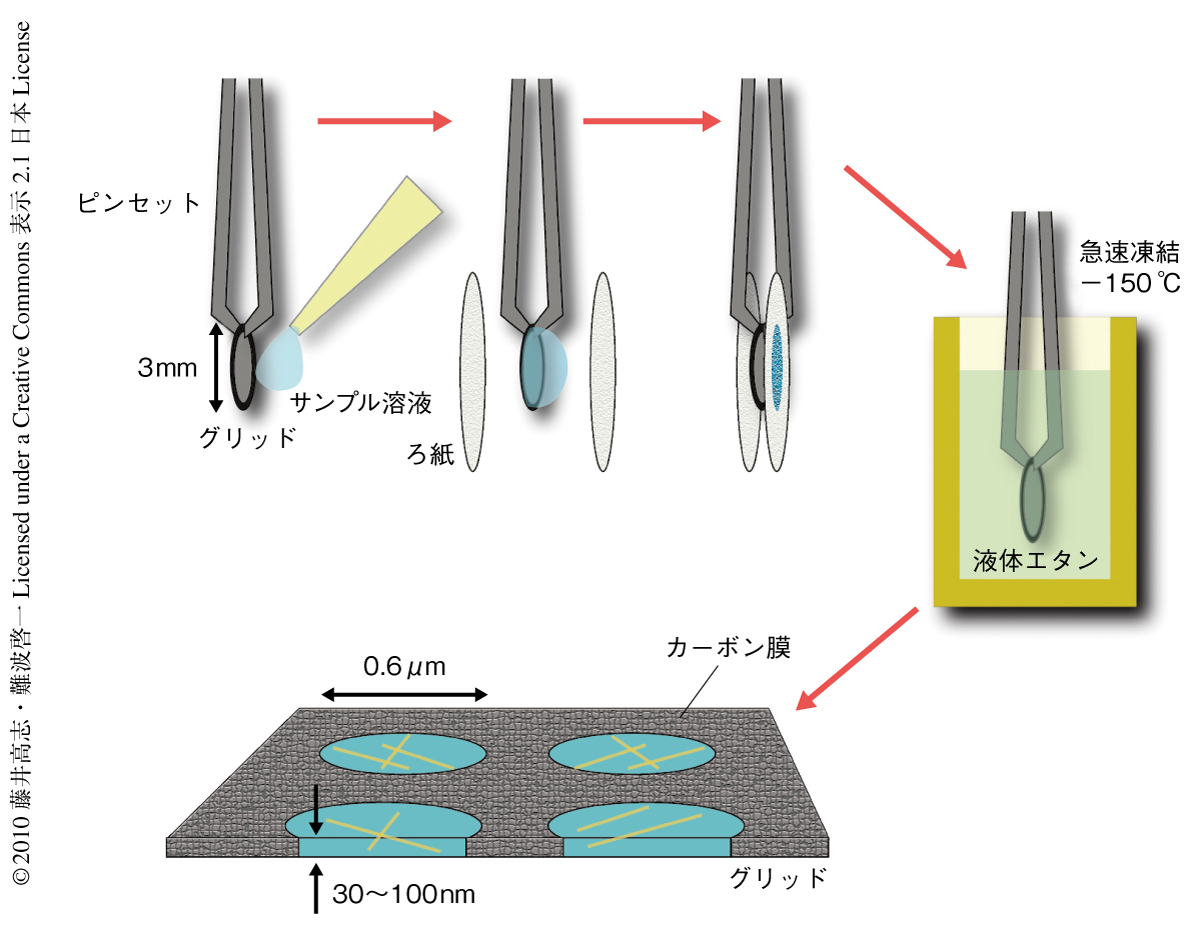
低温電子顕微鏡法では,直径1μmほどの穴が無数に開いたカーボン薄膜を載せた試料グリッドのうえに,生体分子の水溶液を載せその大半をろ紙で吸い取り,グリッドを液体エタンに突入させて急速凍結し電子顕微鏡の低温試料とする.こうして生体分子を50~100 nm厚の非晶質の氷薄膜に閉じ込め,電子線による投影像を撮影する(図1).電子顕微鏡の分解能自体は個々の原子の並びを解像できるほどに高いが,生体分子は水素結合などの弱い結合で立体構造を保持しているため電子線による損傷がきわめて大きく,損傷をさけるために電子線の照射量を低く抑えざるをえないため,ノイズレベルが高くコントラストの低い像しか得られず個々の分子像の分解能はきわめて低い.高分解能の像情報が記録されているにもかかわらず,高いノイズレベルによりその情報は埋もれてしまうのである.ノイズを抑えて高分解能の像情報をうかびあがらせるには,均一な構造の生体分子から数千数万もの数多くの像を収集し,その投影方向ごとに分類して整列し平均する必要がある.この分類・整列・平均により十分に多くの方向で高分解能の投影像が得られれば,原理的には病院で行われているX線CTと同じ計算法で立体像を再構成することができる.
直径が50 nm以上の大きな球形ウイルスや直径25 nmの太めのチューブ構造である細菌べん毛繊維などでは,タンパク質の主鎖や側鎖などの微細構造がみえる分解能(3~4Å)が達成されている6,7).大きな分子集合体では投影像の高精度での分類と整列に必要な高い像コントラストが得られるためである.X線結晶解析に必要な良質の結晶を得ることの困難さを考えれば,球形ウイルスの構造解析は,近い将来,低温電子顕微鏡法の独壇場となることは想像にかたくない.それほど強力な手法になった低温電子顕微鏡法でも,小さな分子や細い繊維の高分解能での構造解析は依然として困難である.生体分子と非晶質氷との密度差が小さいために像コントラストが低いからである.
筆者らは,種々のくふうにより像コントラストを大幅に向上することに成功した8)(図2a).氷薄膜の厚さを制御して試料の立体構造を保持したままできるかぎり薄い氷薄膜を作製することに成功し,約1.6倍のコントラストを得た.また,試料温度を電子線の照射損傷をもっとも抑制することが可能な4 Kから50 Kに昇温することで非晶質氷の極低温での高密度化をさけ,1.7倍のコントラストを実現した.さらに,エネルギー分光器による非弾性散乱電子の除去により,1.8倍のコントラストを実現した.これらを積算すると約5倍ものコントラスト向上になった.同時に,電気や熱の伝導度のきわめて低い4 Kの極低温では試料の帯電などにより高分解能の像の得られる歩留まりは1%程度ときわめて低かったが,50 Kに試料温度を昇温することでこれが95%以上と改善し,データ収集効率が劇的に高まった.このようにして得られた高コントラスト像,すなわち,シグナル/ノイズ比の高い像を解析に使うことによって像の分類と整列がより正確にできるようになり,これがアクチン繊維の高分解能での立体像の再構成に結びついた.
こうして得られた6.6Å分解能の密度マップ(PDB ID:3MFP)では,アクチン単量体の結晶構造9) にみられるαヘリックスやβ構造などの2次構造をすべて鮮明に解像することができた(図2b).特筆すべき点は,DNase I結合ループ(Dループ)とよばれ結晶構造ごとにαヘリックスやループなど異なるかたちをとる部分や,これまでみえたことのないN末端部分の密度を明確に解像できたことである.このDループは,結合相手をもたないアクチンの結晶ではαヘリックスであるが,アクチン繊維ではアクチン素繊維にそったアクチン分子間の相互作用を保つために大きく伸びたループとなっている.
一般に,タンパク質は複数のドメイン構造からできており,各ドメインは疎水性アミノ酸残基が内部に密集することで安定な立体構造を保持するため,X線結晶解析により解かれた構成ドメインの原子モデルの存在する場合,その集合体の電子顕微鏡像による解析結果がたとえ主鎖や側鎖のみえない分解能であっても,2次構造の配置と方位が明確にみえればドメインごとにモデルをあてはめることで信頼性の高い原子モデルの構築が可能である.アクチン繊維では,6.6Å分解能の3次元マップにアクチンの4つのドメイン(図3a)のモデルを個別にあてはめ,分子動力学にもとづいたフレキシブルフィッティングのプログラムを使用して各ドメインのコンフォメーションを精密化あるいは改変した.
繊維の形成にともなうアクチンの構造変化は4つのドメインの相対的な移動と回転であり,各ドメインの構造は結晶構造とほぼ一致した.このこと自体が今回の解析によって得られた立体像の高い信頼性を示すものである.ただし,ドメインD2のDループはαヘリックスからループに変化していた(図3b).また,ドメインのあいだの変化ではドメインD1とドメインD3とのあいだの動きがもっとも大きかった.この相対的なドメインの回転によりドメインD1のGln137がATPのγリン酸部位に接近しており,アクチン繊維の形成にともなうATP加水分解活性の40,000倍もの上昇が説明できた.
アクチン繊維は2本の素繊維が束ねられたリボン状の構造で,そのためにねじれやすく曲がりやすいといわれてきた5).電子顕微鏡像の解析による分解能が低いのはさまざまなねじれをもつ構造が混ざっているからであると解釈され,そのこと自体がアクチン繊維の生理的な機能に重要な構造ダイナミクスの特徴であると考えられてきた5).しかし,今回の高分解能の解析結果から,熱運動によるねじれの振幅はさほど大きくないことが推察された.そこで,得られたアクチン繊維の原子モデルをもとに,左巻き一重らせんにそって隣接するアクチン分子の回転角が0.2度ずつ異なる40種類のモデル構造を作成し,構造解析に用いたすべての電子顕微鏡像をねじれによって分類した結果,約90%の像は平均角度166.6度から±1度の範囲におさまった.
低温電子顕微鏡像はそもそも高いノイズレベルをもつため,実際より大きなねじれをもつ構造として分類される可能性がある.つまり,ねじれの分布は像のノイズに依存して広くなる傾向をもつ.よって,これまでの電子顕微鏡像の解析により広い分布をもつとされてきたアクチン繊維のねじれは,像のノイズレベルの高さか,あるいは,凍結グリッド試料の作製のときの機械的な擾乱による可能性が高い.アクチン繊維のねじれはさまざまなアクチン結合蛋白質との結合により大きく変化するが,繊維自体の生理的なねじれのダイナミクスはこれまでいわれてきたほど大きくはないようである.
素繊維は塩橋を含む多くの親水的な分子間相互作用で形成されており,その接触面積は比較的大きい.ドメインD2のDループは相手分子のC末端の周辺にあるドメインD1-ドメインD3ポケットに伸びて入り込み,ドメインD4といっしょになって相手分子のドメインD3をはさみ込んでいる.そのため,分子間の接触面積は広く素繊維にそった相互作用は強い.この相互作用に関与するのは,Ile64-Tyr166,Lys61-Glu167,Arg62-Asp288,Glu205-Asp286,Asp244-Arg290,Asp241-Thr324,Gly245-Pro322などで,その多くは親水的なものであった.
それに比べて素繊維のあいだの相互作用はきわめて弱くみえた.実際には安定な素繊維のあいだの相互作用を説明するため,Holmesらは,1990年のモデルで疎水性プラグの存在を提案した3).結晶構造にあったコンパクトなプラグ構造(Phe262~Ile274)がほどけて隣接する素繊維にむかって大きく伸び,その際に露出した疎水性側鎖と相手側の疎水的ポケットとのあいだで強い疎水性相互作用が形成されるというもので,モデルにおける素繊維のあいだの相互作用があまりに小さいことをおぎなうために提案された.しかし,今回の構造解析により,プラグ構造は結晶構造のままで親水性プラグとして素繊維のあいだの結合に関与していることが明らかになった.素繊維のあいだの相互作用に関与するのは,Dループから伸びるArg39とプラグ構造のGlu270との塩橋,それに,His40-Ser265,His40-Gly268,Ile267主鎖のCOとHis173との相互作用など,極性基のあいだの相互作用であった.
このように,素繊維のあいだの相互作用も素繊維にそった相互作用も親水的なもので,数多くの相互作用が協同的にはたらいてアクチン繊維の構造を安定化していた.このことは,比較的小さな環境変化やアクチン結合蛋白質との相互作用による構造変化により繊維構造の安定性を制御できることを示唆しており,アクチン繊維形成のダイナミクスをささえるしくみが明らかになったといえる.
アクチン繊維のように細くて曲がりやすい構造を低温電子顕微鏡法で解析し,アクチン分子の2次構造までを可視化することに成功したことは,この構造解析技術の細胞生物学分野における幅広い応用可能性とその高いポテンシャルを示すものである.アクチン繊維や微小管など,多くの繊維構造が多くのタンパク質と相互作用することで,その繊維の形成や解離がダイナミックに制御され,発生や分化における細胞の形態形成や運動などに必須な役割をはたしている.そういったタンパク質と繊維との複合体の構造を原子レベルで解明することは,さまざまな生命機能の分子機構を解明するうえできわめて重要である.今回のアクチン繊維の高分解能での構造解析は,その方向への展開にむけて大きな扉を開いた.アクチン結合タンパク質との複合体の構造はアクチン繊維よりも実質的に太いため,低温電子顕微鏡法にとってはアクチン繊維自体の解析より簡単である.そして,低温電子顕微鏡法の到達分解能が現在のレベルにとどまる原理的な理由はなく,さらなる技術開発によりタンパク質や核酸の主鎖や側鎖のみえる3Å分解能を達成することも夢ではない.そうすれば,構成因子のX線結晶解析にたよることなく複合体の原子モデルを構築し,原子間相互作用やその変化を詳細に議論して,細胞システムの動態をささえる分子機構にせまることも可能になるであろう.現在,それをめざしてさらなる技術開発を進めている.
略歴:2009年 大阪大学大学院生命機能研究科博士課程 修了(工学博士),2010年より同 研究員.
研究テーマ:低温電子顕微鏡による生体分子の高分解能での構造解析と生物物理学.
関心事:低温電子顕微鏡法で生体分子の原子構造を決定する.
難波 啓一(Keiichi Namba)
大阪大学大学院生命機能研究科 教授.
研究室URL:http://www.fbs.osaka-u.ac.jp/labs/namba/index.html
© 2010 藤井高志・難波啓一 Licensed under CC 表示 2.1 日本
(大阪大学大学院生命機能研究科 プロトニックナノマシン研究室)
email:難波啓一
DOI: 10.7875/first.author.2010.045
Direct visualization of secondary structures of F-actin by electron cryomicroscopy.
Takashi Fujii, Atsuko H. Iwane, Toshio Yanagida, Keiichi Namba
Nature, 467, 724-728 (2010)
要 約
アクチン繊維は筋細胞においてミオシン繊維と相互作用し力を発生して筋収縮をひき起こすだけでなく,細胞骨格としてあらゆる細胞の形態形成や運動に関与し,脳神経回路の形成にも重要な役割をはたしている.しかし,幅わずか10 nmときわめて細いリボン状の繊維構造をもち曲がりやすくねじれやすいため,その立体構造を高分解能で解析するのはたいへん困難であった.今回,急速凍結により立体構造を保持したまま低温電子顕微鏡で観察する方法を用い,その立体構造を6.6Å分解能で解明した.要した時間は電子顕微像の収集と解析計算を含めて5日間であった.さまざまな技術的くふうにより像質とコントラストとを大幅に改善し,画像収集と解析の効率化および高速化を進めた成果であった.この3次元密度マップにはαヘリックスやβ構造など2次構造のみならず,線維の形成に重要なループや外側に突き出したN末端などが観察され,繊維形成の際に起こるアクチン分子の構造変化や分子間相互作用など,繊維形成の分子機構が明らかになった.
はじめに
アクチンは筋細胞の主要な構成成分として発見されたが,あらゆる真核細胞に存在し,しかも,もっとも大量に存在するタンパク質のひとつである.そのアミノ酸配列の種間での保存性の高さは驚くべきものであり,ヒトと酵母のあいだですら87%の相同性がある.このことは,アクチンがいかに重要な生命活動の基盤を担い,細胞での分子間相互作用ネットワークのハブとしてはたらいているか,そのわずかな変化がいかに大きな影響を及ぼすかという事実を物語っている.実際,アクチンはミオシンを代表とする150種類以上のタンパク質と相互作用し,細胞のさまざまな機能の基盤としてはたらいている.
単量体のアクチンはGアクチンとよばれ,細胞ではFアクチンとよばれるらせん状の重合体として繊維構造を形成してはたらく.筋細胞においてはミオシン繊維と相互作用して筋収縮力を発生する.また,あらゆる真核生物の細胞骨格としてはたらき,さまざまなタンパク質と相互作用して細胞の形態形成,運動や分裂を駆動する.アクチン繊維の両端では重合能が異なり,一端で重合しつつもう一端で解離することで,あたかもキャタピラーの接地面のようにみかけの移動推進力を生み出す過程はトレッドミルともよばれ,これが細胞の形態形成,運動や分裂を駆動する1).これらの機能特性はアクチン分子の立体構造とそのダイナミックな変化によるものであり,よって,その構造を知ることは,アクチン機能の発現機構を知るうえで欠かすことのできないものである.
アクチンの構造については,1990年に,DNase Iとの複合体としての結晶構造がX線解析により明らかにされて以来2),約25種類のさまざまな複合体として結晶構造が明らかにされてきたが,アクチン繊維の構造解明はあまり進まなかった.繊維状の重合体は長さに分布があるため結晶にならず,原子分解能での構造解析法としてもっとも強力なX線結晶解析法が適用できないためであった.アクチン繊維の構造はこれまで電子顕微鏡法とX線繊維回折法により解析されてきた.1990年には,結晶構造を解いたHolmesらにより,アクチン繊維の配向液晶からのX線繊維回折像の層線回折強度にあわせたモデル構造が提案され3),2009年には,Odaらが,電子顕微鏡法の助けも借りてより高分解能のX線繊維回折データにあわせたモデル構造を発表した4).しかしながら,これらのモデルは観測強度とモデル計算強度との一致度に依存しているため正しいモデルである保証がなくその信頼性に限界があった.分子構造の3次元密度分布を再構成するためにはその回折(フーリエ)データの強度(振幅)と位相とが必要であるが,強度データだけではいくとおりにも解釈が可能でその構造に一意性がない.
それに対して低温電子顕微鏡法では,画像を解析するため当然ながら位相情報も得られる.ただし,これまでに報告されたアクチン繊維構造の最高分解能は13Åで4,5),アクチン分子のかたちがぼんやりとみえる程度にとどまっていた.幅わずか10 nmときわめて細いリボン状の繊維構造であるため,無染色の凍結氷包埋試料では電子顕微鏡像のコントラストがきわめて低く,多くの像を整列して平均することで高分解能の解析を実現する画像解析法がうまくはたらかないためであった.曲がりやすくねじれやすい構造も高分解能の達成をさまたげていた.今回,筆者らは,長年にわたって開発してきた低温電子顕微鏡法の新しい技術をアクチン繊維の構造解析に応用し,2次構造がみえる6.6Å分解能でその3次元密度分布を明らかにし,信頼性の高い原子モデルを構築した.
1.低温電子顕微鏡による高分解能の構造解析
低温電子顕微鏡法では,直径1μmほどの穴が無数に開いたカーボン薄膜を載せた試料グリッドのうえに,生体分子の水溶液を載せその大半をろ紙で吸い取り,グリッドを液体エタンに突入させて急速凍結し電子顕微鏡の低温試料とする.こうして生体分子を50~100 nm厚の非晶質の氷薄膜に閉じ込め,電子線による投影像を撮影する(図1).電子顕微鏡の分解能自体は個々の原子の並びを解像できるほどに高いが,生体分子は水素結合などの弱い結合で立体構造を保持しているため電子線による損傷がきわめて大きく,損傷をさけるために電子線の照射量を低く抑えざるをえないため,ノイズレベルが高くコントラストの低い像しか得られず個々の分子像の分解能はきわめて低い.高分解能の像情報が記録されているにもかかわらず,高いノイズレベルによりその情報は埋もれてしまうのである.ノイズを抑えて高分解能の像情報をうかびあがらせるには,均一な構造の生体分子から数千数万もの数多くの像を収集し,その投影方向ごとに分類して整列し平均する必要がある.この分類・整列・平均により十分に多くの方向で高分解能の投影像が得られれば,原理的には病院で行われているX線CTと同じ計算法で立体像を再構成することができる.
直径が50 nm以上の大きな球形ウイルスや直径25 nmの太めのチューブ構造である細菌べん毛繊維などでは,タンパク質の主鎖や側鎖などの微細構造がみえる分解能(3~4Å)が達成されている6,7).大きな分子集合体では投影像の高精度での分類と整列に必要な高い像コントラストが得られるためである.X線結晶解析に必要な良質の結晶を得ることの困難さを考えれば,球形ウイルスの構造解析は,近い将来,低温電子顕微鏡法の独壇場となることは想像にかたくない.それほど強力な手法になった低温電子顕微鏡法でも,小さな分子や細い繊維の高分解能での構造解析は依然として困難である.生体分子と非晶質氷との密度差が小さいために像コントラストが低いからである.
筆者らは,種々のくふうにより像コントラストを大幅に向上することに成功した8)(図2a).氷薄膜の厚さを制御して試料の立体構造を保持したままできるかぎり薄い氷薄膜を作製することに成功し,約1.6倍のコントラストを得た.また,試料温度を電子線の照射損傷をもっとも抑制することが可能な4 Kから50 Kに昇温することで非晶質氷の極低温での高密度化をさけ,1.7倍のコントラストを実現した.さらに,エネルギー分光器による非弾性散乱電子の除去により,1.8倍のコントラストを実現した.これらを積算すると約5倍ものコントラスト向上になった.同時に,電気や熱の伝導度のきわめて低い4 Kの極低温では試料の帯電などにより高分解能の像の得られる歩留まりは1%程度ときわめて低かったが,50 Kに試料温度を昇温することでこれが95%以上と改善し,データ収集効率が劇的に高まった.このようにして得られた高コントラスト像,すなわち,シグナル/ノイズ比の高い像を解析に使うことによって像の分類と整列がより正確にできるようになり,これがアクチン繊維の高分解能での立体像の再構成に結びついた.
2.アクチン繊維の原子モデルの構築と精密化
こうして得られた6.6Å分解能の密度マップ(PDB ID:3MFP)では,アクチン単量体の結晶構造9) にみられるαヘリックスやβ構造などの2次構造をすべて鮮明に解像することができた(図2b).特筆すべき点は,DNase I結合ループ(Dループ)とよばれ結晶構造ごとにαヘリックスやループなど異なるかたちをとる部分や,これまでみえたことのないN末端部分の密度を明確に解像できたことである.このDループは,結合相手をもたないアクチンの結晶ではαヘリックスであるが,アクチン繊維ではアクチン素繊維にそったアクチン分子間の相互作用を保つために大きく伸びたループとなっている.
一般に,タンパク質は複数のドメイン構造からできており,各ドメインは疎水性アミノ酸残基が内部に密集することで安定な立体構造を保持するため,X線結晶解析により解かれた構成ドメインの原子モデルの存在する場合,その集合体の電子顕微鏡像による解析結果がたとえ主鎖や側鎖のみえない分解能であっても,2次構造の配置と方位が明確にみえればドメインごとにモデルをあてはめることで信頼性の高い原子モデルの構築が可能である.アクチン繊維では,6.6Å分解能の3次元マップにアクチンの4つのドメイン(図3a)のモデルを個別にあてはめ,分子動力学にもとづいたフレキシブルフィッティングのプログラムを使用して各ドメインのコンフォメーションを精密化あるいは改変した.
3.繊維の形成にともなうアクチンの構造変化
繊維の形成にともなうアクチンの構造変化は4つのドメインの相対的な移動と回転であり,各ドメインの構造は結晶構造とほぼ一致した.このこと自体が今回の解析によって得られた立体像の高い信頼性を示すものである.ただし,ドメインD2のDループはαヘリックスからループに変化していた(図3b).また,ドメインのあいだの変化ではドメインD1とドメインD3とのあいだの動きがもっとも大きかった.この相対的なドメインの回転によりドメインD1のGln137がATPのγリン酸部位に接近しており,アクチン繊維の形成にともなうATP加水分解活性の40,000倍もの上昇が説明できた.
4.アクチン繊維のねじれのダイナミクス
アクチン繊維は2本の素繊維が束ねられたリボン状の構造で,そのためにねじれやすく曲がりやすいといわれてきた5).電子顕微鏡像の解析による分解能が低いのはさまざまなねじれをもつ構造が混ざっているからであると解釈され,そのこと自体がアクチン繊維の生理的な機能に重要な構造ダイナミクスの特徴であると考えられてきた5).しかし,今回の高分解能の解析結果から,熱運動によるねじれの振幅はさほど大きくないことが推察された.そこで,得られたアクチン繊維の原子モデルをもとに,左巻き一重らせんにそって隣接するアクチン分子の回転角が0.2度ずつ異なる40種類のモデル構造を作成し,構造解析に用いたすべての電子顕微鏡像をねじれによって分類した結果,約90%の像は平均角度166.6度から±1度の範囲におさまった.
低温電子顕微鏡像はそもそも高いノイズレベルをもつため,実際より大きなねじれをもつ構造として分類される可能性がある.つまり,ねじれの分布は像のノイズに依存して広くなる傾向をもつ.よって,これまでの電子顕微鏡像の解析により広い分布をもつとされてきたアクチン繊維のねじれは,像のノイズレベルの高さか,あるいは,凍結グリッド試料の作製のときの機械的な擾乱による可能性が高い.アクチン繊維のねじれはさまざまなアクチン結合蛋白質との結合により大きく変化するが,繊維自体の生理的なねじれのダイナミクスはこれまでいわれてきたほど大きくはないようである.
5.繊維形成に重要なアクチンの分子間相互作用
素繊維は塩橋を含む多くの親水的な分子間相互作用で形成されており,その接触面積は比較的大きい.ドメインD2のDループは相手分子のC末端の周辺にあるドメインD1-ドメインD3ポケットに伸びて入り込み,ドメインD4といっしょになって相手分子のドメインD3をはさみ込んでいる.そのため,分子間の接触面積は広く素繊維にそった相互作用は強い.この相互作用に関与するのは,Ile64-Tyr166,Lys61-Glu167,Arg62-Asp288,Glu205-Asp286,Asp244-Arg290,Asp241-Thr324,Gly245-Pro322などで,その多くは親水的なものであった.
それに比べて素繊維のあいだの相互作用はきわめて弱くみえた.実際には安定な素繊維のあいだの相互作用を説明するため,Holmesらは,1990年のモデルで疎水性プラグの存在を提案した3).結晶構造にあったコンパクトなプラグ構造(Phe262~Ile274)がほどけて隣接する素繊維にむかって大きく伸び,その際に露出した疎水性側鎖と相手側の疎水的ポケットとのあいだで強い疎水性相互作用が形成されるというもので,モデルにおける素繊維のあいだの相互作用があまりに小さいことをおぎなうために提案された.しかし,今回の構造解析により,プラグ構造は結晶構造のままで親水性プラグとして素繊維のあいだの結合に関与していることが明らかになった.素繊維のあいだの相互作用に関与するのは,Dループから伸びるArg39とプラグ構造のGlu270との塩橋,それに,His40-Ser265,His40-Gly268,Ile267主鎖のCOとHis173との相互作用など,極性基のあいだの相互作用であった.
このように,素繊維のあいだの相互作用も素繊維にそった相互作用も親水的なもので,数多くの相互作用が協同的にはたらいてアクチン繊維の構造を安定化していた.このことは,比較的小さな環境変化やアクチン結合蛋白質との相互作用による構造変化により繊維構造の安定性を制御できることを示唆しており,アクチン繊維形成のダイナミクスをささえるしくみが明らかになったといえる.
おわりに
アクチン繊維のように細くて曲がりやすい構造を低温電子顕微鏡法で解析し,アクチン分子の2次構造までを可視化することに成功したことは,この構造解析技術の細胞生物学分野における幅広い応用可能性とその高いポテンシャルを示すものである.アクチン繊維や微小管など,多くの繊維構造が多くのタンパク質と相互作用することで,その繊維の形成や解離がダイナミックに制御され,発生や分化における細胞の形態形成や運動などに必須な役割をはたしている.そういったタンパク質と繊維との複合体の構造を原子レベルで解明することは,さまざまな生命機能の分子機構を解明するうえできわめて重要である.今回のアクチン繊維の高分解能での構造解析は,その方向への展開にむけて大きな扉を開いた.アクチン結合タンパク質との複合体の構造はアクチン繊維よりも実質的に太いため,低温電子顕微鏡法にとってはアクチン繊維自体の解析より簡単である.そして,低温電子顕微鏡法の到達分解能が現在のレベルにとどまる原理的な理由はなく,さらなる技術開発によりタンパク質や核酸の主鎖や側鎖のみえる3Å分解能を達成することも夢ではない.そうすれば,構成因子のX線結晶解析にたよることなく複合体の原子モデルを構築し,原子間相互作用やその変化を詳細に議論して,細胞システムの動態をささえる分子機構にせまることも可能になるであろう.現在,それをめざしてさらなる技術開発を進めている.
文 献
- Pollard, T. D. & Borisy, G. G.: Cellular motility driven by assembly and disassembly of actin filaments. Cell, 112, 453-465 (2003)[PubMed]
- Kabsch, W., Mannherz, H. G., Suck, D. et al.: Atomic model of the actin:DNase I complex. Nature, 347, 37-44 (1990)[PubMed]
- Holmes, K. C., Popp, D., Gebhard, W. et al.: Atomic model of the actin filament. Nature, 347, 44-49 (1990)[PubMed]
- Oda, T., Iwasa, M., Aihara, T. et al.: The nature of the globular- to fibrous-actin transition. Nature, 457, 441-445 (2009)[PubMed]
- Galkin, V. E., Orlova, A., Cherepanova, O. et al.: High-resolution cryo-EM structure of the F-actin-fimbrin/plastin ABD2 complex. Proc. Natl Acad. Sci. USA, 105, 1494-1498 (2008)[PubMed]
- Zhang, X., Jin, L., Fang, Q. et al.: 3.3Å cryo-EM structure of a nonenveloped virus reveals a priming mechanism for cell entry. Cell, 141, 472-482 (2010)[PubMed]
- Yonekura, K., Maki-Yonekura, S. & Namba, K.: Complete atomic model of the bacterial flagellar filament by electron cryomicroscopy. Nature, 424, 643-650 (2003)[PubMed]
- Fujii, T., Kato, T. & Namba, K.: Specific Arrangement of α-helical coiled coils in the core domain of the bacterial flagellar hook for the universal joint function. Structure, 17, 1-9 (2009)[PubMed]
- Otterbein, L. R., Graceffa, P. & Dominguez, R.: The crystal structure of uncomplexed actin in the ADP state. Science, 293, 708-711 (2001)[PubMed]
著者プロフィール
略歴:2009年 大阪大学大学院生命機能研究科博士課程 修了(工学博士),2010年より同 研究員.
研究テーマ:低温電子顕微鏡による生体分子の高分解能での構造解析と生物物理学.
関心事:低温電子顕微鏡法で生体分子の原子構造を決定する.
難波 啓一(Keiichi Namba)
大阪大学大学院生命機能研究科 教授.
研究室URL:http://www.fbs.osaka-u.ac.jp/labs/namba/index.html
© 2010 藤井高志・難波啓一 Licensed under CC 表示 2.1 日本