抗CD47抗体はアポトーシスを起こした細胞の除去を亢進することにより動脈硬化を抑制する
児島陽子・Nicholas J. Leeper
(米国Stanford大学School of Medicine,Division of Vascular Surgery)
email:児島陽子
DOI: 10.7875/first.author.2016.086
CD47-blocking antibodies restore phagocytosis and prevent atherosclerosis.
Yoko Kojima, Jens-Peter Volkmer, Kelly McKenna, Mete Civelek, Aldons Jake Lusis, Clint L. Miller, Daniel Direnzo, Vivek Nanda, Jianqin Ye, Andrew J. Connolly, Eric E. Schadt, Thomas Quertermous, Paola Betancur, Lars Maegdefessel, Ljubica Perisic Matic, Ulf Hedin, Irving L. Weissman, Nicholas J. Leeper
Nature, 536, 86-90 (2016)
アポトーシスを起こした細胞がマクロファージによる貪食により除去されるしくみをエフェロサイトーシスという.動脈硬化を含む種々の疾患においてエフェロサイトーシスの低下が報告されている.今回,筆者らは,ヒトおよびマウスの動脈硬化の病変においてはエフェロサイトーシスを抑制する役割をもつCD47の発現が亢進しており,これにより,アポトーシスを起こした細胞が蓄積し動脈硬化が促進されることを明らかにした.TNFαはNF-κBを介して血管平滑筋においてCD47の発現を上昇させ,TNFαにより刺激された細胞はエフェロサイトーシスに対し抵抗性を示した.マウスにおいて,抗CD47抗体の投与によりエフェロサイトーシスは回復し,動脈硬化の進展および不安定化が抑制された.現在,悪性疾患の患者に対する抗CD47抗体による治療の臨床試験が行われている.CD47は動脈硬化を含む炎症性疾患の新たな治療法において有効な標的になると考えられる.
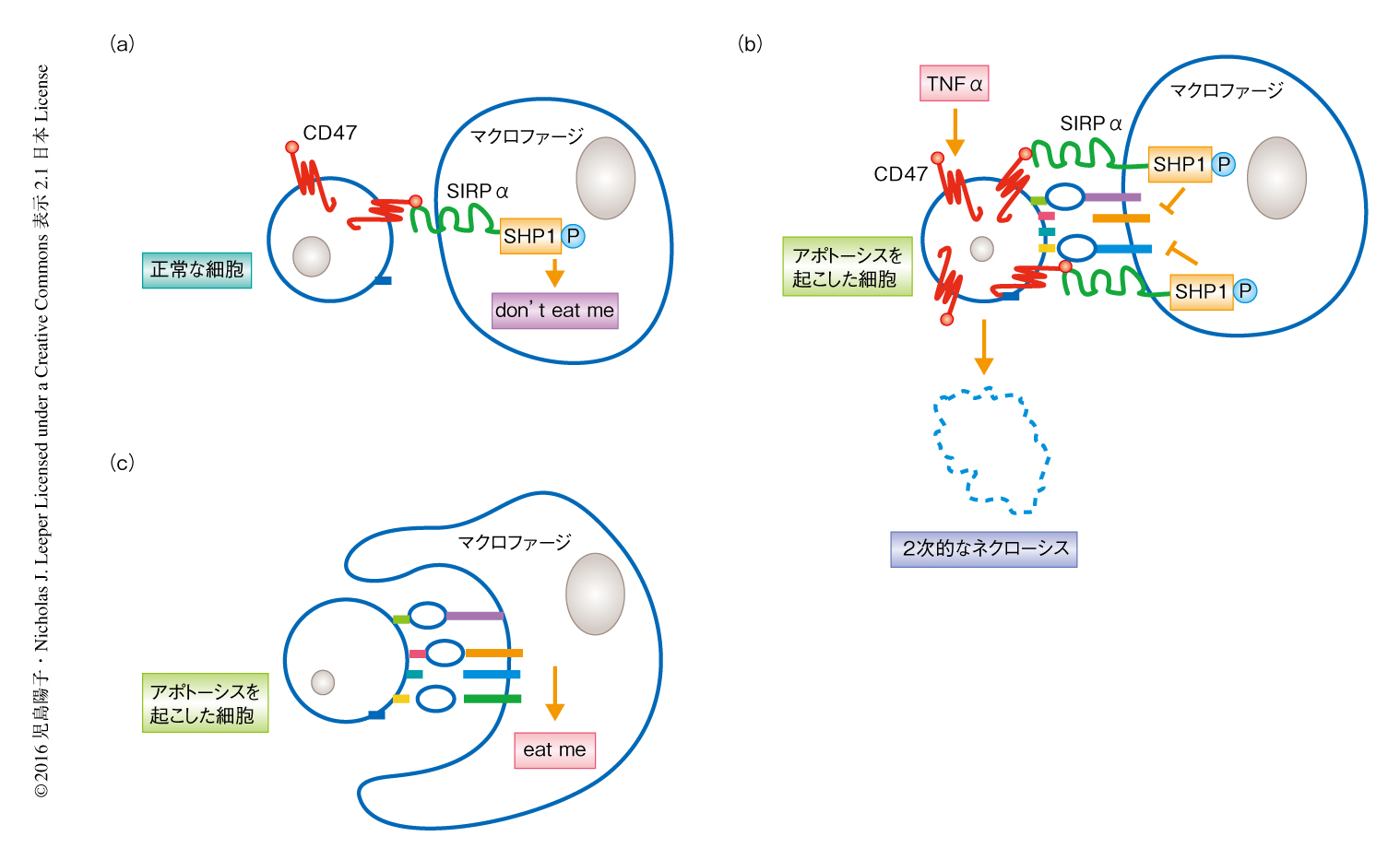
正常な組織においてアポトーシスを起こした細胞は通常はほとんど検出されないが,これは,アポトーシスを起こした細胞がエフェロサイトーシス(efferocytosis)とよばれる過程によりマクロファージなどに効率よく貪食され迅速に除去されるためである1).エフェロサイトーシスには,アポトーシスを起こした細胞に存在するリガンド,マクロファージに発現する受容体,それらのあいだを結ぶブリッジタンパク質など,多くの分子が関与する(図1a).アポトーシスを起こした細胞は細胞の表面にホスファチジルセリンなどのeat meリガンドを提示し,マクロファージはこれを認識してエフェロサイトーシスを起こす.一方,健常な細胞にはCD47が発現しており,マクロファージにSIRPαを介しdon’t eat meシグナルが伝達されることによりマクロファージによる貪食に抵抗する.アポトーシスを起こした細胞や老化した赤血球においてはCD47の発現が低下しており,マクロファージなどにより貪食されることが報告されている2,3).
動脈硬化は心筋梗塞や脳梗塞の基礎となる病変である.動脈硬化においては血管に脂質,細胞,細胞外基質などが蓄積し血管内腔の狭窄が起こる.また,動脈硬化プラークが破綻すると,続発した血栓が血管内腔を閉塞して血液の供給を途絶させ心筋梗塞などをひき起こす.進行した動脈硬化の病変においてはアポトーシスを起こした細胞が蓄積し,これがさらなる炎症反応をひき起こし,病変の進行,壊死巣の拡大,動脈硬化プラークの不安定化に寄与すると考えられる.動脈硬化の病変におけるアポトーシスを起こした細胞の蓄積は,低酸素や酸化ストレスによるアポトーシスの増加とともに,エフェロサイトーシスの低下によると考えられる4).なぜ,動脈硬化の病変においてエフェロサイトーシスが低下しているかにつきいくつかの原因があげられてはいるが,完全には解明されていない.また,近年,エフェロサイトーシスの低下は悪性腫瘍や自己免疫疾患などの病因になることがわかってきた.多くの悪性腫瘍の細胞においてCD47の発現が亢進しており,免疫機構による監視からのがれている5).今回,筆者らは,CD47の動脈硬化の病変における役割および治療への応用について検討した.
ヒトの頚動脈に対するマイクロアレイ法による遺伝子発現の解析において,CD47の発現は動脈硬化の病変において健常な動脈と比べ有意に上昇していた.さらに,脳梗塞などの症状をもつ患者の頚動脈においては症状のない患者の病変と比べ,CD47の発現は上昇していた.健常な動脈においては免疫染色により血管内膜および血管中膜にCD47の弱い発現がみられ,動脈硬化の進展とともにCD47の発現は亢進した.進行した動脈硬化の病変においては壊死性コアとその周辺にCD47のとくに強い発現がみられた.同様に,apoEノックアウトマウスに高コレステロール食を負荷し動脈硬化を起こさせると,大動脈におけるCD47の発現は経時的に上昇の傾向を示した.動脈硬化の病変におけるCD47の発現の亢進は,動脈硬化巣におけるエフェロサイトーシスの低下の原因のひとつであると考えられた.
apoEノックアウトマウスにアンジオテンシンIIの投与および高コレステロール食の負荷を開始するとともに,CD47を阻害する抗CD47抗体を4週間にわたり投与した.抗CD47抗体を投与したマウスは対照となる抗体を投与したマウスと比べ,動脈硬化が著明に抑制された.マクロファージあるいはリンパ球の侵入および血管平滑筋の増殖に差はみられなかった.活性化カスパーゼ3染色やTUNEL染色によりアポトーシスを検出したところ,抗CD47抗体を投与したマウスにおいてアポトーシスは有意に減少していた.in vitroにおける実験においては,抗CD47抗体にアポトーシスを直接的に抑制する作用はみられず,マクロファージおよびアポトーシスを起こした血管平滑筋細胞においては,抗CD47抗体はアポトーシスを起こした細胞のマクロファージによる貪食を有意に促進した.抗CD47抗体を投与したマウスにおいてみられたアポトーシスの減少はエフェロサイトーシスの亢進によるものと考え,これをin vivoにおいて証明するため,アポトーシスおよびマクロファージの二重染色をしたところ,対照となるマウスにおいては活性化カスパーゼ3陽性を示す遊離のアポトーシス細胞が動脈硬化の病変に多くみられたのに対し,抗CD47抗体を投与したマウスにおいてはアポトーシスを起こしたほとんどの細胞はマクロファージに貪食あるいはマクロファージと隣接していた.電子顕微鏡による観察においても,対照となるマウスにおいてはアポトーシスを起こした遊離の細胞が多くみられたが,抗CD47抗体を投与したマウスにおいてはほとんどみられず,マクロファージがアポトーシス小体を大量に貪食しているようすが観察された.CD47抗体を投与したマウスにおいては対照となるマウスと比べ,動脈硬化プラークにおける壊死性コアの大きさも抑制されていた.抗CD47抗体によりdon’t eat meシグナルが抑制されることを証明するため,CD47の受容体であるSIRPαの下流に存在するSHP1のリン酸化を測定したところ,CD47抗体を投与したマウスにおいては有意に抑制されていた.アポトーシスを起こした細胞が除去されないと2次的なネクローシスが起こり,さらなる炎症反応のカスケードがひき起こされ動脈硬化は悪化する.抗CD47抗体はエフェロサイトーシスを亢進することにより動脈硬化の進展を抑制すると考えられた.
同様の作用は,apoEノックアウトマウスに12週間にわたり高コレステロール食を負荷した長期モデルにおいても認められ,頚動脈のタンデムな狭窄を用いた動脈硬化プラーク破綻モデル6) においては動脈硬化プラークにおける出血が抑制され,抗CD47抗体は動脈硬化プラークの拡大とともにその不安定化も抑制することが示唆された.
抗CD47抗体は体重,血糖値,血清脂質,インスリン値,肝臓および腎臓の機能には影響をおよぼさなかった.CD47抗体を投与したマウスにおいては対照となるマウスと比べ,血中のヘモグロビン値の低下,網赤血球値の上昇,脾腫が認められた.これは,脾臓におけるCD47抗体による赤血球の破壊の亢進によるものと考えられた.
CD47はマクロファージに発現するSIRPαのリガンドとしてdon’t eat meシグナルを伝達するほか,インテグリンやVEGF受容体2などとも相互作用することが知られており,なかでも,トロンボスポンジン1は動脈硬化の病変において重要な役割をはたす7).トロンボスポンジン1がCD47と結合すると内皮型NO合成酵素の活性化が抑制される.内皮型NO合成酵素により産生されるNOは,血管平滑筋の収縮の抑制による血圧の低下の作用や炎症性サイトカインの分泌の抑制の作用など動脈硬化の抑制にはたらく多くの作用をもつ.抗CD47抗体による動脈硬化の抑制の作用は,トロンボスポンジン1による内皮型NO合成酵素の抑制を阻害することによるものかどうかを確かめるため,マウスの血圧および肺におけるNOの産生量を測定したが対象となるマウスとのあいだに差はみられなかった.in vitroにおいても,抗CD47抗体の投与は内皮型NO合成酵素のリン酸化およびトロンボスポンジン1のシグナルには影響をおよぼさなかった.
動脈硬化プラークにおいては,酸化ストレスや炎症性サイトカインなどの作用によりアポトーシスは亢進すると考えられる.通常なら,don’t eat meシグナルであるCD47の発現は低下しアポトーシスを起こした細胞はマクロファージなどによりすみやかに貪食されるはずであるが,さきに述べたように,動脈硬化の病変においてCD47の発現は上昇していた.この発現の上昇の機序について解明するためヒトおよびマウスの血管組織についてバイオインフォマティクスにより解析したところ,CD47の発現を制御するタンパク質としてTNFαがうかびあがった.ヒトの動脈硬化の病変におけるCD47の発現とTNFαとの発現のあいだには正の相関がみられたが,インターロイキン4やTGFβなどそのほかのサイトカインの発現との相関はみられなかった.
血管平滑筋細胞においてTNFαによる刺激によりCD47のmRNAレベルおよびタンパク質レベルでの発現の上昇が認められた.TNFαはNF-κBを介してCD47の発現を上昇させた.細胞をスタウロスポリンにより刺激しアポトーシスを起こさせると,以前から報告されていたとおりCD47の発現は低下したが,TNFαの存在のもとではCD47の発現の低下は抑制された.また,TNFαにより刺激した細胞はマクロファージによる貪食に対し抵抗性を示し,抗CD47抗体はTNFαにより刺激した細胞においても有効であった.抗TNFα療法と抗CD47抗体の併用により,in vitroにおいてマクロファージによる貪食の増加がみられ,マウスの動脈硬化の病変におけるアポトーシスを起こした細胞の蓄積およびエフェロサイトーシスの低下は改善された.
この研究により,動脈硬化の病変においてはTNFαによりCD47の発現が亢進しており,これが動脈硬化プラークにおけるエフェロサイトーシスの低下の一因であることがわかった.増加したCD47はSIRPαおよびSHP1を介してeat meシグナルを抑制し,アポトーシスを起こした細胞は2次的なネクローシスを起こし炎症性物質を放出してCD47をさらに増加させると考えられた(図1b).抗CD47抗体の投与によりエフェロサイトーシスは回復し動脈硬化の進展および不安定化は抑制された.
新しい抗ヒトCD47抗体Hu5F9-G4が開発され,この抗CD47抗体はヒトのCD47に対し高い親和性を示しCD47とSIRPαとの結合を阻害してマクロファージによる白血病細胞の貪食を促進した.サルにおいては用量に依存して貧血がみられたが2週間後には正常になり,そのほか心臓,腎臓,肝臓の機能に異常はみられなかった8).2015年より,この抗CD47抗体を用いて白血病およびリンパ腫の患者に対するフェーズ1の臨床試験が行われている.CD47は動脈硬化においても有効な治療の標的と考えられ,臨床への迅速な応用が期待される.
略歴:2005年 神戸大学大学院医学系研究科 修了,2006年 米国Stanford大学Postdoctoral Fellow,2010年 米国Yale大学を経て,2012年より米国Stanford大学School of MedicineにてResearch Associate.
Nicholas J. Leeper
米国Stanford大学School of MedicineにてAssociate Professor.
研究室URL:http://med.stanford.edu/leeperlab.html
© 2016 児島陽子・Nicholas J. Leeper Licensed under CC 表示 2.1 日本
(米国Stanford大学School of Medicine,Division of Vascular Surgery)
email:児島陽子
DOI: 10.7875/first.author.2016.086
CD47-blocking antibodies restore phagocytosis and prevent atherosclerosis.
Yoko Kojima, Jens-Peter Volkmer, Kelly McKenna, Mete Civelek, Aldons Jake Lusis, Clint L. Miller, Daniel Direnzo, Vivek Nanda, Jianqin Ye, Andrew J. Connolly, Eric E. Schadt, Thomas Quertermous, Paola Betancur, Lars Maegdefessel, Ljubica Perisic Matic, Ulf Hedin, Irving L. Weissman, Nicholas J. Leeper
Nature, 536, 86-90 (2016)
この論文に出現する遺伝子・タンパク質のUniprot ID
CD47(Q08722), TNFα(P01375), NF-κB, SIRPα(P78324), apoE(P08226), SHP1(P29350), インテグリン, VEGF受容体2(P35968), トロンボスポンジン1(P07996), NO合成酵素(P29477), 炎症性サイトカイン, インターロイキン4, TGFβ, サイトカイン
要 約
アポトーシスを起こした細胞がマクロファージによる貪食により除去されるしくみをエフェロサイトーシスという.動脈硬化を含む種々の疾患においてエフェロサイトーシスの低下が報告されている.今回,筆者らは,ヒトおよびマウスの動脈硬化の病変においてはエフェロサイトーシスを抑制する役割をもつCD47の発現が亢進しており,これにより,アポトーシスを起こした細胞が蓄積し動脈硬化が促進されることを明らかにした.TNFαはNF-κBを介して血管平滑筋においてCD47の発現を上昇させ,TNFαにより刺激された細胞はエフェロサイトーシスに対し抵抗性を示した.マウスにおいて,抗CD47抗体の投与によりエフェロサイトーシスは回復し,動脈硬化の進展および不安定化が抑制された.現在,悪性疾患の患者に対する抗CD47抗体による治療の臨床試験が行われている.CD47は動脈硬化を含む炎症性疾患の新たな治療法において有効な標的になると考えられる.
はじめに
正常な組織においてアポトーシスを起こした細胞は通常はほとんど検出されないが,これは,アポトーシスを起こした細胞がエフェロサイトーシス(efferocytosis)とよばれる過程によりマクロファージなどに効率よく貪食され迅速に除去されるためである1).エフェロサイトーシスには,アポトーシスを起こした細胞に存在するリガンド,マクロファージに発現する受容体,それらのあいだを結ぶブリッジタンパク質など,多くの分子が関与する(図1a).アポトーシスを起こした細胞は細胞の表面にホスファチジルセリンなどのeat meリガンドを提示し,マクロファージはこれを認識してエフェロサイトーシスを起こす.一方,健常な細胞にはCD47が発現しており,マクロファージにSIRPαを介しdon’t eat meシグナルが伝達されることによりマクロファージによる貪食に抵抗する.アポトーシスを起こした細胞や老化した赤血球においてはCD47の発現が低下しており,マクロファージなどにより貪食されることが報告されている2,3).
動脈硬化は心筋梗塞や脳梗塞の基礎となる病変である.動脈硬化においては血管に脂質,細胞,細胞外基質などが蓄積し血管内腔の狭窄が起こる.また,動脈硬化プラークが破綻すると,続発した血栓が血管内腔を閉塞して血液の供給を途絶させ心筋梗塞などをひき起こす.進行した動脈硬化の病変においてはアポトーシスを起こした細胞が蓄積し,これがさらなる炎症反応をひき起こし,病変の進行,壊死巣の拡大,動脈硬化プラークの不安定化に寄与すると考えられる.動脈硬化の病変におけるアポトーシスを起こした細胞の蓄積は,低酸素や酸化ストレスによるアポトーシスの増加とともに,エフェロサイトーシスの低下によると考えられる4).なぜ,動脈硬化の病変においてエフェロサイトーシスが低下しているかにつきいくつかの原因があげられてはいるが,完全には解明されていない.また,近年,エフェロサイトーシスの低下は悪性腫瘍や自己免疫疾患などの病因になることがわかってきた.多くの悪性腫瘍の細胞においてCD47の発現が亢進しており,免疫機構による監視からのがれている5).今回,筆者らは,CD47の動脈硬化の病変における役割および治療への応用について検討した.
1.CD47の発現はヒトおよびマウスの動脈硬化プラークにおいて亢進する
ヒトの頚動脈に対するマイクロアレイ法による遺伝子発現の解析において,CD47の発現は動脈硬化の病変において健常な動脈と比べ有意に上昇していた.さらに,脳梗塞などの症状をもつ患者の頚動脈においては症状のない患者の病変と比べ,CD47の発現は上昇していた.健常な動脈においては免疫染色により血管内膜および血管中膜にCD47の弱い発現がみられ,動脈硬化の進展とともにCD47の発現は亢進した.進行した動脈硬化の病変においては壊死性コアとその周辺にCD47のとくに強い発現がみられた.同様に,apoEノックアウトマウスに高コレステロール食を負荷し動脈硬化を起こさせると,大動脈におけるCD47の発現は経時的に上昇の傾向を示した.動脈硬化の病変におけるCD47の発現の亢進は,動脈硬化巣におけるエフェロサイトーシスの低下の原因のひとつであると考えられた.
2.抗CD47抗体は動脈硬化を抑制する
apoEノックアウトマウスにアンジオテンシンIIの投与および高コレステロール食の負荷を開始するとともに,CD47を阻害する抗CD47抗体を4週間にわたり投与した.抗CD47抗体を投与したマウスは対照となる抗体を投与したマウスと比べ,動脈硬化が著明に抑制された.マクロファージあるいはリンパ球の侵入および血管平滑筋の増殖に差はみられなかった.活性化カスパーゼ3染色やTUNEL染色によりアポトーシスを検出したところ,抗CD47抗体を投与したマウスにおいてアポトーシスは有意に減少していた.in vitroにおける実験においては,抗CD47抗体にアポトーシスを直接的に抑制する作用はみられず,マクロファージおよびアポトーシスを起こした血管平滑筋細胞においては,抗CD47抗体はアポトーシスを起こした細胞のマクロファージによる貪食を有意に促進した.抗CD47抗体を投与したマウスにおいてみられたアポトーシスの減少はエフェロサイトーシスの亢進によるものと考え,これをin vivoにおいて証明するため,アポトーシスおよびマクロファージの二重染色をしたところ,対照となるマウスにおいては活性化カスパーゼ3陽性を示す遊離のアポトーシス細胞が動脈硬化の病変に多くみられたのに対し,抗CD47抗体を投与したマウスにおいてはアポトーシスを起こしたほとんどの細胞はマクロファージに貪食あるいはマクロファージと隣接していた.電子顕微鏡による観察においても,対照となるマウスにおいてはアポトーシスを起こした遊離の細胞が多くみられたが,抗CD47抗体を投与したマウスにおいてはほとんどみられず,マクロファージがアポトーシス小体を大量に貪食しているようすが観察された.CD47抗体を投与したマウスにおいては対照となるマウスと比べ,動脈硬化プラークにおける壊死性コアの大きさも抑制されていた.抗CD47抗体によりdon’t eat meシグナルが抑制されることを証明するため,CD47の受容体であるSIRPαの下流に存在するSHP1のリン酸化を測定したところ,CD47抗体を投与したマウスにおいては有意に抑制されていた.アポトーシスを起こした細胞が除去されないと2次的なネクローシスが起こり,さらなる炎症反応のカスケードがひき起こされ動脈硬化は悪化する.抗CD47抗体はエフェロサイトーシスを亢進することにより動脈硬化の進展を抑制すると考えられた.
同様の作用は,apoEノックアウトマウスに12週間にわたり高コレステロール食を負荷した長期モデルにおいても認められ,頚動脈のタンデムな狭窄を用いた動脈硬化プラーク破綻モデル6) においては動脈硬化プラークにおける出血が抑制され,抗CD47抗体は動脈硬化プラークの拡大とともにその不安定化も抑制することが示唆された.
抗CD47抗体は体重,血糖値,血清脂質,インスリン値,肝臓および腎臓の機能には影響をおよぼさなかった.CD47抗体を投与したマウスにおいては対照となるマウスと比べ,血中のヘモグロビン値の低下,網赤血球値の上昇,脾腫が認められた.これは,脾臓におけるCD47抗体による赤血球の破壊の亢進によるものと考えられた.
CD47はマクロファージに発現するSIRPαのリガンドとしてdon’t eat meシグナルを伝達するほか,インテグリンやVEGF受容体2などとも相互作用することが知られており,なかでも,トロンボスポンジン1は動脈硬化の病変において重要な役割をはたす7).トロンボスポンジン1がCD47と結合すると内皮型NO合成酵素の活性化が抑制される.内皮型NO合成酵素により産生されるNOは,血管平滑筋の収縮の抑制による血圧の低下の作用や炎症性サイトカインの分泌の抑制の作用など動脈硬化の抑制にはたらく多くの作用をもつ.抗CD47抗体による動脈硬化の抑制の作用は,トロンボスポンジン1による内皮型NO合成酵素の抑制を阻害することによるものかどうかを確かめるため,マウスの血圧および肺におけるNOの産生量を測定したが対象となるマウスとのあいだに差はみられなかった.in vitroにおいても,抗CD47抗体の投与は内皮型NO合成酵素のリン酸化およびトロンボスポンジン1のシグナルには影響をおよぼさなかった.
3.TNFαはCD47の発現を上昇させる
動脈硬化プラークにおいては,酸化ストレスや炎症性サイトカインなどの作用によりアポトーシスは亢進すると考えられる.通常なら,don’t eat meシグナルであるCD47の発現は低下しアポトーシスを起こした細胞はマクロファージなどによりすみやかに貪食されるはずであるが,さきに述べたように,動脈硬化の病変においてCD47の発現は上昇していた.この発現の上昇の機序について解明するためヒトおよびマウスの血管組織についてバイオインフォマティクスにより解析したところ,CD47の発現を制御するタンパク質としてTNFαがうかびあがった.ヒトの動脈硬化の病変におけるCD47の発現とTNFαとの発現のあいだには正の相関がみられたが,インターロイキン4やTGFβなどそのほかのサイトカインの発現との相関はみられなかった.
血管平滑筋細胞においてTNFαによる刺激によりCD47のmRNAレベルおよびタンパク質レベルでの発現の上昇が認められた.TNFαはNF-κBを介してCD47の発現を上昇させた.細胞をスタウロスポリンにより刺激しアポトーシスを起こさせると,以前から報告されていたとおりCD47の発現は低下したが,TNFαの存在のもとではCD47の発現の低下は抑制された.また,TNFαにより刺激した細胞はマクロファージによる貪食に対し抵抗性を示し,抗CD47抗体はTNFαにより刺激した細胞においても有効であった.抗TNFα療法と抗CD47抗体の併用により,in vitroにおいてマクロファージによる貪食の増加がみられ,マウスの動脈硬化の病変におけるアポトーシスを起こした細胞の蓄積およびエフェロサイトーシスの低下は改善された.
おわりに
この研究により,動脈硬化の病変においてはTNFαによりCD47の発現が亢進しており,これが動脈硬化プラークにおけるエフェロサイトーシスの低下の一因であることがわかった.増加したCD47はSIRPαおよびSHP1を介してeat meシグナルを抑制し,アポトーシスを起こした細胞は2次的なネクローシスを起こし炎症性物質を放出してCD47をさらに増加させると考えられた(図1b).抗CD47抗体の投与によりエフェロサイトーシスは回復し動脈硬化の進展および不安定化は抑制された.
新しい抗ヒトCD47抗体Hu5F9-G4が開発され,この抗CD47抗体はヒトのCD47に対し高い親和性を示しCD47とSIRPαとの結合を阻害してマクロファージによる白血病細胞の貪食を促進した.サルにおいては用量に依存して貧血がみられたが2週間後には正常になり,そのほか心臓,腎臓,肝臓の機能に異常はみられなかった8).2015年より,この抗CD47抗体を用いて白血病およびリンパ腫の患者に対するフェーズ1の臨床試験が行われている.CD47は動脈硬化においても有効な治療の標的と考えられ,臨床への迅速な応用が期待される.
文 献
- Elliott, M. R. & Ravichandran, K. S.: Clearance of apoptotic cells: implications in health and disease. J. Cell Biol., 189, 1059-1070 (2010)[PubMed]
- Oldenborg, P. A., Zheleznyak, A., Fang, Y. F. et al.: Role of CD47 as a marker of self on red blood cells. Science, 288, 2051-2054 (2000)[PubMed]
- Gardai, S. J., McPhillips, K. A., Frasch, S. C. et al.: Cell-surface calreticulin initiates clearance of viable or apoptotic cells through trans-activation of LRP on the phagocyte. Cell, 123, 321-334 (2005)[PubMed]
- Schrijvers, D. M., De Meyer, G. R., Kockx, M. M. et al.: Phagocytosis of apoptotic cells by macrophages is impaired in atherosclerosis. Arterioscler. Thromb. Vasc. Biol., 25, 1256-1261 (2005)[PubMed]
- Majeti, R., Chao, M. P., Alizadeh, A. A. et al.: CD47 is an adverse prognostic factor and therapeutic antibody target on human acute myeloid leukemia stem cells. Cell, 138, 286-299 (2009)[PubMed]
- Chen, Y. C., Bui, A. V., Diesch, J. et al.: A novel mouse model of atherosclerotic plaque instability for drug testing and mechanistic/therapeutic discoveries using gene and microRNA expression profiling. Circ. Res., 113, 252-265 (2013)[PubMed]
- Soto-Pantoja, D. R., Stein, E. V., Rogers, N. M. et al.: Therapeutic opportunities for targeting the ubiquitous cell surface receptor CD47. Expert Opin. Ther. Targets, 17, 89-103 (2013)[PubMed]
- Liu, J., Wang, L., Zhao F., et al.: Pre-clinical development of a humanized anti-CD47 antibody with anti-cancer therapeutic potential. PLoS One, 10, e0137345 (2015)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2005年 神戸大学大学院医学系研究科 修了,2006年 米国Stanford大学Postdoctoral Fellow,2010年 米国Yale大学を経て,2012年より米国Stanford大学School of MedicineにてResearch Associate.
Nicholas J. Leeper
米国Stanford大学School of MedicineにてAssociate Professor.
研究室URL:http://med.stanford.edu/leeperlab.html
© 2016 児島陽子・Nicholas J. Leeper Licensed under CC 表示 2.1 日本