ジカウイルスはヒトのさまざまな胎盤に由来する初代培養細胞に感染し2つの垂直感染経路の可能性が示唆される
田端 貴子
(米国California大学San Francisco校School of Dentistry,Department of Cell and Tissue Biology)
email:田端貴子
DOI: 10.7875/first.author.2016.085
Zika virus targets different primary human placental cells, suggesting two routes for vertical transmission.
Takako Tabata, Matthew Petitt, Henry Puerta-Guardo, Daniela Michlmayr, Chunling Wang, June Fang-Hoover, Eva Harris, Lenore Pereira
Cell Host & Microbe, 20, 155-166 (2016)
妊婦へのジカウイルスへの感染と胎児の重篤な先天性の異常が関連づけられているが,ジカウイルスの母子感染の機序についてはほとんど解明されていない.今回,筆者らは,妊娠中期あるいは妊娠後期の胎盤に由来する初代培養細胞,および,妊娠初期の胎盤の絨毛膜絨毛の組織片に対しジカウイルスのプロトタイプ株および病原株の感染を試みた.ジカウイルスはウイルスの侵入に必要な宿主のタンパク質であるAxl,Tyro3,TIM1を発現する栄養膜細胞,血管内皮細胞,線維芽細胞,Hofbauer細胞,羊膜上皮細胞,栄養芽細胞前駆細胞,絨毛膜絨毛の組織片に感染し,ウイルスのタンパク質であるNS3およびEを発現した.また,妊娠中期の羊膜から単離した羊膜上皮細胞のほうが,妊娠後期の羊膜上皮細胞よりも力価の高い子孫ウイルスを産生した.さらに,ウイルスとTIM1との結合を阻害する環状ペプチドであるデュラマイシンによりジカウイルスの感染は阻害された.これらの結果より,ジカウイルスの妊婦から胎児への垂直感染経路として,基底脱落膜から胎盤を介する経路,および,胎盤を介さずに壁脱落膜から感染する経路の2つの可能性があることが明らかにされた.また,TIM1を標的とすることによりジカウイルスの感染を抑制できることが考えられた.
ジカウイルスはフラビウイルス科に属し,蚊により媒介される.ほとんどの場合,感染しても症状がないか軽症ですむ.しかし,2007年にミクロネシア連邦のヤップ島,2013年にフランス領ポリネシアにおいて流行がはじまり,2015年以降,ブラジルを含む中南米やカリブ海において流行が持続し,流行地が急速に拡大している.さらには,ジカウイルスとGuillain-Barre症候群との関連も明らかにされた1,2).妊娠初期にジカウイルスに感染することにより胎児が感染し小頭症や重篤な脳障害などの先天性の異常が多発しており,流産,死産,胎児の発育の不全も報告されている3,4).胎児が小頭症と確認された妊婦の羊水や胎盤,小頭症により死亡した新生児の脳のグリア細胞やニューロンからはジカウイルスのRNAが検出されている4,5).しかし,ジカウイルスがどのような機序により胎盤さらには胎児に感染するのかについては解明されていない.
胎盤は母体と胎児のあいだの栄養および老廃物の輸送やガス交換を行うとともに,種々のホルモンや成長因子を産生しており,正常な胎児の発育において重要なはたらきを担う.胎盤は胎児に由来する絨毛膜絨毛および母体に由来する基底脱落膜から構成される.妊娠初期の絨毛膜は栄養膜細胞,絨毛の表面をおおう合胞体栄養細胞,絨毛間質から構成され,間質には胎児の血液が流れる.絨毛外性の栄養膜細胞は増殖して分化し,基底脱落膜のらせん動脈壁と置換するよう浸潤する(中間型の栄養細胞).妊娠15週ごろまでには,胎盤の発達にともない子宮の内面をおおう壁脱落膜は羊膜が融合した絨毛膜板と隣接するようになる.羊膜は羊水と胎児を包む一層の膜で,胎児の側は羊膜上皮細胞によりおおわれており,絨毛膜板には壁脱落膜へと浸潤する栄養膜細胞に分化する栄養芽細胞前駆細胞が存在する6).
フラビウイルス科のデングウイルスの細胞への侵入に必要な宿主のタンパク質としてTyro3,Axl,TIM1が同定されている7,8).TIM1はデングウイルス,西ナイルウイルス,エボラウイルスのエンベロープに存在するホスファチジルセリンおよびホスファチジルエタノールアミンと直接に結合する9).さらには,DC-SIGN,Axl,Tyro3,TIM1はジカウイルスの皮膚線維芽細胞,表皮角化細胞,未熟樹状細胞への侵入を促進し,とりわけAxlが重要な役割を担うことが報告された10).
ジカウイルスが胎盤に由来する初代培養細胞に感染するかどうか,羊膜上皮細胞,栄養芽細胞前駆細胞,絨毛間質の線維芽細胞,栄養膜細胞,血管内皮細胞にジカウイルスのプロトタイプ株を感染させたところ,すべての細胞においてウイルスのタンパク質であるEおよびNS3の発現がみられた.なかでも,羊膜上皮細胞は感染に対する感受性がもっとも高く,かつ,培養液にもっとも高力価の子孫ウイルスを産生した.さらに,羊膜上皮細胞は2016年にニカラグアにおいて分離された病原株にも容易に感染した.また,妊娠中期の羊膜から単離した羊膜上皮細胞のほうが妊娠後期の羊膜上皮細胞よりも高力価の子孫ウイルスを産生した.絨毛膜絨毛の組織片の器官培養においては,絨毛外性の栄養膜細胞および中間型の栄養膜細胞であるHofbauer細胞においてウイルスのタンパク質の発現がみられた.感染した絨毛外性の栄養膜細胞においては細胞増殖のマーカーであるKi67の発現が低下していた.以上の結果より,ジカウイルスのプロトタイプ株および病原株とも,妊娠中期および妊娠後期の胎盤に由来する初代培養細胞に対し感受性を示し,感染により絨毛外性の栄養膜細胞の増殖が阻害されることがわかった.
ジカウイルスは胎盤に由来する初代培養細胞に感染したことから,これらの細胞における感染に必要と考えられている宿主のタンパク質の発現についてイムノブロット法により検討した.感染に必要な宿主のタンパク質のうちTIM1の発現については,栄養膜細胞における発現はドナーあるいは細胞の分化の程度により異なり,分化につれて発現が減弱する傾向が認められた.羊膜上皮細胞の培養細胞においてはドナーあるいは妊娠時期に関係なく一貫して強く発現し,栄養芽細胞前駆細胞,絨毛間質の線維芽細胞,血管内皮細胞においては低程度から中程度に発現していた.一方,Axlの発現は細胞型,ドナー,細胞の分化の程度によりまちまちであり,栄養膜細胞においてはTIM1と異なり,分化につれて発現が強くなる傾向が認められた.また,妊娠後期の細胞を単離するまえの組織においては発現しておらず,培養により発現することがわかった.Tyro3の発現も細胞型,ドナー,細胞の分化の程度により異なり,羊膜上皮細胞には発現のみられない細胞もあった.
表皮角化細胞におけるジカウイルスの感染においてはAxlがもっとも重要であることから10),妊娠中期の脱落膜,胎盤,胎児膜の生検組織においてAxlの発現および局在を蛍光免疫染色法により検討した.Axlは基底脱落膜においては脱落膜細胞および脱落膜に深く浸潤した栄養膜細胞(中間型の栄養細胞)に発現していた.絨毛膜絨毛においてはHofbauer細胞,血管内皮細胞,絨毛間質の線維芽細胞,羊膜-絨毛膜板においては羊膜上皮細胞,栄養芽細胞前駆細胞に発現がみられた.
さらに,31例の妊娠中期および後期の組織のパラフィン切片を免疫染色した.Axlの発現は羊膜および絨毛において多様であり,妊娠後期の羊膜において発現は認められず,基底脱落膜および壁脱落膜において発現が認められた.Tyro3は羊膜上皮,基底脱落膜,壁脱落膜に発現していたが,絨毛膜絨毛において発現はみられなかった.一方,TIM1は妊娠期間をとわずすべての組織において一貫して強く発現していた.以上より,AxlおよびTyro3の発現はドナー,妊娠期間,組織における細胞の局在により異なることがわかった.
ジカウイルスはTyro3の発現とは関係なくAxlやTIM1を発現する絨毛膜絨毛あるいは羊膜-絨毛膜板に由来する細胞に感染したことから,AxlおよびTIM1が胎盤細胞へのジカウイルスの感染に必要な宿主のタンパク質として機能すると考えられた.しかし,Axlの発現は妊娠後期の羊膜の生検組織および培養のまえの組織において認められなかった.そこで,Axlの特異的な阻害剤であるR428がジカウイルスの感染を抑制するかどうか検討したところ,高濃度のR428により感染は40~50%ほど抑制された.
TIM1はすべての培養細胞およびすべてのドナーのどの組織においても広く発現していたことから,放線菌に由来する環状ペプチドであるデュラマイシンを用いてジカウイルスの感染を阻害することができるかどうか検討した.デュラマイシンはウイルスのエンベロープに存在するホスファチジルエタノールアミンと結合し,ジカウイルスともっとも近縁のデングウイルスがTIM1を発現する細胞に感染するのを阻害する.その結果,妊娠中期および妊娠後期の羊膜上皮細胞において,デュラマイシンはジカウイルスのプロトタイプ株の感染を強く阻害した.また,デュラマイシンはプロトタイプ株の栄養芽細胞前駆細胞,絨毛間質の線維芽細胞,血管内皮細胞への感染も阻害し,病原株の羊膜上皮細胞あるいは栄養膜細胞への感染も同様に阻害した.
デュラマイシンがin vivoに近い状態においてジカウイルスの感染に影響をおよぼすかどうかを検討した.デュラマイシンを処理したジカウイルスのプロトタイプ株を妊娠初期の絨毛膜絨毛の組織片に感染させたところ,デュラマイシンを処理しなかったジカウイルスの感染と比べ,子孫ウイルスの力価は95%以上も減少した.これらの結果より,デュラマイシンは妊娠中期および妊娠後期の胎盤の初代培養細胞におけるジカウイルスの感染を阻害するが,Axlの阻害剤による感染の阻害効果は低いことが示された.さらに,デュラマイシンは絨毛組織片へのジカウイルスの感染の阻害にも有効であった.
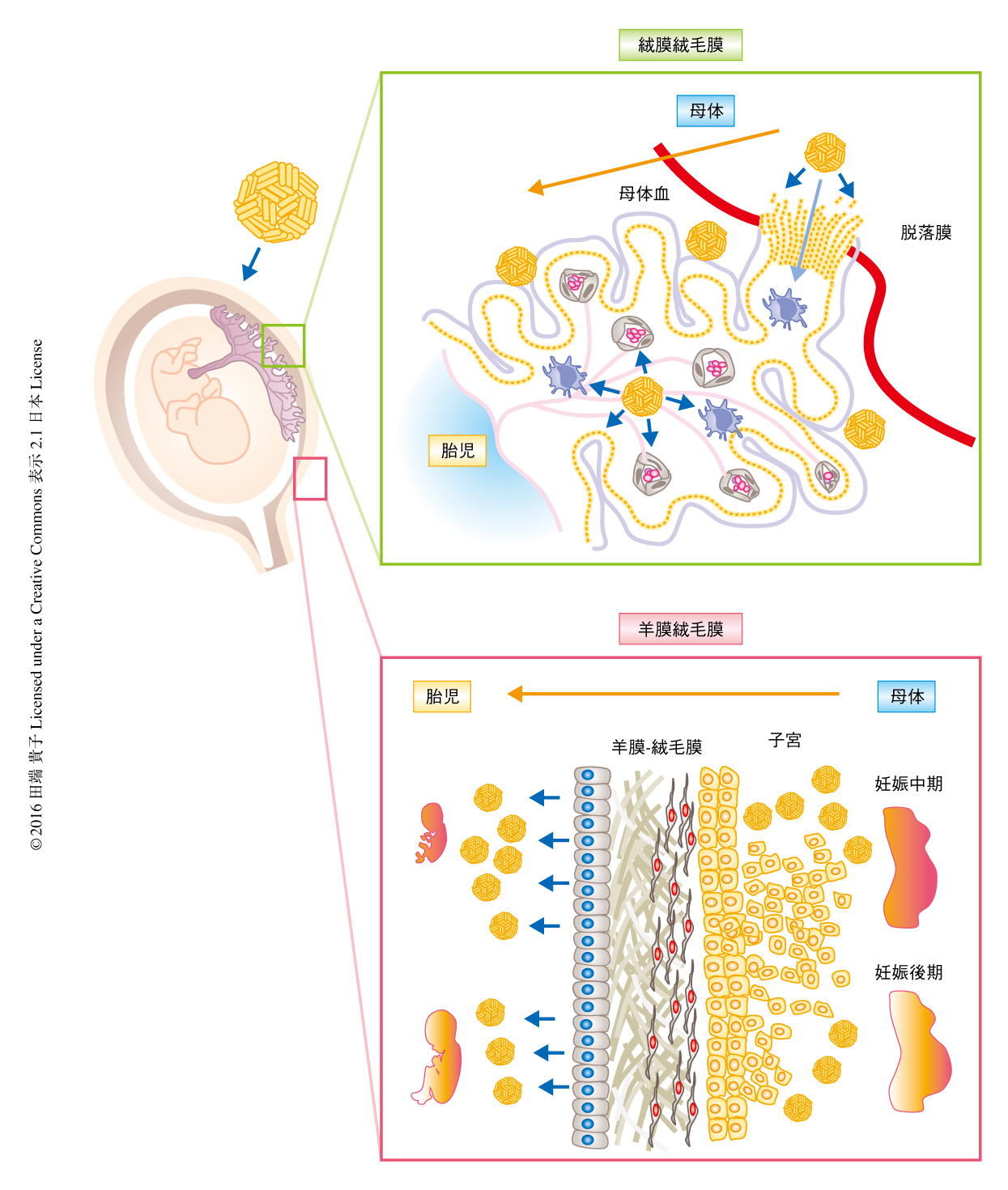
この研究により,ジカウイルスは胎盤から単離されたさまざまな細胞および胎盤組織に感染し子孫ウイルスを産生することがわかった.とくに,胎児をとりかこむ羊膜上皮細胞が感染しやすく,しかも,妊娠後期よりも妊娠中期においてより高力価の子孫ウイルスが産生された.このことから,妊婦が胎児の脳の発達においてもっとも重要な時期である妊娠初期から妊娠中期にジカウイルスに感染すると,胎児が羊水のより高力価のウイルスにさらされることが考えられた.感染した細胞の局在およびさまざまな細胞のウイルスに対する感受性から,ジカウイルスの感染経路は,妊娠初期においては子宮が隣接する胎盤に接する基底脱落膜から胎盤を介する経路であり,妊娠中期から妊娠後期においては胎盤を介さない経路,すなわち,子宮と胎児膜とが接触するようになる壁脱落膜から羊膜-絨毛膜板の栄養膜細胞,栄養芽細胞前駆細胞,羊膜上皮細胞などさまざまな細胞に感染することにより胎児へ感染が伝播する可能性が考えられた(図1).
組織片の器官培養の結果から,ジカウイルスの感染により栄養膜細胞の増殖が阻害されることが考えられた.栄養膜細胞の増殖の阻害により,栄養膜細胞の子宮への浸潤の阻害,胎児へ栄養を輸送する子宮のらせん動脈の置換の抑制につながる.その結果,ジカウイルスの感染において報告されている胎児の発育の不全につながることが示唆された.
さらには,胎盤細胞へのジカウイルスの感染においては宿主のタンパク質であるTIM1が重要な役割を担い,デュラマイシンは胎盤の細胞および組織へのジカウイルスの感染を効率よく阻害することが示された.TIM1はジカウイルスと同じフラビウイルス科に属する西ナイルウイルス,デングウイルス,さらには,フィロウイルス科に属するエボラウイルスの感染に必要な宿主のタンパク質であり,デュラマイシンはこれらのウイルスの感染を阻害することが報告されている9,11,12).デュラマイシンは一般的には動物薬として使われ,現在,膿疱性線維症の患者において臨床試験が行われている.今後,TIM1を標的とした新薬の開発,および,先天性の感染への広範囲での適用が期待される.また,ジカウイルスの先天性の感染の機序の解明や,抗ウイルス薬の効果の判定などに胎盤組織片の器官培養の系が有用となるであろう.
略歴:1999年 昭和大学大学院医学研究科にて博士号取得,2002年 米国California大学San Francisco校School of DentistryにてResearch Assistant,同Research Associateを経て,同Research Scientist.
研究テーマ:ジカウイルスおよびヒトサイトメガロウイルスの先天性の感染の機序.
© 2016 田端 貴子 Licensed under CC 表示 2.1 日本
(米国California大学San Francisco校School of Dentistry,Department of Cell and Tissue Biology)
email:田端貴子
DOI: 10.7875/first.author.2016.085
Zika virus targets different primary human placental cells, suggesting two routes for vertical transmission.
Takako Tabata, Matthew Petitt, Henry Puerta-Guardo, Daniela Michlmayr, Chunling Wang, June Fang-Hoover, Eva Harris, Lenore Pereira
Cell Host & Microbe, 20, 155-166 (2016)
要 約
妊婦へのジカウイルスへの感染と胎児の重篤な先天性の異常が関連づけられているが,ジカウイルスの母子感染の機序についてはほとんど解明されていない.今回,筆者らは,妊娠中期あるいは妊娠後期の胎盤に由来する初代培養細胞,および,妊娠初期の胎盤の絨毛膜絨毛の組織片に対しジカウイルスのプロトタイプ株および病原株の感染を試みた.ジカウイルスはウイルスの侵入に必要な宿主のタンパク質であるAxl,Tyro3,TIM1を発現する栄養膜細胞,血管内皮細胞,線維芽細胞,Hofbauer細胞,羊膜上皮細胞,栄養芽細胞前駆細胞,絨毛膜絨毛の組織片に感染し,ウイルスのタンパク質であるNS3およびEを発現した.また,妊娠中期の羊膜から単離した羊膜上皮細胞のほうが,妊娠後期の羊膜上皮細胞よりも力価の高い子孫ウイルスを産生した.さらに,ウイルスとTIM1との結合を阻害する環状ペプチドであるデュラマイシンによりジカウイルスの感染は阻害された.これらの結果より,ジカウイルスの妊婦から胎児への垂直感染経路として,基底脱落膜から胎盤を介する経路,および,胎盤を介さずに壁脱落膜から感染する経路の2つの可能性があることが明らかにされた.また,TIM1を標的とすることによりジカウイルスの感染を抑制できることが考えられた.
はじめに
ジカウイルスはフラビウイルス科に属し,蚊により媒介される.ほとんどの場合,感染しても症状がないか軽症ですむ.しかし,2007年にミクロネシア連邦のヤップ島,2013年にフランス領ポリネシアにおいて流行がはじまり,2015年以降,ブラジルを含む中南米やカリブ海において流行が持続し,流行地が急速に拡大している.さらには,ジカウイルスとGuillain-Barre症候群との関連も明らかにされた1,2).妊娠初期にジカウイルスに感染することにより胎児が感染し小頭症や重篤な脳障害などの先天性の異常が多発しており,流産,死産,胎児の発育の不全も報告されている3,4).胎児が小頭症と確認された妊婦の羊水や胎盤,小頭症により死亡した新生児の脳のグリア細胞やニューロンからはジカウイルスのRNAが検出されている4,5).しかし,ジカウイルスがどのような機序により胎盤さらには胎児に感染するのかについては解明されていない.
胎盤は母体と胎児のあいだの栄養および老廃物の輸送やガス交換を行うとともに,種々のホルモンや成長因子を産生しており,正常な胎児の発育において重要なはたらきを担う.胎盤は胎児に由来する絨毛膜絨毛および母体に由来する基底脱落膜から構成される.妊娠初期の絨毛膜は栄養膜細胞,絨毛の表面をおおう合胞体栄養細胞,絨毛間質から構成され,間質には胎児の血液が流れる.絨毛外性の栄養膜細胞は増殖して分化し,基底脱落膜のらせん動脈壁と置換するよう浸潤する(中間型の栄養細胞).妊娠15週ごろまでには,胎盤の発達にともない子宮の内面をおおう壁脱落膜は羊膜が融合した絨毛膜板と隣接するようになる.羊膜は羊水と胎児を包む一層の膜で,胎児の側は羊膜上皮細胞によりおおわれており,絨毛膜板には壁脱落膜へと浸潤する栄養膜細胞に分化する栄養芽細胞前駆細胞が存在する6).
フラビウイルス科のデングウイルスの細胞への侵入に必要な宿主のタンパク質としてTyro3,Axl,TIM1が同定されている7,8).TIM1はデングウイルス,西ナイルウイルス,エボラウイルスのエンベロープに存在するホスファチジルセリンおよびホスファチジルエタノールアミンと直接に結合する9).さらには,DC-SIGN,Axl,Tyro3,TIM1はジカウイルスの皮膚線維芽細胞,表皮角化細胞,未熟樹状細胞への侵入を促進し,とりわけAxlが重要な役割を担うことが報告された10).
1.ジカウイルスは妊娠中期および妊娠後期の胎盤に由来する初代培養細胞と妊娠初期の胎盤の絨毛膜絨毛の組織片に感染する
ジカウイルスが胎盤に由来する初代培養細胞に感染するかどうか,羊膜上皮細胞,栄養芽細胞前駆細胞,絨毛間質の線維芽細胞,栄養膜細胞,血管内皮細胞にジカウイルスのプロトタイプ株を感染させたところ,すべての細胞においてウイルスのタンパク質であるEおよびNS3の発現がみられた.なかでも,羊膜上皮細胞は感染に対する感受性がもっとも高く,かつ,培養液にもっとも高力価の子孫ウイルスを産生した.さらに,羊膜上皮細胞は2016年にニカラグアにおいて分離された病原株にも容易に感染した.また,妊娠中期の羊膜から単離した羊膜上皮細胞のほうが妊娠後期の羊膜上皮細胞よりも高力価の子孫ウイルスを産生した.絨毛膜絨毛の組織片の器官培養においては,絨毛外性の栄養膜細胞および中間型の栄養膜細胞であるHofbauer細胞においてウイルスのタンパク質の発現がみられた.感染した絨毛外性の栄養膜細胞においては細胞増殖のマーカーであるKi67の発現が低下していた.以上の結果より,ジカウイルスのプロトタイプ株および病原株とも,妊娠中期および妊娠後期の胎盤に由来する初代培養細胞に対し感受性を示し,感染により絨毛外性の栄養膜細胞の増殖が阻害されることがわかった.
2.胎盤に由来する初代培養細胞におけるジカウイルスの感染に必要な宿主のタンパク質の発現
ジカウイルスは胎盤に由来する初代培養細胞に感染したことから,これらの細胞における感染に必要と考えられている宿主のタンパク質の発現についてイムノブロット法により検討した.感染に必要な宿主のタンパク質のうちTIM1の発現については,栄養膜細胞における発現はドナーあるいは細胞の分化の程度により異なり,分化につれて発現が減弱する傾向が認められた.羊膜上皮細胞の培養細胞においてはドナーあるいは妊娠時期に関係なく一貫して強く発現し,栄養芽細胞前駆細胞,絨毛間質の線維芽細胞,血管内皮細胞においては低程度から中程度に発現していた.一方,Axlの発現は細胞型,ドナー,細胞の分化の程度によりまちまちであり,栄養膜細胞においてはTIM1と異なり,分化につれて発現が強くなる傾向が認められた.また,妊娠後期の細胞を単離するまえの組織においては発現しておらず,培養により発現することがわかった.Tyro3の発現も細胞型,ドナー,細胞の分化の程度により異なり,羊膜上皮細胞には発現のみられない細胞もあった.
3.組織におけるジカウイルスの感染に必要な宿主のタンパク質の発現
表皮角化細胞におけるジカウイルスの感染においてはAxlがもっとも重要であることから10),妊娠中期の脱落膜,胎盤,胎児膜の生検組織においてAxlの発現および局在を蛍光免疫染色法により検討した.Axlは基底脱落膜においては脱落膜細胞および脱落膜に深く浸潤した栄養膜細胞(中間型の栄養細胞)に発現していた.絨毛膜絨毛においてはHofbauer細胞,血管内皮細胞,絨毛間質の線維芽細胞,羊膜-絨毛膜板においては羊膜上皮細胞,栄養芽細胞前駆細胞に発現がみられた.
さらに,31例の妊娠中期および後期の組織のパラフィン切片を免疫染色した.Axlの発現は羊膜および絨毛において多様であり,妊娠後期の羊膜において発現は認められず,基底脱落膜および壁脱落膜において発現が認められた.Tyro3は羊膜上皮,基底脱落膜,壁脱落膜に発現していたが,絨毛膜絨毛において発現はみられなかった.一方,TIM1は妊娠期間をとわずすべての組織において一貫して強く発現していた.以上より,AxlおよびTyro3の発現はドナー,妊娠期間,組織における細胞の局在により異なることがわかった.
4.TIM1の阻害ペプチドはジカウイルスの胎盤に由来する細胞への感染を阻害し絨毛膜絨毛の組織片への感染を減弱する
ジカウイルスはTyro3の発現とは関係なくAxlやTIM1を発現する絨毛膜絨毛あるいは羊膜-絨毛膜板に由来する細胞に感染したことから,AxlおよびTIM1が胎盤細胞へのジカウイルスの感染に必要な宿主のタンパク質として機能すると考えられた.しかし,Axlの発現は妊娠後期の羊膜の生検組織および培養のまえの組織において認められなかった.そこで,Axlの特異的な阻害剤であるR428がジカウイルスの感染を抑制するかどうか検討したところ,高濃度のR428により感染は40~50%ほど抑制された.
TIM1はすべての培養細胞およびすべてのドナーのどの組織においても広く発現していたことから,放線菌に由来する環状ペプチドであるデュラマイシンを用いてジカウイルスの感染を阻害することができるかどうか検討した.デュラマイシンはウイルスのエンベロープに存在するホスファチジルエタノールアミンと結合し,ジカウイルスともっとも近縁のデングウイルスがTIM1を発現する細胞に感染するのを阻害する.その結果,妊娠中期および妊娠後期の羊膜上皮細胞において,デュラマイシンはジカウイルスのプロトタイプ株の感染を強く阻害した.また,デュラマイシンはプロトタイプ株の栄養芽細胞前駆細胞,絨毛間質の線維芽細胞,血管内皮細胞への感染も阻害し,病原株の羊膜上皮細胞あるいは栄養膜細胞への感染も同様に阻害した.
デュラマイシンがin vivoに近い状態においてジカウイルスの感染に影響をおよぼすかどうかを検討した.デュラマイシンを処理したジカウイルスのプロトタイプ株を妊娠初期の絨毛膜絨毛の組織片に感染させたところ,デュラマイシンを処理しなかったジカウイルスの感染と比べ,子孫ウイルスの力価は95%以上も減少した.これらの結果より,デュラマイシンは妊娠中期および妊娠後期の胎盤の初代培養細胞におけるジカウイルスの感染を阻害するが,Axlの阻害剤による感染の阻害効果は低いことが示された.さらに,デュラマイシンは絨毛組織片へのジカウイルスの感染の阻害にも有効であった.
おわりに
この研究により,ジカウイルスは胎盤から単離されたさまざまな細胞および胎盤組織に感染し子孫ウイルスを産生することがわかった.とくに,胎児をとりかこむ羊膜上皮細胞が感染しやすく,しかも,妊娠後期よりも妊娠中期においてより高力価の子孫ウイルスが産生された.このことから,妊婦が胎児の脳の発達においてもっとも重要な時期である妊娠初期から妊娠中期にジカウイルスに感染すると,胎児が羊水のより高力価のウイルスにさらされることが考えられた.感染した細胞の局在およびさまざまな細胞のウイルスに対する感受性から,ジカウイルスの感染経路は,妊娠初期においては子宮が隣接する胎盤に接する基底脱落膜から胎盤を介する経路であり,妊娠中期から妊娠後期においては胎盤を介さない経路,すなわち,子宮と胎児膜とが接触するようになる壁脱落膜から羊膜-絨毛膜板の栄養膜細胞,栄養芽細胞前駆細胞,羊膜上皮細胞などさまざまな細胞に感染することにより胎児へ感染が伝播する可能性が考えられた(図1).
組織片の器官培養の結果から,ジカウイルスの感染により栄養膜細胞の増殖が阻害されることが考えられた.栄養膜細胞の増殖の阻害により,栄養膜細胞の子宮への浸潤の阻害,胎児へ栄養を輸送する子宮のらせん動脈の置換の抑制につながる.その結果,ジカウイルスの感染において報告されている胎児の発育の不全につながることが示唆された.
さらには,胎盤細胞へのジカウイルスの感染においては宿主のタンパク質であるTIM1が重要な役割を担い,デュラマイシンは胎盤の細胞および組織へのジカウイルスの感染を効率よく阻害することが示された.TIM1はジカウイルスと同じフラビウイルス科に属する西ナイルウイルス,デングウイルス,さらには,フィロウイルス科に属するエボラウイルスの感染に必要な宿主のタンパク質であり,デュラマイシンはこれらのウイルスの感染を阻害することが報告されている9,11,12).デュラマイシンは一般的には動物薬として使われ,現在,膿疱性線維症の患者において臨床試験が行われている.今後,TIM1を標的とした新薬の開発,および,先天性の感染への広範囲での適用が期待される.また,ジカウイルスの先天性の感染の機序の解明や,抗ウイルス薬の効果の判定などに胎盤組織片の器官培養の系が有用となるであろう.
文 献
- Sarno, M., Sacramento, G. A., Khouri, R. et al.: Zika virus infection and stillbirths: a case of hydrops fetalis, hydranencephaly and fetal demise. PLoS Negl. Trop. Dis., 10, e0004517 (2016)[PubMed]
- Cao-Lormeau, V. M., Blake, A., Mons, S. et al.: Guillain-Barre Syndrome outbreak associated with Zika virus infection in French Polynesia: a case-control study. Lancet, 387, 1531-1539 (2016)[PubMed]
- Brasil, P., Pereira, J. P. Jr., Raja Gabaglia, C. et al.: Zika virus infection in pregnant women in Rio de Janeiro: preliminary report. N. Engl. J. Med., 375, 2321-2334 (2016)[PubMed]
- Mlakar, J., Korva, M., Tul, N. et al.: Zika virus associated with microcephaly. N. Engl. J. Med., 374, 951-958 (2016)[PubMed]
- Rasmussen, S. A., Jamieson, D. J., Honein, M. A. et al.: Zika virus and birth defects: reviewing the evidence for causality. N. Engl. J. Med., 374, 1981-1987 (2016)[PubMed]
- Genbacev, O., Vicovac, L. & Larocque, N.: The role of chorionic cytotrophoblasts in the smooth chorion fusion with parietal decidua. Placenta, 36, 716-722 (2015)[PubMed]
- Meertens, L., Carnec, X., Lecoin, M. P. et al.: The TIM and TAM families of phosphatidylserine receptors mediate dengue virus entry. Cell Host Microbe, 12, 544-557 (2012)[PubMed]
- Perera-Lecoin, M., Meertens, L., Carnec, X. et al.: Flavivirus entry receptors: an update. Viruses, 6, 69-88 (2014)[PubMed]
- Richard, A. S., Zhang, A., Park, S. J. et al.: Virion-associated phosphatidylethanolamine promotes TIM1-mediated infection by Ebola, dengue, and West Nile viruses. Proc. Natl. Acad. Sci. USA, 112, 14682-14687 (2015)[PubMed]
- Hamel, R., Dejarnac, O., Wichit, S. et al.: Biology of Zika virus infection in human skin cells. J. Virol., 89, 8880-8896 (2015)[PubMed]
- Kondratowicz, A..S., Lennemann, N. J., Sinn, P. L. et al.: T-cell immunoglobulin and mucin domain 1 (TIM-1) is a receptor for Zaire Ebolavirus and Lake Victoria Marburgvirus. Proc. Natl. Acad. Sci. USA, 108, 8426-8431 (2011)[PubMed]
- Moller-Tank, S., Kondratowicz, A. S., Davey, R. A. et al.: Role of the phosphatidylserine receptor TIM-1 in enveloped-virus entry. J. Virol., 87, 8327-8341 (2013)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:1999年 昭和大学大学院医学研究科にて博士号取得,2002年 米国California大学San Francisco校School of DentistryにてResearch Assistant,同Research Associateを経て,同Research Scientist.
研究テーマ:ジカウイルスおよびヒトサイトメガロウイルスの先天性の感染の機序.
© 2016 田端 貴子 Licensed under CC 表示 2.1 日本