ヒストン脱アセチル化酵素HDAC6の結晶構造から明らかにされたチューブリンに対する特異性および選択的な阻害剤との結合
三宅康之・Patrick Matthias
(スイスFriedrich Miescher Institute for Biomedical Research)
email:三宅康之
DOI: 10.7875/first.author.2016.083
Structural insights into HDAC6 tubulin deacetylation and its selective inhibition.
Yasuyuki Miyake, Jeremy J. Keusch, Longlong Wang, Makoto Saito, Daniel Hess, Xiaoning Wang, Bruce J. Melancon, Paul Helquist, Heinz Gut, Patrick Matthias
Nature Chemical Biology, 12, 748-754 (2016)
ヒストン脱アセチル化酵素のひとつであるHDAC6は,タンデムにならんだ2つの触媒ドメインをもつ.筆者らは,HDAC6をその阻害剤であるTrichostatin AあるいはNexturastat Aとの複合体として,2つの触媒ドメインおよびそれぞれの触媒ドメインのX線結晶構造を明らかにした.2つの触媒ドメインはリンカーとともに擬2回転対称性をもつ複合体を形成していた.さらに,2つの触媒ドメインそれぞれのもつ活性部位の重要な相違点および選択的な阻害剤との結合の様式が明らかされ,HDAC6に特徴的なαヘリックスおよびTrpを含むループがチューブリンの脱アセチル化において重要であることが示された.また,Trichostatin Aを用いた脱アセチル化活性の阻害実験により,(R)-Trichostatin Aは広範な阻害剤としてはたらく一方,その光学異性体である (S)-Trichostatin AはHDAC6に対しわずかに高い選択性を示すことが明らかにされた.in vitroにおける1分子解析および生化学的な解析により,HDAC6は微小管を形成するチューブリンを脱アセチル化することが示されたが,HDAC6は微小管を形成するチューブリンよりも脱重合した遊離のチューブリンを効率よく脱アセチル化した.
ヒストンやそのほかのタンパク質のもつLysのアセチル化は,タンパク質の機能にさまざまな影響をおよぼす主要な翻訳後修飾として知られている.アセチル化のレベルはアセチル化酵素と脱アセチル化酵素のバランスにより制御される.ヒストン脱アセチル化酵素のひとつであるHDAC6はおもにチューブリンを脱アセチル化することが知られているが,ほかにもHSP90やCortactinなどの脱アセチル化に関与する.また,ほかのヒストン脱アセチル化酵素とは異なり,おもに細胞質に局在し,タンデムにならんだ2つの触媒ドメインをもち,C末端側には遊離のユビキチンと直接に結合するZnF-UBPドメインがあるという非常にユニークな特徴をもつ.HDAC6はストレス応答やオートファジーにおいて中心的な役割をはたし,アグリソームやストレス顆粒の形成に必須である.ほかにも,制御性T細胞,また,インフルエンザウイルスの感染,がん,炎症,神経の変性といった病因において重要な役割を担うと考えられている1,2).
微小管はαチューブリンおよびβチューブリンのヘテロ二量体からなり,細胞周期,細胞骨格,細胞運動,細胞内物質輸送といったさまざまな細胞機能にかかわる動的な細胞骨格である.微小管はその安定性や機能を制御すると考えられるアセチル化,グルタミル化,チロシン化,リン酸化を含むさまざまな翻訳後修飾をうける.αTATは微小管を形成するαチューブリンのLys40を標的にする唯一のアセチル化酵素である.αTATは遊離のチューブリンヘテロ二量体よりむしろ微小管を形成するαチューブリンを効率よくアセチル化し,最近,この反応は確率論的に起こることが明らかにされた3).一方,チューブリンの脱アセチル化はHDAC6およびNAD依存性クラスIII脱アセチル化酵素に属するSIRT2によることが知られている.HDAC6とSIRT2は相互作用し協調して機能しているのかもしれないが,HDAC6の発現量の低下はチューブリンのアセチル化のレベルを有意に上昇させ,また,HDAC6を欠失した細胞のチューブリンは高度にアセチル化されることから,HDAC6がチューブリンの主要な脱アセチル化酵素であると考えられる.HDAC6はほかにも微小管結合タンパク質であるEB1やArp1と相互作用することが報告されており4),微小管の末端からチューブリンを脱アセチル化する可能性が示唆されているが,これまで,HDAC6が基質としてどのような状態のチューブリンを好むのかは明らかにされていない.
ヒストン脱アセチル化酵素は11種類のファミリータンパク質からなることが知られており,そのいくつかはがんといった病因の標的となっている.本質的に重要なヒストン脱アセチル化酵素の同定にはいたっていないが,すでに4つのヒストン脱アセチル化酵素の阻害剤ががんの治療薬として承認されている.最近,HDAC6は多発性骨髄腫の治療において標的になると考えられており,現在,HDAC6の選択的な阻害剤のひとつであるricolinostat(ACY-1215)の臨床試験が行われている5).
この研究においては,X線結晶構造解析によりHDAC6の全体の構造および選択的な阻害剤の結合の様式を明らかにし,なぜHDAC6が特異的にチューブリンを脱アセチル化するのかを検証した.
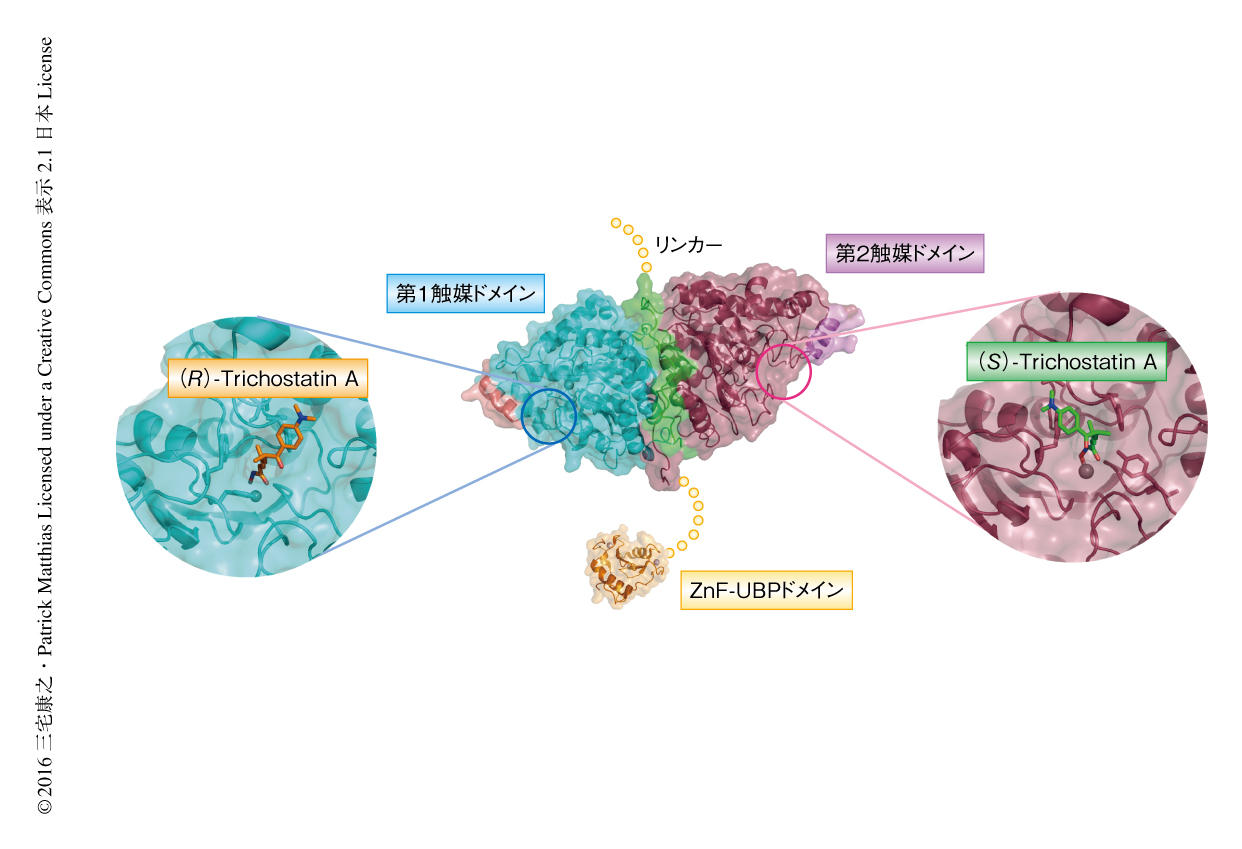
当初,マウスに由来するHDAC6の精製および結晶化を試みたが,タンパク質の安定性が悪く精製は困難であった.そこで,ゼブラフィッシュに由来するHDAC6の精製および結晶化を試みた.その結果,HDAC6の選択的な阻害剤であるNexturastat Aと結合したタンデムにならんだ第1触媒ドメインおよび第2触媒ドメインのX線結晶構造(PDB ID:5G0J),ヒストン脱アセチル化酵素の阻害剤であるTrichostatin Aと結合した第1触媒ドメインのX線結晶構造(PDB ID:5G0G)および第2触媒ドメインのX線結晶構造(PDB ID:5G0H),C末端側にあるユビキチン結合活性をもつZnF-UBPドメインのX線結晶構造(PDB ID:5G0F)が明らかにされた(図1).ヒストン脱アセチル化酵素としての基本的な骨格はほかのヒストン脱アセチル化酵素と同様によく保存されていたが,タンデムにならんだ2つの触媒ドメインは互いに接しており,そのリンカーはジッパーを閉じたように外側に配置され,活性部位を外側にむけ擬2回転対称性をとっていた.このリンカーは細胞内モータータンパク質との結合領域であると報告されており6),タンパク質の表面に配置していたことは合理的と考えられた.さらに,リンカーが相互作用する表面のアミノ酸残基の保存性は高かった.また,2つの触媒ドメインは非常によく似た構造をしていた.構造をとりにくい可変な領域をはさみC末端側に存在するZnF-UBPドメインには3つのZn2+が配位し,ヒトのHDAC6のもつZnF-UBPドメイン7) と同様の構造をとっていた.
生化学的な解析により,チューブリンの脱アセチル化は第2触媒ドメインのみで十分であるが,第1触媒ドメインを失うとその脱アセチル化の効率は低下することが明らかにされた.また,第1触媒ドメインもわずかに活性をもっていた.2つの触媒ドメインそれぞれの表面の電荷の違いからも基質に対する特異性の違いが想定され,第1触媒ドメインには未知の基質の存在が予想された.
これまで,HDAC6の構造は明らかにされていなかったものの多くの選択的な阻害剤が開発されている.偶然にも,HDAC6の結晶において第1触媒ドメインには (R)-Trichostatin Aが,第2触媒ドメインにはその光学異性体である (S)-Trichostatin Aが結合していた(図1).これまで,(S)-Trichostatin Aは生物学的に不活性であると報告されていたが8),(S)-Trichostatin Aと結合した結晶構造が得られたことから,(R)-Trichostatin Aおよび (S)-Trichostatin Aを精製しその生物学的な阻害の効果について再検証した.その結果,(R)-Trichostatin Aはどのヒストン脱アセチル化酵素に対しても広く阻害を示したのに対し,(S)-Trichostatin AはHDAC6に対しわずかに高い選択性を示した.
HDAC6の選択的な阻害剤のひとつであるNexturastat Aとの複合体としてHDAC6のX線結晶構造が明らかにされた.HDAC6はゼブラフィッシュとヒトとで高い保存性を示すため,そのホモロジーモデリングが有効である.とくに,(S)-Trichostatin AおよびNexturastat Aと相互作用する活性部位に存在するアミノ酸残基が完全に保存されていたことは,HDAC6の選択的な阻害剤の設計において重要な情報になる.これまでに構造解析がなされたすべてのヒストン脱アセチル化酵素と重ね合わせることにより,阻害剤の選択性に影響をおよぼすと考えられる重要な違いが見い出された.すなわち,HDAC6のみがもつαへリックスであるヘリックス25とそれにつづくループは14Åの広いくぼみを形成しており,Nexturastat Aとの結合において選択性を上昇させていた.今後,HDAC6の結晶構造をもとにした,新たなHDAC6の選択的な阻害剤の設計が望まれる.
11種類が存在するヒストン脱アセチル化酵素のなかで,なぜHDAC6だけがチューブリンを脱アセチル化するのだろうか? HDAC6のもつ2つの触媒ドメインに特徴的な構造を比較することにより,第1触媒ドメインにおいてヘリックス1とヘリックス2とのあいだのループに含まれるTrp78およびヘリックス6,第2触媒ドメインにおいてヘリックス20とヘリックス21とのあいだのループに含まれるTrp459およびへリックス25が,基質の認識において重要であろうと推測された.そこで,これらのTrpの変異体,および,これらのへリックスをHDAC8の同じ領域(HDAC8においてへリックスはなくループになっている)と置換した変異体を作製し,マウスに由来するHDAC6ノックアウト細胞の細胞抽出液にくわえチューブリンの脱アセチル化活性を測定した.その結果,第1触媒ドメインに変異をもつ変異体の活性に違いはなかったが,第2触媒ドメインに変異をもつ変異体は活性が大きく損なわれていた.これらの変異体は低分子の基質を用いた脱アセチル化活性の測定においては正常であったことから,第2触媒ドメインに存在するTrp459およびヘリックス25がチューブリンの認識において重要であると考えられた.
最近,チューブリンのアセチル化酵素としてαTATが同定され,その構造および機能の解析によりαTATが微小管を形成するαチューブリンのLys40をアセチル化する機構が明らかにされた3).しかし,微小管を形成するチューブリンのHDAC6による脱アセチル化の詳細については不明であった.そこで,精製したHDAC6の触媒ドメインをチューブリンを高度にアセチル化させた微小管とin vitroにおいて反応させることによりその詳細を調べた.その結果,αTATと同様に,HDAC6は微小管の内部に自由拡散により入り込み,ランダムにチューブリンを脱アセチル化することが示された.さらに,微小管を形成するチューブリンと脱重合した遊離のチューブリンとを比較したところ,HDAC6による脱アセチル化活性は,脱重合した遊離のチューブリンに対するほうが約2.5倍も高かった.このことから,細胞においてダイナミックに変化する微小管においては,チューブリンは脱重合した際にHDAC6によりすみやかに脱アセチル化されリセットされることが示された.微小管におけるチューブリンのアセチル化の状態は微小管の安定性との関連が示唆されているが,その詳細は不明であった.今回の結果により,安定に存在する微小管を形成するチューブリンは高アセチル化状態になりやすく,微小管のカタストロフによりチューブリンが脱重合した場合,HDAC6によりすみやかに脱アセチル化されることによりチューブリンのアセチル化の状態がリセットされる可能性が考えられた(図2).
HDAC6は細胞質に局在し,その主要な基質は細胞骨格を構成するチューブリンであり,ストレス応答タンパク質であると考えられている.とくに,神経変性疾患やインフルエンザウイルスの感染において重要な役割をはたしており,ほかにもさまざまな疾患にかかわる可能性が高いと考えられる.HDAC6の発現の異常によりひき起こされるヒトの疾患として軟骨異形成が報告されており9),HDAC6ノックアウトマウスでは骨の形成のわずかな異常が観察されている10).このように,HDAC6は多彩な生命現象に関与するため,現在も世界的にその選択的な阻害剤の開発が活発に進められている.今回の結晶構造解析の結果を基盤に,特異的な阻害剤をはじめとするさらなる新しい分子の設計および開発につながることが期待される.また,HDAC6がチューブリンを脱アセチル化する生物学的な分子機構が明らかにされた点も興味深い.
略歴:2006年 大阪大学大学院医学系研究科 修了,同年 京都大学大学院生命科学研究科 博士研究員,2010年 スイスFriedrich Miescher Institute for Biomedical Researchにて博士研究員を経て,2016年より信州大学医学部 研究員.
研究テーマ:疾患に関連する遺伝子の探索およびその機能の解析.
抱負:疾患に関連するタンパク質の解析をつうじ創薬に結びつけたい.
関心事:子育てと研究の両立は可能か? ポスドクは一生つづけられるか?
Patrick Matthias
スイスFriedrich Miescher Institute for Biomedical ResearchにてSenior Group Leader.
研究室URL:http://www.fmi.ch/research/groupleader/?group=21
© 2016 三宅康之・Patrick Matthias Licensed under CC 表示 2.1 日本
(スイスFriedrich Miescher Institute for Biomedical Research)
email:三宅康之
DOI: 10.7875/first.author.2016.083
Structural insights into HDAC6 tubulin deacetylation and its selective inhibition.
Yasuyuki Miyake, Jeremy J. Keusch, Longlong Wang, Makoto Saito, Daniel Hess, Xiaoning Wang, Bruce J. Melancon, Paul Helquist, Heinz Gut, Patrick Matthias
Nature Chemical Biology, 12, 748-754 (2016)
要 約
ヒストン脱アセチル化酵素のひとつであるHDAC6は,タンデムにならんだ2つの触媒ドメインをもつ.筆者らは,HDAC6をその阻害剤であるTrichostatin AあるいはNexturastat Aとの複合体として,2つの触媒ドメインおよびそれぞれの触媒ドメインのX線結晶構造を明らかにした.2つの触媒ドメインはリンカーとともに擬2回転対称性をもつ複合体を形成していた.さらに,2つの触媒ドメインそれぞれのもつ活性部位の重要な相違点および選択的な阻害剤との結合の様式が明らかされ,HDAC6に特徴的なαヘリックスおよびTrpを含むループがチューブリンの脱アセチル化において重要であることが示された.また,Trichostatin Aを用いた脱アセチル化活性の阻害実験により,(R)-Trichostatin Aは広範な阻害剤としてはたらく一方,その光学異性体である (S)-Trichostatin AはHDAC6に対しわずかに高い選択性を示すことが明らかにされた.in vitroにおける1分子解析および生化学的な解析により,HDAC6は微小管を形成するチューブリンを脱アセチル化することが示されたが,HDAC6は微小管を形成するチューブリンよりも脱重合した遊離のチューブリンを効率よく脱アセチル化した.
はじめに
ヒストンやそのほかのタンパク質のもつLysのアセチル化は,タンパク質の機能にさまざまな影響をおよぼす主要な翻訳後修飾として知られている.アセチル化のレベルはアセチル化酵素と脱アセチル化酵素のバランスにより制御される.ヒストン脱アセチル化酵素のひとつであるHDAC6はおもにチューブリンを脱アセチル化することが知られているが,ほかにもHSP90やCortactinなどの脱アセチル化に関与する.また,ほかのヒストン脱アセチル化酵素とは異なり,おもに細胞質に局在し,タンデムにならんだ2つの触媒ドメインをもち,C末端側には遊離のユビキチンと直接に結合するZnF-UBPドメインがあるという非常にユニークな特徴をもつ.HDAC6はストレス応答やオートファジーにおいて中心的な役割をはたし,アグリソームやストレス顆粒の形成に必須である.ほかにも,制御性T細胞,また,インフルエンザウイルスの感染,がん,炎症,神経の変性といった病因において重要な役割を担うと考えられている1,2).
微小管はαチューブリンおよびβチューブリンのヘテロ二量体からなり,細胞周期,細胞骨格,細胞運動,細胞内物質輸送といったさまざまな細胞機能にかかわる動的な細胞骨格である.微小管はその安定性や機能を制御すると考えられるアセチル化,グルタミル化,チロシン化,リン酸化を含むさまざまな翻訳後修飾をうける.αTATは微小管を形成するαチューブリンのLys40を標的にする唯一のアセチル化酵素である.αTATは遊離のチューブリンヘテロ二量体よりむしろ微小管を形成するαチューブリンを効率よくアセチル化し,最近,この反応は確率論的に起こることが明らかにされた3).一方,チューブリンの脱アセチル化はHDAC6およびNAD依存性クラスIII脱アセチル化酵素に属するSIRT2によることが知られている.HDAC6とSIRT2は相互作用し協調して機能しているのかもしれないが,HDAC6の発現量の低下はチューブリンのアセチル化のレベルを有意に上昇させ,また,HDAC6を欠失した細胞のチューブリンは高度にアセチル化されることから,HDAC6がチューブリンの主要な脱アセチル化酵素であると考えられる.HDAC6はほかにも微小管結合タンパク質であるEB1やArp1と相互作用することが報告されており4),微小管の末端からチューブリンを脱アセチル化する可能性が示唆されているが,これまで,HDAC6が基質としてどのような状態のチューブリンを好むのかは明らかにされていない.
ヒストン脱アセチル化酵素は11種類のファミリータンパク質からなることが知られており,そのいくつかはがんといった病因の標的となっている.本質的に重要なヒストン脱アセチル化酵素の同定にはいたっていないが,すでに4つのヒストン脱アセチル化酵素の阻害剤ががんの治療薬として承認されている.最近,HDAC6は多発性骨髄腫の治療において標的になると考えられており,現在,HDAC6の選択的な阻害剤のひとつであるricolinostat(ACY-1215)の臨床試験が行われている5).
この研究においては,X線結晶構造解析によりHDAC6の全体の構造および選択的な阻害剤の結合の様式を明らかにし,なぜHDAC6が特異的にチューブリンを脱アセチル化するのかを検証した.
1.HDAC6の全体の構造
当初,マウスに由来するHDAC6の精製および結晶化を試みたが,タンパク質の安定性が悪く精製は困難であった.そこで,ゼブラフィッシュに由来するHDAC6の精製および結晶化を試みた.その結果,HDAC6の選択的な阻害剤であるNexturastat Aと結合したタンデムにならんだ第1触媒ドメインおよび第2触媒ドメインのX線結晶構造(PDB ID:5G0J),ヒストン脱アセチル化酵素の阻害剤であるTrichostatin Aと結合した第1触媒ドメインのX線結晶構造(PDB ID:5G0G)および第2触媒ドメインのX線結晶構造(PDB ID:5G0H),C末端側にあるユビキチン結合活性をもつZnF-UBPドメインのX線結晶構造(PDB ID:5G0F)が明らかにされた(図1).ヒストン脱アセチル化酵素としての基本的な骨格はほかのヒストン脱アセチル化酵素と同様によく保存されていたが,タンデムにならんだ2つの触媒ドメインは互いに接しており,そのリンカーはジッパーを閉じたように外側に配置され,活性部位を外側にむけ擬2回転対称性をとっていた.このリンカーは細胞内モータータンパク質との結合領域であると報告されており6),タンパク質の表面に配置していたことは合理的と考えられた.さらに,リンカーが相互作用する表面のアミノ酸残基の保存性は高かった.また,2つの触媒ドメインは非常によく似た構造をしていた.構造をとりにくい可変な領域をはさみC末端側に存在するZnF-UBPドメインには3つのZn2+が配位し,ヒトのHDAC6のもつZnF-UBPドメイン7) と同様の構造をとっていた.
生化学的な解析により,チューブリンの脱アセチル化は第2触媒ドメインのみで十分であるが,第1触媒ドメインを失うとその脱アセチル化の効率は低下することが明らかにされた.また,第1触媒ドメインもわずかに活性をもっていた.2つの触媒ドメインそれぞれの表面の電荷の違いからも基質に対する特異性の違いが想定され,第1触媒ドメインには未知の基質の存在が予想された.
2.HDAC6の選択的な阻害剤の開発
これまで,HDAC6の構造は明らかにされていなかったものの多くの選択的な阻害剤が開発されている.偶然にも,HDAC6の結晶において第1触媒ドメインには (R)-Trichostatin Aが,第2触媒ドメインにはその光学異性体である (S)-Trichostatin Aが結合していた(図1).これまで,(S)-Trichostatin Aは生物学的に不活性であると報告されていたが8),(S)-Trichostatin Aと結合した結晶構造が得られたことから,(R)-Trichostatin Aおよび (S)-Trichostatin Aを精製しその生物学的な阻害の効果について再検証した.その結果,(R)-Trichostatin Aはどのヒストン脱アセチル化酵素に対しても広く阻害を示したのに対し,(S)-Trichostatin AはHDAC6に対しわずかに高い選択性を示した.
HDAC6の選択的な阻害剤のひとつであるNexturastat Aとの複合体としてHDAC6のX線結晶構造が明らかにされた.HDAC6はゼブラフィッシュとヒトとで高い保存性を示すため,そのホモロジーモデリングが有効である.とくに,(S)-Trichostatin AおよびNexturastat Aと相互作用する活性部位に存在するアミノ酸残基が完全に保存されていたことは,HDAC6の選択的な阻害剤の設計において重要な情報になる.これまでに構造解析がなされたすべてのヒストン脱アセチル化酵素と重ね合わせることにより,阻害剤の選択性に影響をおよぼすと考えられる重要な違いが見い出された.すなわち,HDAC6のみがもつαへリックスであるヘリックス25とそれにつづくループは14Åの広いくぼみを形成しており,Nexturastat Aとの結合において選択性を上昇させていた.今後,HDAC6の結晶構造をもとにした,新たなHDAC6の選択的な阻害剤の設計が望まれる.
3.HDAC6は微小管を形成するチューブリンより遊離のチューブリンに対する活性が高い
11種類が存在するヒストン脱アセチル化酵素のなかで,なぜHDAC6だけがチューブリンを脱アセチル化するのだろうか? HDAC6のもつ2つの触媒ドメインに特徴的な構造を比較することにより,第1触媒ドメインにおいてヘリックス1とヘリックス2とのあいだのループに含まれるTrp78およびヘリックス6,第2触媒ドメインにおいてヘリックス20とヘリックス21とのあいだのループに含まれるTrp459およびへリックス25が,基質の認識において重要であろうと推測された.そこで,これらのTrpの変異体,および,これらのへリックスをHDAC8の同じ領域(HDAC8においてへリックスはなくループになっている)と置換した変異体を作製し,マウスに由来するHDAC6ノックアウト細胞の細胞抽出液にくわえチューブリンの脱アセチル化活性を測定した.その結果,第1触媒ドメインに変異をもつ変異体の活性に違いはなかったが,第2触媒ドメインに変異をもつ変異体は活性が大きく損なわれていた.これらの変異体は低分子の基質を用いた脱アセチル化活性の測定においては正常であったことから,第2触媒ドメインに存在するTrp459およびヘリックス25がチューブリンの認識において重要であると考えられた.
最近,チューブリンのアセチル化酵素としてαTATが同定され,その構造および機能の解析によりαTATが微小管を形成するαチューブリンのLys40をアセチル化する機構が明らかにされた3).しかし,微小管を形成するチューブリンのHDAC6による脱アセチル化の詳細については不明であった.そこで,精製したHDAC6の触媒ドメインをチューブリンを高度にアセチル化させた微小管とin vitroにおいて反応させることによりその詳細を調べた.その結果,αTATと同様に,HDAC6は微小管の内部に自由拡散により入り込み,ランダムにチューブリンを脱アセチル化することが示された.さらに,微小管を形成するチューブリンと脱重合した遊離のチューブリンとを比較したところ,HDAC6による脱アセチル化活性は,脱重合した遊離のチューブリンに対するほうが約2.5倍も高かった.このことから,細胞においてダイナミックに変化する微小管においては,チューブリンは脱重合した際にHDAC6によりすみやかに脱アセチル化されリセットされることが示された.微小管におけるチューブリンのアセチル化の状態は微小管の安定性との関連が示唆されているが,その詳細は不明であった.今回の結果により,安定に存在する微小管を形成するチューブリンは高アセチル化状態になりやすく,微小管のカタストロフによりチューブリンが脱重合した場合,HDAC6によりすみやかに脱アセチル化されることによりチューブリンのアセチル化の状態がリセットされる可能性が考えられた(図2).
おわりに
HDAC6は細胞質に局在し,その主要な基質は細胞骨格を構成するチューブリンであり,ストレス応答タンパク質であると考えられている.とくに,神経変性疾患やインフルエンザウイルスの感染において重要な役割をはたしており,ほかにもさまざまな疾患にかかわる可能性が高いと考えられる.HDAC6の発現の異常によりひき起こされるヒトの疾患として軟骨異形成が報告されており9),HDAC6ノックアウトマウスでは骨の形成のわずかな異常が観察されている10).このように,HDAC6は多彩な生命現象に関与するため,現在も世界的にその選択的な阻害剤の開発が活発に進められている.今回の結晶構造解析の結果を基盤に,特異的な阻害剤をはじめとするさらなる新しい分子の設計および開発につながることが期待される.また,HDAC6がチューブリンを脱アセチル化する生物学的な分子機構が明らかにされた点も興味深い.
文 献
- Seidel, C., Schnekenburger, M., Dicato, M. et al.: Histone deacetylase 6 in health and disease. Epigenomics, 7, 103-118 (2015)[PubMed]
- Banerjee, I., Miyake, M., Nobs, S. P. et al.: Influenza A virus uses the aggresome processing machinery for host cell entry. Science, 346, 473-477 (2014)[PubMed]
- Szyk, A., Deaconescu, A. M., Spector, J. et al.: Molecular basis for age-dependent microtubule acetylation by tubulin acetyltransferase. Cell, 157, 1405-1415 (2014)[PubMed]
- Zilberman, Y., Ballestrem, C., Carramusa, L. et al.: Regulation of microtubule dynamics by inhibition of the tubulin deacetylase HDAC6. J. Cell Sci., 122, 3531-3541 (2009)[PubMed]
- Falkenberg, K. J. & Johnstone, R. W.: Histone deacetylases and their inhibitors in cancer, neurological diseases and immune disorders. Nat. Rev. Drug Discov., 13, 673-691 (2014)[PubMed]
- Kawaguchi Y., Kovacs, J. J., McLaurin A. et al.: The deacetylase HDAC6 regulates aggresome formation and cell viability in response to misfolded protein stress. Cell, 115, 727-738 (2003)[PubMed]
- Ouyang, H., Ali, Y. O., Ravichandran M. et al.: Protein aggregates are recruited to aggresome by histone deacetylase 6 via unanchored ubiquitin C termini. J. Biol. Chem., 287, 2317-2327 (2012)[PubMed]
- Yoshida, M., Hoshikawa, Y., Koseki, K. et al.: Structural specificity for biological activity of trichostatin A, a specific inhibitor of mammalian cell cycle with potent differentiation-inducing activity in friend leukemia cells. J. Antibiot., 43, 1101-1106 (1990)[PubMed]
- Simon, D., Laloo, B., Barillot, M. et al.: A mutation in the 3’-UTR of the HDAC6 gene abolishing the post-transcriptional regulation mediated by has-miR-433 is linked to a new form of dominant X-linked chondrodysplasia. Hum. Mol. Genet., 19, 2015-2027 (2010)[PubMed]
- Zhang, Y., Kwon, S., Yamaguchi, T. et al.: Mice lacking histone deacetylase 6 have hyperacetylated tubulin but are viable and develop normally. Mol. Cell. Biol., 28, 1688-1701 (2008)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2006年 大阪大学大学院医学系研究科 修了,同年 京都大学大学院生命科学研究科 博士研究員,2010年 スイスFriedrich Miescher Institute for Biomedical Researchにて博士研究員を経て,2016年より信州大学医学部 研究員.
研究テーマ:疾患に関連する遺伝子の探索およびその機能の解析.
抱負:疾患に関連するタンパク質の解析をつうじ創薬に結びつけたい.
関心事:子育てと研究の両立は可能か? ポスドクは一生つづけられるか?
Patrick Matthias
スイスFriedrich Miescher Institute for Biomedical ResearchにてSenior Group Leader.
研究室URL:http://www.fmi.ch/research/groupleader/?group=21
© 2016 三宅康之・Patrick Matthias Licensed under CC 表示 2.1 日本