自発的な膜型免疫グロブリンEのシグナルは免疫グロブリンE型の免疫記憶の形成を抑制する
羽生田 圭・北村大介
(東京理科大学生命医科学研究所 分子生物学研究部門)
email:羽生田 圭,北村大介
DOI: 10.7875/first.author.2016.082
Autonomous membrane IgE signaling prevents IgE-memory formation.
Kei Haniuda, Saori Fukao, Tadahiro Kodama, Hitoshi Hasegawa, Daisuke Kitamura
Nature Immunology, 17, 1109-1117 (2016)
免疫グロブリンEの異常な産生はアレルギー疾患の発症の原因になる.免疫グロブリンEの産生のもとになる免疫グロブリンE陽性のB細胞は,通常,胚中心において維持されず,寿命の長いメモリーB細胞あるいは長期に生存するプラズマ細胞には分化しない.しかし,この特徴的な免疫グロブリンE陽性のB細胞の分化の機構は不明であった.今回,筆者らは,免疫グロブリンE陽性のB細胞の発現する膜型免疫グロブリンEが抗原の非存在下において自発的なシグナルを惹起し,2つのアダプタータンパク質BLNKおよびCD19を介したシグナル伝達系により短命なプラズマ細胞への分化を促進することを見い出した.BLNKノックアウトマウスおよびCD19ヘテロノックアウトマウスにおいては免疫により免疫グロブリンE陽性の胚中心B細胞が維持されて免疫グロブリンEの産生が持続し,2次免疫によるアナフィラキシー反応が増強した.以上より,膜型免疫グロブリンEによる自発的なシグナルが免疫グロブリンE型の免疫記憶の形成を抑制することが明らかにされた.
ナイーブB細胞は膜型免疫グロブリンMおよび免疫グロブリンDを発現し,これらはIgα-Igβ複合体と会合してB細胞受容体として特異的な抗原を認識し結合する.抗原を認識したB細胞はT細胞のはたらきにより活性化し,免疫グロブリンGや免疫グロブリンAへのクラススイッチが誘導され,一部のB細胞は短命なプラズマ細胞へと分化し,別の一部は胚中心を形成して増殖をつづける.胚中心においてはB細胞の免疫グロブリン遺伝子に体細胞変異が誘導されて抗原の親和性が多様化し,抗原の親和性にもとづく選択が起こり,最終的に選択された胚中心B細胞はメモリーB細胞や長期に生存するプラズマ細胞へと分化する.
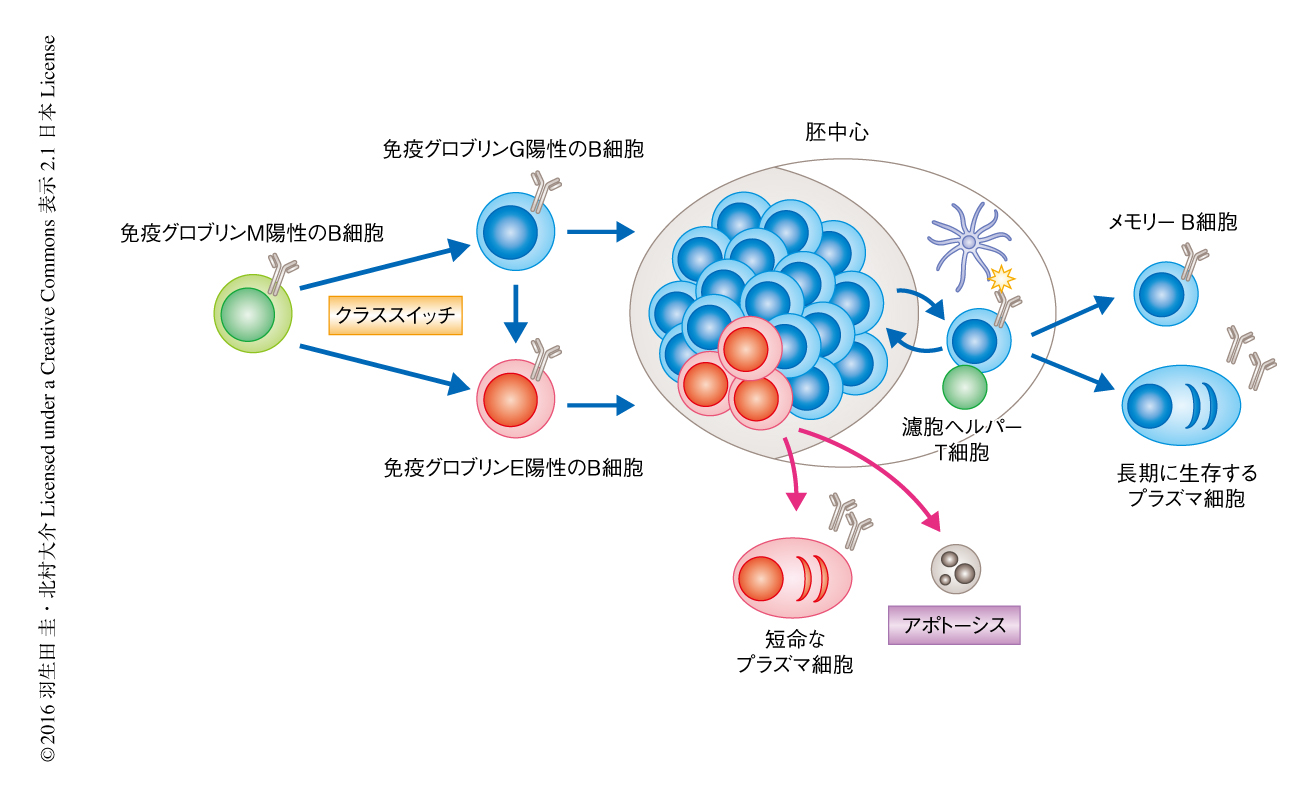
一方で,免疫グロブリンE陽性のB細胞は僅少なため検出が困難であり,その分化の機構や体内における動態についてはながらく不明であった.しかし最近になり,膜型免疫グロブリンEの発現をモニターできるレポーターマウスを用いた解析により,免疫グロブリンE陽性の胚中心B細胞の存在が明らかにされた1-3).それらの報告においては,免疫グロブリンE陽性の胚中心B細胞は免疫ののち早期に一過性に存在するものの,胚中心において維持される期間は非常に短く,メモリーB細胞や長期に生存するプラズマ細胞へと分化する細胞はわずかであることが示された.免疫グロブリンE陽性の胚中心B細胞が維持されない理由として,プラズマ細胞への分化の亢進2),あるいは,アポトーシスの亢進3,4) があげられたが,根底にある分子機構についてはまったく不明であった(図1).
ナイーブB細胞の発現する膜型免疫グロブリンMおよび免疫グロブリンDは3アミノ酸残基からなる短い細胞内ドメインをもち,そのシグナル伝達系はB細胞受容体と会合するIgα-Igβ複合体に依存する.一方で,膜型免疫グロブリンGおよび免疫グロブリンEは28アミノ酸残基からなる長い細胞内ドメインをもち,そこには種のあいだで高度に保存されたTyrモチーフが存在する5).抗原による刺激によりこのTyrモチーフがリン酸化されると,Grb2-BLNK-Btk-ホスホリパーゼCγ2モジュールが動員されて強力なCa2+の流入が誘導される6).しかし,膜型免疫グロブリンEのみに特異的に結合するシグナルタンパク質などについては明らかにされていない.
そこで,膜型免疫グロブリンEそれ自体に短命化を誘導する機能があると考え,独自に構築した免疫グロブリン重鎖の置換系を用いて初代培養B細胞において膜型免疫グロブリンEの機能を解析した.この系においては,loxP配列によりはさまれた免疫グロブリン重鎖の可変領域の遺伝子およびCγ1-Creという2つの免疫グロブリン遺伝子のアレルをもつノックインマウスのB細胞を,CD40リガンドおよびBAFFを発現する40LB細胞7) をフィーダー細胞としてインターロイキン4の存在のもとで培養する.この培養により,B細胞は胚中心B細胞の表現型を獲得するとともに,Cre-loxP組換えにより内在性の免疫グロブリン重鎖が欠損する.さらに,ここにレトロウイルスを用いて任意の免疫グロブリン重鎖の遺伝子を導入することができる.以上により,高効率に目的の膜型免疫グロブリンを発現した初代培養B細胞を大量に得ることが可能になり,従来はB細胞株を用いてきた生化学的な解析に,より生理的なB細胞を用いることが可能になった.この免疫グロブリン重鎖の置換系を用いてB細胞に膜型免疫グロブリンEを発現させたところ,B細胞は抗原の非存在下においてプラズマ細胞へと分化し,同時にアポトーシスが誘導された.これは,膜型免疫グロブリンGを発現させたB細胞のB細胞受容体を免疫グロブリン軽鎖に対する抗体により刺激した際と同様の反応であった.
膜型免疫グロブリンEを発現させたB細胞をウェスタンブロット法により解析したところ,B細胞受容体のすぐ下流のキナーゼであるSykおよびBLNKのリン酸化,また,B細胞受容体の共受容体であるCD19のリン酸化の誘導が見い出された.さらに,抗原ビーズを用いてB細胞受容体を精製しその複合体を解析したところ,膜型免疫グロブリンEはCD19と恒常的に会合していた.したがって,細胞の表面への膜型免疫グロブリンEの発現は抗原の非存在下においてB細胞受容体のシグナルを自発的に惹起することが明らかにされた.B細胞受容体シグナル伝達経路において,BLNKおよびCD19は種々のシグナルタンパク質と会合してシグナルを下流へと伝達するアダプタータンパク質として機能することが知られている8).BLNKノックアウトマウスおよびCD19ノックアウトマウスに由来する培養B細胞を解析したところ,自発的な膜型免疫グロブリンEのシグナルは,BLNKを介してp38-JNKシグナル伝達経路の活性化によるアポトーシスおよびプラズマ細胞への分化を誘導すること,および,CD19を介してPI3K-Aktシグナル伝達経路を活性化しIRF4の発現を上昇させプラズマ細胞への分化を誘導した.すなわち,免疫グロブリンEへのクラススイッチにより発現した膜型免疫グロブリンEは抗原に非依存的に2つのシグナル伝達経路を活性化し,短命なプラズマ細胞への分化を誘導することが明らかにされた.
BLNKおよびCD19による自発的な膜型免疫グロブリンEのシグナルの生理的な意義を明らかにするため,BLNKノックアウトマウスおよびCD19ヘテロノックアウトマウス(CD19ホモノックアウトマウスは胚中心の反応や抗体の産生がほとんど起こらない9))を免疫して免疫グロブリンE陽性のB細胞の応答を解析した.その結果,BLNKノックアウトマウスにおいては免疫グロブリンE陽性の胚中心B細胞のアポトーシスが抑制され,CD19ヘテロノックアウトマウスにおいては免疫グロブリンE陽性の胚中心B細胞のアポトーシスに変化はなかったがプラズマ細胞への分化が抑制された.BLNKノックアウトマウスおよびCD19ヘテロノックアウトマウスにおいては,免疫グロブリンE陽性の胚中心B細胞は免疫の2週間のちにおいても多く維持され,さらに,血中における免疫グロブリンEの抗体価が長期にわたり高値で維持され,2次免疫した際には重篤なアナフィラキシー反応が誘発された.また,BLNKノックアウトマウスにおいては免疫グロブリンE型の長期に生存するプラズマ細胞およびメモリーB細胞が多く検出された.以上より,BLNKおよびCD19を介した自発的な膜型免疫グロブリンEのシグナルは免疫グロブリンE陽性の胚中心B細胞の短命なプラズマ細胞への分化を誘導して免疫グロブリンE型の免疫記憶の形成を抑制し,アレルギー反応をひき起こす持続的な免疫グロブリンEの産生をふせぐことが明らかにされた.
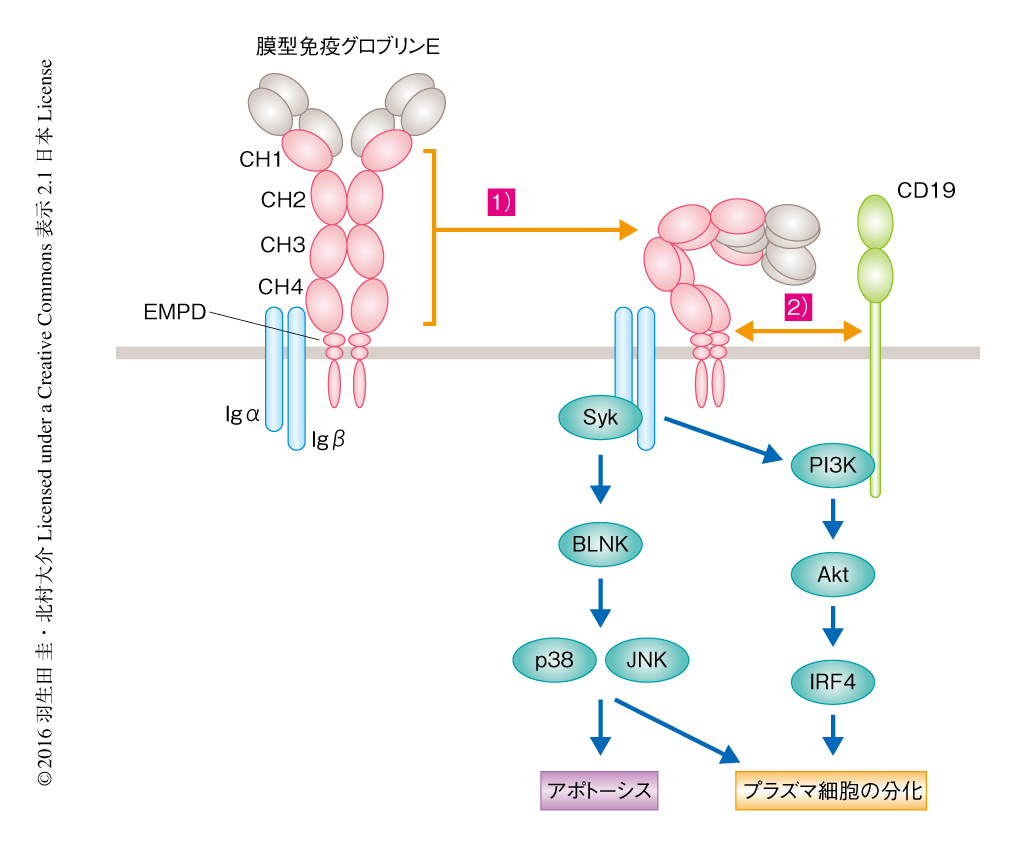
BLNKシグナル伝達経路およびCD19シグナル伝達経路の自発的な活性化を担う膜型免疫グロブリンEの責任領域を探索した.膜型免疫グロブリンG1と免疫グロブリンEの種々のキメラタンパク質の発現ベクターを作製して免疫グロブリン重鎖の置換系により培養B細胞に発現させ解析したところ,膜型免疫グロブリンEの細胞外領域に自発的なシグナルを惹起する責任のあることがわかった.すなわち,CH1ドメイン~CH4ドメインの全体が自発的なシグナルの惹起からBLNKシグナル伝達経路の活性化およびアポトーシスの誘導に必須であった.また,細胞膜の直上の短いリンカードメインであるEMPDは自発的なシグナルの惹起それ自体には必要ではなかったが,CD19シグナル伝達経路の活性化およびプラズマ細胞への分化に必須であった.クラススイッチした膜型免疫グロブリンはその細胞内領域に特有のモチーフをもつが,膜型免疫グロブリンEによるアポトーシスおよびプラズマ細胞への分化の誘導には膜型免疫グロブリンEの細胞外領域に特有の機能のあることが明らかにされた(図2).
免疫グロブリンE型の免疫記憶の形成は免疫グロブリンE陽性のB細胞に存在する膜型免疫グロブリンEにより自律的に抑制されることが明らかにされた.膜型免疫グロブリンEの細胞の表面への発現は自発的なシグナルを惹起して短命なプラズマ細胞への分化を誘導し,胚中心における親和性の成熟および長期に生存するプラズマ細胞やメモリーB細胞への分化を停止させ,ごく一過性の低親和性の免疫グロブリンEの産生にとどまらせる.さらに,この自発的な膜型免疫グロブリンEのシグナルの破綻が免疫グロブリンE型の免疫記憶の形成や持続的な免疫グロブリンEの産生を惹起しアレルギーの発症につながることが示唆された.また,自発的なシグナルを惹起する責任領域が細胞外領域にあったことから,膜型免疫グロブリンEは自己どうしの相互作用あるいはほかの細胞外タンパク質との会合により自発的なシグナルを惹起すると考えられた.ヒトの免疫グロブリンEはCH2ドメインがCH3ドメイン-CH4ドメインと近接し折れ曲がった構造を示す10).膜型免疫グロブリンEの構造は明らかにされていないが,免疫グロブリンEと同様の特殊な構造が自発的なシグナルの惹起に関与するのかもしれない.膜型免疫グロブリンEの細胞外領域によるシグナルの惹起の機構はいまのところ不明であるが,それが破綻した場合も免疫グロブリンE型の免疫記憶の形成にいたることが予想される.その解明は今後の重要な課題である.
略歴:2014年 東京理科大学大学院生命科学研究科博士後期課程 修了,同年より東京理科大学生命医科学研究所 助教.
研究テーマ:B細胞における免疫記憶の制御の機構.
関心事:自己免疫疾患やアレルギーの発症における免疫記憶の関与.
北村 大介(Daisuke Kitamura)
東京理科大学生命医科学研究所 教授.
研究室URL:http://www.rs.noda.tus.ac.jp/~ribsjm/kitamuralab/indexj.html
© 2016 羽生田 圭・北村大介 Licensed under CC 表示 2.1 日本
(東京理科大学生命医科学研究所 分子生物学研究部門)
email:羽生田 圭,北村大介
DOI: 10.7875/first.author.2016.082
Autonomous membrane IgE signaling prevents IgE-memory formation.
Kei Haniuda, Saori Fukao, Tadahiro Kodama, Hitoshi Hasegawa, Daisuke Kitamura
Nature Immunology, 17, 1109-1117 (2016)
要 約
免疫グロブリンEの異常な産生はアレルギー疾患の発症の原因になる.免疫グロブリンEの産生のもとになる免疫グロブリンE陽性のB細胞は,通常,胚中心において維持されず,寿命の長いメモリーB細胞あるいは長期に生存するプラズマ細胞には分化しない.しかし,この特徴的な免疫グロブリンE陽性のB細胞の分化の機構は不明であった.今回,筆者らは,免疫グロブリンE陽性のB細胞の発現する膜型免疫グロブリンEが抗原の非存在下において自発的なシグナルを惹起し,2つのアダプタータンパク質BLNKおよびCD19を介したシグナル伝達系により短命なプラズマ細胞への分化を促進することを見い出した.BLNKノックアウトマウスおよびCD19ヘテロノックアウトマウスにおいては免疫により免疫グロブリンE陽性の胚中心B細胞が維持されて免疫グロブリンEの産生が持続し,2次免疫によるアナフィラキシー反応が増強した.以上より,膜型免疫グロブリンEによる自発的なシグナルが免疫グロブリンE型の免疫記憶の形成を抑制することが明らかにされた.
はじめに
ナイーブB細胞は膜型免疫グロブリンMおよび免疫グロブリンDを発現し,これらはIgα-Igβ複合体と会合してB細胞受容体として特異的な抗原を認識し結合する.抗原を認識したB細胞はT細胞のはたらきにより活性化し,免疫グロブリンGや免疫グロブリンAへのクラススイッチが誘導され,一部のB細胞は短命なプラズマ細胞へと分化し,別の一部は胚中心を形成して増殖をつづける.胚中心においてはB細胞の免疫グロブリン遺伝子に体細胞変異が誘導されて抗原の親和性が多様化し,抗原の親和性にもとづく選択が起こり,最終的に選択された胚中心B細胞はメモリーB細胞や長期に生存するプラズマ細胞へと分化する.
一方で,免疫グロブリンE陽性のB細胞は僅少なため検出が困難であり,その分化の機構や体内における動態についてはながらく不明であった.しかし最近になり,膜型免疫グロブリンEの発現をモニターできるレポーターマウスを用いた解析により,免疫グロブリンE陽性の胚中心B細胞の存在が明らかにされた1-3).それらの報告においては,免疫グロブリンE陽性の胚中心B細胞は免疫ののち早期に一過性に存在するものの,胚中心において維持される期間は非常に短く,メモリーB細胞や長期に生存するプラズマ細胞へと分化する細胞はわずかであることが示された.免疫グロブリンE陽性の胚中心B細胞が維持されない理由として,プラズマ細胞への分化の亢進2),あるいは,アポトーシスの亢進3,4) があげられたが,根底にある分子機構についてはまったく不明であった(図1).
1.膜型免疫グロブリンEの発現は抗原の非存在下においてプラズマ細胞への分化およびアポトーシスを誘導する
ナイーブB細胞の発現する膜型免疫グロブリンMおよび免疫グロブリンDは3アミノ酸残基からなる短い細胞内ドメインをもち,そのシグナル伝達系はB細胞受容体と会合するIgα-Igβ複合体に依存する.一方で,膜型免疫グロブリンGおよび免疫グロブリンEは28アミノ酸残基からなる長い細胞内ドメインをもち,そこには種のあいだで高度に保存されたTyrモチーフが存在する5).抗原による刺激によりこのTyrモチーフがリン酸化されると,Grb2-BLNK-Btk-ホスホリパーゼCγ2モジュールが動員されて強力なCa2+の流入が誘導される6).しかし,膜型免疫グロブリンEのみに特異的に結合するシグナルタンパク質などについては明らかにされていない.
そこで,膜型免疫グロブリンEそれ自体に短命化を誘導する機能があると考え,独自に構築した免疫グロブリン重鎖の置換系を用いて初代培養B細胞において膜型免疫グロブリンEの機能を解析した.この系においては,loxP配列によりはさまれた免疫グロブリン重鎖の可変領域の遺伝子およびCγ1-Creという2つの免疫グロブリン遺伝子のアレルをもつノックインマウスのB細胞を,CD40リガンドおよびBAFFを発現する40LB細胞7) をフィーダー細胞としてインターロイキン4の存在のもとで培養する.この培養により,B細胞は胚中心B細胞の表現型を獲得するとともに,Cre-loxP組換えにより内在性の免疫グロブリン重鎖が欠損する.さらに,ここにレトロウイルスを用いて任意の免疫グロブリン重鎖の遺伝子を導入することができる.以上により,高効率に目的の膜型免疫グロブリンを発現した初代培養B細胞を大量に得ることが可能になり,従来はB細胞株を用いてきた生化学的な解析に,より生理的なB細胞を用いることが可能になった.この免疫グロブリン重鎖の置換系を用いてB細胞に膜型免疫グロブリンEを発現させたところ,B細胞は抗原の非存在下においてプラズマ細胞へと分化し,同時にアポトーシスが誘導された.これは,膜型免疫グロブリンGを発現させたB細胞のB細胞受容体を免疫グロブリン軽鎖に対する抗体により刺激した際と同様の反応であった.
2.膜型免疫グロブリンEの発現は自発的なシグナルを惹起し2つのシグナル伝達経路を活性化する
膜型免疫グロブリンEを発現させたB細胞をウェスタンブロット法により解析したところ,B細胞受容体のすぐ下流のキナーゼであるSykおよびBLNKのリン酸化,また,B細胞受容体の共受容体であるCD19のリン酸化の誘導が見い出された.さらに,抗原ビーズを用いてB細胞受容体を精製しその複合体を解析したところ,膜型免疫グロブリンEはCD19と恒常的に会合していた.したがって,細胞の表面への膜型免疫グロブリンEの発現は抗原の非存在下においてB細胞受容体のシグナルを自発的に惹起することが明らかにされた.B細胞受容体シグナル伝達経路において,BLNKおよびCD19は種々のシグナルタンパク質と会合してシグナルを下流へと伝達するアダプタータンパク質として機能することが知られている8).BLNKノックアウトマウスおよびCD19ノックアウトマウスに由来する培養B細胞を解析したところ,自発的な膜型免疫グロブリンEのシグナルは,BLNKを介してp38-JNKシグナル伝達経路の活性化によるアポトーシスおよびプラズマ細胞への分化を誘導すること,および,CD19を介してPI3K-Aktシグナル伝達経路を活性化しIRF4の発現を上昇させプラズマ細胞への分化を誘導した.すなわち,免疫グロブリンEへのクラススイッチにより発現した膜型免疫グロブリンEは抗原に非依存的に2つのシグナル伝達経路を活性化し,短命なプラズマ細胞への分化を誘導することが明らかにされた.
3.BLNKあるいはCD19を欠損したマウスにおける免疫グロブリンEの産生の異常
BLNKおよびCD19による自発的な膜型免疫グロブリンEのシグナルの生理的な意義を明らかにするため,BLNKノックアウトマウスおよびCD19ヘテロノックアウトマウス(CD19ホモノックアウトマウスは胚中心の反応や抗体の産生がほとんど起こらない9))を免疫して免疫グロブリンE陽性のB細胞の応答を解析した.その結果,BLNKノックアウトマウスにおいては免疫グロブリンE陽性の胚中心B細胞のアポトーシスが抑制され,CD19ヘテロノックアウトマウスにおいては免疫グロブリンE陽性の胚中心B細胞のアポトーシスに変化はなかったがプラズマ細胞への分化が抑制された.BLNKノックアウトマウスおよびCD19ヘテロノックアウトマウスにおいては,免疫グロブリンE陽性の胚中心B細胞は免疫の2週間のちにおいても多く維持され,さらに,血中における免疫グロブリンEの抗体価が長期にわたり高値で維持され,2次免疫した際には重篤なアナフィラキシー反応が誘発された.また,BLNKノックアウトマウスにおいては免疫グロブリンE型の長期に生存するプラズマ細胞およびメモリーB細胞が多く検出された.以上より,BLNKおよびCD19を介した自発的な膜型免疫グロブリンEのシグナルは免疫グロブリンE陽性の胚中心B細胞の短命なプラズマ細胞への分化を誘導して免疫グロブリンE型の免疫記憶の形成を抑制し,アレルギー反応をひき起こす持続的な免疫グロブリンEの産生をふせぐことが明らかにされた.
4.膜型免疫グロブリンEの細胞外領域は自発的なシグナルを誘発する
BLNKシグナル伝達経路およびCD19シグナル伝達経路の自発的な活性化を担う膜型免疫グロブリンEの責任領域を探索した.膜型免疫グロブリンG1と免疫グロブリンEの種々のキメラタンパク質の発現ベクターを作製して免疫グロブリン重鎖の置換系により培養B細胞に発現させ解析したところ,膜型免疫グロブリンEの細胞外領域に自発的なシグナルを惹起する責任のあることがわかった.すなわち,CH1ドメイン~CH4ドメインの全体が自発的なシグナルの惹起からBLNKシグナル伝達経路の活性化およびアポトーシスの誘導に必須であった.また,細胞膜の直上の短いリンカードメインであるEMPDは自発的なシグナルの惹起それ自体には必要ではなかったが,CD19シグナル伝達経路の活性化およびプラズマ細胞への分化に必須であった.クラススイッチした膜型免疫グロブリンはその細胞内領域に特有のモチーフをもつが,膜型免疫グロブリンEによるアポトーシスおよびプラズマ細胞への分化の誘導には膜型免疫グロブリンEの細胞外領域に特有の機能のあることが明らかにされた(図2).
おわりに
免疫グロブリンE型の免疫記憶の形成は免疫グロブリンE陽性のB細胞に存在する膜型免疫グロブリンEにより自律的に抑制されることが明らかにされた.膜型免疫グロブリンEの細胞の表面への発現は自発的なシグナルを惹起して短命なプラズマ細胞への分化を誘導し,胚中心における親和性の成熟および長期に生存するプラズマ細胞やメモリーB細胞への分化を停止させ,ごく一過性の低親和性の免疫グロブリンEの産生にとどまらせる.さらに,この自発的な膜型免疫グロブリンEのシグナルの破綻が免疫グロブリンE型の免疫記憶の形成や持続的な免疫グロブリンEの産生を惹起しアレルギーの発症につながることが示唆された.また,自発的なシグナルを惹起する責任領域が細胞外領域にあったことから,膜型免疫グロブリンEは自己どうしの相互作用あるいはほかの細胞外タンパク質との会合により自発的なシグナルを惹起すると考えられた.ヒトの免疫グロブリンEはCH2ドメインがCH3ドメイン-CH4ドメインと近接し折れ曲がった構造を示す10).膜型免疫グロブリンEの構造は明らかにされていないが,免疫グロブリンEと同様の特殊な構造が自発的なシグナルの惹起に関与するのかもしれない.膜型免疫グロブリンEの細胞外領域によるシグナルの惹起の機構はいまのところ不明であるが,それが破綻した場合も免疫グロブリンE型の免疫記憶の形成にいたることが予想される.その解明は今後の重要な課題である.
文 献
- Talay, O., Yan, D., Brightbill, H. et al.: IgE+ memory B cells and plasma cells generated through a germinal-center pathway. Nat. Immunol., 13, 396-404 (2012)[PubMed]
- Yang, Z., Sullivan, B. M. & Allen, C. D.: Fluorescent in vivo detection reveals that IgE+ B cells are restrained by an intrinsic cell fate predisposition. Immunity, 36, 857-872 (2012)[PubMed]
- He, J. -S., Meyer-Hermann, M., Xiangying, D. et al.: The distinctive germinal center phase of IgE+ B lymphocytes limits their contribution to the classical memory response. J. Exp. Med., 210, 2755-2771 (2013)[PubMed]
- Laffleur, B., Duchez, S., Tarte, K. et al.: Self-restrained B cells arise following membrane IgE expression. Cell Rep., 10, 900-909 (2015)[PubMed]
- Engels, N., Konig, L., Heemann, C. et al.: Recruitment of the cytoplasmic adaptor Grb2 to surface IgG and IgE provides antigen receptor-intrinsic costimulation to class-switched B cells. Nat. Immunol., 10, 1018-1025 (2009)[PubMed]
- Engels, N., Konig, L., Schulze, W. et al.: The immunoglobulin tail tyrosine motif upgrades memory-type BCRs by incorporating a Grb2-Btk signalling module. Nat. Commun., 5, 5456 (2014)[PubMed]
- Nojima, T., Haniuda, K., Moutai, T. et al.: In-vitro derived germinal centre B cells differentially generate memory B or plasma cells in vivo. Nat. Commun., 2, 465 (2011)[PubMed]
- Kurosaki, T.: Regulation of B-cell signal transduction by adaptor proteins. Nat. Rev. Immunol., 2, 354-63 (2002)[PubMed]
- Rickert, R. C., Rajewsky, K. & Roes, J.: Impairment of T-cell-dependent B-cell responses and B-1 cell development in CD19-deficient mice. Nature, 376, 352-355 (1995)[PubMed]
- Wan, T., Beavil, R., Fabiane, S. et al.: The crystal structure of IgE Fc reveals an asymmetrically bent conformation. Nat. Immunol., 3, 681-686 (2002)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2014年 東京理科大学大学院生命科学研究科博士後期課程 修了,同年より東京理科大学生命医科学研究所 助教.
研究テーマ:B細胞における免疫記憶の制御の機構.
関心事:自己免疫疾患やアレルギーの発症における免疫記憶の関与.
北村 大介(Daisuke Kitamura)
東京理科大学生命医科学研究所 教授.
研究室URL:http://www.rs.noda.tus.ac.jp/~ribsjm/kitamuralab/indexj.html
© 2016 羽生田 圭・北村大介 Licensed under CC 表示 2.1 日本