p38MAPキナーゼはストレス造血においてプリン体の代謝を介して造血幹細胞の細胞周期を促進する
雁金大樹・田久保圭誉
(国立国際医療研究センター研究所 生体恒常性プロジェクト)
email:田久保圭誉
DOI: 10.7875/first.author.2016.077
p38α activates purine metabolism to initiate hematopoietic stem/progenitor cell cycling in response to stress.
Daiki Karigane, Hiroshi Kobayashi, Takayuki Morikawa, Yukako Ootomo, Mashito Sakai, Go Nagamatsu, Yoshiaki Kubota, Nobuhito Goda, Michihiro Matsumoto, Emi K. Nishimura, Tomoyoshi Soga, Kinya Otsu, Makoto Suematsu, Shinichiro Okamoto, Toshio Suda, Keiyo Takubo
Cell Stem Cell, 19, 192-204 (2016)
造血幹細胞は造血系におけるもっとも未分化な細胞として定常な状態において造血の維持に寄与する.また,ストレスを負荷されたのちには造血系の全体を再構築する機能をはたす.こうしたストレスが負荷されたのちの造血系の再構築を“ストレス造血”とよぶが,その機序には不明な点が多く残されている.今回,筆者らは,ストレス造血の制御においてp38MAPキナーゼに着目し,とりわけ,造血器において高発現するアイソザイムp38αについて解析した.p38αを欠損した造血幹細胞は骨髄移植において生着率が低下し,ストレスに対し明らかに脆弱であった.また,移植ののち早期に細胞周期が遅延し,これがストレスに対する脆弱性の一因と考えられた.メタボローム解析により,p38αを欠損した造血幹細胞は移植ののちにプリン体の代謝に異常がみられ,グアニン合成経路において律速段階の反応を触媒する酵素であるImpdh2の発現が低下していた.p38αを欠損した造血幹細胞においてImpdh2の発現を回復させたところ,細胞周期の遅延や移植における生着率が有意に回復した.また,p38αによるImpdh2の発現の誘導を仲介する転写因子としてMitfが同定された.これらの結果から,ストレス造血においてp38αは転写因子Mitfを介してプリン体の代謝を制御し,最終的には,造血幹細胞の細胞周期を促進することにより幹細胞としての特性を維持することが明らかにされた.
造血幹細胞はひとつの個体において生涯にわたりすべての血球細胞をつくりつづける1).定常な状態のみならず,移植や抗がん剤の投与などのストレスが負荷されたのちにも,造血幹細胞の特性である自己複製能および多分化能により造血系は再構築される.これをストレス造血とよぶが,その機序には不明な点が多く残されている.近年,ほぼすべてのがんに対し化学療法や放射線療法が導入されている.これらの治療においては,副作用として正常な血球細胞が傷害され,その結果,造血幹細胞はストレスにさらされる.そのため,ストレス造血の機序を解明することは医学的にも重要な意味をもつ.今回の研究において,筆者らは,代表的なストレス応答タンパク質であるp38MAPキナーゼのストレス造血における機能に注目した.その結果,p38MAPキナーゼのアイソザイムのひとつであるp38αはストレス造血において造血幹細胞におけるプリン体の代謝を活性化し,細胞周期の進行および骨髄の再生において重要な役割をはたすことを見い出した.
p38MAPキナーゼは活性酸素など細胞の外からの刺激により細胞内にシグナルを伝達するMAPキナーゼスーパーファミリーの一員であり2),ErkやJnkなどとともに急性のストレス応答においてさまざまな下流タンパク質を制御することにより重要な役割をはたす.p38MAPキナーゼにはp38α,p38β,p38γ,p38δの4つのアイソザイムが知れられている.造血系におけるそれぞれのアイソザイムの発現を測定したところp38αが高発現しており,とりわけ,未分化な細胞ほど発現が高い傾向があった.p38αノックアウトマウスは胎生致死であるため3),タモキシフェンの投与によりp38αを出生ののちに欠損させることのできるコンディショナルノックアウトマウス4,5) の造血系を野生型のマウスと比較した.ストレスが負荷されていない定常な状態においては,p38αを欠損したマウスの造血幹細胞,造血前駆細胞,分化した血球の数や頻度は,野生型のマウスと差はなかった.
ストレスのもとでの造血幹細胞の活性について検討するため,p38αを欠損したマウスから造血幹細胞を採取し,致死量の放射線を照射したレシピエントマウスに骨髄移植した.レシピエントマウスの末梢血におけるドナーマウスに由来する血球細胞の割合(キメリズム)は,造血幹細胞による血球の産生能を反映する.p38αを欠損した造血幹細胞を移植されたマウスのキメリズムは,対照となるマウスと比較して顕著に低かった.造血幹細胞にさらなるストレスを負荷するため,移植の4カ月のちにレシピエントマウスの骨髄を2次レシピエントマウスに連続移植したところ,その差はより顕著になった.別の種類のストレスとして,抗がん剤5-フルオロウラシルを投与したところ,p38αを欠損したマウスにおいて生存率が有意に低下した.以上の結果から,p38αはストレス造血において重要な役割を担っており,p38αの欠損により造血幹細胞はストレスに対し脆弱になることがわかった.
p38MAPキナーゼがどのような機序によりストレス造血に寄与するか検討するため,ストレスの負荷ののちにp38MAPキナーゼが活性化するタイミングについて評価した.p38MAPキナーゼは細胞の外からの刺激をシグナル伝達タンパク質のリン酸化により細胞内に連鎖的に伝達する.すなわち,p38MAPキナーゼそれ自体のリン酸化の状態は活性化の状態を反映する.そこで,野生型の造血幹細胞および造血前駆細胞における移植ののちのp38MAPキナーゼのリン酸化の状態を,細胞内フローサイトメトリー法により定常な状態から移植ののち7日目まで経時的に測定した.その結果,p38MAPキナーゼのリン酸化は移植の直後に高まったのち,すみやかに減弱し,移植ののち7日目にはほぼ定常な状態にまで回復した.この結果から,p38αを欠損した造血幹細胞において移植ののちにキメリズムが低下するのは,移植ののち早期にp38αの活性が消失するためと考えられた.
移植ののち1日目の造血幹細胞および造血前駆細胞における生物学的な変化について検討した.移植された造血幹細胞に起こりうる生物学的な現象として,造血幹細胞が静脈から骨髄に到達するホーミング,活性酸素の産生の亢進,アポトーシスの増加,細胞周期の促進がある.ホーミング,活性酸素の産生,アポトーシスについてはp38αの欠損による差は生じなかったが,p38αを欠損した造血幹細胞においては細胞周期が遅延した.すなわち,p38αは移植の直後に活性化して細胞周期を促進することにより幹細胞としての特性を維持すると考えられた.
p38αによる細胞周期の制御について解析するため,p38αを欠損した造血幹細胞および造血前駆細胞における移植ののちの遺伝子発現の変化についてマイクロアレイ法により解析したが,細胞周期の制御にかかわる分子機構の解明にはいたらなかった.近年,細胞における代謝による細胞動態の制御が注目されている.造血幹細胞においても,筆者らも含む複数の研究グループから,幹細胞の細胞周期において静止期が解糖系の代謝により制御されることが報告されている6-8)(文献6) は新着論文レビュー でも掲載).同様に,p38αを介してある種の代謝経路が活性化し細胞周期を制御する可能性を考慮し,メタボローム解析により代謝産物を測定した.
野生型のマウスあるいはp38αを欠損したマウスから造血幹前駆細胞を定常な状態あるいは移植ののち1日目に採取し,キャピラリー電気泳動-飛行時間型質量分析法により細胞における代謝産物を測定した.その結果,検出された代謝産物すべてが移植ののち上昇しており,移植というストレスは細胞において全体的な代謝を活性化させることがわかった.また,細胞周期がより速い野生型の造血幹前駆細胞においては移植ののち代謝産物の濃度が高い傾向にあった.しかし,いくつかの代謝産物はそれとは異なり,プリン体の合成の材料になるグリシンおよびアスパラギン酸はp38αを欠損した造血幹細胞において高値を示した.逆に,マウスにおけるプリン体の代謝経路の最終代謝産物であるアラントイン(ヒトにおける尿酸)は,p38αを欠損した造血幹細胞において移植ののち顕著に低下していた.すなわち,材料が過剰となり最終代謝産物が低値であることから,p38αを欠損した造血幹細胞において移植ののちにプリン体の合成が遅延していると考えた.そこで,プリン体の代謝経路を構成する酵素の遺伝子発現を解析したところ,グアニン合成経路において律速段階の反応を触媒するImpdh2の遺伝子発現がp38αを欠損した造血幹細胞において移植ののちに有意に低下しており,Impdh2の発現の低下は細胞周期の遅延にかかわると考えられた.
移植の直後のImpdh2の発現の低下が造血幹細胞にいかなる影響をおよぼすのかを検討した.ミコフェノール酸はImpdh2の阻害剤であり,そのプロドラッグであるミコフェノール酸モティフィルはすでに臓器移植において免疫抑制剤として臨床で使用されている.in vitroにおいて,サイトカインの刺激により活発に増殖している造血幹細胞に対しミコフェノール酸がおよぼす影響について検討したところ,ミコフェノール酸の濃度に依存して造血幹細胞の増殖は抑制され,細胞周期も遅延した.in vivoにおける評価として,骨髄単核球を移植したレシピエントマウスに移植日よりミコフェノール酸モティフィルを内服させ,移植ののち4日目における細胞の増殖を評価したところ,ミコフェノール酸モティフィルを内服したマウスにおいて血液細胞の数は有意に低下し,とくに,造血幹細胞は対照の1%未満まで抑制された.このように,Impdh2の阻害剤はこれまで知られていた分化した免疫細胞の抑制のみならず,ストレス造血における造血幹細胞の増殖も抑制した.つまり,ストレス造血において,造血幹細胞でのImpdh2によるグアニン合成の制御は重要な役割を担うことが見い出された.
p38αがImpdh2の発現を制御する分子機構について検討した.データベース9,10) を利用して,Impdh2遺伝子のプロモーターに結合し,かつ,造血幹細胞において高く発現する転写因子を検索した.いくつかの候補のなかから,最終的にMitfに注目した.Mitfは皮膚における色素幹細胞の維持に必須な転写因子であるが,p38MAPキナーゼの下流において機能することが知られている11,12).Mitfの活性が低下した変異マウスを用いて,Mitfの造血幹細胞における機能を評価したところ,Mitfの活性が低下した造血幹細胞の細胞周期はp38αを欠損した造血幹細胞と同様に移植ののちに遅延し,また,Impdh2の発現は低下した.このことより,p38αによるプリン体の代謝の制御はMitfが介する可能性が示唆された.メラノーマ細胞株においてp38MAPキナーゼはCREBを介してMitfの発現を制御することを参考に,サイトカインの刺激により活発に増殖している造血幹前駆細胞株において,p38MAPキナーゼの阻害剤を処理したうえでクロマチン免疫沈降法によりゲノムと転写因子の相互作用について解析したところ,p38MAPキナーゼの阻害により,Mitf遺伝子のプロモーターへのCREBの結合,および,Impdh2遺伝子のプロモーターへのMitfの結合が低下した.これらの結果から,p38MAPキナーゼはCREBおよびMitfを介してImpdh2の発現を正に制御すると考えられた.
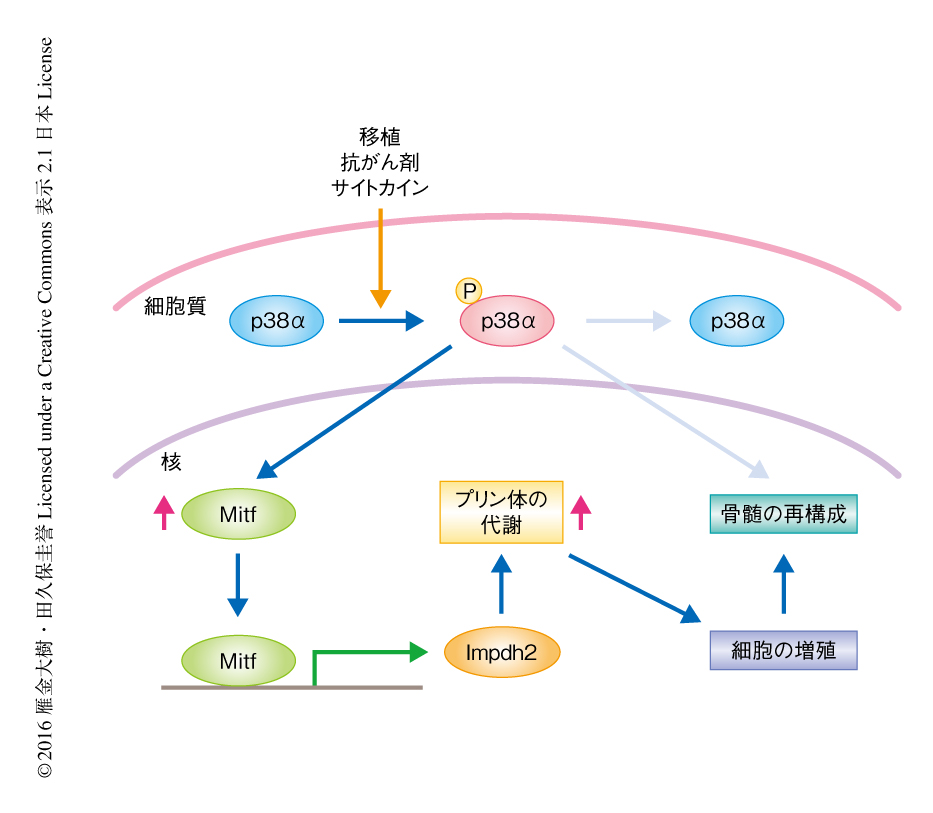
ストレス造血においてImpdh2がp38αおよびMitfの機能的な下流タンパク質であることを検証した.レトロウイルスを用いてImpdh2を過剰に発現させたところ,p38αを欠損した造血幹細胞およびMitfの活性が低下した造血幹細胞において,ストレスの負荷による細胞周期の遅延が完全に回復した.また,p38αを欠損した造血幹細胞の移植ののちのキメリズムは移植から1~2カ月という短期間で回復し,Mitfの活性が低下した造血幹細胞の移植ののちのキメリズムも完全に回復した.以上より,ストレス造血において,p38α-Mitf-Impdh2シグナル伝達系を介したプリン体の合成の活性化は造血幹細胞の細胞周期を促進する役割をはたすことが見い出された(図1).
筆者らも含む研究グループからの過去の報告においては,p38MAPキナーゼは造血幹細胞において細胞老化の形質を誘導するなど好ましくない機能をもつと考えられてきた.こうした先行研究においては,造血幹細胞におけるp38MAPキナーゼの機能は低分子阻害剤やウイルスベクターによるノックダウンにより解析されていた.今回の研究においては,p38αコンディショナルノックアウトマウスを用いることにより,p38αは定常な状態においては造血あるいは造血幹細胞の維持への寄与は少なく,移植,抗がん剤の投与,サイトカインの刺激のもとでの培養などストレス造血において重要な役割を担うことが明らかにされた.また,p38αは転写因子Mitfを介してプリン体の代謝酵素であるImpdh2の発現をストレスのもとで造血幹細胞において誘導することにより細胞の増殖を亢進することも見い出された.Impdh2はグアニン合成経路における律速段階の反応を触媒する酵素であり,メタボローム解析からもグアニンプールの減少が示された.しかし,グアニンの低下によりなぜ造血幹細胞が増殖できなくなるのかはまだ解明されていない.グアニンはDNAの材料になったりエネルギー通貨として利用されたりする.アデニンの代謝に関しては多くの研究がなされているが,グアニンの代謝に関してはまだ詳細な検討は進んでいない.今後は,造血幹細胞におけるグアニンの代謝の詳細な検討が重要になると思われる.
現代の医療において,造血幹細胞は移植,化学療法,放射線療法,重症感染などさまざまなストレスにさらされている.ストレスのもとでのp38α-Mitf-Impdh2シグナル伝達系を介した細胞の増殖の制御機構は,造血幹細胞の理解のみならず,さまざまな病態の理解や新規の治療法の開発の一助になることが期待される.
略歴:慶應義塾大学医学部 特任助教.
研究テーマ:ストレスおよび老化における造血幹細胞の動態.
抱負:造血幹細胞の解析を手がかりとし,幹細胞疾患の発生の機序を解明したい.
田久保 圭誉(Keiyo Takubo)
国立国際医療研究センター研究所 プロジェクト長.
研究室URL:http://www.rincgm.jp/department/pro/04/
© 2016 雁金大樹・田久保圭誉 Licensed under CC 表示 2.1 日本
(国立国際医療研究センター研究所 生体恒常性プロジェクト)
email:田久保圭誉
DOI: 10.7875/first.author.2016.077
p38α activates purine metabolism to initiate hematopoietic stem/progenitor cell cycling in response to stress.
Daiki Karigane, Hiroshi Kobayashi, Takayuki Morikawa, Yukako Ootomo, Mashito Sakai, Go Nagamatsu, Yoshiaki Kubota, Nobuhito Goda, Michihiro Matsumoto, Emi K. Nishimura, Tomoyoshi Soga, Kinya Otsu, Makoto Suematsu, Shinichiro Okamoto, Toshio Suda, Keiyo Takubo
Cell Stem Cell, 19, 192-204 (2016)
要 約
造血幹細胞は造血系におけるもっとも未分化な細胞として定常な状態において造血の維持に寄与する.また,ストレスを負荷されたのちには造血系の全体を再構築する機能をはたす.こうしたストレスが負荷されたのちの造血系の再構築を“ストレス造血”とよぶが,その機序には不明な点が多く残されている.今回,筆者らは,ストレス造血の制御においてp38MAPキナーゼに着目し,とりわけ,造血器において高発現するアイソザイムp38αについて解析した.p38αを欠損した造血幹細胞は骨髄移植において生着率が低下し,ストレスに対し明らかに脆弱であった.また,移植ののち早期に細胞周期が遅延し,これがストレスに対する脆弱性の一因と考えられた.メタボローム解析により,p38αを欠損した造血幹細胞は移植ののちにプリン体の代謝に異常がみられ,グアニン合成経路において律速段階の反応を触媒する酵素であるImpdh2の発現が低下していた.p38αを欠損した造血幹細胞においてImpdh2の発現を回復させたところ,細胞周期の遅延や移植における生着率が有意に回復した.また,p38αによるImpdh2の発現の誘導を仲介する転写因子としてMitfが同定された.これらの結果から,ストレス造血においてp38αは転写因子Mitfを介してプリン体の代謝を制御し,最終的には,造血幹細胞の細胞周期を促進することにより幹細胞としての特性を維持することが明らかにされた.
はじめに
造血幹細胞はひとつの個体において生涯にわたりすべての血球細胞をつくりつづける1).定常な状態のみならず,移植や抗がん剤の投与などのストレスが負荷されたのちにも,造血幹細胞の特性である自己複製能および多分化能により造血系は再構築される.これをストレス造血とよぶが,その機序には不明な点が多く残されている.近年,ほぼすべてのがんに対し化学療法や放射線療法が導入されている.これらの治療においては,副作用として正常な血球細胞が傷害され,その結果,造血幹細胞はストレスにさらされる.そのため,ストレス造血の機序を解明することは医学的にも重要な意味をもつ.今回の研究において,筆者らは,代表的なストレス応答タンパク質であるp38MAPキナーゼのストレス造血における機能に注目した.その結果,p38MAPキナーゼのアイソザイムのひとつであるp38αはストレス造血において造血幹細胞におけるプリン体の代謝を活性化し,細胞周期の進行および骨髄の再生において重要な役割をはたすことを見い出した.
1.p38αを欠損した造血幹前駆細胞はストレスに対し脆弱である
p38MAPキナーゼは活性酸素など細胞の外からの刺激により細胞内にシグナルを伝達するMAPキナーゼスーパーファミリーの一員であり2),ErkやJnkなどとともに急性のストレス応答においてさまざまな下流タンパク質を制御することにより重要な役割をはたす.p38MAPキナーゼにはp38α,p38β,p38γ,p38δの4つのアイソザイムが知れられている.造血系におけるそれぞれのアイソザイムの発現を測定したところp38αが高発現しており,とりわけ,未分化な細胞ほど発現が高い傾向があった.p38αノックアウトマウスは胎生致死であるため3),タモキシフェンの投与によりp38αを出生ののちに欠損させることのできるコンディショナルノックアウトマウス4,5) の造血系を野生型のマウスと比較した.ストレスが負荷されていない定常な状態においては,p38αを欠損したマウスの造血幹細胞,造血前駆細胞,分化した血球の数や頻度は,野生型のマウスと差はなかった.
ストレスのもとでの造血幹細胞の活性について検討するため,p38αを欠損したマウスから造血幹細胞を採取し,致死量の放射線を照射したレシピエントマウスに骨髄移植した.レシピエントマウスの末梢血におけるドナーマウスに由来する血球細胞の割合(キメリズム)は,造血幹細胞による血球の産生能を反映する.p38αを欠損した造血幹細胞を移植されたマウスのキメリズムは,対照となるマウスと比較して顕著に低かった.造血幹細胞にさらなるストレスを負荷するため,移植の4カ月のちにレシピエントマウスの骨髄を2次レシピエントマウスに連続移植したところ,その差はより顕著になった.別の種類のストレスとして,抗がん剤5-フルオロウラシルを投与したところ,p38αを欠損したマウスにおいて生存率が有意に低下した.以上の結果から,p38αはストレス造血において重要な役割を担っており,p38αの欠損により造血幹細胞はストレスに対し脆弱になることがわかった.
2.p38αは移植ののち早期に活性化し細胞周期を促進する
p38MAPキナーゼがどのような機序によりストレス造血に寄与するか検討するため,ストレスの負荷ののちにp38MAPキナーゼが活性化するタイミングについて評価した.p38MAPキナーゼは細胞の外からの刺激をシグナル伝達タンパク質のリン酸化により細胞内に連鎖的に伝達する.すなわち,p38MAPキナーゼそれ自体のリン酸化の状態は活性化の状態を反映する.そこで,野生型の造血幹細胞および造血前駆細胞における移植ののちのp38MAPキナーゼのリン酸化の状態を,細胞内フローサイトメトリー法により定常な状態から移植ののち7日目まで経時的に測定した.その結果,p38MAPキナーゼのリン酸化は移植の直後に高まったのち,すみやかに減弱し,移植ののち7日目にはほぼ定常な状態にまで回復した.この結果から,p38αを欠損した造血幹細胞において移植ののちにキメリズムが低下するのは,移植ののち早期にp38αの活性が消失するためと考えられた.
移植ののち1日目の造血幹細胞および造血前駆細胞における生物学的な変化について検討した.移植された造血幹細胞に起こりうる生物学的な現象として,造血幹細胞が静脈から骨髄に到達するホーミング,活性酸素の産生の亢進,アポトーシスの増加,細胞周期の促進がある.ホーミング,活性酸素の産生,アポトーシスについてはp38αの欠損による差は生じなかったが,p38αを欠損した造血幹細胞においては細胞周期が遅延した.すなわち,p38αは移植の直後に活性化して細胞周期を促進することにより幹細胞としての特性を維持すると考えられた.
3.移植ののちのプリン体の代謝にはp38αが必要である
p38αによる細胞周期の制御について解析するため,p38αを欠損した造血幹細胞および造血前駆細胞における移植ののちの遺伝子発現の変化についてマイクロアレイ法により解析したが,細胞周期の制御にかかわる分子機構の解明にはいたらなかった.近年,細胞における代謝による細胞動態の制御が注目されている.造血幹細胞においても,筆者らも含む複数の研究グループから,幹細胞の細胞周期において静止期が解糖系の代謝により制御されることが報告されている6-8)(文献6) は新着論文レビュー でも掲載).同様に,p38αを介してある種の代謝経路が活性化し細胞周期を制御する可能性を考慮し,メタボローム解析により代謝産物を測定した.
野生型のマウスあるいはp38αを欠損したマウスから造血幹前駆細胞を定常な状態あるいは移植ののち1日目に採取し,キャピラリー電気泳動-飛行時間型質量分析法により細胞における代謝産物を測定した.その結果,検出された代謝産物すべてが移植ののち上昇しており,移植というストレスは細胞において全体的な代謝を活性化させることがわかった.また,細胞周期がより速い野生型の造血幹前駆細胞においては移植ののち代謝産物の濃度が高い傾向にあった.しかし,いくつかの代謝産物はそれとは異なり,プリン体の合成の材料になるグリシンおよびアスパラギン酸はp38αを欠損した造血幹細胞において高値を示した.逆に,マウスにおけるプリン体の代謝経路の最終代謝産物であるアラントイン(ヒトにおける尿酸)は,p38αを欠損した造血幹細胞において移植ののち顕著に低下していた.すなわち,材料が過剰となり最終代謝産物が低値であることから,p38αを欠損した造血幹細胞において移植ののちにプリン体の合成が遅延していると考えた.そこで,プリン体の代謝経路を構成する酵素の遺伝子発現を解析したところ,グアニン合成経路において律速段階の反応を触媒するImpdh2の遺伝子発現がp38αを欠損した造血幹細胞において移植ののちに有意に低下しており,Impdh2の発現の低下は細胞周期の遅延にかかわると考えられた.
4.Impdh2によるグアニン合成の制御は移植ののちの造血幹細胞の増殖に必須である
移植の直後のImpdh2の発現の低下が造血幹細胞にいかなる影響をおよぼすのかを検討した.ミコフェノール酸はImpdh2の阻害剤であり,そのプロドラッグであるミコフェノール酸モティフィルはすでに臓器移植において免疫抑制剤として臨床で使用されている.in vitroにおいて,サイトカインの刺激により活発に増殖している造血幹細胞に対しミコフェノール酸がおよぼす影響について検討したところ,ミコフェノール酸の濃度に依存して造血幹細胞の増殖は抑制され,細胞周期も遅延した.in vivoにおける評価として,骨髄単核球を移植したレシピエントマウスに移植日よりミコフェノール酸モティフィルを内服させ,移植ののち4日目における細胞の増殖を評価したところ,ミコフェノール酸モティフィルを内服したマウスにおいて血液細胞の数は有意に低下し,とくに,造血幹細胞は対照の1%未満まで抑制された.このように,Impdh2の阻害剤はこれまで知られていた分化した免疫細胞の抑制のみならず,ストレス造血における造血幹細胞の増殖も抑制した.つまり,ストレス造血において,造血幹細胞でのImpdh2によるグアニン合成の制御は重要な役割を担うことが見い出された.
5.p38αは転写因子Mitfを介してプリン体の代謝を制御する
p38αがImpdh2の発現を制御する分子機構について検討した.データベース9,10) を利用して,Impdh2遺伝子のプロモーターに結合し,かつ,造血幹細胞において高く発現する転写因子を検索した.いくつかの候補のなかから,最終的にMitfに注目した.Mitfは皮膚における色素幹細胞の維持に必須な転写因子であるが,p38MAPキナーゼの下流において機能することが知られている11,12).Mitfの活性が低下した変異マウスを用いて,Mitfの造血幹細胞における機能を評価したところ,Mitfの活性が低下した造血幹細胞の細胞周期はp38αを欠損した造血幹細胞と同様に移植ののちに遅延し,また,Impdh2の発現は低下した.このことより,p38αによるプリン体の代謝の制御はMitfが介する可能性が示唆された.メラノーマ細胞株においてp38MAPキナーゼはCREBを介してMitfの発現を制御することを参考に,サイトカインの刺激により活発に増殖している造血幹前駆細胞株において,p38MAPキナーゼの阻害剤を処理したうえでクロマチン免疫沈降法によりゲノムと転写因子の相互作用について解析したところ,p38MAPキナーゼの阻害により,Mitf遺伝子のプロモーターへのCREBの結合,および,Impdh2遺伝子のプロモーターへのMitfの結合が低下した.これらの結果から,p38MAPキナーゼはCREBおよびMitfを介してImpdh2の発現を正に制御すると考えられた.
6.ストレス造血における造血幹細胞の増殖にp38α-Mitf-Impdh2シグナル伝達系が必要である
ストレス造血においてImpdh2がp38αおよびMitfの機能的な下流タンパク質であることを検証した.レトロウイルスを用いてImpdh2を過剰に発現させたところ,p38αを欠損した造血幹細胞およびMitfの活性が低下した造血幹細胞において,ストレスの負荷による細胞周期の遅延が完全に回復した.また,p38αを欠損した造血幹細胞の移植ののちのキメリズムは移植から1~2カ月という短期間で回復し,Mitfの活性が低下した造血幹細胞の移植ののちのキメリズムも完全に回復した.以上より,ストレス造血において,p38α-Mitf-Impdh2シグナル伝達系を介したプリン体の合成の活性化は造血幹細胞の細胞周期を促進する役割をはたすことが見い出された(図1).
おわりに
筆者らも含む研究グループからの過去の報告においては,p38MAPキナーゼは造血幹細胞において細胞老化の形質を誘導するなど好ましくない機能をもつと考えられてきた.こうした先行研究においては,造血幹細胞におけるp38MAPキナーゼの機能は低分子阻害剤やウイルスベクターによるノックダウンにより解析されていた.今回の研究においては,p38αコンディショナルノックアウトマウスを用いることにより,p38αは定常な状態においては造血あるいは造血幹細胞の維持への寄与は少なく,移植,抗がん剤の投与,サイトカインの刺激のもとでの培養などストレス造血において重要な役割を担うことが明らかにされた.また,p38αは転写因子Mitfを介してプリン体の代謝酵素であるImpdh2の発現をストレスのもとで造血幹細胞において誘導することにより細胞の増殖を亢進することも見い出された.Impdh2はグアニン合成経路における律速段階の反応を触媒する酵素であり,メタボローム解析からもグアニンプールの減少が示された.しかし,グアニンの低下によりなぜ造血幹細胞が増殖できなくなるのかはまだ解明されていない.グアニンはDNAの材料になったりエネルギー通貨として利用されたりする.アデニンの代謝に関しては多くの研究がなされているが,グアニンの代謝に関してはまだ詳細な検討は進んでいない.今後は,造血幹細胞におけるグアニンの代謝の詳細な検討が重要になると思われる.
現代の医療において,造血幹細胞は移植,化学療法,放射線療法,重症感染などさまざまなストレスにさらされている.ストレスのもとでのp38α-Mitf-Impdh2シグナル伝達系を介した細胞の増殖の制御機構は,造血幹細胞の理解のみならず,さまざまな病態の理解や新規の治療法の開発の一助になることが期待される.
文 献
- Orkin, S. H. & Zon, L. I.: Hematopoiesis: an evolving paradigm for stem cell biology. Cell, 132, 631-644 (2008)[PubMed]
- Ashwell, J. D.: The many paths to p38 mitogen-activated protein kinase activation in the immune system. Nat. Rev. Immunol., 6, 532-540 (2006)[PubMed]
- Tamura, K., Sudo, T., Senftleben, U. et al.: Requirement for p38α in erythropoietin expression: a role for stress kinases in erythropoiesis. Cell, 102, 221-231 (2000)[PubMed]
- Hayashi, S. & McMahon, A. P.: Efficient recombination in diverse tissues by a tamoxifen-inducible form of Cre: a tool for temporally regulated gene activation/inactivation in the mouse. Dev. Biol., 244, 305-318 (2002)[PubMed]
- Nishida, K., Yamaguchi, O., Hirotani, S. et al.: p38α mitogen-activated protein kinase plays a critical role in cardiomyocyte survival but not in cardiac hypertrophic growth in response to pressure overload. Mol. Cell. Biol., 24, 10611-10620 (2004)[PubMed]
- Takubo, K., Goda, N., Yamada, W. et al.: Regulation of the HIF-1α level is essential for hematopoietic stem cells. Cell Stem Cell, 7, 391-402 (2010)[PubMed] [新着論文レビュー]
- Takubo, K., Nagamatsu, G., Kobayashi, C. I. et al.: Regulation of glycolysis by Pdk functions as a metabolic checkpoint for cell cycle quiescence in hematopoietic stem cells. Cell Stem Cell, 12, 49-61 (2013)[PubMed]
- Wang, Y. H., Israelsen, W. J., Lee, D. et al.: Cell-state-specific metabolic dependency in hematopoiesis and leukemogenesis. Cell, 158, 1309-1323 (2014)[PubMed]
- Lachmann, A., Xu, H., Krishnan, J. et al.: ChEA: transcription factor regulation inferred from integrating genome-wide ChIP-X experiments. Bioinformatics, 26, 2438-2444 (2010)[PubMed]
- Seita, J., Sahoo, D., Rossi, D. J. et al.: Gene Expression Commons: an open platform for absolute gene expression profiling. PLoS One, 7, e40321 (2012)[PubMed]
- Lerner, A. B., Shiohara, T., Boissy, R. E. et al.: A mouse model for vitiligo. J. Invest. Dermatol., 87, 299-304 (1986)[PubMed]
- Saha, B., Singh, S. K., Sarkar, C. et al.: Activation of the Mitf promoter by lipid-stimulated activation of p38-stress signalling to CREB. Pigment Cell Res., 19, 595-605 (2006)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:慶應義塾大学医学部 特任助教.
研究テーマ:ストレスおよび老化における造血幹細胞の動態.
抱負:造血幹細胞の解析を手がかりとし,幹細胞疾患の発生の機序を解明したい.
田久保 圭誉(Keiyo Takubo)
国立国際医療研究センター研究所 プロジェクト長.
研究室URL:http://www.rincgm.jp/department/pro/04/
© 2016 雁金大樹・田久保圭誉 Licensed under CC 表示 2.1 日本