U1 snRNPはmRNA前駆体を異常な切断とポリA化から保護する
甲斐田 大輔
(米国Pennsylvania大学School of Medicine,Department of Biochemistry and Biophysics)
email:甲斐田大輔
DOI: 10.7875/first.author.2010.043
U1 snRNP protects pre-mRNAs from premature cleavage and polyadenylation.
Daisuke Kaida, Michael G. Berg, Ihab Younis, Mumtaz Kasim, Larry N. Singh, Lili Wan, Gideon Dreyfuss
Nature, 468, 664-668 (2010)
スプライソソームはU1,U2,U4,U5,U6という5つの低分子リボヌクレオタンパク質(snRNP)が一対一の割合で会合することで構成されているが,ヒトにおいてはU1 snRNPがほかのsnRNPと比べ過剰に存在している.このことから,U1 snRNPにはスプライシング以外の機能があるのではないかと考え,その機能阻害によるトランスクリプトームへの影響を観察した.予想どおり,さまざまなイントロンにおいてスプライシングの阻害が観察されたが,驚くべきことに,多くの遺伝子においてmRNAがイントロンでの異常な切断とポリA化をうけることが明らかとなった.この現象はスプライシング阻害剤によってはひき起こされなかったことから,U1 snRNPはスプライシングにくわえ,新規の転写産物を異常な切断とポリA化から保護するという機能をもっており,この機能のためほかのsnRNPより多く存在しているのではないかと考えられた.
真核細胞において転写されたばかりのmRNA前駆体(precursor mRNA)は,タンパク質をコードする遺伝情報をもつエキソンとその情報をもたないイントロンとからなっている1).スプライシングによるイントロンの除去にくわえ,5’末端でのキャッピング,3’末端でのポリA化などの転写後修飾をうけて,mRNAは核外へと輸送される2)(図1).スプライシング反応は,高分子のリボヌクレオタンパク質であるスプライソソームによって行われており,そのおもな構成因子はU1,U2,U4,U5,U6という5つの低分子核内リボヌクレオタンパク質(small nuclear ribonucleoprotein:snRNP)である3).おのおののsnRNPは核となるsnRNAとそれぞれのsnRNPに特異的なタンパク質から構成されている.一方,mRNA前駆体にはイントロンの5’末端と3’末端にスプライソソームによって認識される配列が存在し,それぞれ,5’側スプライス部位,3’側スプライス部位とよばれている.おのおののsnRNPがRNA-RNA結合,タンパク質-RNA結合,タンパク質-タンパク質結合を介してこれらスプライス部位を認識することによって,正確にイントロンを切り出してエキソンどうしをつなげている(図2).
スプライソソームはおのおののsnRNPが一対一の割合で会合することで形成されているが,ヒトにおいてはU1 snRNPがほかのsnRNPと比べて過剰に存在している4).このことから筆者らは,U1 snRNPにはスプライシング以外の機能があるのではないかと考え,その機能阻害がトランスクリプトームにあたえる影響について解析を行うことにした.
U1 snRNPはU1 snRNAと5’側スプライス部位とのあいだのRNA-RNA結合を介して5’側スプライス部位を認識している1,3).そこで,U1 snRNAの5’側スプライス部位との結合領域に対するアンチセンスモルフォリノオリゴを用い,RNA-RNA結合をさまたげることによってその機能阻害を試みた.実際にこのアンチセンスモルフォリノオリゴがU1 snRNAに結合しているかどうかを確認するためRNase保護アッセイを行った.RNase HはDNA-RNA 2本鎖を認識してRNA鎖を分解するが,アンチセンスモルフォリノオリゴとRNAの形成する2本鎖はRNase H耐性である.もし,アンチセンスモルフォリノオリゴがすでにU1 snRNAと結合しているなら,あとからくわえられた1本鎖DNAはU1 snRNAと結合できず,U1 snRNAはRNase Hにより切断されることはない.この実験から,U1 snRNAの5’側スプライス部位との結合領域に対するアンチセンスモルフォリノオリゴが実際にU1 snRNAに結合しており,ほぼ100%のU1 snRNPの阻害されていることが確認された.さらには,このアンチセンスモルフォリノオリゴはin vitroでのスプライシング反応を阻害することから,U1 snRNAの5’側スプライス部位との結合領域に対するアンチセンスモルフォリノオリゴはU1 snRNAと結合し,5’側スプライス部位との結合を阻害することでその機能を阻害しているものと考えられた.
つぎに,U1 snRNPの阻害がトランスクリプトームにどのような変化をあたえるかタイリングアレイを用いて解析した.通常のマイクロアレイがエキソン領域に対応するプローブしかもたないのに対し,タイリングアレイは全ゲノム領域に対応するプローブをチップに敷き詰めたものであり,通常のマイクロアレイでは得られないイントロン配列の情報をも解析することが可能である.また,対照としてU2 snRNPに結合してスプライシングを阻害する化合物スプライソスタチンA(spliceostatin A)を用いた5).U1 snRNAの5’側スプライス部位との結合領域に対するアンチセンスモルフォリノオリゴまたはスプライソスタチンAで細胞を処理した結果,予想どおり,スプライシング阻害により遺伝子全体のイントロンの蓄積している例がいくつも観察された.
しかしながら,アンチセンスモルフォリノオリゴ処理細胞においては,より多くの遺伝子において遺伝子の5’側のいくつかのイントロンしか蓄積しないという予想外の現象が観察された.この理由として,U1 snRNPの阻害により転写の早期終結がひき起こされているのではないかと考えた.そこで,3’RACE(rapid amplification of cDNA end)法を用いて転写終結点を明らかにしたところ,驚くべきことに,それら早期に転写が終結したmRNAはイントロンにおいて異常な切断とポリA化をうけていることが明らかになった.
通常,mRNAは3’末端において切断され,ポリA鎖が付加されることにより転写が終結しエキソヌクレアーゼから保護される.mRNAの3’末端にはポリA付加シグナル(AATAAAもしくはATTAAA)が存在し,このシグナルをポリA化酵素が認識することにより切断とポリA化が行われる6).しかしながら,U1 snRNPが阻害されることによってイントロンでポリA化がひき起こされた.さらには,ポリA化をうけたイントロンにも同様のポリA付加シグナルが存在したことから,この異常な切断とポリA化は3’末端におけるmRNAのポリA化と同一の分子機構で行われているのではないかと考えた.そこで,実際にイントロンでのポリA化が観察された遺伝子のミニ遺伝子を作製し,そのポリA付加シグナルに変異を導入した.野生型のポリA付加シグナルをもつミニ遺伝子は内在性の遺伝子と同様にU1 snRNPの阻害によりイントロンにおいてポリA化をうけたが,ポリA付加シグナルに変異をもつミニ遺伝子においてはポリA化は観察されなかった.このことから,この異常なポリA化は3’末端のポリA化と同様の分子機構で行われていることが示唆された.
スプライソスタチンA処理細胞ではこのような転写の早期終結は観察されなかったことから,この現象はスプライシングの阻害によるものではなく,U1 snRNPの阻害に特有なものであると考えられた.そこで,その可能性をより直接的に検証するため,ほかのスプライシング阻害法によりmRNA前駆体の切断とポリA化が観察されるかどうかを検証した.U2 snRNPはU2 snRNAとmRNA前駆体のあいだのRNA-RNA結合をとおしてmRNA前駆体の結合部位を認識しており,U2 snRNAのmRNA前駆体の認識部位に対するアンチセンスオリゴを用いることでその機能を阻害することができる7).そこで,細胞を,U1 snRNAの5’側スプライス部位との結合領域に対するアンチセンスオリゴ,U2 snRNAのmRNA前駆体の認識部位に対するアンチセンスオリゴ,スプライソスタチンAで処理したのち,細胞での異常な切断とポリA化を3’RACE法によって検出したところ,U1 snRNAの5’側スプライス部位との結合領域に対するアンチセンスオリゴ処理細胞でのみこの異常なポリA化が観察された.以上のことから,U1 snRNPにはスプライシング以外の機能として,mRNA前駆体を異常なポリA化から保護するという役割のあることが明らかとなった.
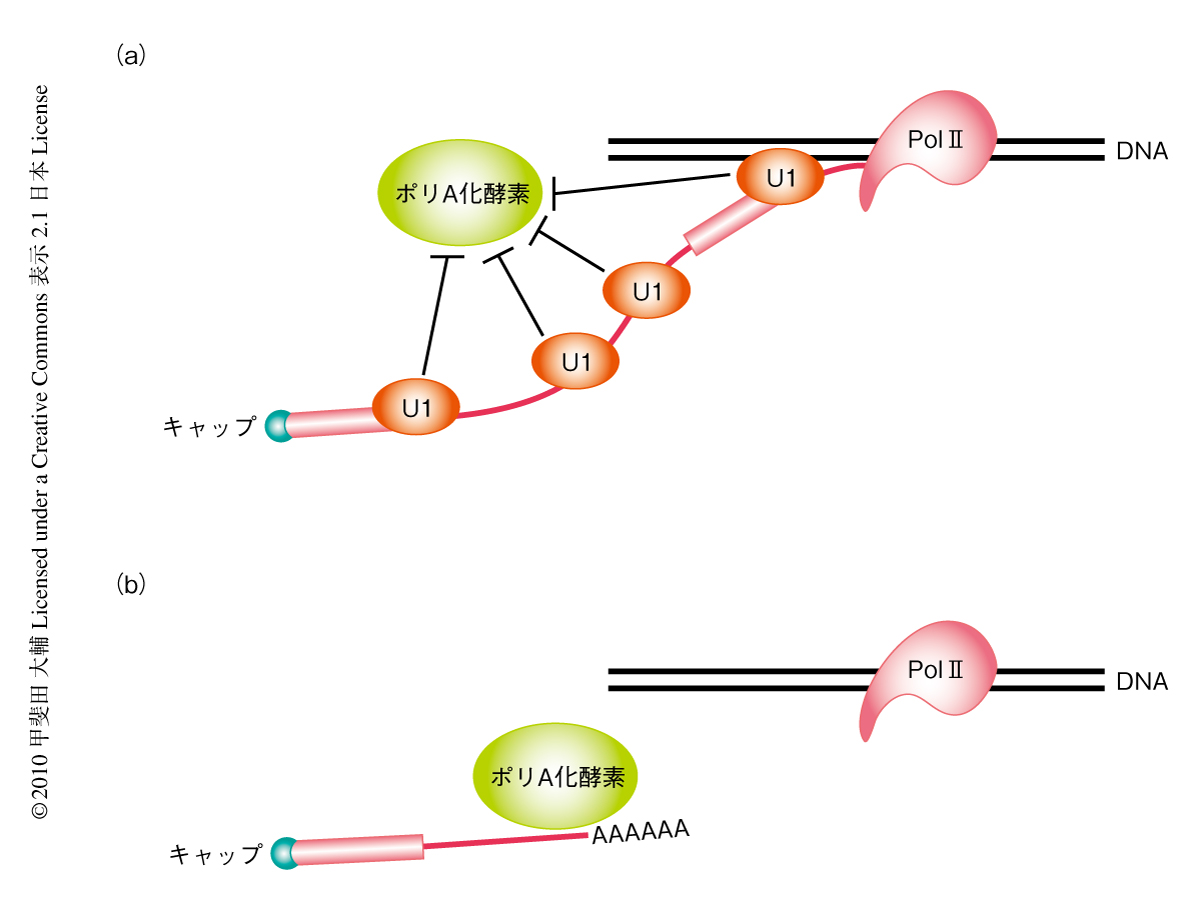
U1 snRNAと5’側スプライス部位とのRNA-RNA結合はスプライシングに重要であるが,このRNA-RNA結合がmRNA前駆体を異常な切断とポリA化から保護することにも必要であるかどうかを確かめるため,さきに用いた,実際にイントロンでのポリA化が観察された遺伝子のミニ遺伝子において5’側スプライス部位に変異を導入しU1 snRNPと5’側スプライス部位との結合を阻害したところ,イントロンでの異常なポリA化が観察された.このことから,U1 snRNPと5’側スプライス部位とのあいだのRNA-RNA結合がmRNA前駆体の保護にも重要であることがわかった.しかしながら,驚くべきことに,U1 snRNAの5’側スプライス部位との結合領域に対するアンチセンスオリゴを処理することにより,さらに多くのポリA化が観察された.このことから,U1 snRNPは5’側スプライス部位のみならず,mRNA前駆体のさまざまな部位に結合することで,mRNA前駆体の全体をこの異常な切断とポリA化から保護しているものと考えられた(図3).
U1 snRNPの阻害によるmRNA前駆体の異常な切断とポリA化の発見は,大きな驚きであった.これにより,なぜU1 snRNPがほかのsnRNPと比較して過剰に存在しているのかが説明できるのではなかろうか.mRNA前駆体はイントロンにも多くのポリA付加シグナルをもち,つねに切断とポリA化の危機にさらされている.とくに,ヒトのような高等真核生物ではイントロンが非常に長く8),イントロンが短い生物と比較して異常な切断とポリA化をうける危険性が高い.U1 snRNPはmRNA前駆体の異常な切断とポリA化を阻害するが,5’側スプライス部位に結合するU1 snRNPだけでは長いイントロンの全体を保護することができない.そのため,U1 snRNPは5’側スプライス部位のみならず,イントロンのさまざまな部位に結合する必要があり,U1 snRNPはほかのsnRNPと比較してより多くが必要なのであろう.もちろん,このようなU1 snRNPは選択的スプライシングにも用いられている可能性があり9),U1 snRNPのイントロン配列への結合はmRNA前駆体の保護と選択的スプライシングという2つの意味をもつのかもしれない.U1 snRNPはスプライシングに必須であるという点のみならず,新規の転写産物を異常な切断とポリA化から保護するという点においても,トランスクリプトーム全体を守るためになくてはならない因子のひとつである.
略歴:2003年 東京大学大学院理学系研究科博士課程 修了,同年 理化学研究所 協力研究員,2004年 同 基礎科学特別研究員を経て,2007年より米国Pennsylvania大学Postdoctoral fellow.
研究テーマ:スプライソソームの機能解析.
抱負:サイエンスを楽しみつつ,教科書に載るような仕事をする.
© 2010 甲斐田 大輔 Licensed under CC 表示 2.1 日本
(米国Pennsylvania大学School of Medicine,Department of Biochemistry and Biophysics)
email:甲斐田大輔
DOI: 10.7875/first.author.2010.043
U1 snRNP protects pre-mRNAs from premature cleavage and polyadenylation.
Daisuke Kaida, Michael G. Berg, Ihab Younis, Mumtaz Kasim, Larry N. Singh, Lili Wan, Gideon Dreyfuss
Nature, 468, 664-668 (2010)
この論文に出現する遺伝子・タンパク質のUniprot ID
U1 snRNP, スプライソソーム, U1, U2, U4, U5, U6, snRNP, 低分子核内リボヌクレオタンパク質, small nuclear ribonucleoprotein, snRNA, U1 snRNA, U2 snRNP, U2 snRNA, RNAポリメラーゼ II, Pol II, RNAポリメラーゼII
要 約
スプライソソームはU1,U2,U4,U5,U6という5つの低分子リボヌクレオタンパク質(snRNP)が一対一の割合で会合することで構成されているが,ヒトにおいてはU1 snRNPがほかのsnRNPと比べ過剰に存在している.このことから,U1 snRNPにはスプライシング以外の機能があるのではないかと考え,その機能阻害によるトランスクリプトームへの影響を観察した.予想どおり,さまざまなイントロンにおいてスプライシングの阻害が観察されたが,驚くべきことに,多くの遺伝子においてmRNAがイントロンでの異常な切断とポリA化をうけることが明らかとなった.この現象はスプライシング阻害剤によってはひき起こされなかったことから,U1 snRNPはスプライシングにくわえ,新規の転写産物を異常な切断とポリA化から保護するという機能をもっており,この機能のためほかのsnRNPより多く存在しているのではないかと考えられた.
はじめに
真核細胞において転写されたばかりのmRNA前駆体(precursor mRNA)は,タンパク質をコードする遺伝情報をもつエキソンとその情報をもたないイントロンとからなっている1).スプライシングによるイントロンの除去にくわえ,5’末端でのキャッピング,3’末端でのポリA化などの転写後修飾をうけて,mRNAは核外へと輸送される2)(図1).スプライシング反応は,高分子のリボヌクレオタンパク質であるスプライソソームによって行われており,そのおもな構成因子はU1,U2,U4,U5,U6という5つの低分子核内リボヌクレオタンパク質(small nuclear ribonucleoprotein:snRNP)である3).おのおののsnRNPは核となるsnRNAとそれぞれのsnRNPに特異的なタンパク質から構成されている.一方,mRNA前駆体にはイントロンの5’末端と3’末端にスプライソソームによって認識される配列が存在し,それぞれ,5’側スプライス部位,3’側スプライス部位とよばれている.おのおののsnRNPがRNA-RNA結合,タンパク質-RNA結合,タンパク質-タンパク質結合を介してこれらスプライス部位を認識することによって,正確にイントロンを切り出してエキソンどうしをつなげている(図2).
スプライソソームはおのおののsnRNPが一対一の割合で会合することで形成されているが,ヒトにおいてはU1 snRNPがほかのsnRNPと比べて過剰に存在している4).このことから筆者らは,U1 snRNPにはスプライシング以外の機能があるのではないかと考え,その機能阻害がトランスクリプトームにあたえる影響について解析を行うことにした.
1.アンチセンスモルフォリノオリゴによるU1 snRNPの機能阻害
U1 snRNPはU1 snRNAと5’側スプライス部位とのあいだのRNA-RNA結合を介して5’側スプライス部位を認識している1,3).そこで,U1 snRNAの5’側スプライス部位との結合領域に対するアンチセンスモルフォリノオリゴを用い,RNA-RNA結合をさまたげることによってその機能阻害を試みた.実際にこのアンチセンスモルフォリノオリゴがU1 snRNAに結合しているかどうかを確認するためRNase保護アッセイを行った.RNase HはDNA-RNA 2本鎖を認識してRNA鎖を分解するが,アンチセンスモルフォリノオリゴとRNAの形成する2本鎖はRNase H耐性である.もし,アンチセンスモルフォリノオリゴがすでにU1 snRNAと結合しているなら,あとからくわえられた1本鎖DNAはU1 snRNAと結合できず,U1 snRNAはRNase Hにより切断されることはない.この実験から,U1 snRNAの5’側スプライス部位との結合領域に対するアンチセンスモルフォリノオリゴが実際にU1 snRNAに結合しており,ほぼ100%のU1 snRNPの阻害されていることが確認された.さらには,このアンチセンスモルフォリノオリゴはin vitroでのスプライシング反応を阻害することから,U1 snRNAの5’側スプライス部位との結合領域に対するアンチセンスモルフォリノオリゴはU1 snRNAと結合し,5’側スプライス部位との結合を阻害することでその機能を阻害しているものと考えられた.
2.タイリングアレイを用いたU1 snRNPの阻害によるトランスクリプトーム変化の解析
つぎに,U1 snRNPの阻害がトランスクリプトームにどのような変化をあたえるかタイリングアレイを用いて解析した.通常のマイクロアレイがエキソン領域に対応するプローブしかもたないのに対し,タイリングアレイは全ゲノム領域に対応するプローブをチップに敷き詰めたものであり,通常のマイクロアレイでは得られないイントロン配列の情報をも解析することが可能である.また,対照としてU2 snRNPに結合してスプライシングを阻害する化合物スプライソスタチンA(spliceostatin A)を用いた5).U1 snRNAの5’側スプライス部位との結合領域に対するアンチセンスモルフォリノオリゴまたはスプライソスタチンAで細胞を処理した結果,予想どおり,スプライシング阻害により遺伝子全体のイントロンの蓄積している例がいくつも観察された.
しかしながら,アンチセンスモルフォリノオリゴ処理細胞においては,より多くの遺伝子において遺伝子の5’側のいくつかのイントロンしか蓄積しないという予想外の現象が観察された.この理由として,U1 snRNPの阻害により転写の早期終結がひき起こされているのではないかと考えた.そこで,3’RACE(rapid amplification of cDNA end)法を用いて転写終結点を明らかにしたところ,驚くべきことに,それら早期に転写が終結したmRNAはイントロンにおいて異常な切断とポリA化をうけていることが明らかになった.
3.転写の早期終結機構の解析
通常,mRNAは3’末端において切断され,ポリA鎖が付加されることにより転写が終結しエキソヌクレアーゼから保護される.mRNAの3’末端にはポリA付加シグナル(AATAAAもしくはATTAAA)が存在し,このシグナルをポリA化酵素が認識することにより切断とポリA化が行われる6).しかしながら,U1 snRNPが阻害されることによってイントロンでポリA化がひき起こされた.さらには,ポリA化をうけたイントロンにも同様のポリA付加シグナルが存在したことから,この異常な切断とポリA化は3’末端におけるmRNAのポリA化と同一の分子機構で行われているのではないかと考えた.そこで,実際にイントロンでのポリA化が観察された遺伝子のミニ遺伝子を作製し,そのポリA付加シグナルに変異を導入した.野生型のポリA付加シグナルをもつミニ遺伝子は内在性の遺伝子と同様にU1 snRNPの阻害によりイントロンにおいてポリA化をうけたが,ポリA付加シグナルに変異をもつミニ遺伝子においてはポリA化は観察されなかった.このことから,この異常なポリA化は3’末端のポリA化と同様の分子機構で行われていることが示唆された.
4.mRNA前駆体の保護というU1 snRNPの新たな機能
スプライソスタチンA処理細胞ではこのような転写の早期終結は観察されなかったことから,この現象はスプライシングの阻害によるものではなく,U1 snRNPの阻害に特有なものであると考えられた.そこで,その可能性をより直接的に検証するため,ほかのスプライシング阻害法によりmRNA前駆体の切断とポリA化が観察されるかどうかを検証した.U2 snRNPはU2 snRNAとmRNA前駆体のあいだのRNA-RNA結合をとおしてmRNA前駆体の結合部位を認識しており,U2 snRNAのmRNA前駆体の認識部位に対するアンチセンスオリゴを用いることでその機能を阻害することができる7).そこで,細胞を,U1 snRNAの5’側スプライス部位との結合領域に対するアンチセンスオリゴ,U2 snRNAのmRNA前駆体の認識部位に対するアンチセンスオリゴ,スプライソスタチンAで処理したのち,細胞での異常な切断とポリA化を3’RACE法によって検出したところ,U1 snRNAの5’側スプライス部位との結合領域に対するアンチセンスオリゴ処理細胞でのみこの異常なポリA化が観察された.以上のことから,U1 snRNPにはスプライシング以外の機能として,mRNA前駆体を異常なポリA化から保護するという役割のあることが明らかとなった.
5.U1 snRNPは5’側スプライス部位以外にも結合しmRNA前駆体を保護している
U1 snRNAと5’側スプライス部位とのRNA-RNA結合はスプライシングに重要であるが,このRNA-RNA結合がmRNA前駆体を異常な切断とポリA化から保護することにも必要であるかどうかを確かめるため,さきに用いた,実際にイントロンでのポリA化が観察された遺伝子のミニ遺伝子において5’側スプライス部位に変異を導入しU1 snRNPと5’側スプライス部位との結合を阻害したところ,イントロンでの異常なポリA化が観察された.このことから,U1 snRNPと5’側スプライス部位とのあいだのRNA-RNA結合がmRNA前駆体の保護にも重要であることがわかった.しかしながら,驚くべきことに,U1 snRNAの5’側スプライス部位との結合領域に対するアンチセンスオリゴを処理することにより,さらに多くのポリA化が観察された.このことから,U1 snRNPは5’側スプライス部位のみならず,mRNA前駆体のさまざまな部位に結合することで,mRNA前駆体の全体をこの異常な切断とポリA化から保護しているものと考えられた(図3).
おわりに
U1 snRNPの阻害によるmRNA前駆体の異常な切断とポリA化の発見は,大きな驚きであった.これにより,なぜU1 snRNPがほかのsnRNPと比較して過剰に存在しているのかが説明できるのではなかろうか.mRNA前駆体はイントロンにも多くのポリA付加シグナルをもち,つねに切断とポリA化の危機にさらされている.とくに,ヒトのような高等真核生物ではイントロンが非常に長く8),イントロンが短い生物と比較して異常な切断とポリA化をうける危険性が高い.U1 snRNPはmRNA前駆体の異常な切断とポリA化を阻害するが,5’側スプライス部位に結合するU1 snRNPだけでは長いイントロンの全体を保護することができない.そのため,U1 snRNPは5’側スプライス部位のみならず,イントロンのさまざまな部位に結合する必要があり,U1 snRNPはほかのsnRNPと比較してより多くが必要なのであろう.もちろん,このようなU1 snRNPは選択的スプライシングにも用いられている可能性があり9),U1 snRNPのイントロン配列への結合はmRNA前駆体の保護と選択的スプライシングという2つの意味をもつのかもしれない.U1 snRNPはスプライシングに必須であるという点のみならず,新規の転写産物を異常な切断とポリA化から保護するという点においても,トランスクリプトーム全体を守るためになくてはならない因子のひとつである.
文 献
- Will, C. L. & Luhrmann, R.: Splicing of a rare class of introns by the U12-dependent spliceosome. Biol. Chem., 386, 713-724 (2005)[PubMed]
- Moore, M. J. & Proudfoot, N. J.: Pre-mRNA processing reaches back to transcription and ahead to translation. Cell, 136, 688-700 (2009)[PubMed]
- Wahl, M. C., Will, C. L. & Luhrmann, R.: The spliceosome: design principles of a dynamic RNP machine. Cell, 136, 701-718 (2009)[PubMed]
- Baserga, S. J., Steitz, J. A.: in The RNA World (Gesteland, R. F. & Atkins, J. F. eds.), pp. 359-381, Cold Spring Harbor Laboratory Press, Cold Spring Harbor (1993)
- Kaida, D., Motoyoshi, H., Tashiro, E. et al.: Spliceostatin A targets SF3b and inhibits both splicing and nuclear retention of pre-mRNA. Nat. Chem. Biol., 3, 576-583 (2007)[PubMed]
- Millevoi, S. & Vagner, S.: Molecular mechanisms of eukaryotic pre-mRNA 3' end processing regulation. Nucleic Acids Res., 38, 2757-2774 (2010)[PubMed]
- Matter, N. & Konig, H.: Targeted 'knockdown' of spliceosome function in mammalian cells. Nucleic Acids Res., 33, e41 (2005)[PubMed]
- Deutsch, M. & Long, M.: Intron-exon structures of eukaryotic model organisms. Nucleic Acids Res., 27, 3219-3228 (1999)[PubMed]
- Keren, H., Lev-Maor, G. & Ast, G.: Alternative splicing and evolution: diversification, exon definition and function. Nat. Rev. Genet., 11, 345-355 (2010)[PubMed]
著者プロフィール
略歴:2003年 東京大学大学院理学系研究科博士課程 修了,同年 理化学研究所 協力研究員,2004年 同 基礎科学特別研究員を経て,2007年より米国Pennsylvania大学Postdoctoral fellow.
研究テーマ:スプライソソームの機能解析.
抱負:サイエンスを楽しみつつ,教科書に載るような仕事をする.
© 2010 甲斐田 大輔 Licensed under CC 表示 2.1 日本