受精にかかわる精子の融合タンパク質IZUMO1と卵の受容体JUNOとの認識の機構
石田英子・大戸梅治・清水敏之
(東京大学大学院薬学系研究科 蛋白構造生物学教室)
email:石田英子,大戸梅治,清水敏之
DOI: 10.7875/first.author.2016.071
Structure of IZUMO1-JUNO reveals sperm-oocyte recognition during mammalian fertilization.
Umeharu Ohto, Hanako Ishida, Elena Krayukhina, Susumu Uchiyama, Naokazu Inoue, Toshiyuki Shimizu
Nature, 534, 566-569 (2016)
哺乳類の受精においては,オスとメスの配偶子である精子と卵が互いに認識して細胞膜を融合し,それぞれのもつ遺伝情報が組み合わされることにより新たな遺伝情報をもつ個体がつくりだされる.細胞膜の融合のためには配偶子どうしの認識が不可欠であり,精子および卵において互いの認識に関与するタンパク質の研究がなされてきたが,その特異的な認識の機構についての構造生物学的な知見は得られていない.今回,筆者らは,受精に必須のタンパク質として同定された精子の細胞膜に局在する膜タンパク質IZUMO1と,その卵の受容体JUNOについて,それぞれの単体および複合体の結晶構造を明らかにした.IZUMO1は,N末端側の4本のαへリックスが束になったIZUMOドメイン,中央部分のβヘアピン構造,C末端側の免疫グロブリン様ドメインから構成され,βヘアピン構造はジスルフィド結合によりIZUMOドメインおよび免疫グロブリン様ドメインと架橋され安定なロッド状の構造を形成していた.IZUMO1とJUNOは,IZUMO1のβヘアピン構造とJUNOの疎水性ポケットの裏側とで結合していた.構造にもとづく変異体を用いた解析により,IZUMO1とJUNOとの認識は生物学的に重要であることが証明された.この研究により,新しい避妊薬の開発など創薬への応用も期待される.
ヒトにおいてはいちどに1億~3億の精子が射出され,そのうちひとつだけが卵と結合して受精卵となり,その直後に卵はほかの精子の受容能を失う1-4).この過程は複数の分子機構により厳密に制御されると考えられる.なかでも,受精においてもっとも重要な過程である細胞膜の融合にはとくに厳密な制御が必要とされる.IZUMO1は精子の細胞膜に局在するI型膜貫通タンパク質で,受精に必須のタンパク質として同定された5).αへリックスが束になったIZUMOドメインおよび免疫グロブリン様ドメインからなる細胞外領域とごく短い細胞内領域から構成され6),IZUMOドメインは精子と卵との結合に重要である7).JUNOは卵に存在するIZUMO1の受容体として同定された8).葉酸受容体ファミリーに属するGPIアンカー型膜タンパク質であるが,葉酸結合能をもたない8,9).IZUMO1およびJUNOは受精において決定的な役割をはたしており,避妊薬の標的ともなりうる.そのため,IZUMO1とJUNOとのあいだの特異的な認識の機構の解明が待望されていた.
ヒトのIZUMO1およびJUNOの細胞外領域をそれぞれ単独でショウジョウバエS2細胞において発現させ精製した試料を用いてその性状を解析した.ゲルろ過法および超遠心分析の結果,IZUMO1およびJUNOはいずれも溶液において単量体として存在した.等温滴定型カロリメトリー法により相互作用を解析した結果,IZUMO1とJUNOは結合比1対1,解離定数91 nMで結合することが示された.超遠心分析の結果からも,IZUMO1とJUNOは1対1の複合体を形成することが示された.また,IZUMO1およびJUNOはともに1箇所の糖鎖結合部位をもつが,糖鎖の有無は結合には影響しなかった.
単体のIZUMO1につき1つ(PDB ID:5JK9),単体のJUNOにつき2つ(PDB ID:5JKA,5JKB),IZUMO1とJUNOとの複合体につき3つ(PDB ID:5JKC,5JKD,5JKE)の結晶構造が明らかにされた.その一部の結晶化においては,結晶の質の改善のため糖鎖の切断およびLysのアルキル化などの処理をしたタンパク質を用いた.
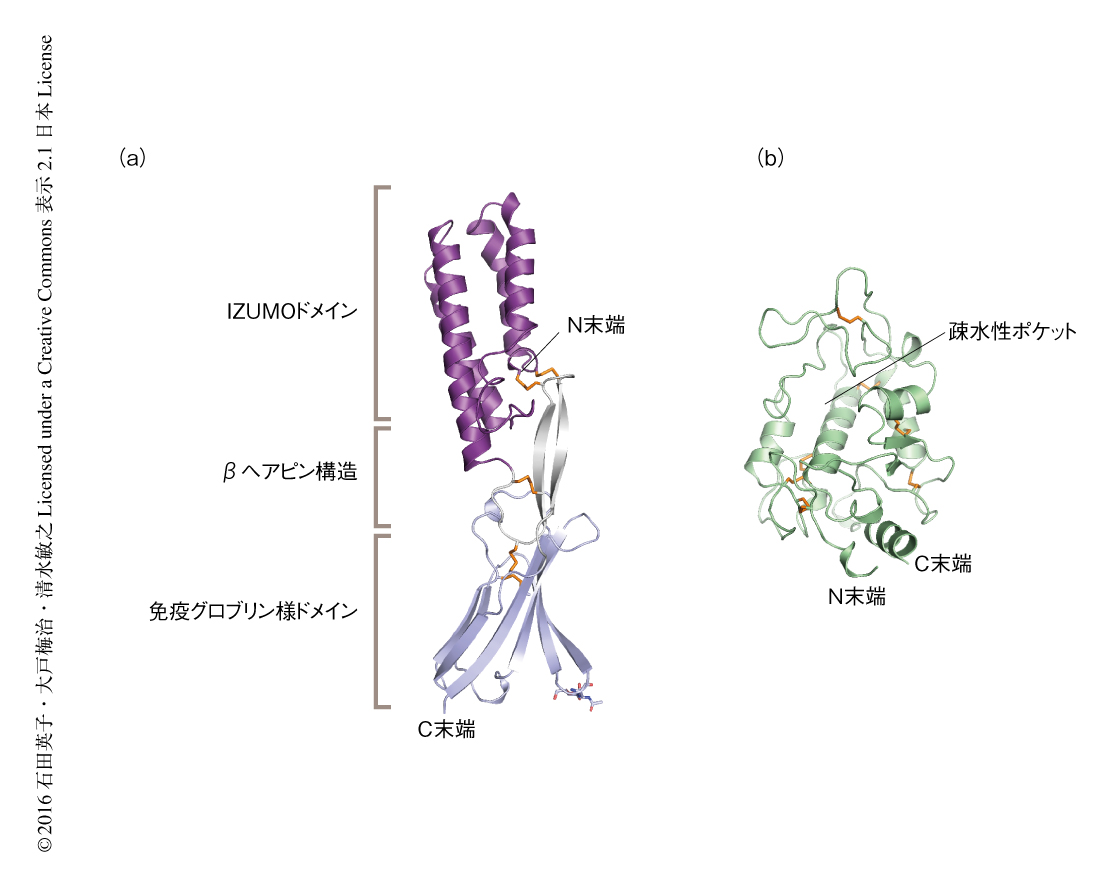
ヒトのIZUMO1は長辺が約90Åのロッド状の構造をしており,N末端側の4本のαへリックスの束からなるIZUMOドメイン,中央のβヘアピン構造,C末端側の免疫グロブリン様ドメインから構成されていた(図1a).IZUMO1には哺乳動物において保存されている10個のCysがあり,すべてジスルフィド結合を形成していた.Cys22-Cys149およびCys25-Cys152はIZUMOドメインとβヘアピン構造,Cys139-Cys165はβヘアピン構造と免疫グロブリン様ドメインを架橋していた.これらのジスルフィド結合により,3つのドメインは互いに独立な配向をとるのではなく,一定の配向を保持したひとつづきのロッド状の構造を形成するものと考えられた.また,Cys135-Cys159はβヘアピン構造の内部,Cys182-Cys233は免疫グロブリン様ドメインの内部においてジスルフィド結合を形成していた.
ヒトのJUNOは高い配列相同性をもつ葉酸受容体と類似した全体構造をしていた(図1b).8本のαへリックスと4つのβストランドが8つのジスルフィド結合により連結された球状の構造をしており,このジスルフィド結合は葉酸受容体10,11),リボフラビン結合タンパク質12),JUNOに共通してみられた.JUNOには葉酸受容体における葉酸結合ポケットに相当する疎水性ポケットが存在したが,葉酸との結合能はもたない8).葉酸受容体とJUNOとで疎水性ポケットに存在する疎水性残基はほとんど保存されていた.一方,葉酸受容体はそれらによる疎水性相互作用にくわえ,葉酸のプテリン部位と複数の残基を介して極性相互作用を形成するが10,11),これらの残基はひとつを除きJUNOにおいては保存されていなかった.さらに,葉酸受容体とは異なり,JUNOにおいてTrp190の側鎖は疎水性ポケットをせばめるかたちで配向していた.これらの違いにより,JUNOは葉酸との結合能をもたないものと考えられた.
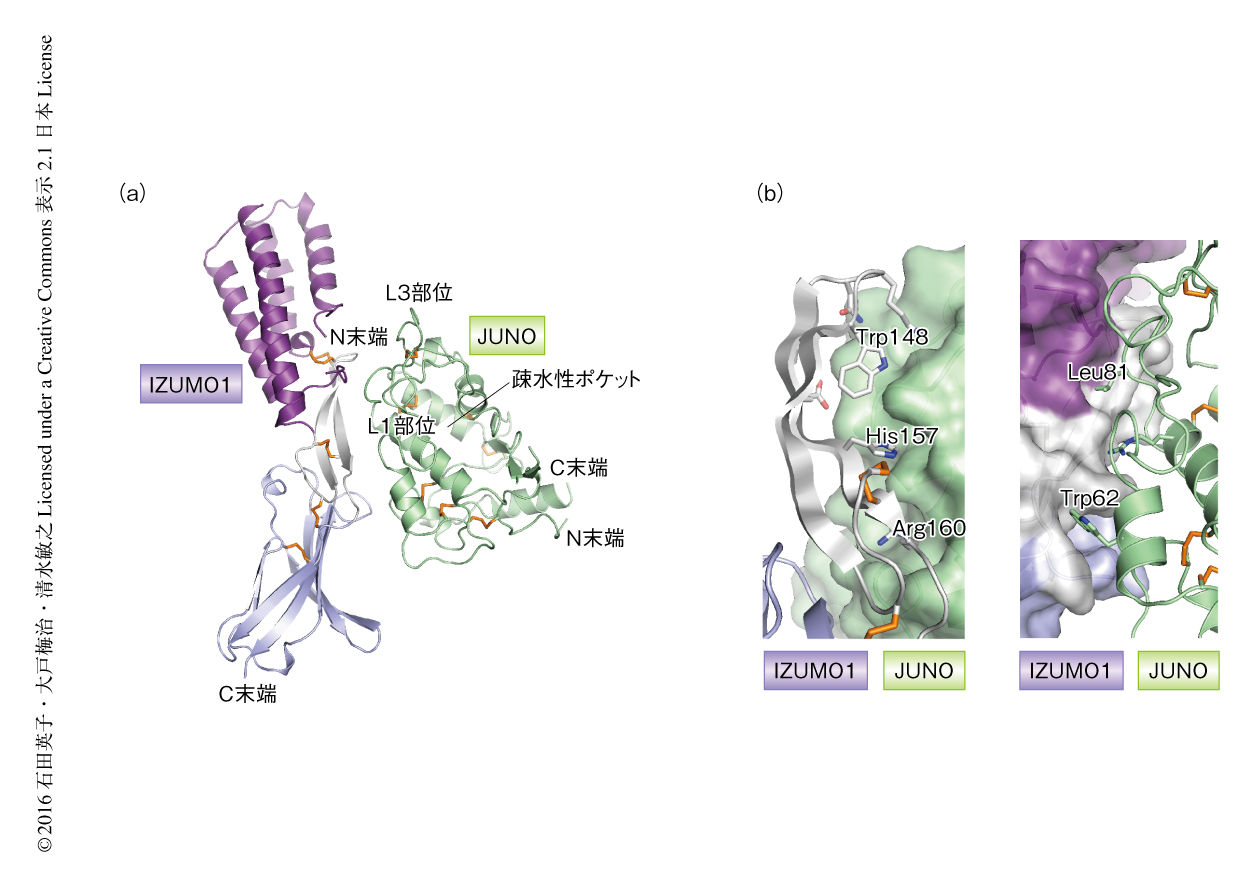
IZUMO1およびJUNOは結晶において1対1の複合体を形成していた(図2a).IZUMO1およびJUNOは複合体においても単体の場合と基本的に同じ構造をとっており,IZUMO1のβヘアピン構造の部分とJUNOの疎水性ポケットの裏側とが結合面を形成していた.IZUMO1とJUNOはおもに疎水性相互作用とファンデルワールス相互作用により結合しており,それらにくわえ6つの水素結合が結合に寄与していた.IZUMO1のTrp148とJUNOのTrp62が互いに相補的な形状で結合面を形成しており(図2b),これらのTrpはすべての種において保存されていた.JUNOのL1部位およびL3部位がIZUMO1との結合に関与し,その際,L1部位の保存されたGly80-Leu81モチーフが,IZUMO1の表面に相補的な形状で相互作用できるよう構造変化を起こしていた.実際に,これらの相互作用に関与する残基のうち,IZUMO1のTrp148,JUNOのTrp62およびLeu81への変異の導入により,IZUMO1とJUNOとの結合は低下した.
精子と卵との認識におけるIZUMO1とJUNOとの複合体の相互作用の機能的な関連について確かめるため,野生型あるいはJUNOとの相互作用面の残基に変異を導入したマウスのIzumo1を発現させたCOS-7細胞とマウスの卵母細胞との結合を解析した.その結果,変異を導入したIzumo1を発現させると卵母細胞と結合するCOS-7細胞の数は減少し,とくに,保存された残基に変異を導入したときには結合するCOS-7細胞の数はいちじるしく減少した.また,複数の変異を導入したIzumo1を発現させたCOS-7細胞は卵母細胞とまったく結合しなくなった.これらのことから,IZUMO1とJUNOとの相互作用が精子と卵との認識に重要であることが示された.
IZUMO1とJUNOとの相互作用には種特異性がみられる.たとえば,ヒトのIZUMO1はハムスターのJunoとは結合するが,マウスのJunoとは結合しない8,9,13).IZUMO1とJUNOとの相互作用面は,種間で保存性の高いコア領域と保存性の低い周辺領域から構成されていた.コア領域により共通した様式の結合,周辺領域により種特異的な結合が達成されるものと考えられた.
IZUMO1とJUNOが複合体を形成したのち,IZUMO1は構造変化を起こして二量体を形成し,これにともないIZUMO1とJUNOは解離するという仮説がたてられている14).しかし,超遠心分析の結果,単体のIZUMO1は高濃度の条件において二量体を形成するが,IZUMO1とJUNOとの1対1の複合体はそれ以上の多量体を形成しないことが明らかにされた.このため,この研究において構造の解かれたIZUMO1とJUNOとの複合体の構造は配偶子の接合において初期の段階の状態にあると考えられ,受精の過程においてはIZUMO1とJUNOとの複合体はさらに構造変化を起こすことが予想された.
JUNOとの結合に重要なIZUMO1のβヘアピン構造は,となりあうドメインとジスルフィド結合により連結されていた.IZUMO1は還元剤の存在のもとでは凝集体を形成したことから,還元剤への感受性が高いことが示された.一方,JUNOには還元剤の影響は確認されなかった.また,IZUMO1とJUNOとの結合は酸性条件において弱くなった.葉酸受容体はpHに依存して構造変化を起こすことが知られており10),同様に,JUNOも酸性条件においてはIZUMO1に対し親和性の低い構造をとる可能性がある.IZUMO1およびJUNOのもつこれらの性質は相互作用の制御にかかわる可能性が考えられる.また,受精ののちの過程にかかわる未知のタンパク質の存在する可能性もある.IZUMO1とJUNOとの認識ののち細胞膜の融合にいたる過程の解明には,さらなる研究が必要とされる.
Nature誌にこの論文と同時に掲載された別の研究グループによる論文において,基本的に同じ内容が報告された15).その論文においては,筆者らと同様に,X線結晶構造解析によりIZUMO1とJUNOとの複合体の構造を決定し,さらに種々の性状を解析していた.今回の研究により,IZUMO1とJUNOとの相互作用の様式が明らかにされ,受精における精子と卵との細胞膜の融合の最初の段階が構造的に示された.この情報をもとに,新たな非ホルモン性の避妊薬の開発へとつながることも期待される.
略歴:東京大学大学院薬学系研究科 特任研究員.
抱負:やるべきことをやる.
大戸 梅治(Umeharu Ohto)
東京大学大学院薬学系研究科 准教授.
清水 敏之(Toshiyuki Shimizu)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~kouzou/
© 2016 石田英子・大戸梅治・清水敏之 Licensed under CC 表示 2.1 日本
(東京大学大学院薬学系研究科 蛋白構造生物学教室)
email:石田英子,大戸梅治,清水敏之
DOI: 10.7875/first.author.2016.071
Structure of IZUMO1-JUNO reveals sperm-oocyte recognition during mammalian fertilization.
Umeharu Ohto, Hanako Ishida, Elena Krayukhina, Susumu Uchiyama, Naokazu Inoue, Toshiyuki Shimizu
Nature, 534, 566-569 (2016)
要 約
哺乳類の受精においては,オスとメスの配偶子である精子と卵が互いに認識して細胞膜を融合し,それぞれのもつ遺伝情報が組み合わされることにより新たな遺伝情報をもつ個体がつくりだされる.細胞膜の融合のためには配偶子どうしの認識が不可欠であり,精子および卵において互いの認識に関与するタンパク質の研究がなされてきたが,その特異的な認識の機構についての構造生物学的な知見は得られていない.今回,筆者らは,受精に必須のタンパク質として同定された精子の細胞膜に局在する膜タンパク質IZUMO1と,その卵の受容体JUNOについて,それぞれの単体および複合体の結晶構造を明らかにした.IZUMO1は,N末端側の4本のαへリックスが束になったIZUMOドメイン,中央部分のβヘアピン構造,C末端側の免疫グロブリン様ドメインから構成され,βヘアピン構造はジスルフィド結合によりIZUMOドメインおよび免疫グロブリン様ドメインと架橋され安定なロッド状の構造を形成していた.IZUMO1とJUNOは,IZUMO1のβヘアピン構造とJUNOの疎水性ポケットの裏側とで結合していた.構造にもとづく変異体を用いた解析により,IZUMO1とJUNOとの認識は生物学的に重要であることが証明された.この研究により,新しい避妊薬の開発など創薬への応用も期待される.
はじめに
ヒトにおいてはいちどに1億~3億の精子が射出され,そのうちひとつだけが卵と結合して受精卵となり,その直後に卵はほかの精子の受容能を失う1-4).この過程は複数の分子機構により厳密に制御されると考えられる.なかでも,受精においてもっとも重要な過程である細胞膜の融合にはとくに厳密な制御が必要とされる.IZUMO1は精子の細胞膜に局在するI型膜貫通タンパク質で,受精に必須のタンパク質として同定された5).αへリックスが束になったIZUMOドメインおよび免疫グロブリン様ドメインからなる細胞外領域とごく短い細胞内領域から構成され6),IZUMOドメインは精子と卵との結合に重要である7).JUNOは卵に存在するIZUMO1の受容体として同定された8).葉酸受容体ファミリーに属するGPIアンカー型膜タンパク質であるが,葉酸結合能をもたない8,9).IZUMO1およびJUNOは受精において決定的な役割をはたしており,避妊薬の標的ともなりうる.そのため,IZUMO1とJUNOとのあいだの特異的な認識の機構の解明が待望されていた.
1.細胞外領域の発現および性状の解析
ヒトのIZUMO1およびJUNOの細胞外領域をそれぞれ単独でショウジョウバエS2細胞において発現させ精製した試料を用いてその性状を解析した.ゲルろ過法および超遠心分析の結果,IZUMO1およびJUNOはいずれも溶液において単量体として存在した.等温滴定型カロリメトリー法により相互作用を解析した結果,IZUMO1とJUNOは結合比1対1,解離定数91 nMで結合することが示された.超遠心分析の結果からも,IZUMO1とJUNOは1対1の複合体を形成することが示された.また,IZUMO1およびJUNOはともに1箇所の糖鎖結合部位をもつが,糖鎖の有無は結合には影響しなかった.
2.IZUMO1およびJUNOの結晶構造解析
単体のIZUMO1につき1つ(PDB ID:5JK9),単体のJUNOにつき2つ(PDB ID:5JKA,5JKB),IZUMO1とJUNOとの複合体につき3つ(PDB ID:5JKC,5JKD,5JKE)の結晶構造が明らかにされた.その一部の結晶化においては,結晶の質の改善のため糖鎖の切断およびLysのアルキル化などの処理をしたタンパク質を用いた.
3.単体のIZUMO1の構造
ヒトのIZUMO1は長辺が約90Åのロッド状の構造をしており,N末端側の4本のαへリックスの束からなるIZUMOドメイン,中央のβヘアピン構造,C末端側の免疫グロブリン様ドメインから構成されていた(図1a).IZUMO1には哺乳動物において保存されている10個のCysがあり,すべてジスルフィド結合を形成していた.Cys22-Cys149およびCys25-Cys152はIZUMOドメインとβヘアピン構造,Cys139-Cys165はβヘアピン構造と免疫グロブリン様ドメインを架橋していた.これらのジスルフィド結合により,3つのドメインは互いに独立な配向をとるのではなく,一定の配向を保持したひとつづきのロッド状の構造を形成するものと考えられた.また,Cys135-Cys159はβヘアピン構造の内部,Cys182-Cys233は免疫グロブリン様ドメインの内部においてジスルフィド結合を形成していた.
4.単体のJUNOの構造および葉酸受容体との比較
ヒトのJUNOは高い配列相同性をもつ葉酸受容体と類似した全体構造をしていた(図1b).8本のαへリックスと4つのβストランドが8つのジスルフィド結合により連結された球状の構造をしており,このジスルフィド結合は葉酸受容体10,11),リボフラビン結合タンパク質12),JUNOに共通してみられた.JUNOには葉酸受容体における葉酸結合ポケットに相当する疎水性ポケットが存在したが,葉酸との結合能はもたない8).葉酸受容体とJUNOとで疎水性ポケットに存在する疎水性残基はほとんど保存されていた.一方,葉酸受容体はそれらによる疎水性相互作用にくわえ,葉酸のプテリン部位と複数の残基を介して極性相互作用を形成するが10,11),これらの残基はひとつを除きJUNOにおいては保存されていなかった.さらに,葉酸受容体とは異なり,JUNOにおいてTrp190の側鎖は疎水性ポケットをせばめるかたちで配向していた.これらの違いにより,JUNOは葉酸との結合能をもたないものと考えられた.
5.IZUMO1とJUNOとの複合体における認識の機構
IZUMO1およびJUNOは結晶において1対1の複合体を形成していた(図2a).IZUMO1およびJUNOは複合体においても単体の場合と基本的に同じ構造をとっており,IZUMO1のβヘアピン構造の部分とJUNOの疎水性ポケットの裏側とが結合面を形成していた.IZUMO1とJUNOはおもに疎水性相互作用とファンデルワールス相互作用により結合しており,それらにくわえ6つの水素結合が結合に寄与していた.IZUMO1のTrp148とJUNOのTrp62が互いに相補的な形状で結合面を形成しており(図2b),これらのTrpはすべての種において保存されていた.JUNOのL1部位およびL3部位がIZUMO1との結合に関与し,その際,L1部位の保存されたGly80-Leu81モチーフが,IZUMO1の表面に相補的な形状で相互作用できるよう構造変化を起こしていた.実際に,これらの相互作用に関与する残基のうち,IZUMO1のTrp148,JUNOのTrp62およびLeu81への変異の導入により,IZUMO1とJUNOとの結合は低下した.
精子と卵との認識におけるIZUMO1とJUNOとの複合体の相互作用の機能的な関連について確かめるため,野生型あるいはJUNOとの相互作用面の残基に変異を導入したマウスのIzumo1を発現させたCOS-7細胞とマウスの卵母細胞との結合を解析した.その結果,変異を導入したIzumo1を発現させると卵母細胞と結合するCOS-7細胞の数は減少し,とくに,保存された残基に変異を導入したときには結合するCOS-7細胞の数はいちじるしく減少した.また,複数の変異を導入したIzumo1を発現させたCOS-7細胞は卵母細胞とまったく結合しなくなった.これらのことから,IZUMO1とJUNOとの相互作用が精子と卵との認識に重要であることが示された.
IZUMO1とJUNOとの相互作用には種特異性がみられる.たとえば,ヒトのIZUMO1はハムスターのJunoとは結合するが,マウスのJunoとは結合しない8,9,13).IZUMO1とJUNOとの相互作用面は,種間で保存性の高いコア領域と保存性の低い周辺領域から構成されていた.コア領域により共通した様式の結合,周辺領域により種特異的な結合が達成されるものと考えられた.
IZUMO1とJUNOが複合体を形成したのち,IZUMO1は構造変化を起こして二量体を形成し,これにともないIZUMO1とJUNOは解離するという仮説がたてられている14).しかし,超遠心分析の結果,単体のIZUMO1は高濃度の条件において二量体を形成するが,IZUMO1とJUNOとの1対1の複合体はそれ以上の多量体を形成しないことが明らかにされた.このため,この研究において構造の解かれたIZUMO1とJUNOとの複合体の構造は配偶子の接合において初期の段階の状態にあると考えられ,受精の過程においてはIZUMO1とJUNOとの複合体はさらに構造変化を起こすことが予想された.
JUNOとの結合に重要なIZUMO1のβヘアピン構造は,となりあうドメインとジスルフィド結合により連結されていた.IZUMO1は還元剤の存在のもとでは凝集体を形成したことから,還元剤への感受性が高いことが示された.一方,JUNOには還元剤の影響は確認されなかった.また,IZUMO1とJUNOとの結合は酸性条件において弱くなった.葉酸受容体はpHに依存して構造変化を起こすことが知られており10),同様に,JUNOも酸性条件においてはIZUMO1に対し親和性の低い構造をとる可能性がある.IZUMO1およびJUNOのもつこれらの性質は相互作用の制御にかかわる可能性が考えられる.また,受精ののちの過程にかかわる未知のタンパク質の存在する可能性もある.IZUMO1とJUNOとの認識ののち細胞膜の融合にいたる過程の解明には,さらなる研究が必要とされる.
おわりに
Nature誌にこの論文と同時に掲載された別の研究グループによる論文において,基本的に同じ内容が報告された15).その論文においては,筆者らと同様に,X線結晶構造解析によりIZUMO1とJUNOとの複合体の構造を決定し,さらに種々の性状を解析していた.今回の研究により,IZUMO1とJUNOとの相互作用の様式が明らかにされ,受精における精子と卵との細胞膜の融合の最初の段階が構造的に示された.この情報をもとに,新たな非ホルモン性の避妊薬の開発へとつながることも期待される.
文 献
- Klinovska, K., Sebkova, N. & Dvorakova-Hortova, K.: Sperm-egg fusion: a molecular enigma of mammalian reproduction. Int. J. Mol. Sci., 15, 10652-10668 (2014)[PubMed]
- Okabe, M.: The cell biology of mammalian fertilization. Development, 140, 4471-4479 (2013)[PubMed]
- Evans, J. P.: Sperm-egg interaction. Annu. Rev. Physiol., 74, 477-502 (2012)[PubMed]
- Knobil, E. & Neill, J. D. (eds.): The Physiology of Reproduction (2nd Ed.). Raven Press, New York (1994)
- Inoue, N., Ikawa, M., Isotani, A. et al.: The immunoglobulin superfamily protein Izumo is required for sperm to fuse with eggs. Nature, 434, 234-238 (2005)[PubMed]
- Ellerman, D. A., Pei, J., Guptam, S. et al.: Izumo is part of a multiprotein family whose members form large complexes on mammalian sperm. Mol. Reprod. Dev., 76, 1188-1199 (2009)[PubMed]
- Inoue, N., Hamada, D., Kamikubo, H. et al.: Molecular dissection of IZUMO1, a sperm protein essential for sperm-egg fusion. Development, 140, 3221-3229 (2013)[PubMed]
- Bianchi, E., Doe, B., Goulding, D. et al.: Juno is the egg Izumo receptor and is essential for mammalian fertilization. Nature, 508, 483-487 (2014)[PubMed]
- Han, L., Nishimura, K., Sadat Al Hosseini, H. et al.: Divergent evolution of vitamin B9 binding underlies Junomediated adhesion of mammalian gametes. Curr. Biol., 26, R100-R101 (2016)[PubMed]
- Wibowo, A. S., Singh, M., Reeder, K. M. et al.: Structures of human folate receptors reveal biological trafficking states and diversity in folate and antifolate recognition. Proc. Natl Acad. Sci. USA, 110, 15180-15188 (2013)[PubMed]
- Chen, C., Ke, J., Zhou, X. E. et al.: Structural basis for molecular recognition of folic acid by folate receptors. Nature, 500, 486-489 (2013)[PubMed]
- Monaco, H. L.: Crystal structure of chicken riboflavin-binding protein. EMBO J., 16, 1475-1483 (1997)[PubMed]
- Bianchi, E. & Wright, G. J.: Cross-species fertilization: the hamster egg receptor, Juno, binds the human sperm ligand, Izumo1. Philos. Trans. R. Soc. Lond. B Biol. Sci., 370, 20140101 (2015)[PubMed]
- Inoue, N., Hagihara, Y., Wright, D. et al.: Oocyte-triggered dimerization of sperm IZUMO1 promotes sperm-egg fusion in mice. Nat. Commun., 6, 8858 (2015)[PubMed]
- Aydin, H., Sultana, A., Li, S. et al.: Molecular architecture of the human sperm IZUMO1 and egg JUNO fertilization complex. Nature, 534, 562-565 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:東京大学大学院薬学系研究科 特任研究員.
抱負:やるべきことをやる.
大戸 梅治(Umeharu Ohto)
東京大学大学院薬学系研究科 准教授.
清水 敏之(Toshiyuki Shimizu)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~kouzou/
© 2016 石田英子・大戸梅治・清水敏之 Licensed under CC 表示 2.1 日本