ヒストンアセチル化酵素KAT7はヘテロクロマチンの拡大からセントロメアを守る
大関淳一郎・舛本 寛
(かずさDNA研究所 細胞工学研究室)
email:大関淳一郎,舛本 寛
DOI: 10.7875/first.author.2016.066
KAT7/HBO1/MYST2 regulates CENP-A chromatin assembly by antagonizing Suv39h1-mediated centromere inactivation.
Jun-ichirou Ohzeki, Nobuaki Shono, Koichiro Otake, Nuno M.C. Martins, Kazuto Kugou, Hiroshi Kimura, Takahiro Nagase, Vladimir Larionov, William C. Earnshaw, Hiroshi Masumoto
Developmental Cell, 37, 413-427 (2016)
染色体の均等な分配に必須なセントロメアには,ヒストンH3の代わりにそのバリアントであるCENP-Aを含むヌクレオソームが集合し,これを指標としてキネトコア構造が形成される.ヒトにおいては,アルフォイドDNAとよばれる171 bpを単位とする巨大な反復DNA領域にCENP-Aを含むヌクレオソームが集合しセントロメアのクロマチンを形成するが,この領域にはヘテロクロマチンも形成される.ヘテロクロマチンはM期において姉妹染色分体の接着を維持し染色体分配の安定性に寄与する反面,近傍のセントロメアのクロマチンへと拡大する.このように,いっけん拮抗するセントロメアとヘテロクロマチンが同一の領域において共存しその機能を維持する機構についてはほとんどわかっていなかった.今回,筆者らは,ヒストンアセチル化酵素であるKAT7がセントロメアタンパク質であるM18BP1と相互作用しセントロメアに集合することを見い出した.KAT7によるヒストンのアセチル化は,ヘテロクロマチンにおいてLys9のトリメチル化されたヒストンH3を除去し,そこに新しくCENP-Aをもつヌクレオソームを補充することにより,ヘテロクロマチンの拡大からセントロメアを守っていることが明らかにされた.
染色体分配の機構に乱れが生じると細胞死,異常増殖,疾病などの原因になるため,その過程はきわめて正確に制御される必要がある.この染色体分配に必須な役割をはたす領域がセントロメアである.セントロメアのクロマチンに含まれるCENP-Aを含むヌクレオソームはセントロメアに特異的なタンパク質の集合に必須であり,M期においてはセントロメアのクロマチンにキネトコア構造が形成される.キネトコアはセントロメアと紡錘体微小管との相互作用をチェックするとともに,染色体の動きを制御する.現在では,100をこえるタンパク質がこのキネトコア構造に集合すると考えられている1-3).
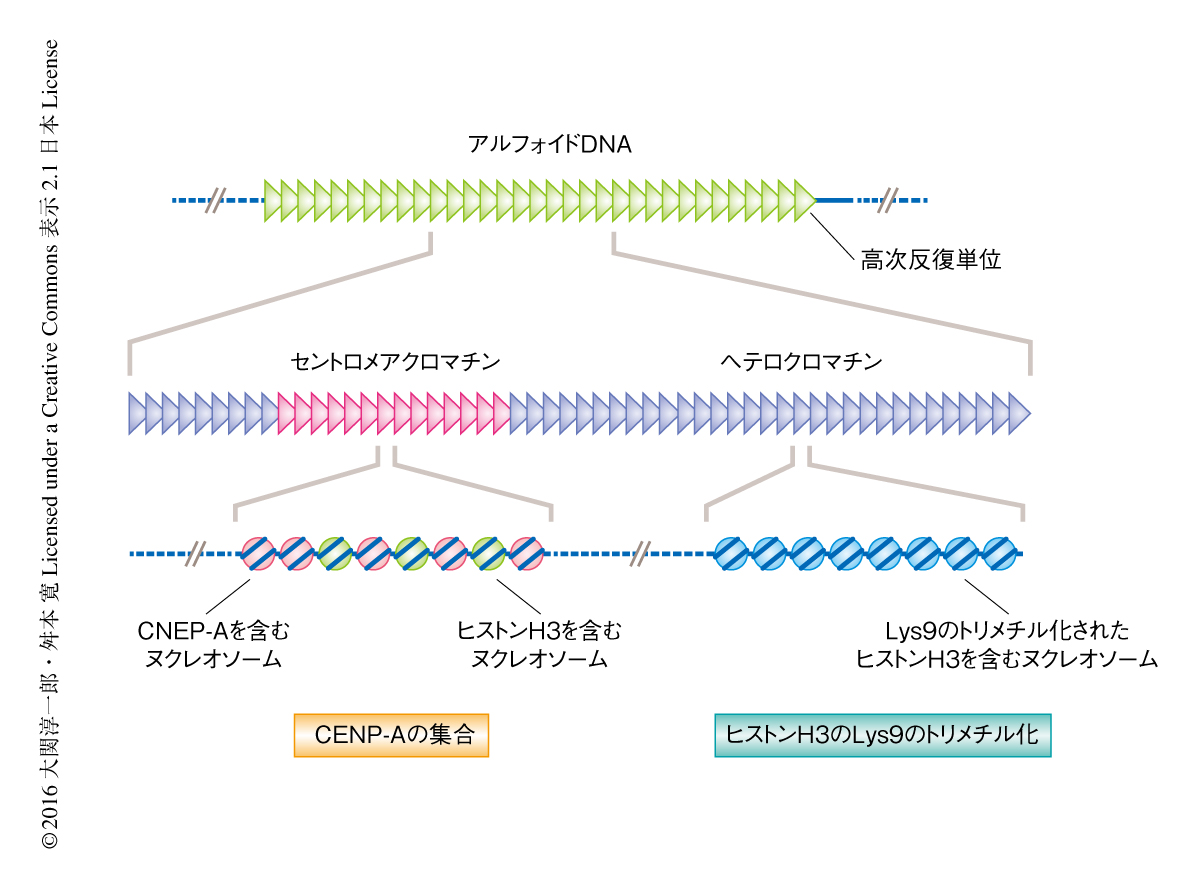
ヒトの染色体においては,アルフォイドDNAとよばれる171 bpを単位とする0.5 Mbから数Mbにもおよぶ巨大な領域にセントロメアが形成される.CENP-Aを含むヌクレオソームが集合するのはこの領域の一部であり,残りの大部分はLys9のトリメチル化されたヒストンH3に富んだヘテロクロマチンによりしめられる(図1).このヘテロクロマチンはコヒーシンの集合を促進し,M期において姉妹染色分体の接着を維持することにより染色体の均等な分配に重要なはたらきをする.また,Lys9のトリメチル化されたヒストンH3と結合するHP1はヒストンメチル化酵素であるSuv39h1との相互作用を介し,近傍のヒストンH3にもLys9のトリメチル化を導入し,隣接する領域へのヘテロクロマチンの拡大にかかわる4).
アルフォイドDNAから新規に機能をもつセントロメアの構造を形成させることも可能である.ゲノムDNAからクローニングされた30~80 kbのアルフォイドDNAをヒトの培養細胞であるHT1080細胞に導入すると,複数の導入DNAが連結して新規にセントロメアが形成される.セントロメアの機能を獲得した導入DNAは,宿主のほかの染色体から独立して安定に分配および維持されることから,ヒト人工染色体とよばれる5,6).この新規のセントロメアの形成には,アルフォイドDNAの171 bpの反復単位において2回に1回の頻度で出現するCENP-Bボックスおよびこれに結合するCENP-Bが必要である7-9).
さらに,セントロメアの新規の形成および維持はヒストンの修飾により制御される.HeLa細胞,U2OS細胞,TIG7細胞などにおいては,HT1080細胞と比較して,アルフォイドDNAが強くヘテロクロマチン化される傾向にあり,このような細胞にアルフォイドDNAを導入しても新規のセントロメアの形成は抑制される.実際に,アルフォイドDNAおよびアルフォイドDNAと結合するCENP-Bには,セントロメアのクロマチンだけでなく,ヘテロクロマチンも新規に形成する能力のあることがわかってきた.そこで,筆者らは,テトラサイクリンのオペレーター配列を挿入した人工のアルフォイドDNAを合成し,ここにテトラサイクリンのリプレッサーとの融合タンパク質を結合させる実験系を開発した10).この人工のアルフォイドDNAにヒストンアセチル化酵素を結合させることにより,強すぎるヘテロクロマチン化活性に拮抗して,アルフォイドDNAのうえに新規にセントロメアの形成されることが見い出された11).
このようなヘテロクロマチン化活性の強い細胞においても,いったん確立された人工の染色体におけるセントロメアの構造はアセチル化酵素の結合なしに自律的に維持された.一方で,この人工の染色体にヒストンメチル化酵素Suv39h1を結合させてさらにヘテロクロマチン化を強めると,CENP-Aを含むヌクレオソームが減少しセントロメアの機能が失われることも判明した11).これらのことから,ヘテロクロマチン化活性の強すぎる場合にはセントロメアの形成が抑えられること,また,いったん確立されたセントロメアにはヘテロクロマチン化による不活性化をふせぐ内在性の機構の存在することが示唆されていた.
セントロメアにおけるCENP-Aの補充の機構とヒストンのアセチル化との関連も示唆されている.S期においてはセントロメアDNAも複製されるが,このときCENP-Aを含むヌクレオソームは同時には補充されず,複製したDNAあたりのCENP-Aの量は半減する.この半減した状態でM期におけるキネトコアの形成および染色体分配が起こり,つぎのG1期においてCENP-Aが補充されることによりセントロメアのエピジェネティックな記憶が保たれる.このCENP-Aの補充にかかわるMis18複合体はM期の終期からG1期にかけてセントロメアに一過的に集合する.Mis18複合体はCENP-Aの分子シャペロンであるHJURPとの相互作用を介しCENP-Aを補充する.このMis18複合体のサブユニットのひとつであるMis18αをノックダウンするとCENP-Aの補充は起こらなくなる.ところが,この細胞をヒストン脱アセチル化酵素の阻害剤であるトリコスタチンAにより処理しヒストンを高アセチル化の状態にすると,新規に合成されたCENP-Aが補充されるようになった12).そこで,この研究においては,Mis18複合体と相互作用する内在性のアセチル化酵素が存在しセントロメアとヘテロクロマチンの共存にかかわるのではないかという仮説をたてた.
Mis18複合体と相互作用する内在性のアセチル化酵素を探索するため,テトラサイクリンのオペレーター配列を挿入したアルフォイドDNAが宿主の染色体の腕部に異所的に挿入されたHeLa細胞株と,約1万のヒトの完全長遺伝子cDNAを含むHaloタグ融合遺伝子ライブラリーを用いた.この人工のアルフォイドDNAを挿入した部位は強くヘテロクロマチン化されCENP-Aは集合していなかった.人工のアルフォイドDNAを挿入した部位にMis18複合体のサブユニットであるhMis18α,hMis18β,M18BPを結合させ,ここに,Haloタグを融合させたヒストンアセチル化酵素が集合するかどうかを,顕微鏡を用いた観察により検証した.その結果,15種類のヒストンアセチル化酵素のうち,KAT7(HBO1,あるいは,MYST2ともよばれる)がM18BP1と相互作用することがつきとめられた.
同様のタンパク質間相互作用ネットワークの解析により,さらに,KAT7-Mis18複合体とHJURP,BRPF2,ING4,ING5が複合体を形成することが見い出された.また,KAT7あるいはほかのヒストンアセチル化酵素であるPCAFを人工のアルフォイドDNAを挿入した部位に結合させると,この部位にCENP-Aの集合へのかかわりの示唆されていたクロマチンリモデリングタンパク質RSF1が集合した.免疫沈降実験においてRSF1はKAT7あるいはM18BP1と共沈降しなかったことから,RSF1はクロマチンにおいてヒストンのアセチル化を認識して集合すると考えられた.
Mis18複合体はG1期のセントロメアに局在するが,Mis18複合体と相互作用するKAT7,BRPF2,ING4,ING5もG1期のセントロメアに局在することが顕微鏡を用いた観察により確認された.また,KAT7はG1期のセントロメアにおいてHJURPおよび新たに補充されたCENP-Aと共局在し,KAT7とCENP-Aの補充の機構との関連が示唆された.そこで,KAT7を欠損したHeLa細胞株を作製したところ,KAT7ノックアウト細胞においては,セントロメアに集合したCENP-Aの総量,および,新規に補充されたCENP-Aの量がともにもとのHeLa細胞の約半分まで低下した.セントロメアに集合したCENP-Aの量の低下は染色体分配を不安定化させることが予想された.そこで,M期において染色体の整列および分配に異常が生じる頻度を顕微鏡を用いた観察により解析したところ,KAT7ノックアウト細胞においてはもとのHeLa細胞の約3.8倍も染色体の整列および分配に異常が起こった.
Suv39h1の過剰な発現はセントロメアの近傍のヘテロクロマチン化を促進する11).KAT7がセントロメアへのヘテロクロマチンの拡大をふせぐはたらきをもつのであれば,KAT7ノックアウト細胞はSuv39h1の過剰発現に対し感受性となり,染色体の整列および分配の異常が増加すると予想された.実際に,KAT7ノックアウト細胞ではもとのHeLa細胞と比較して,Suv39h1の過剰発現のもとでは約11倍の頻度で染色体の整列および分配に異常が起こった.
セントロメアが機能を失い染色体分配が正しく起こらない場合,染色体は核の外に取り残されて微小核を形成する.顕微鏡による観察の結果,もとのHeLa細胞に比べ,KAT7ノックアウト細胞では約13倍,さらにSuv39h1を発現した場合には約120倍の頻度で微小核が生じた.また,微小核となった染色体のセントロメアにおいては,セントロメアに集合したCENP-Aの量は核に存在する正常なセントロメアの平均に比べ約80%も減少していた.これらの解析の結果から,KAT7にはSuv39h1によるヒストンH3のLys9のトリメチル化を介したヘテロクロマチン化の拡大から,CENP-Aのセントロメアへの集合の機構やセントロメアの機能を守るはたらきのあることが示唆された.
ヒストンH3のLys9のトリメチル化に対するKAT7の効果について調べるため,人工のアルフォイドDNAを異所的に挿入した部位にKAT7を結合させた.その結果,KAT7は約2割の細胞においてヒストンH3のLys9のトリメチル化を減少させた.また,人工のアルフォイドDNAを異所的に挿入した部位にヒストンのアセチル化したクロマチンに集合するRSF1を結合させたところ,約4割の細胞においてヒストンH3のLys9のトリメチル化は減少した.
KAT7やRSF1がどのようにヒストンH3のLys9のトリメチル化を減少させるのかについては,2つの可能性が考えられた.ひとつは単純にヒストンH3のLys9を脱メチル化する可能性,もうひとつはLys9がトリメチル化されたヒストンH3をクロマチンから除去する可能性である.ヒストンH3を除去する場合には,新しいヒストンを取り込む余地が生じる.実際に,人工のアルフォイドDNAを異所的に挿入した部位にKAT7あるいはRSF1を結合させたときには,その部位にCENP-AあるいはヒストンH3.3が新規に集合した.一方,ヒストンH3のLys9のトリメチル化の脱メチル化酵素であるJMJD2Bを結合させたときには,ヒストンH3のLys9のトリメチル化はほぼすべて消失したが,新規のヒストンの集合は起こらなかった.
これらの結果から,KAT7やRSF1はLys9がトリメチル化されたヒストンH3をクロマチンから除去することにより,ヘテロクロマチンの拡大をふせぐと同時に,CENP-Aがセントロメアに集合できる余地をつくりだしていることがわかった.また,人工のアルフォイドDNAを異所的に挿入した部位にKAT7あるいはRSF1を結合させると,その領域の転写は約2倍に上昇した.このヒストンの交換反応には転写の機構がかかわる可能性もある.
分裂酵母においてはセントロメアのコア領域とヘテロクロマチン領域とのあいだにtRNA遺伝子クラスターが存在し,これを除去するとヘテロクロマチンがセントロメアへと拡大し染色体分配が不安定化することが知られている.一方,ヒトのセントロメアにおいてはセントロメアのクロマチンとヘテロクロマチンとを分断するDNA配列の防壁はみつかっていない.今回の研究により,Mis18複合体はKAT7やHJURPと相互作用すること,KAT7はヒストンのアセチル化を介しRSF1を集合させることがわかった.また,筆者らおよびほかの研究グループにより,M18BP1はCENP-Aを含むヌクレオソームと直接に結合するCENP-Cと相互作用し,セントロメアに集合することも明らかにされている13).これらのことから,ヒトにおいては,CENP-Aを含むヌクレオソームの分布するセントロメアのクロマチンにおいて,CENP-CおよびM18BP1を介しKAT7およびRSF1が集合し,Lys9がトリメチル化されたヒストンH3を除去する.ここにHJURPが相互作用し,新規にCENP-Aを補充する.Mis18複合体の下流においてこれらがほぼ同時に起こることにより,つねにヘテロクロマチンが拡大してくるセントロメアを補修する機構の存在が示唆された(図2).これを単純化していい換えれば,セントロメアのクロマチンそれ自体が,ヘテロクロマチンの拡大をふせぐエピジェネティックな防壁の機構を備えている.このヘテロクロマチンの拡大とセントロメアの補修の機構の動的なバランスが拮抗することにより,M期において姉妹染色体の接着とキネトコアの機能とが両立し,正確な染色体分配が遂行されると考えられた.
KAT7はCDT1を介して複製起点に集合し,MCM複合体のクロマチンへの集合を促進するはたらきのあることも知られている.M18BP1やCDT1など相互作用のパートナーを変えることにより,同じKAT7がセントロメアあるいは複製起点など染色体の異なる領域においてそれぞれ別の機能を制御することは興味深い.このような多様な機構にかかわるクロマチンタンパク質のもつ異なるはたらきを明らかにすることにより,新しい制御機構のネットワークも明らかになると期待される.さらに,新規のセントロメアの形成およびヘテロクロマチンの形成にかかわるCENP-Bが8),どのようにしてこれらの異なるクロマチンの形成を同一のアルフォイドDNAにおいて誘導できるのか,セントロメアにおけるヒストンのアセチル化やヘテロクロマチンにおけるヒストンH3のLys9のトリメチル化はこれとどうかかわるのか,興味はつきない.
略歴:2003年 名古屋大学大学院理学研究科博士課程 修了,同年 米国NIH National Cancer InstituteにてVisiting Fellowを経て,2008年よりかずさDNA研究所 研究員.
研究テーマ:染色体分配の機構,人工染色体の構築.
関心事:Genome Project-Write,人工染色体を用いた人工オルガネラの創成とその応用.
舛本 寛(Hiroshi Masumoto)
かずさDNA研究所 室長.
研究室URL:http://www.kazusa.or.jp/j/laboratories/lab_ce.html
© 2016 大関淳一郎・舛本 寛 Licensed under CC 表示 2.1 日本
(かずさDNA研究所 細胞工学研究室)
email:大関淳一郎,舛本 寛
DOI: 10.7875/first.author.2016.066
KAT7/HBO1/MYST2 regulates CENP-A chromatin assembly by antagonizing Suv39h1-mediated centromere inactivation.
Jun-ichirou Ohzeki, Nobuaki Shono, Koichiro Otake, Nuno M.C. Martins, Kazuto Kugou, Hiroshi Kimura, Takahiro Nagase, Vladimir Larionov, William C. Earnshaw, Hiroshi Masumoto
Developmental Cell, 37, 413-427 (2016)
要 約
染色体の均等な分配に必須なセントロメアには,ヒストンH3の代わりにそのバリアントであるCENP-Aを含むヌクレオソームが集合し,これを指標としてキネトコア構造が形成される.ヒトにおいては,アルフォイドDNAとよばれる171 bpを単位とする巨大な反復DNA領域にCENP-Aを含むヌクレオソームが集合しセントロメアのクロマチンを形成するが,この領域にはヘテロクロマチンも形成される.ヘテロクロマチンはM期において姉妹染色分体の接着を維持し染色体分配の安定性に寄与する反面,近傍のセントロメアのクロマチンへと拡大する.このように,いっけん拮抗するセントロメアとヘテロクロマチンが同一の領域において共存しその機能を維持する機構についてはほとんどわかっていなかった.今回,筆者らは,ヒストンアセチル化酵素であるKAT7がセントロメアタンパク質であるM18BP1と相互作用しセントロメアに集合することを見い出した.KAT7によるヒストンのアセチル化は,ヘテロクロマチンにおいてLys9のトリメチル化されたヒストンH3を除去し,そこに新しくCENP-Aをもつヌクレオソームを補充することにより,ヘテロクロマチンの拡大からセントロメアを守っていることが明らかにされた.
はじめに
染色体分配の機構に乱れが生じると細胞死,異常増殖,疾病などの原因になるため,その過程はきわめて正確に制御される必要がある.この染色体分配に必須な役割をはたす領域がセントロメアである.セントロメアのクロマチンに含まれるCENP-Aを含むヌクレオソームはセントロメアに特異的なタンパク質の集合に必須であり,M期においてはセントロメアのクロマチンにキネトコア構造が形成される.キネトコアはセントロメアと紡錘体微小管との相互作用をチェックするとともに,染色体の動きを制御する.現在では,100をこえるタンパク質がこのキネトコア構造に集合すると考えられている1-3).
ヒトの染色体においては,アルフォイドDNAとよばれる171 bpを単位とする0.5 Mbから数Mbにもおよぶ巨大な領域にセントロメアが形成される.CENP-Aを含むヌクレオソームが集合するのはこの領域の一部であり,残りの大部分はLys9のトリメチル化されたヒストンH3に富んだヘテロクロマチンによりしめられる(図1).このヘテロクロマチンはコヒーシンの集合を促進し,M期において姉妹染色分体の接着を維持することにより染色体の均等な分配に重要なはたらきをする.また,Lys9のトリメチル化されたヒストンH3と結合するHP1はヒストンメチル化酵素であるSuv39h1との相互作用を介し,近傍のヒストンH3にもLys9のトリメチル化を導入し,隣接する領域へのヘテロクロマチンの拡大にかかわる4).
アルフォイドDNAから新規に機能をもつセントロメアの構造を形成させることも可能である.ゲノムDNAからクローニングされた30~80 kbのアルフォイドDNAをヒトの培養細胞であるHT1080細胞に導入すると,複数の導入DNAが連結して新規にセントロメアが形成される.セントロメアの機能を獲得した導入DNAは,宿主のほかの染色体から独立して安定に分配および維持されることから,ヒト人工染色体とよばれる5,6).この新規のセントロメアの形成には,アルフォイドDNAの171 bpの反復単位において2回に1回の頻度で出現するCENP-Bボックスおよびこれに結合するCENP-Bが必要である7-9).
さらに,セントロメアの新規の形成および維持はヒストンの修飾により制御される.HeLa細胞,U2OS細胞,TIG7細胞などにおいては,HT1080細胞と比較して,アルフォイドDNAが強くヘテロクロマチン化される傾向にあり,このような細胞にアルフォイドDNAを導入しても新規のセントロメアの形成は抑制される.実際に,アルフォイドDNAおよびアルフォイドDNAと結合するCENP-Bには,セントロメアのクロマチンだけでなく,ヘテロクロマチンも新規に形成する能力のあることがわかってきた.そこで,筆者らは,テトラサイクリンのオペレーター配列を挿入した人工のアルフォイドDNAを合成し,ここにテトラサイクリンのリプレッサーとの融合タンパク質を結合させる実験系を開発した10).この人工のアルフォイドDNAにヒストンアセチル化酵素を結合させることにより,強すぎるヘテロクロマチン化活性に拮抗して,アルフォイドDNAのうえに新規にセントロメアの形成されることが見い出された11).
このようなヘテロクロマチン化活性の強い細胞においても,いったん確立された人工の染色体におけるセントロメアの構造はアセチル化酵素の結合なしに自律的に維持された.一方で,この人工の染色体にヒストンメチル化酵素Suv39h1を結合させてさらにヘテロクロマチン化を強めると,CENP-Aを含むヌクレオソームが減少しセントロメアの機能が失われることも判明した11).これらのことから,ヘテロクロマチン化活性の強すぎる場合にはセントロメアの形成が抑えられること,また,いったん確立されたセントロメアにはヘテロクロマチン化による不活性化をふせぐ内在性の機構の存在することが示唆されていた.
セントロメアにおけるCENP-Aの補充の機構とヒストンのアセチル化との関連も示唆されている.S期においてはセントロメアDNAも複製されるが,このときCENP-Aを含むヌクレオソームは同時には補充されず,複製したDNAあたりのCENP-Aの量は半減する.この半減した状態でM期におけるキネトコアの形成および染色体分配が起こり,つぎのG1期においてCENP-Aが補充されることによりセントロメアのエピジェネティックな記憶が保たれる.このCENP-Aの補充にかかわるMis18複合体はM期の終期からG1期にかけてセントロメアに一過的に集合する.Mis18複合体はCENP-Aの分子シャペロンであるHJURPとの相互作用を介しCENP-Aを補充する.このMis18複合体のサブユニットのひとつであるMis18αをノックダウンするとCENP-Aの補充は起こらなくなる.ところが,この細胞をヒストン脱アセチル化酵素の阻害剤であるトリコスタチンAにより処理しヒストンを高アセチル化の状態にすると,新規に合成されたCENP-Aが補充されるようになった12).そこで,この研究においては,Mis18複合体と相互作用する内在性のアセチル化酵素が存在しセントロメアとヘテロクロマチンの共存にかかわるのではないかという仮説をたてた.
1.人工のアルフォイドDNAを用いたタンパク質間相互作用ネットワークの解析
Mis18複合体と相互作用する内在性のアセチル化酵素を探索するため,テトラサイクリンのオペレーター配列を挿入したアルフォイドDNAが宿主の染色体の腕部に異所的に挿入されたHeLa細胞株と,約1万のヒトの完全長遺伝子cDNAを含むHaloタグ融合遺伝子ライブラリーを用いた.この人工のアルフォイドDNAを挿入した部位は強くヘテロクロマチン化されCENP-Aは集合していなかった.人工のアルフォイドDNAを挿入した部位にMis18複合体のサブユニットであるhMis18α,hMis18β,M18BPを結合させ,ここに,Haloタグを融合させたヒストンアセチル化酵素が集合するかどうかを,顕微鏡を用いた観察により検証した.その結果,15種類のヒストンアセチル化酵素のうち,KAT7(HBO1,あるいは,MYST2ともよばれる)がM18BP1と相互作用することがつきとめられた.
同様のタンパク質間相互作用ネットワークの解析により,さらに,KAT7-Mis18複合体とHJURP,BRPF2,ING4,ING5が複合体を形成することが見い出された.また,KAT7あるいはほかのヒストンアセチル化酵素であるPCAFを人工のアルフォイドDNAを挿入した部位に結合させると,この部位にCENP-Aの集合へのかかわりの示唆されていたクロマチンリモデリングタンパク質RSF1が集合した.免疫沈降実験においてRSF1はKAT7あるいはM18BP1と共沈降しなかったことから,RSF1はクロマチンにおいてヒストンのアセチル化を認識して集合すると考えられた.
2.KAT7のノックアウトはCENP-Aの量を半減させ染色体分配を不安定にする
Mis18複合体はG1期のセントロメアに局在するが,Mis18複合体と相互作用するKAT7,BRPF2,ING4,ING5もG1期のセントロメアに局在することが顕微鏡を用いた観察により確認された.また,KAT7はG1期のセントロメアにおいてHJURPおよび新たに補充されたCENP-Aと共局在し,KAT7とCENP-Aの補充の機構との関連が示唆された.そこで,KAT7を欠損したHeLa細胞株を作製したところ,KAT7ノックアウト細胞においては,セントロメアに集合したCENP-Aの総量,および,新規に補充されたCENP-Aの量がともにもとのHeLa細胞の約半分まで低下した.セントロメアに集合したCENP-Aの量の低下は染色体分配を不安定化させることが予想された.そこで,M期において染色体の整列および分配に異常が生じる頻度を顕微鏡を用いた観察により解析したところ,KAT7ノックアウト細胞においてはもとのHeLa細胞の約3.8倍も染色体の整列および分配に異常が起こった.
3.KAT7はヘテロクロマチン化からセントロメアを守る
Suv39h1の過剰な発現はセントロメアの近傍のヘテロクロマチン化を促進する11).KAT7がセントロメアへのヘテロクロマチンの拡大をふせぐはたらきをもつのであれば,KAT7ノックアウト細胞はSuv39h1の過剰発現に対し感受性となり,染色体の整列および分配の異常が増加すると予想された.実際に,KAT7ノックアウト細胞ではもとのHeLa細胞と比較して,Suv39h1の過剰発現のもとでは約11倍の頻度で染色体の整列および分配に異常が起こった.
セントロメアが機能を失い染色体分配が正しく起こらない場合,染色体は核の外に取り残されて微小核を形成する.顕微鏡による観察の結果,もとのHeLa細胞に比べ,KAT7ノックアウト細胞では約13倍,さらにSuv39h1を発現した場合には約120倍の頻度で微小核が生じた.また,微小核となった染色体のセントロメアにおいては,セントロメアに集合したCENP-Aの量は核に存在する正常なセントロメアの平均に比べ約80%も減少していた.これらの解析の結果から,KAT7にはSuv39h1によるヒストンH3のLys9のトリメチル化を介したヘテロクロマチン化の拡大から,CENP-Aのセントロメアへの集合の機構やセントロメアの機能を守るはたらきのあることが示唆された.
4.KAT7はアルフォイドDNAにおいてヒストンの交換反応を促進する
ヒストンH3のLys9のトリメチル化に対するKAT7の効果について調べるため,人工のアルフォイドDNAを異所的に挿入した部位にKAT7を結合させた.その結果,KAT7は約2割の細胞においてヒストンH3のLys9のトリメチル化を減少させた.また,人工のアルフォイドDNAを異所的に挿入した部位にヒストンのアセチル化したクロマチンに集合するRSF1を結合させたところ,約4割の細胞においてヒストンH3のLys9のトリメチル化は減少した.
KAT7やRSF1がどのようにヒストンH3のLys9のトリメチル化を減少させるのかについては,2つの可能性が考えられた.ひとつは単純にヒストンH3のLys9を脱メチル化する可能性,もうひとつはLys9がトリメチル化されたヒストンH3をクロマチンから除去する可能性である.ヒストンH3を除去する場合には,新しいヒストンを取り込む余地が生じる.実際に,人工のアルフォイドDNAを異所的に挿入した部位にKAT7あるいはRSF1を結合させたときには,その部位にCENP-AあるいはヒストンH3.3が新規に集合した.一方,ヒストンH3のLys9のトリメチル化の脱メチル化酵素であるJMJD2Bを結合させたときには,ヒストンH3のLys9のトリメチル化はほぼすべて消失したが,新規のヒストンの集合は起こらなかった.
これらの結果から,KAT7やRSF1はLys9がトリメチル化されたヒストンH3をクロマチンから除去することにより,ヘテロクロマチンの拡大をふせぐと同時に,CENP-Aがセントロメアに集合できる余地をつくりだしていることがわかった.また,人工のアルフォイドDNAを異所的に挿入した部位にKAT7あるいはRSF1を結合させると,その領域の転写は約2倍に上昇した.このヒストンの交換反応には転写の機構がかかわる可能性もある.
おわりに
分裂酵母においてはセントロメアのコア領域とヘテロクロマチン領域とのあいだにtRNA遺伝子クラスターが存在し,これを除去するとヘテロクロマチンがセントロメアへと拡大し染色体分配が不安定化することが知られている.一方,ヒトのセントロメアにおいてはセントロメアのクロマチンとヘテロクロマチンとを分断するDNA配列の防壁はみつかっていない.今回の研究により,Mis18複合体はKAT7やHJURPと相互作用すること,KAT7はヒストンのアセチル化を介しRSF1を集合させることがわかった.また,筆者らおよびほかの研究グループにより,M18BP1はCENP-Aを含むヌクレオソームと直接に結合するCENP-Cと相互作用し,セントロメアに集合することも明らかにされている13).これらのことから,ヒトにおいては,CENP-Aを含むヌクレオソームの分布するセントロメアのクロマチンにおいて,CENP-CおよびM18BP1を介しKAT7およびRSF1が集合し,Lys9がトリメチル化されたヒストンH3を除去する.ここにHJURPが相互作用し,新規にCENP-Aを補充する.Mis18複合体の下流においてこれらがほぼ同時に起こることにより,つねにヘテロクロマチンが拡大してくるセントロメアを補修する機構の存在が示唆された(図2).これを単純化していい換えれば,セントロメアのクロマチンそれ自体が,ヘテロクロマチンの拡大をふせぐエピジェネティックな防壁の機構を備えている.このヘテロクロマチンの拡大とセントロメアの補修の機構の動的なバランスが拮抗することにより,M期において姉妹染色体の接着とキネトコアの機能とが両立し,正確な染色体分配が遂行されると考えられた.
KAT7はCDT1を介して複製起点に集合し,MCM複合体のクロマチンへの集合を促進するはたらきのあることも知られている.M18BP1やCDT1など相互作用のパートナーを変えることにより,同じKAT7がセントロメアあるいは複製起点など染色体の異なる領域においてそれぞれ別の機能を制御することは興味深い.このような多様な機構にかかわるクロマチンタンパク質のもつ異なるはたらきを明らかにすることにより,新しい制御機構のネットワークも明らかになると期待される.さらに,新規のセントロメアの形成およびヘテロクロマチンの形成にかかわるCENP-Bが8),どのようにしてこれらの異なるクロマチンの形成を同一のアルフォイドDNAにおいて誘導できるのか,セントロメアにおけるヒストンのアセチル化やヘテロクロマチンにおけるヒストンH3のLys9のトリメチル化はこれとどうかかわるのか,興味はつきない.
文 献
- Black, B. E. & Cleveland, D. W.: Epigenetic centromere propagation and the nature of CENP-A nucleosomes. Cell, 144, 471-479 (2011)[PubMed]
- Fukagawa, T. & Earnshaw, W. C.: The centromere: chromatin foundation for the kinetochore machinery. Dev. Cell, 30, 496-508 (2014)[PubMed]
- McKinley, K. L. & Cheeseman, I. M.: The molecular basis for centromere identity and function. Nat. Rev. Mol. Cell Biol., 17, 16-29 (2016)[PubMed]
- Grewal, S. I. & Jia, S.: Heterochromatin revisited. Nat. Rev. Genet., 8, 35-46 (2007)[PubMed]
- Harrington, J. J., Van, Bokkelen, G., Mays, R. W. et al.: Formation of de novo centromeres and construction of first-generation human artificial microchromosomes. Nat. Genet., 15, 345-355 (1997)[PubMed]
- Ikeno, M., Grimes, B., Okazaki, T. et al.: Construction of YAC-based mammalian artificial chromosomes. Nat. Biotechnol., 16, 431-439 (1998)[PubMed]
- Ohzeki, J., Nakano, M., Okada, T. et al.: CENP-B box is required for de novo centromere chromatin assembly on human alphoid DNA. J. Cell Biol., 159, 765-775 (2002)[PubMed]
- Okada, T., Ohzeki, J., Nakano, M. et al.: CENP-B controls centromere formation depending on the chromatin context. Cell, 131, 1287-1300 (2007)[PubMed]
- Ohzeki, J., Larionov, V., Earnshaw, W. C. et al.: Genetic and epigenetic regulation of centromeres: a look at HAC formation. Chromosome Res., 23, 87-103 (2015)[PubMed]
- Nakano, M., Cardinale, S., Noskov, V. N. et al.: Inactivation of a human kinetochore by specific targeting of chromatin modifiers. Dev. Cell, 14, 507-522 (2008)[PubMed]
- Ohzeki, J., Bergmann, J. H., Kouprina, N. et al.: Breaking the HAC barrier: histone H3K9 acetyl/methyl balance regulates CENP-A assembly. EMBO J., 31, 2391-2402 (2012)[PubMed]
- Fujita, Y., Hayashi, T., Kiyomitsu, T. et al.: Priming of centromere for CENP-A recruitment by human hMis18α, hMis18β, and M18BP1. Dev. Cell, 12, 17-30 (2007)[PubMed]
- Shono, N., Ohzeki, J., Otake, K. et al.: CENP-C and CENP-I are key connecting factors for kinetochore and CENP-A assembly. J. Cell Sci., 128, 4572-4587 (2015)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2003年 名古屋大学大学院理学研究科博士課程 修了,同年 米国NIH National Cancer InstituteにてVisiting Fellowを経て,2008年よりかずさDNA研究所 研究員.
研究テーマ:染色体分配の機構,人工染色体の構築.
関心事:Genome Project-Write,人工染色体を用いた人工オルガネラの創成とその応用.
舛本 寛(Hiroshi Masumoto)
かずさDNA研究所 室長.
研究室URL:http://www.kazusa.or.jp/j/laboratories/lab_ce.html
© 2016 大関淳一郎・舛本 寛 Licensed under CC 表示 2.1 日本