自然免疫におけるパターン認識受容体であるMDA5およびLGP2のX線結晶構造解析
内川瑛美子・Stephen Cusack
(フランスEuropean Molecular Biology Laboratory,Grenoble Outstation)
email:内川瑛美子
DOI: 10.7875/first.author.2016.064
Structural analysis of dsRNA binding to anti-viral pattern recognition receptors LGP2 and MDA5.
Emiko Uchikawa, Mathilde Lethier, Hélène Malet, Joanna Brunel, Denis Gerlier, Stephen Cusack
Molecular Cell, 62, 586-602 (2016)
Rig-I,MDA5,LGP2はRig-I様ヘリカーゼであり,パターン認識受容体としてRNAウイルスのもつ2本鎖RNAの構造を認識し自然免疫応答を誘導する.今回,筆者らは,ニワトリに由来するLGP2とさまざまな2本鎖RNAとの複合体の結晶構造を高分解能で決定し,相互作用の詳細を明らかにした.LGP2はRig-Iと比べ1 bp長い2本鎖RNAと結合しており,ATPの加水分解にともなうヘリカーゼドメインのコンフォメーションの変化がとらえられた.また,ニワトリに由来するMDA5と10~27 bpの2本鎖RNAとの結晶構造を決定し,MDA5は短い2本鎖RNAに対しては,以前に報告された長い2本鎖RNAに対する配向とは異なる配向をとり結合することが明らかにされた.さらに,結晶構造をもとに作製した変異体を用いて,LGP2の2本鎖RNAとの結合がMDA5によるインターフェロンβの産生の誘導の亢進に重要であることが示された.このことから,LGP2は2本鎖RNAとの結合により核を形成し,MDA5を線維状の重合体の形成へと導くことが示唆された.
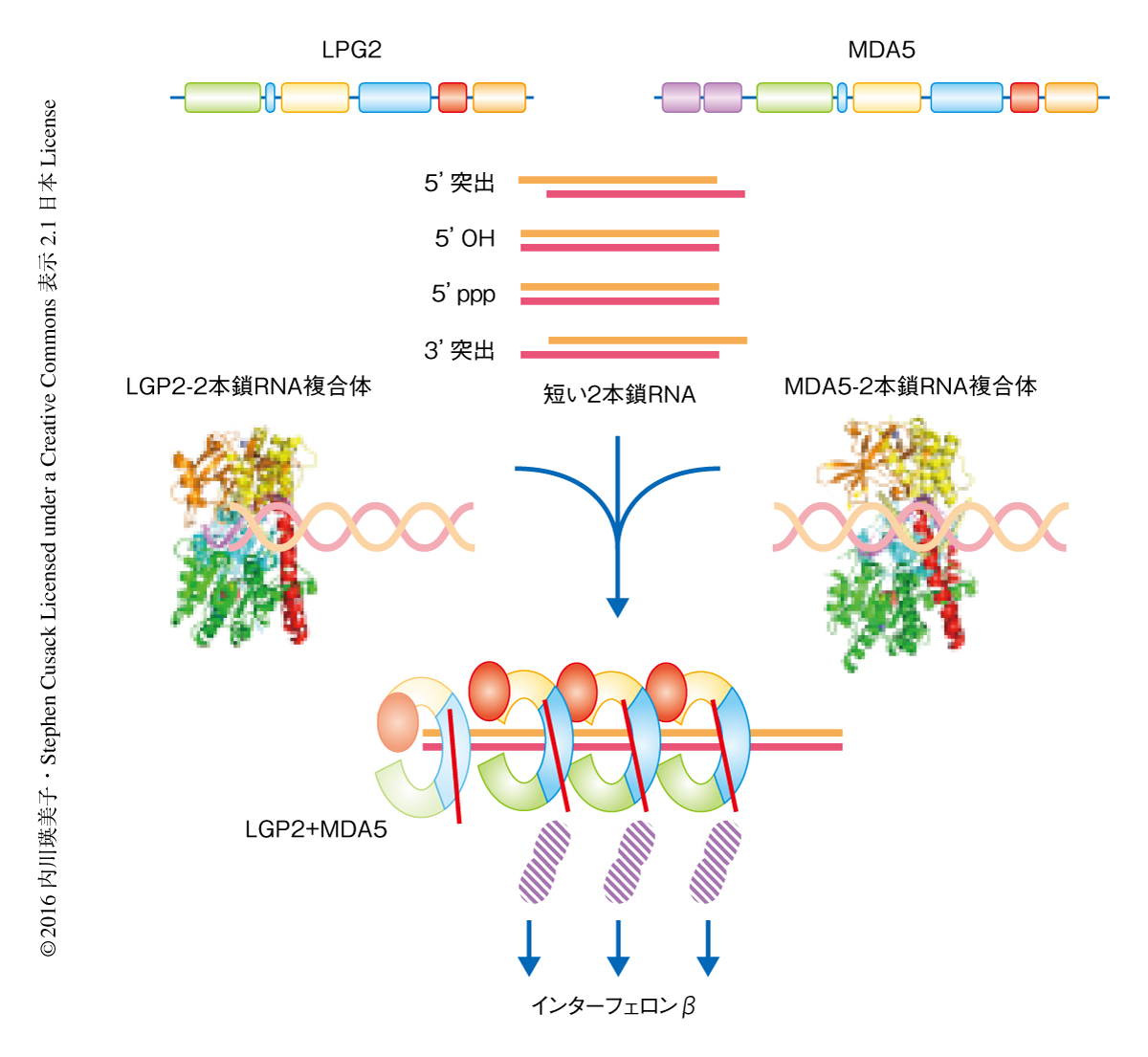
Rig-I,MDA5,LGP2はRig-I様ヘリカーゼとよばれ,自然免疫系においてパターン認識受容体としてRNAウイルスのもつ2本鎖RNAの構造を認識する1,2).Rig-IはウイルスのもつRNAの5’-リン酸を,また,MDA5は長い2本鎖RNAを認識する.Rig-IおよびMDA5はCARDドメイン,ヘリカーゼドメイン,C末端ドメインをもつが,LGP2はシグナル伝達に機能するCARDドメインをもたない.これまで,Rig-IおよびMDA5については多くの研究が報告されている.Rig-Iは5’末端に三リン酸をもつ2本鎖RNAを認識すると,C末端ドメインとCARDドメインとが解離し,CARDドメインがシグナル伝達におけるパートナータンパク質であるMAVSのCARDドメインと複合体を形成しインターフェロンβの産生を誘導する3-5).一方,MDA5は長い2本鎖RNAと協同的に結合して線維状の重合体を形成し,CARDドメインがMAVSのCARDドメインと複合体を形成する6-8).LGP2はRig-IおよびMDA5に対し正にも負にもはたらくことが報告されている.とくに近年,正にはたらく例として,LGP2がMDA5と協同的に機能してインターフェロンβの産生をより効率的に誘導することが報告されている9,10).ニワトリにRig-Iは存在しないが,おもにRig-Iに対し応答するインフルエンザウイルスに対してもインターフェロンβの産生の誘導が確認されることから,ニワトリにおいては,LGP2とMDA5の協同的な作用によりインターフェロンβの産生が誘導されるのではないかと考えられた.そこで,筆者らは,LGP2がMDA5によるインターフェロンβの産生の誘導を亢進する作用の機構をよりくわしく知るため,X線結晶構造解析,生化学的な手法,細胞生物学的な手法を用いた.
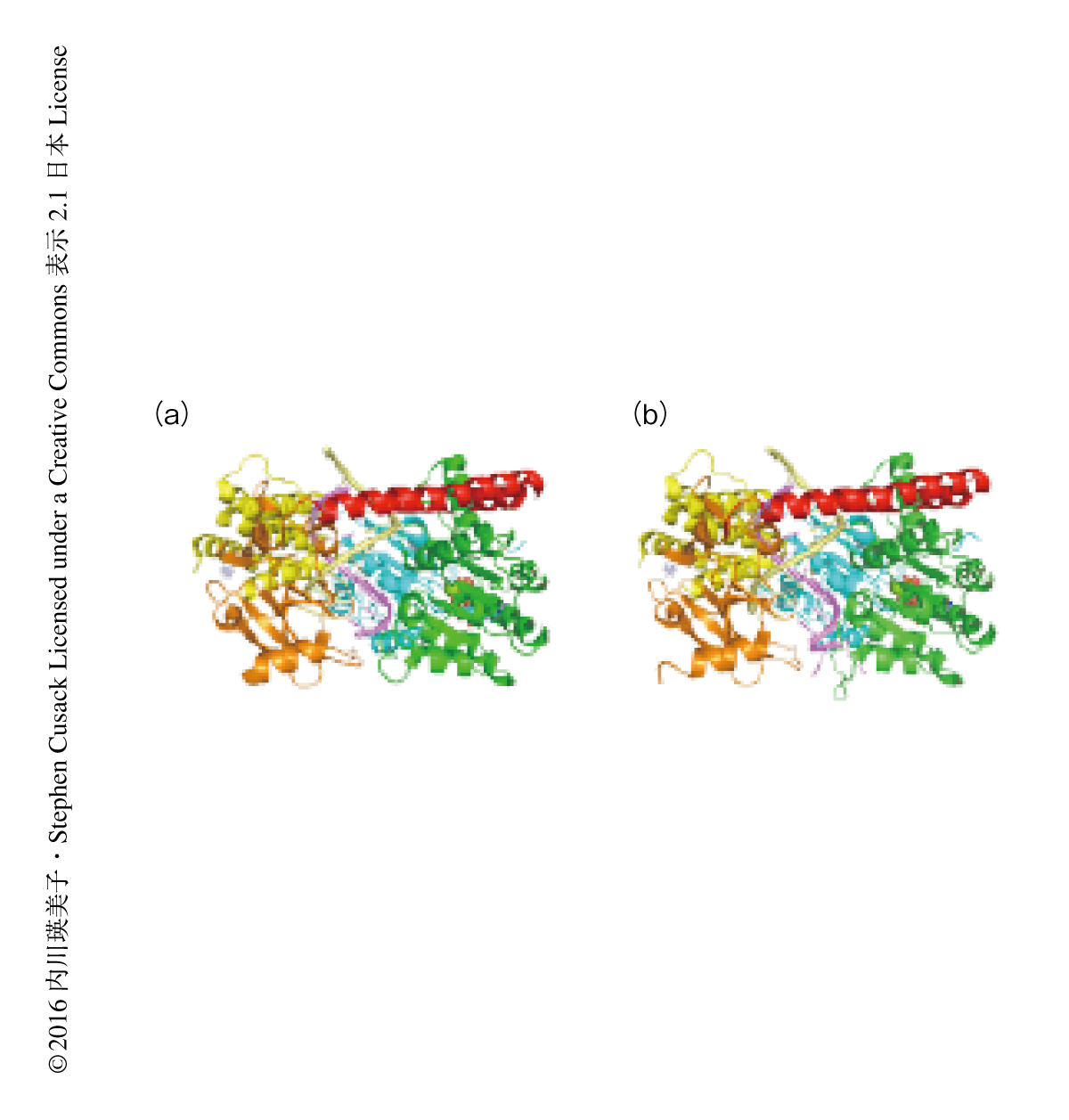
ニワトリに由来するLGP2と2本鎖RNAとの複合体の結晶構造を高分解能で決定した(PDB ID:5JAJ,5JB2,5JBG,5JBJ,図1).全体構造は,Rig-IおよびMDA5と似た,2本鎖RNAのまわりをヘリカーゼドメインおよびC末端ドメインがつつんだ円盤のような構造であった.ATP結合部位はヘリカーゼドメインのHel1とHel2とのあいだに位置し,ATPの加水分解における遷移状態の詳細なようすが明らかにされた.Rig-Iとは異なりα3へリックスが屈曲しており,LGP2と12 bpの2本鎖RNAとの複合体においてはATP結合部位に何も結合していない構造が得られ,ATPの加水分解におけるドメインの構造変化をおうことができた.これまで,LGP2は2本鎖RNAとの結合なしにATPを加水分解すると報告されていたが,ニワトリに由来するLGP2およびヒトに由来するLGP2において,2本鎖RNAの存在のもとでしかATPの加水分解は確認されなかった.ヘリカーゼドメインのHel1およびHel2は多くの水素結合を形成し,2本鎖RNAと非常に密接に結合していることが明らかにされた.LGP2はRig-Iと比べ1 bp長い2本鎖RNAと結合していた.また,LGP2は5’末端の異なるさまざまな2本鎖RNAとの複合体として構造が決定されたが,Rig-Iとは異なり,その構造からは5’-リン酸や5’-三リン酸と特異的な相互作用は確認されなかった.5’-リン酸をもつ2本鎖RNAとの複合体と比較して,3’末端に2塩基の突出した2本鎖RNAとの複合体の構造においては,C末端ドメインはわずかに位置を変えただけで,ヘリカーゼドメインにおいてHel1のβ4とα3とのあいだのループが大きくHel1の側に移動し,突出した2塩基はこのループと相互作用していた.LGP2と2本鎖RNAとの相互作用はおもにC末端ドメインと2本鎖RNAの末端の塩基対との非常に安定した疎水性の相互作用によっていた.LGP2はさまざまな5’末端をもつ2本鎖RNAに対し解離定数2 nM~5 nMという非常に高い親和性を示した.
ニワトリに由来するMDA5と10 bpの2本鎖RNAとの1対1の複合体,および,2分子のMDA5と24 bpあるいは27 bpの2本鎖RNAとの2対1の複合体の結晶構造を高分解能で決定した(PDB ID:5JC3,5JCH,5JCF,5JC7,図2).MDA5と2本鎖RNAとの1対1の複合体の全体構造は,以前に報告されたヒトに由来するMDA5と12 bpの2本鎖RNAとの複合体と非常によく似ていたが,MDA5のループ構造の部分はほかのRig-I様ヘリカーゼよりも多くかつ長かった.ヘリカーゼドメインのHel2iにおいてα12へリックスとα13へリックスとのあいだにループ構造が観察され,C末端ドメインと相互作用していた.構造解析に用いたMDA5はATPの加水分解を担う保存されたモチーフにおいてGluをGlnに変異させ,また,ATPのアナログであるAMPPNPと結晶化したのにもかかわらずATPの加水分解が起こり,ATP結合部位にはADPおよびMg2+が確認された.MDA5の構造においてもα3へリックスは屈曲しており,ADPの3’-OH基と相互作用していた.ヒトに由来するMDA5の構造を含め,すべてのMDA5の構造において2本鎖RNAの異なる位置が観察された.長い2本鎖RNAとの複合体においてMDA5はヘッド-テイル配向をとると報告されていたが,MDA5と2本鎖RNAとの2対1の複合体においてMDA5はヘッド-ヘッド配向をとり二量体を形成していた.24 bpの2本鎖RNAとの複合体において2本鎖RNAはその安定な二量体を保つかのように30度ほど屈曲していた.27 bpの2本鎖RNAとの複合体において2本鎖RNAは真っすぐになっていたが,MDA5はヘッド-ヘッド配向のままであった.いずれの構造においても,MDA5は2本鎖RNAの末端に結合する傾向があった.
ニワトリに由来するLGP2が2本鎖RNAにおいて重合体を形成するかどうかを,φ6ファージに由来する4000~8000 bpの2本鎖RNAを用いて電子顕微鏡により観察した.その結果,LGP2はMDA5と比べて効率的ではないが,2本鎖RNAにおいて線維状の重合体を形成した.さらに,低分解能での解析より,MDA5とLGP2は2本鎖RNAにおいて同じ間隔をとり結合することがわかった.
ニワトリおよびヒトにおいて,LGP2はMDA5によるインターフェロンβの産生の誘導を亢進することが確認された.その分子機構を解析するため,LGP2と2本鎖RNAとの複合体の構造をもとに,2本鎖RNAと相互作用するヘリカーゼドメインのHelおよびC末端ドメインに変異を導入したLGP2を作製し,MDA5によるインターフェロンβの産生の誘導を観察した.その結果,いずれの変異体もインターフェロンβの産生の誘導を亢進しなかったことから,LGP2と2本鎖RNAが相互作用することがMDA5によるインターフェロンβの産生の誘導の亢進に必要であることが示された(図3).
この論文において報告された,ニワトリに由来するLGP2およびMDA5のさまざまな2本鎖RNAとの複合体の高分解能での結晶構造およびその機能的な解析は,MDA5によるインターフェロンβの産生の誘導へのLGP2の寄与の詳細,さらに,LGP2の細胞における役割の解明の基礎となるものである.今後,LGP2およびMDA5が2本鎖RNAにおいてどのように線維状の重合体を形成するのか可視化したいと考えている.
略歴:2011年 お茶の水女子大学大学院人間文化創成科学研究科・フランスStrasbourg大学 共同博士号取得,同年よりEuropean Molecular Biology Laboratoryポストドクトラルフェロー.
研究テーマ:X線構造解析によるRNAウイルスに対する免疫応答の解明.
Stephen Cusack
European Molecular Biology LaboratoryにてHead of Outstation.
研究室URL:https://www.embl.fr/research/unit/cusack/
© 2016 内川瑛美子・Stephen Cusack Licensed under CC 表示 2.1 日本
(フランスEuropean Molecular Biology Laboratory,Grenoble Outstation)
email:内川瑛美子
DOI: 10.7875/first.author.2016.064
Structural analysis of dsRNA binding to anti-viral pattern recognition receptors LGP2 and MDA5.
Emiko Uchikawa, Mathilde Lethier, Hélène Malet, Joanna Brunel, Denis Gerlier, Stephen Cusack
Molecular Cell, 62, 586-602 (2016)
要 約
Rig-I,MDA5,LGP2はRig-I様ヘリカーゼであり,パターン認識受容体としてRNAウイルスのもつ2本鎖RNAの構造を認識し自然免疫応答を誘導する.今回,筆者らは,ニワトリに由来するLGP2とさまざまな2本鎖RNAとの複合体の結晶構造を高分解能で決定し,相互作用の詳細を明らかにした.LGP2はRig-Iと比べ1 bp長い2本鎖RNAと結合しており,ATPの加水分解にともなうヘリカーゼドメインのコンフォメーションの変化がとらえられた.また,ニワトリに由来するMDA5と10~27 bpの2本鎖RNAとの結晶構造を決定し,MDA5は短い2本鎖RNAに対しては,以前に報告された長い2本鎖RNAに対する配向とは異なる配向をとり結合することが明らかにされた.さらに,結晶構造をもとに作製した変異体を用いて,LGP2の2本鎖RNAとの結合がMDA5によるインターフェロンβの産生の誘導の亢進に重要であることが示された.このことから,LGP2は2本鎖RNAとの結合により核を形成し,MDA5を線維状の重合体の形成へと導くことが示唆された.
はじめに
Rig-I,MDA5,LGP2はRig-I様ヘリカーゼとよばれ,自然免疫系においてパターン認識受容体としてRNAウイルスのもつ2本鎖RNAの構造を認識する1,2).Rig-IはウイルスのもつRNAの5’-リン酸を,また,MDA5は長い2本鎖RNAを認識する.Rig-IおよびMDA5はCARDドメイン,ヘリカーゼドメイン,C末端ドメインをもつが,LGP2はシグナル伝達に機能するCARDドメインをもたない.これまで,Rig-IおよびMDA5については多くの研究が報告されている.Rig-Iは5’末端に三リン酸をもつ2本鎖RNAを認識すると,C末端ドメインとCARDドメインとが解離し,CARDドメインがシグナル伝達におけるパートナータンパク質であるMAVSのCARDドメインと複合体を形成しインターフェロンβの産生を誘導する3-5).一方,MDA5は長い2本鎖RNAと協同的に結合して線維状の重合体を形成し,CARDドメインがMAVSのCARDドメインと複合体を形成する6-8).LGP2はRig-IおよびMDA5に対し正にも負にもはたらくことが報告されている.とくに近年,正にはたらく例として,LGP2がMDA5と協同的に機能してインターフェロンβの産生をより効率的に誘導することが報告されている9,10).ニワトリにRig-Iは存在しないが,おもにRig-Iに対し応答するインフルエンザウイルスに対してもインターフェロンβの産生の誘導が確認されることから,ニワトリにおいては,LGP2とMDA5の協同的な作用によりインターフェロンβの産生が誘導されるのではないかと考えられた.そこで,筆者らは,LGP2がMDA5によるインターフェロンβの産生の誘導を亢進する作用の機構をよりくわしく知るため,X線結晶構造解析,生化学的な手法,細胞生物学的な手法を用いた.
1.ニワトリに由来するLGP2の結晶構造
ニワトリに由来するLGP2と2本鎖RNAとの複合体の結晶構造を高分解能で決定した(PDB ID:5JAJ,5JB2,5JBG,5JBJ,図1).全体構造は,Rig-IおよびMDA5と似た,2本鎖RNAのまわりをヘリカーゼドメインおよびC末端ドメインがつつんだ円盤のような構造であった.ATP結合部位はヘリカーゼドメインのHel1とHel2とのあいだに位置し,ATPの加水分解における遷移状態の詳細なようすが明らかにされた.Rig-Iとは異なりα3へリックスが屈曲しており,LGP2と12 bpの2本鎖RNAとの複合体においてはATP結合部位に何も結合していない構造が得られ,ATPの加水分解におけるドメインの構造変化をおうことができた.これまで,LGP2は2本鎖RNAとの結合なしにATPを加水分解すると報告されていたが,ニワトリに由来するLGP2およびヒトに由来するLGP2において,2本鎖RNAの存在のもとでしかATPの加水分解は確認されなかった.ヘリカーゼドメインのHel1およびHel2は多くの水素結合を形成し,2本鎖RNAと非常に密接に結合していることが明らかにされた.LGP2はRig-Iと比べ1 bp長い2本鎖RNAと結合していた.また,LGP2は5’末端の異なるさまざまな2本鎖RNAとの複合体として構造が決定されたが,Rig-Iとは異なり,その構造からは5’-リン酸や5’-三リン酸と特異的な相互作用は確認されなかった.5’-リン酸をもつ2本鎖RNAとの複合体と比較して,3’末端に2塩基の突出した2本鎖RNAとの複合体の構造においては,C末端ドメインはわずかに位置を変えただけで,ヘリカーゼドメインにおいてHel1のβ4とα3とのあいだのループが大きくHel1の側に移動し,突出した2塩基はこのループと相互作用していた.LGP2と2本鎖RNAとの相互作用はおもにC末端ドメインと2本鎖RNAの末端の塩基対との非常に安定した疎水性の相互作用によっていた.LGP2はさまざまな5’末端をもつ2本鎖RNAに対し解離定数2 nM~5 nMという非常に高い親和性を示した.
2.ニワトリに由来するMDA5の結晶構造
ニワトリに由来するMDA5と10 bpの2本鎖RNAとの1対1の複合体,および,2分子のMDA5と24 bpあるいは27 bpの2本鎖RNAとの2対1の複合体の結晶構造を高分解能で決定した(PDB ID:5JC3,5JCH,5JCF,5JC7,図2).MDA5と2本鎖RNAとの1対1の複合体の全体構造は,以前に報告されたヒトに由来するMDA5と12 bpの2本鎖RNAとの複合体と非常によく似ていたが,MDA5のループ構造の部分はほかのRig-I様ヘリカーゼよりも多くかつ長かった.ヘリカーゼドメインのHel2iにおいてα12へリックスとα13へリックスとのあいだにループ構造が観察され,C末端ドメインと相互作用していた.構造解析に用いたMDA5はATPの加水分解を担う保存されたモチーフにおいてGluをGlnに変異させ,また,ATPのアナログであるAMPPNPと結晶化したのにもかかわらずATPの加水分解が起こり,ATP結合部位にはADPおよびMg2+が確認された.MDA5の構造においてもα3へリックスは屈曲しており,ADPの3’-OH基と相互作用していた.ヒトに由来するMDA5の構造を含め,すべてのMDA5の構造において2本鎖RNAの異なる位置が観察された.長い2本鎖RNAとの複合体においてMDA5はヘッド-テイル配向をとると報告されていたが,MDA5と2本鎖RNAとの2対1の複合体においてMDA5はヘッド-ヘッド配向をとり二量体を形成していた.24 bpの2本鎖RNAとの複合体において2本鎖RNAはその安定な二量体を保つかのように30度ほど屈曲していた.27 bpの2本鎖RNAとの複合体において2本鎖RNAは真っすぐになっていたが,MDA5はヘッド-ヘッド配向のままであった.いずれの構造においても,MDA5は2本鎖RNAの末端に結合する傾向があった.
3.LGP2が2本鎖RNAにおいて形成する線維状の重合体の構造
ニワトリに由来するLGP2が2本鎖RNAにおいて重合体を形成するかどうかを,φ6ファージに由来する4000~8000 bpの2本鎖RNAを用いて電子顕微鏡により観察した.その結果,LGP2はMDA5と比べて効率的ではないが,2本鎖RNAにおいて線維状の重合体を形成した.さらに,低分解能での解析より,MDA5とLGP2は2本鎖RNAにおいて同じ間隔をとり結合することがわかった.
4.LGP2とMDA5の協同的なはたらき
ニワトリおよびヒトにおいて,LGP2はMDA5によるインターフェロンβの産生の誘導を亢進することが確認された.その分子機構を解析するため,LGP2と2本鎖RNAとの複合体の構造をもとに,2本鎖RNAと相互作用するヘリカーゼドメインのHelおよびC末端ドメインに変異を導入したLGP2を作製し,MDA5によるインターフェロンβの産生の誘導を観察した.その結果,いずれの変異体もインターフェロンβの産生の誘導を亢進しなかったことから,LGP2と2本鎖RNAが相互作用することがMDA5によるインターフェロンβの産生の誘導の亢進に必要であることが示された(図3).
おわりに
この論文において報告された,ニワトリに由来するLGP2およびMDA5のさまざまな2本鎖RNAとの複合体の高分解能での結晶構造およびその機能的な解析は,MDA5によるインターフェロンβの産生の誘導へのLGP2の寄与の詳細,さらに,LGP2の細胞における役割の解明の基礎となるものである.今後,LGP2およびMDA5が2本鎖RNAにおいてどのように線維状の重合体を形成するのか可視化したいと考えている.
文 献
- Ahmad, S. & Hur, S.: Helicases in antiviral immunity: dual properties as sensors and effectors. Trends Biochem. Sci., 40, 576-585 (2015)[PubMed]
- Hopfner, K. P.: RIG-I holds the CARDs in a game of self versus nonself. Mol. Cell, 55, 505-507 (2014)[PubMed]
- Kowalinski, E., Lunardi, T., Cusack, S. et al.: Structural basis for the activation of innate immune pattern-recognition receptor RIG-I by viral RNA. Cell, 147, 423-435 (2011)[PubMed]
- Peisley, A., Wu, B, Hur, S. et al.: Structural basis for ubiquitin-mediated antiviral signal activation by RIG-I. Nature, 509, 110-114 (2014)[PubMed]
- Wu, B., Peisley, A., Hur, S. et al.: Molecular imprinting as a signal-activation mechanism of the viral RNA sensor RIG-I. Mol. Cell, 55, 511-523 (2014)[PubMed]
- Berke, I. C., Yu, X., Modis, Y. et al.: MDA5 assembles into a polar helical filament on dsRNA. Proc. Natl. Acad. Sci. USA, 109, 18437-18441 (2012)[PubMed]
- Peisley, A., Lin, C., Hur, S. et al.: Cooperative assembly and dynamic disassembly of MDA5 filaments for viral dsRNA recognition. Proc. Natl. Acad. Sci. USA, 108, 21010-21015 (2011)[PubMed]
- Wu, B., Peisley, A., Hur, S. et al.: Structural basis for dsRNA recognition, filament formation, and antiviral signal activation by MDA5. Cell, 152, 276-289 (2013)[PubMed]
- Rodriguez, K. R., Bruns, A. M. & Horvath, C. M.: MDA5 and LGP2: accomplices and antagonists of antiviral signal transduction. J. Virol., 88, 8194-8200 (2014)[PubMed]
- Zhu, Z., Zhang, X., Zheng, H. et al.: The laboratory of genetics and physiology 2: emerging insights into the controversial functions of this RIG-I-like receptor. Biomed Res. Int., 2014, 960190 (2014)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2011年 お茶の水女子大学大学院人間文化創成科学研究科・フランスStrasbourg大学 共同博士号取得,同年よりEuropean Molecular Biology Laboratoryポストドクトラルフェロー.
研究テーマ:X線構造解析によるRNAウイルスに対する免疫応答の解明.
Stephen Cusack
European Molecular Biology LaboratoryにてHead of Outstation.
研究室URL:https://www.embl.fr/research/unit/cusack/
© 2016 内川瑛美子・Stephen Cusack Licensed under CC 表示 2.1 日本