マウスの着床前の初期胚における開いたクロマチン構造の形成
井上 梓・Falong Lu・Yuting Liu・Yi Zhang
(米国Boston Children's Hospital,Program in Cellular and Molecular Medicine)
email:井上 梓
DOI: 10.7875/first.author.2016.060
Establishing chromatin regulatory landscape during mouse preimplantation development.
Falong Lu, Yuting Liu, Azusa Inoue, Tsukasa Suzuki, Keji Zhao, Yi Zhang
Cell, 165, 1375-1388 (2016)
精子および卵におけるクロマチンの構造は受精ののち着床前の発生をつうじ大規模に変化すると考えられているが,その実態は謎につつまれている.今回,筆者らは,ゲノムにおいて局所的にクロマチンのゆるんだ,開いたクロマチン構造をもつDNase I高感受性部位を100個以下の細胞から網羅的に同定することのできる微量DNaseシークエンス法を確立し,マウスにおいて1細胞期から桑実胚期までの胚におけるDNase I高感受性部位を同定した.DNase I高感受性部位は着床前の発生をつうじ増加しており,その変化は8細胞期にかけてとくに顕著であった.DNase I高感受性部位の大部分はプロモーターに位置しており,DNase I高感受性部位の有無と遺伝子の発現レベルとのあいだに正の相関が認められた.また,精子に由来するゲノムのDNase I高感受性部位のプロファイルは,受精の直後の1細胞期においてすでに,卵子に由来するゲノムのプロファイルと類似していた.一方で,インプリント遺伝子においては転写の開始のまえからアレルに特異的なDNase I高感受性部位が形成されていた.さらに,転写因子の機能解析をつうじ,NfyaおよびOct4がそれぞれ2細胞期および8細胞期におけるDNase I高感受性部位の形成に関与することが見い出された.この研究により,哺乳類の着床前の胚におけるクロマチンの構造の大規模な変化およびその分子機構の一端が明らかにされた.
最終分化した卵および精子のエピゲノムは受精をきっかけにリプログラミングされ,あらゆる細胞に分化することのできる全能性を獲得する.全能性は1細胞期および2細胞期の胚がもち,そののちの発生の過程において失われると考えられている.受精から4日目の胚盤胞期には,将来的に胚体になる内部細胞塊と胎盤に関連する組織になる栄養外胚葉とに分化する.このような着床前の胚における細胞運命の転換の背景にある分子機構を解明するためには,遺伝子発現の変化と,それをつかさどる転写因子ネットワークおよびクロマチンの構造の解明が必要である.これまでの研究により,遺伝子発現の変化はマイクロアレイ法やRNAシークエンス法により明らかにされてきた一方1,2),転写因子ネットワークやクロマチンの構造がどのように変化し,それがどのように制御されているのかはほとんど明らかにされていない.
クロマチンは,ヌクレオソームの局在をつうじた1次構造と,Mbの規模での立体配置をつうじた高次構造により階層的に制御される.1次構造については,プロモーター,エンハンサー,インスレーターなどの多様な遺伝子発現の制御領域において,ヌクレオソームが少なく局所的に開いたクロマチン構造を形成することにより,転写因子やクロマチン関連タンパク質の結合が可能となり近傍の遺伝子発現が制御される3).このような開いたクロマチン構造はパイオニア転写因子とよばれる一群の転写因子の結合により形成されると考えられている4).開いたクロマチン構造の局在のパターンは細胞種に固有であり,たとえば,多能性幹細胞の分化の過程において大きく変化する5).
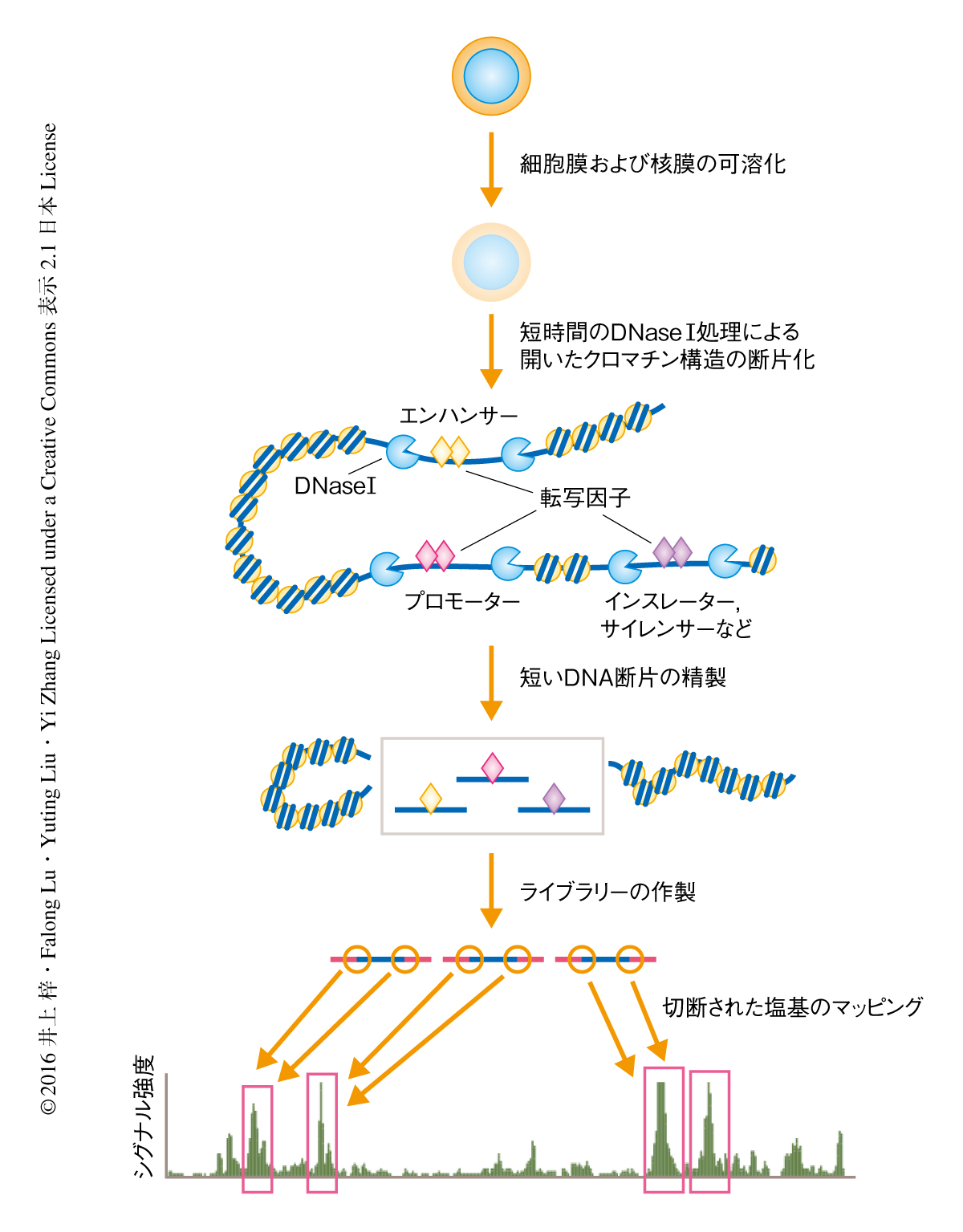
開いたクロマチン構造をもつゲノムの領域はDNase Iに対し高い感受性を示すことから同定することができ,このような領域はDNase I高感受性部位とよばれる.次世代シークエンサーを用いてDNase I高感受性部位を網羅的に同定する方法として,DNaseシークエンス法がある6).そのほか,トランスポザーゼへの感受性を指標に開いたクロマチン構造を同定するATACシークエンス法も存在する7).しかし,これらの方法は数百万個の細胞を必要とするため,多量の細胞を集めることが困難な着床前の胚を解析することはできなかった.近年,これらの技術を単一の細胞に適応することのできる単一細胞DNaseシークエンス法や単一細胞ATACシークエンス法が開発されたが,感度が非常に低いという問題点があった8,9).そこで,この研究においては,100個以下の細胞から開いたクロマチン構造を高感度で同定することのできる微量DNaseシークエンス法を確立し,マウスの着床前の胚におけるクロマチンの1次構造の変化を解析した.
単一細胞DNaseシークエンス法をベースとして,増幅のまえのDNAの精製のステップを減らすこと,DNAの精製にゲルによる精製ではなくSPRIビーズを用いること,などの改良をくわえて,微量DNaseシークエンス法を確立した(図1).この方法を100個のES細胞に対し用いたところ,77,589箇所のDNase I高感受性部位が同定された.ENCODEプロジェクトにおいて標準的なDNaseシークエンス法を用いて約1000万個のES細胞から同定されたDNase I高感受性部位219,515箇所と比較したところ,ENCODEプロジェクトにおいて同定された確度の高い21,330箇所のDNase I高感受性部位のうち,93%が微量DNaseシークエンス法により100個のES細胞からも同定されていた.その逆に,微量DNaseシークエンス法により100個のES細胞から同定された確度の高い29,305箇所のDNase I高感受性部位のうち,97%がENCODEプロジェクトにおいても同定されていた.また,100個のES細胞から同定されたDNase I高感受性部位と30個のES細胞から同定されたDNase I高感受性部位とのシグナル強度の相関係数は0.98,30個のES細胞から同定されたDNase I高感受性部位とENCODEプロジェクトにおいて同定されたDNase I高感受性部位との相関係数は0.93と,それぞれ非常に高い値を示した.これらの結果から,微量DNaseシークエンス法は再現性が高く,ある一定の感度をもってDNase I高感受性部位を網羅的に同定できることが示された.
微量DNaseシークエンス法を用いて,マウスの1細胞期,2細胞期,4細胞期,8細胞期,桑実胚期のおのおののステージの胚においてDNase I高感受性部位を同定した.おのおののステージにおいてそれぞれ100個,100個,50個,25個,10個の胚を用いることにより細胞の数を100~200個に統一した.確度の高いDNase I高感受性部位はそれぞれ844箇所,1006箇所,2957箇所,12,323箇所,19,476箇所であり,発生をへるごとに増加した.おのおののステージにおけるDNase I高感受性部位のゲノムにおける局在をプロモーター,イントロン,エキソン,遺伝子間領域の4つに分類したところ,すべてのステージにおいてプロモーターに高頻度に存在した.1細胞期においてはDNase I高感受性部位のほとんどがプロモーターに位置していたが(87%),2細胞期および8細胞期においてはこの割合が低下し(77%および50%),逆に,遺伝子間領域の割合が大きく上昇した.発生の過程におけるそれぞれのDNase I高感受性部位の出現および消失について調べたところ,いったん現われたDNase I高感受性部位はほとんど消失することなく,そののちの発生の過程において維持された.
プロモーターに存在するDNase I高感受性部位と遺伝子発現との関連を調べるため,おのおののステージにおいてトランスクリプトーム2) と比較した.その結果,すべてのステージにおいて,プロモーターにDNase I高感受性部位をもつ遺伝子はもたない遺伝子と比較して有意に高く発現していた.プロモーターにDNase I高感受性部位をもつ遺伝子の2~10%は,つぎの発生の段階においてはじめて発現を開始する,すなわち,プライム状態にある遺伝子であった.
ゲノムインプリンティングは母方あるいは父方の一方のアレルからのみ発現する遺伝子の制御様式である.インプリント遺伝子の発現アレルは抑制アレルよりもDNase Iに対する感受性の高いことが知られているが10),それが,片アレル性の発現の原因か結果かはわかっていなかった.また,発生のどの時期にDNase I高感受性部位がアレルに対する特異性を獲得するのかも不明であった.これらの疑問に答えるため,亜系統のあいだの遺伝子多型を利用することにより着床前の胚において母性ゲノムと父性ゲノムとを識別し,インプリント遺伝子のプロモーターにおけるDNase I高感受性部位のアレルへの特異性について調べた.150個の既知のインプリント遺伝子のうち,プロモーターに1塩基多型を含む109個を対象として解析したところ,2細胞期,4細胞期,8細胞期,桑実胚期の胚においてそれぞれ2個,3個,9個,18個のインプリント遺伝子がプロモーターにDNase I高感受性部位をもっていた.これらのうちそれぞれ2個,3個,6個,10個のインプリント遺伝子がアレルに特異性をもち,発現アレルのほうがDNase Iに対する感受性が高かった.これらのインプリント遺伝子のうちいくつかは着床前の胚において発現の認められない遺伝子であった.この結果から,インプリント遺伝子のアレルに特異的なDNase Iに対する感受性は,片アレル性の発現の結果として生じるものではなく,片アレル性の発現を制御する機構のひとつである可能性が示唆された.
精子のゲノムはプロタミンにより高度にパッケージングされているが,受精ののちプロタミンからヒストンへの置換が起こり新しくクロマチンが形成される.この過程においてクロマチンの構造が大規模に変化すると考えられるが,それが受精ののちどの時期に完了するのかはわかっていなかった.そこで,精子,受精後7.5時間の胚,12時間の1細胞期の胚から雄性前核および雌性前核を単離して微量DNaseシークエンス法により解析した.その結果,精子にはDNase I高感受性部位はほとんど存在しなかったが,受精後7.5時間の胚において雄性ゲノムはすでにDNase I高感受性部位をゲノムワイドに獲得しており,そのプロファイルは雌性ゲノムのプロファイルと類似していた.この結果から,精子のゲノムのDNase I高感受性部位は受精後7.5時間までにリプログラミングされることが示唆された.
8細胞期においてDNase I高感受性部位が形成される機構について調べるため,この時期において機能する転写因子の同定を試みた.パイオニア転写因子として知られる転写因子の発現パターンを調べたところ,Oct4の発現が8細胞期において急激に上昇していた.そこで,siRNAを用いてOct4をノックダウンし,8細胞期の胚において微量DNaseシークエンス法により解析した.その結果,Oct4をノックダウンした胚は対照となる胚と比較して,8細胞期において形成されるDNase I高感受性部位のうち27%についてDNase Iに対する感受性が1/2以下に低下していた.このことから,Oct4は8細胞期の胚におけるDNase I高感受性部位の形成に関与する転写因子のひとつであることが示唆された.
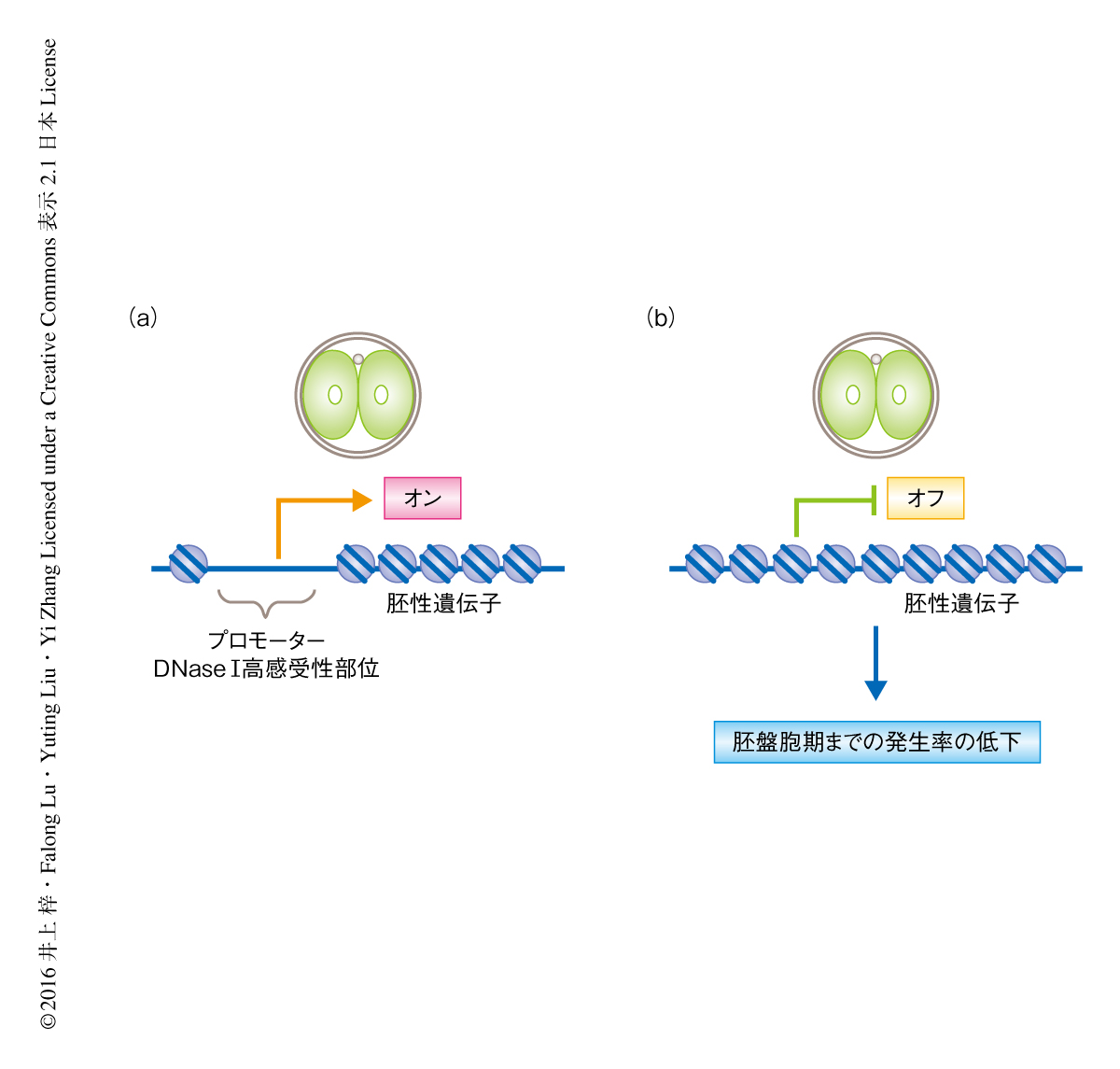
マウスの2細胞期の胚において起こる胚性遺伝子の活性化に必要な転写因子はいまだ同定されていなかった.DNase I高感受性部位は転写因子との結合により形成されることから,2細胞期の胚におけるDNase I高感受性部位に存在する転写因子のDNA結合モチーフについて調べることにより,そこで機能する転写因子を予測できるのではないかと考えた.そこで,2細胞期の胚のプロモーターに存在するDNase I高感受性部位を対象として転写因子の結合を予測した結果,Nfyaの結合モチーフであるCCAAT配列が高頻度で存在することがわかった.そこで,siRNAを用いてNfyaをノックダウンし,2細胞期の胚において微量DNaseシークエンス法により解析した.その結果,Nfyaをノックダウンした胚は対照となる胚と比較して,2細胞期の胚のプロモーターに存在するDNase I高感受性部位のうち28%についてDNase Iへの感受性が1/2以下に低下していた.CCAAT配列を含むプロモーターは含まないプロモーターよりもDNase Iに対する感受性が顕著に低下していた.胚性遺伝子の発現におけるNfyaの必要性について調べるためRNAシークエンス法により解析したところ,Nfyaをノックダウンした胚においては,2細胞期において活性化される1961個の遺伝子のうち297個(15%)の発現が1.5倍以上も抑制されていた.発現の抑制された297個の遺伝子のプロモーターはDNase Iに対する感受性が顕著に低下していた.さらに,Nfyaをノックダウンした胚の胚盤胞期までの発生率は対照となる胚と比較して有意に低かった.これらの結果から,Nfyaは2細胞期の胚におけるDNase I高感受性部位の形成および胚性遺伝子の発現において重要な役割をはたすことが示唆された(図2).
この研究においては,微量DNaseシークエンス法を確立し,マウスの着床前の胚において開いたクロマチン構造を網羅的に同定した.リソースとしての有用性だけでなく,インプリント遺伝子の発現の制御機構および精子のゲノムのリモデリングの機構に関し新たな知見が得られ,さらに,着床前の胚において機能する転写因子を同定する新たなアプローチが可能になった.
この研究の結果を解釈する際の注意点をあげる.この研究において同定されたDNase I高感受性部位はあくまでも微量DNaseシークエンス法により同定されたものであり,すべての開いたクロマチン構造をもらさず同定したものではないと考えている.このことは,ENCODEプロジェクトにおいてはES細胞において219,515個のDNase I高感受性部位が同定された一方,100個のES細胞を用いた微量DNaseシークエンス法においては77,589個しか同定されなかったことからも明白である.そのため,たとえば,2細胞期の胚において同定された1006個のDNase I高感受性部位は,2細胞期の胚に存在するすべての開いたクロマチン構造のうちもっとも安定に存在するものだけにすぎない可能性がある.2細胞期の胚において同定されたDNase I高感受性部位の数が2細胞期の胚において活性化する遺伝子(1961個)より少ないことは,このような技術的な理由によると考えられる.また,標準的なDNaseシークエンス法は抽出したクロマチンに対しDNase Iを処理する一方,微量DNaseシークエンス法では可溶化した細胞にじかにDNase Iを処理するため,細胞や核の大きさの違いがDNase Iの透過性や反応性に影響する可能性を否定できない.とくに着床前の胚においては割球や核の大きさは発生の後期ほど小さく,この研究においてみられたDNase I高感受性部位の増加はそのような技術的な問題が寄与した可能性を考慮する必要がある.今後,これらの問題点を解消し,さらに感度を高めた改良法の確立が必要である.
着床前の胚は胎盤の組織を含むあらゆる細胞に分化することのできる全能性をもつ唯一の細胞であり,その全能性を特徴づけるクロマチンの構造および転写因子ネットワークの解明は生物学的にも医学的にも重要な課題である.微量DNaseシークエンス法がこの分野における研究の幅を広げ,新たな研究展開をもたらすことを期待している.
略歴:2011年 東京大学大学院新領域創成科学研究科 修了,同年 米国North Carolina大学Chapel Hill校 研究員を経て,2012年より米国Harvard Medical School研究員.
研究テーマ:受精卵におけるエピゲノムのリプログラミングの機構.
関心事:卵の研究の発展と子供の成長.
Falong Lu
米国Boston Children's Hospital研究員.
Yuting Liu
米国Boston Children's Hospital研究員.
Yi Zhang
米国Harvard Medical School教授.
研究室URL:http://zhanglab.tch.harvard.edu/
© 2016 井上 梓・Falong Lu・Yuting Liu・Yi Zhang Licensed under CC 表示 2.1 日本
(米国Boston Children's Hospital,Program in Cellular and Molecular Medicine)
email:井上 梓
DOI: 10.7875/first.author.2016.060
Establishing chromatin regulatory landscape during mouse preimplantation development.
Falong Lu, Yuting Liu, Azusa Inoue, Tsukasa Suzuki, Keji Zhao, Yi Zhang
Cell, 165, 1375-1388 (2016)
要 約
精子および卵におけるクロマチンの構造は受精ののち着床前の発生をつうじ大規模に変化すると考えられているが,その実態は謎につつまれている.今回,筆者らは,ゲノムにおいて局所的にクロマチンのゆるんだ,開いたクロマチン構造をもつDNase I高感受性部位を100個以下の細胞から網羅的に同定することのできる微量DNaseシークエンス法を確立し,マウスにおいて1細胞期から桑実胚期までの胚におけるDNase I高感受性部位を同定した.DNase I高感受性部位は着床前の発生をつうじ増加しており,その変化は8細胞期にかけてとくに顕著であった.DNase I高感受性部位の大部分はプロモーターに位置しており,DNase I高感受性部位の有無と遺伝子の発現レベルとのあいだに正の相関が認められた.また,精子に由来するゲノムのDNase I高感受性部位のプロファイルは,受精の直後の1細胞期においてすでに,卵子に由来するゲノムのプロファイルと類似していた.一方で,インプリント遺伝子においては転写の開始のまえからアレルに特異的なDNase I高感受性部位が形成されていた.さらに,転写因子の機能解析をつうじ,NfyaおよびOct4がそれぞれ2細胞期および8細胞期におけるDNase I高感受性部位の形成に関与することが見い出された.この研究により,哺乳類の着床前の胚におけるクロマチンの構造の大規模な変化およびその分子機構の一端が明らかにされた.
はじめに
最終分化した卵および精子のエピゲノムは受精をきっかけにリプログラミングされ,あらゆる細胞に分化することのできる全能性を獲得する.全能性は1細胞期および2細胞期の胚がもち,そののちの発生の過程において失われると考えられている.受精から4日目の胚盤胞期には,将来的に胚体になる内部細胞塊と胎盤に関連する組織になる栄養外胚葉とに分化する.このような着床前の胚における細胞運命の転換の背景にある分子機構を解明するためには,遺伝子発現の変化と,それをつかさどる転写因子ネットワークおよびクロマチンの構造の解明が必要である.これまでの研究により,遺伝子発現の変化はマイクロアレイ法やRNAシークエンス法により明らかにされてきた一方1,2),転写因子ネットワークやクロマチンの構造がどのように変化し,それがどのように制御されているのかはほとんど明らかにされていない.
クロマチンは,ヌクレオソームの局在をつうじた1次構造と,Mbの規模での立体配置をつうじた高次構造により階層的に制御される.1次構造については,プロモーター,エンハンサー,インスレーターなどの多様な遺伝子発現の制御領域において,ヌクレオソームが少なく局所的に開いたクロマチン構造を形成することにより,転写因子やクロマチン関連タンパク質の結合が可能となり近傍の遺伝子発現が制御される3).このような開いたクロマチン構造はパイオニア転写因子とよばれる一群の転写因子の結合により形成されると考えられている4).開いたクロマチン構造の局在のパターンは細胞種に固有であり,たとえば,多能性幹細胞の分化の過程において大きく変化する5).
開いたクロマチン構造をもつゲノムの領域はDNase Iに対し高い感受性を示すことから同定することができ,このような領域はDNase I高感受性部位とよばれる.次世代シークエンサーを用いてDNase I高感受性部位を網羅的に同定する方法として,DNaseシークエンス法がある6).そのほか,トランスポザーゼへの感受性を指標に開いたクロマチン構造を同定するATACシークエンス法も存在する7).しかし,これらの方法は数百万個の細胞を必要とするため,多量の細胞を集めることが困難な着床前の胚を解析することはできなかった.近年,これらの技術を単一の細胞に適応することのできる単一細胞DNaseシークエンス法や単一細胞ATACシークエンス法が開発されたが,感度が非常に低いという問題点があった8,9).そこで,この研究においては,100個以下の細胞から開いたクロマチン構造を高感度で同定することのできる微量DNaseシークエンス法を確立し,マウスの着床前の胚におけるクロマチンの1次構造の変化を解析した.
1.微量DNaseシークエンス法の確立
単一細胞DNaseシークエンス法をベースとして,増幅のまえのDNAの精製のステップを減らすこと,DNAの精製にゲルによる精製ではなくSPRIビーズを用いること,などの改良をくわえて,微量DNaseシークエンス法を確立した(図1).この方法を100個のES細胞に対し用いたところ,77,589箇所のDNase I高感受性部位が同定された.ENCODEプロジェクトにおいて標準的なDNaseシークエンス法を用いて約1000万個のES細胞から同定されたDNase I高感受性部位219,515箇所と比較したところ,ENCODEプロジェクトにおいて同定された確度の高い21,330箇所のDNase I高感受性部位のうち,93%が微量DNaseシークエンス法により100個のES細胞からも同定されていた.その逆に,微量DNaseシークエンス法により100個のES細胞から同定された確度の高い29,305箇所のDNase I高感受性部位のうち,97%がENCODEプロジェクトにおいても同定されていた.また,100個のES細胞から同定されたDNase I高感受性部位と30個のES細胞から同定されたDNase I高感受性部位とのシグナル強度の相関係数は0.98,30個のES細胞から同定されたDNase I高感受性部位とENCODEプロジェクトにおいて同定されたDNase I高感受性部位との相関係数は0.93と,それぞれ非常に高い値を示した.これらの結果から,微量DNaseシークエンス法は再現性が高く,ある一定の感度をもってDNase I高感受性部位を網羅的に同定できることが示された.
2.DNase I高感受性部位は着床前の発生の過程において増加する
微量DNaseシークエンス法を用いて,マウスの1細胞期,2細胞期,4細胞期,8細胞期,桑実胚期のおのおののステージの胚においてDNase I高感受性部位を同定した.おのおののステージにおいてそれぞれ100個,100個,50個,25個,10個の胚を用いることにより細胞の数を100~200個に統一した.確度の高いDNase I高感受性部位はそれぞれ844箇所,1006箇所,2957箇所,12,323箇所,19,476箇所であり,発生をへるごとに増加した.おのおののステージにおけるDNase I高感受性部位のゲノムにおける局在をプロモーター,イントロン,エキソン,遺伝子間領域の4つに分類したところ,すべてのステージにおいてプロモーターに高頻度に存在した.1細胞期においてはDNase I高感受性部位のほとんどがプロモーターに位置していたが(87%),2細胞期および8細胞期においてはこの割合が低下し(77%および50%),逆に,遺伝子間領域の割合が大きく上昇した.発生の過程におけるそれぞれのDNase I高感受性部位の出現および消失について調べたところ,いったん現われたDNase I高感受性部位はほとんど消失することなく,そののちの発生の過程において維持された.
プロモーターに存在するDNase I高感受性部位と遺伝子発現との関連を調べるため,おのおののステージにおいてトランスクリプトーム2) と比較した.その結果,すべてのステージにおいて,プロモーターにDNase I高感受性部位をもつ遺伝子はもたない遺伝子と比較して有意に高く発現していた.プロモーターにDNase I高感受性部位をもつ遺伝子の2~10%は,つぎの発生の段階においてはじめて発現を開始する,すなわち,プライム状態にある遺伝子であった.
3.インプリント遺伝子は片アレル性の発現のまえからアレルに特異的なDNase I高感受性部位をもつ
ゲノムインプリンティングは母方あるいは父方の一方のアレルからのみ発現する遺伝子の制御様式である.インプリント遺伝子の発現アレルは抑制アレルよりもDNase Iに対する感受性の高いことが知られているが10),それが,片アレル性の発現の原因か結果かはわかっていなかった.また,発生のどの時期にDNase I高感受性部位がアレルに対する特異性を獲得するのかも不明であった.これらの疑問に答えるため,亜系統のあいだの遺伝子多型を利用することにより着床前の胚において母性ゲノムと父性ゲノムとを識別し,インプリント遺伝子のプロモーターにおけるDNase I高感受性部位のアレルへの特異性について調べた.150個の既知のインプリント遺伝子のうち,プロモーターに1塩基多型を含む109個を対象として解析したところ,2細胞期,4細胞期,8細胞期,桑実胚期の胚においてそれぞれ2個,3個,9個,18個のインプリント遺伝子がプロモーターにDNase I高感受性部位をもっていた.これらのうちそれぞれ2個,3個,6個,10個のインプリント遺伝子がアレルに特異性をもち,発現アレルのほうがDNase Iに対する感受性が高かった.これらのインプリント遺伝子のうちいくつかは着床前の胚において発現の認められない遺伝子であった.この結果から,インプリント遺伝子のアレルに特異的なDNase Iに対する感受性は,片アレル性の発現の結果として生じるものではなく,片アレル性の発現を制御する機構のひとつである可能性が示唆された.
4.精子のゲノムのDNase I高感受性部位は受精の直後にリプログラミングされる
精子のゲノムはプロタミンにより高度にパッケージングされているが,受精ののちプロタミンからヒストンへの置換が起こり新しくクロマチンが形成される.この過程においてクロマチンの構造が大規模に変化すると考えられるが,それが受精ののちどの時期に完了するのかはわかっていなかった.そこで,精子,受精後7.5時間の胚,12時間の1細胞期の胚から雄性前核および雌性前核を単離して微量DNaseシークエンス法により解析した.その結果,精子にはDNase I高感受性部位はほとんど存在しなかったが,受精後7.5時間の胚において雄性ゲノムはすでにDNase I高感受性部位をゲノムワイドに獲得しており,そのプロファイルは雌性ゲノムのプロファイルと類似していた.この結果から,精子のゲノムのDNase I高感受性部位は受精後7.5時間までにリプログラミングされることが示唆された.
5.転写因子Oct4は8細胞期の胚におけるDNase I高感受性部位の形成に関与する
8細胞期においてDNase I高感受性部位が形成される機構について調べるため,この時期において機能する転写因子の同定を試みた.パイオニア転写因子として知られる転写因子の発現パターンを調べたところ,Oct4の発現が8細胞期において急激に上昇していた.そこで,siRNAを用いてOct4をノックダウンし,8細胞期の胚において微量DNaseシークエンス法により解析した.その結果,Oct4をノックダウンした胚は対照となる胚と比較して,8細胞期において形成されるDNase I高感受性部位のうち27%についてDNase Iに対する感受性が1/2以下に低下していた.このことから,Oct4は8細胞期の胚におけるDNase I高感受性部位の形成に関与する転写因子のひとつであることが示唆された.
6.転写因子Nfyaは2細胞期の胚におけるDNase I高感受性部位の形成および胚性遺伝子の活性化に関与する
マウスの2細胞期の胚において起こる胚性遺伝子の活性化に必要な転写因子はいまだ同定されていなかった.DNase I高感受性部位は転写因子との結合により形成されることから,2細胞期の胚におけるDNase I高感受性部位に存在する転写因子のDNA結合モチーフについて調べることにより,そこで機能する転写因子を予測できるのではないかと考えた.そこで,2細胞期の胚のプロモーターに存在するDNase I高感受性部位を対象として転写因子の結合を予測した結果,Nfyaの結合モチーフであるCCAAT配列が高頻度で存在することがわかった.そこで,siRNAを用いてNfyaをノックダウンし,2細胞期の胚において微量DNaseシークエンス法により解析した.その結果,Nfyaをノックダウンした胚は対照となる胚と比較して,2細胞期の胚のプロモーターに存在するDNase I高感受性部位のうち28%についてDNase Iへの感受性が1/2以下に低下していた.CCAAT配列を含むプロモーターは含まないプロモーターよりもDNase Iに対する感受性が顕著に低下していた.胚性遺伝子の発現におけるNfyaの必要性について調べるためRNAシークエンス法により解析したところ,Nfyaをノックダウンした胚においては,2細胞期において活性化される1961個の遺伝子のうち297個(15%)の発現が1.5倍以上も抑制されていた.発現の抑制された297個の遺伝子のプロモーターはDNase Iに対する感受性が顕著に低下していた.さらに,Nfyaをノックダウンした胚の胚盤胞期までの発生率は対照となる胚と比較して有意に低かった.これらの結果から,Nfyaは2細胞期の胚におけるDNase I高感受性部位の形成および胚性遺伝子の発現において重要な役割をはたすことが示唆された(図2).
おわりに
この研究においては,微量DNaseシークエンス法を確立し,マウスの着床前の胚において開いたクロマチン構造を網羅的に同定した.リソースとしての有用性だけでなく,インプリント遺伝子の発現の制御機構および精子のゲノムのリモデリングの機構に関し新たな知見が得られ,さらに,着床前の胚において機能する転写因子を同定する新たなアプローチが可能になった.
この研究の結果を解釈する際の注意点をあげる.この研究において同定されたDNase I高感受性部位はあくまでも微量DNaseシークエンス法により同定されたものであり,すべての開いたクロマチン構造をもらさず同定したものではないと考えている.このことは,ENCODEプロジェクトにおいてはES細胞において219,515個のDNase I高感受性部位が同定された一方,100個のES細胞を用いた微量DNaseシークエンス法においては77,589個しか同定されなかったことからも明白である.そのため,たとえば,2細胞期の胚において同定された1006個のDNase I高感受性部位は,2細胞期の胚に存在するすべての開いたクロマチン構造のうちもっとも安定に存在するものだけにすぎない可能性がある.2細胞期の胚において同定されたDNase I高感受性部位の数が2細胞期の胚において活性化する遺伝子(1961個)より少ないことは,このような技術的な理由によると考えられる.また,標準的なDNaseシークエンス法は抽出したクロマチンに対しDNase Iを処理する一方,微量DNaseシークエンス法では可溶化した細胞にじかにDNase Iを処理するため,細胞や核の大きさの違いがDNase Iの透過性や反応性に影響する可能性を否定できない.とくに着床前の胚においては割球や核の大きさは発生の後期ほど小さく,この研究においてみられたDNase I高感受性部位の増加はそのような技術的な問題が寄与した可能性を考慮する必要がある.今後,これらの問題点を解消し,さらに感度を高めた改良法の確立が必要である.
着床前の胚は胎盤の組織を含むあらゆる細胞に分化することのできる全能性をもつ唯一の細胞であり,その全能性を特徴づけるクロマチンの構造および転写因子ネットワークの解明は生物学的にも医学的にも重要な課題である.微量DNaseシークエンス法がこの分野における研究の幅を広げ,新たな研究展開をもたらすことを期待している.
文 献
- Hamatani, T., Carter, M., Sharov, A. et al.: Dynamics of global gene expression changes during mouse preimplantation development. Dev. Cell, 6, 117-131 (2004)[PubMed]
- Xue, Z., Huang, K., Cai, C. et al.: Genetic programs in human and mouse early embryos revealed by single-cell RNA sequencing. Nature, 500, 593-597 (2013)[PubMed]
- Bell, O., Tiwari, V. K., Thoma, N. H. et al.: Determinants and dynamics of genome accessibility. Nat. Rev. Genet., 12, 554-564 (2011)[PubMed]
- Iwafuchi-Doi, M. & Zaret, K.: Pioneer transcription factors in cell reprogramming. Genes Dev., 28, 2679-2692 (2014)[PubMed]
- Stergachis, A. B., Neph, S., Reynolds, A. et al.: Developmental fate and cellular maturity encoded in human regulatory DNA landscapes. Cell, 154, 888-903 (2013)[PubMed]
- Boyle, A. P., Davis, S., Shulha, H. P. et al.: High-resolution mapping and characterization of open chromatin across the genome. Cell, 132, 311-322 (2008)[PubMed]
- Buenrostro, J. D., Giresi, P. G., Zaba, L. C. et al.: Transposition of native chromatin for fast and sensitive epigenomic profiling of open chromatin, DNA-binding proteins and nucleosome position. Nat. Methods, 10, 1213-1218 (2013)[PubMed]
- Buenrostro, J. D., Wu, B., Litzenburger, U. M. et al.: Single-cell chromatin accessibility reveals principles of regulatory variation. Nature 523, 486-490 (2015)[PubMed]
- Jin, W., Tang, Q., Wan, M. et al.: Genome-wide detection of DNase I hypersensitive sites in single cells and FFPE tissue samples. Nature 528, 142-146 (2015)[PubMed]
- Watanabe, T., Yoshimura, A., Mishima, Y. et al.: Differential chromatin packaging of genomic imprinted regions between expressed and non-expressed alleles. Hum. Mol. Genet., 9, 3029-3035 (2000)[PubMed]
著者プロフィール
略歴:2011年 東京大学大学院新領域創成科学研究科 修了,同年 米国North Carolina大学Chapel Hill校 研究員を経て,2012年より米国Harvard Medical School研究員.
研究テーマ:受精卵におけるエピゲノムのリプログラミングの機構.
関心事:卵の研究の発展と子供の成長.
Falong Lu
米国Boston Children's Hospital研究員.
Yuting Liu
米国Boston Children's Hospital研究員.
Yi Zhang
米国Harvard Medical School教授.
研究室URL:http://zhanglab.tch.harvard.edu/
© 2016 井上 梓・Falong Lu・Yuting Liu・Yi Zhang Licensed under CC 表示 2.1 日本