腸管上皮細胞間に特異的に存在するCD4CD8ααT細胞は制御性T細胞と相補的に腸管の炎症を抑制する
筋野智久・Bernardo S. Reis・Daniel Mucida
(米国Rockefeller大学Laboratory of Mucosal Immunology)
email:筋野智久
DOI: 10.7875/first.author.2016.058
Tissue adaptation of regulatory and intraepithelial CD4+ T cells controls gut inflammation.
Tomohisa Sujino, Mariya London, David P. Hoytema van Konijnenburg, Tomiko Rendon, Thorsten Buch, Hernandez M. Silva, Juan J. Lafaille, Bernardo S. Reis, Daniel Mucida
Science, 352, 1581-1586 (2016)
腸管は外界と体内をへだてており,腸内細菌に由来する抗原や食物抗原をはじめとする多くの抗原につねにさらされる.腸管は抗原が体内に侵入するのをふせぐと同時に,過剰な免疫反応を起こすことなく栄養素などを取り込む必要があり,腸管免疫系はその絶妙なバランスにより保たれる.腸管免疫系において,T細胞は腸管上皮細胞間および粘膜固有層に存在する.CD4CD8ααT細胞はおもに腸管上皮細胞間に存在するユニークな細胞である.制御性T細胞とCD4CD8ααT細胞はともに,TGFβおよびレチノイン酸を分化に必要とするという共通点がある.制御性T細胞は転写因子ThPOKを発現し粘膜固有層に多く存在するのに対し,CD4CD8ααT細胞はThPOKを発現せず腸管上皮細胞間に多く存在する.この研究においては,CD4陽性T細胞はThPOKの発現に依存して腸管上皮細胞間および粘膜固有層に存在し,さらに,制御性T細胞とCD4CD8ααT細胞は腸管上皮細胞間における炎症の抑制の役割を相補的に担い,一部のCD4CD8ααT細胞は制御性T細胞より分化することが示された.
腸管は腸内細菌に由来する抗原や食物抗原をはじめとする多くの抗原につねにさらされ,体内への抗原の侵入に対する最初の防衛ラインである.腸管には,おもに胸腺において教育されるナチュラルT細胞と末梢において誘導されるT細胞が存在する1).腸管の粘膜において,免疫を担当する細胞は粘膜固有層のみならず腸管上皮細胞間にも存在する.脾臓やリンパ節,あるいは,粘膜固有層とはまったく異なり,腸管上皮細胞間にはTCRγδT細胞やCD4CD8ααT細胞といったユニークな細胞が存在する.通常,脾臓,リンパ節,粘膜固有層においては,CD4陽性T細胞の約10%は炎症抑制能をもつ制御性T細胞から構成される.腸管上皮細胞間において制御性T細胞は約3~5%と少なく,CD4CD8ααT細胞がその多数をしめる一方,粘膜固有層においてCD4CD8ααT細胞は少ない(図1).CD4CD8ααT細胞はCD4およびCD8ααを発現し,T-betやRUNX3といった転写因子により分化が誘導される2,3).さらに,CD4CD8ααT細胞は,胸腺におけるCD4陽性T細胞の分化に必須の転写因子であるThPOKの発現が同時に低下することにより分化が誘導される4,5).これまで,制御性T細胞およびCD4CD8ααT細胞の分化においてはTGFβおよびレチノイン酸が必須であることが示されており2),共通点であるともいえる.しかし,制御性T細胞およびCD4CD8ααT細胞がなぜ腸管上皮細胞間および粘膜固有層においてそれぞれ多数をしめているのかについては不明であった.
腸管におけるT細胞の動きを2光子顕微鏡を用いたイメージング法により解析した.その結果,TCRγδ細胞は大半が粘膜上皮にとどまり,ほぼ同数が粘膜固有層と腸管上皮細胞間とのあいだを行き来することにより恒常性が保たれることがわかった.一方,制御性T細胞は大多数が粘膜固有層にとどまり,一部が腸管上皮細胞間に移動した.粘膜固有層と腸管上皮細胞間とのあいだを移動する制御性T細胞に着目したところ,より多くの細胞が粘膜固有層から腸管上皮細胞間へと移動していた.このことは,腸管上皮細胞間には少数の制御性T細胞しか存在しないことに反していた.つまり,腸管上皮細胞間に存在する制御性T細胞は,粘膜上皮において死んでいるか,あるいは,ほかの細胞に変化している可能性が考えられた.さらには,遺伝子操作マウスを用いた解析により,粘膜固有層と腸管上皮細胞間とのあいだのダイナミズムは,転写因子ThPOKの発現と深くかかわることが示された.
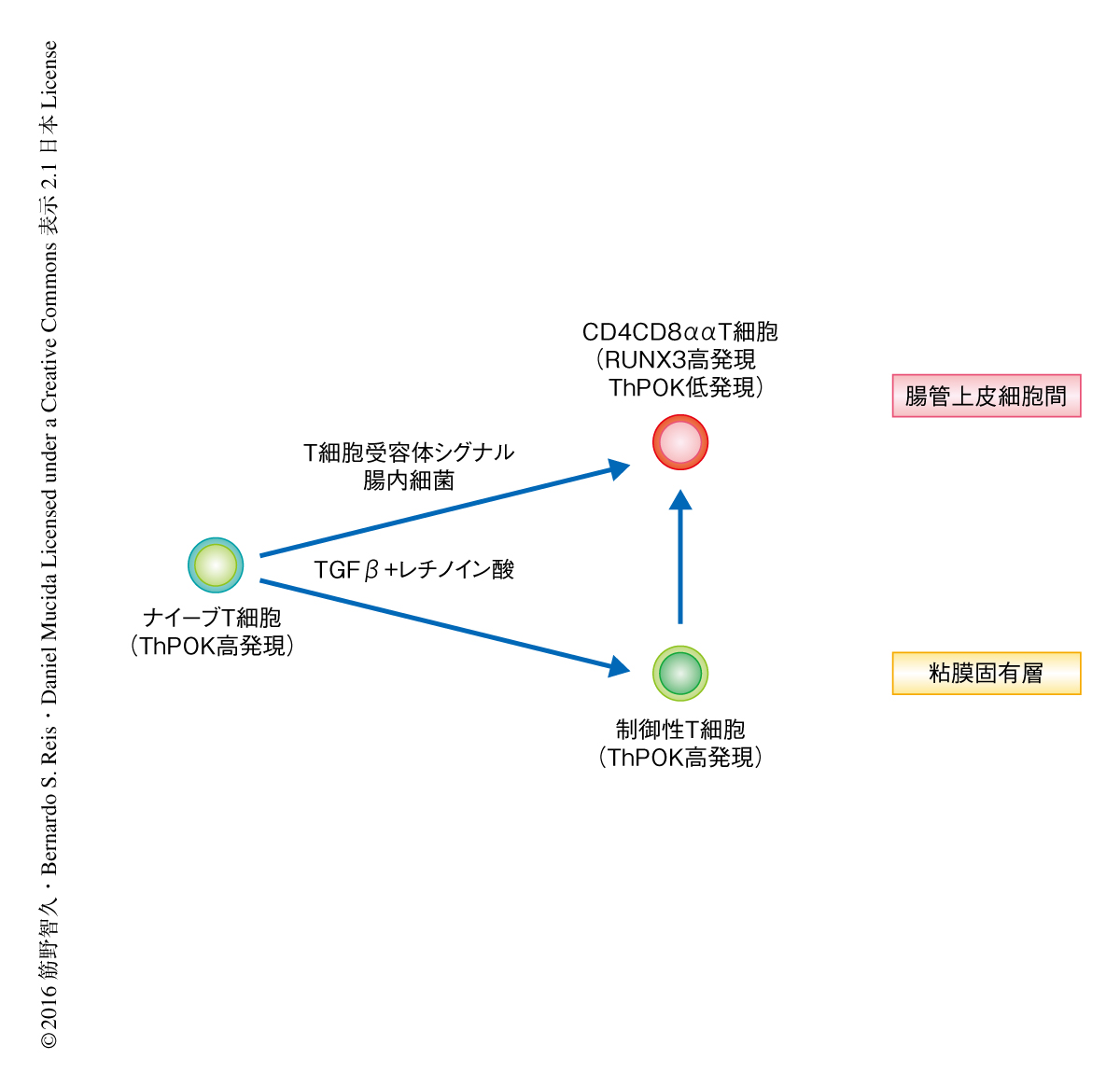
これまで,CD4CD8ααT細胞の分化は転写因子T-betおよびRUNX3,さらに,インターロイキン15に依存することが示されていた.今回,無菌マウスにおいてCD4CD8ααT細胞は分化しないことが確認された.一方,制御性T細胞は,無菌マウスにおいて腸管上皮細胞間における絶対数に変化はなくその割合は上昇していた.小腸におけるこの現象は大腸における現象と逆転しており6),CD4CD8ααT細胞と制御性T細胞は腸管上皮細胞間において腸内細菌に依存してその割合を相互におぎなっていると考えられた.さらに,CD4CD8ααT細胞の生理的な分化においては腸内細菌の存在が必要であり,T細胞受容体への強いシグナルのもとでは腸内細菌に非依存的に分化されうることが確認された(図2).
これまで,制御性T細胞はきわめて安定した細胞であり,いちど分化すると変化しないと考えられてきた7).しかし,いくつかの報告においては,一部の制御性T細胞は濾胞性ヘルパーT細胞やTh17細胞のように変化するとも報告されている8,9).今回,遺伝子操作マウスを用いた解析により,腸管上皮細胞間においてのみ,一部の制御性T細胞はCD4CD8ααT細胞に分化することが判明した.粘膜固有層,脾臓,腸管リンパ節において分化は認められなかった.また,制御性T細胞からCD4CD8ααT細胞への生理的な分化は腸内細菌に依存することが確認された.
胸腺におけるCD4陽性T細胞の分化にはThPOK,CD8陽性T細胞の分化にはRUNX3やRUNX1といった転写因子の発現が必要であり,末梢におけるCD4CD8ααT細胞の分化には転写因子としてRUNX3およびT-betの発現が必要であることが示されていた.今回,遺伝子操作マウスを用いた解析により,CD4CD8ααT細胞の分化にはThPOKの発現の低下が必要であることが判明した.さらに,ThPOKの発現の低下により末梢において制御性T細胞が減少した.さらに,制御性T細胞にThPOKを発現させることにより腸管上皮細胞間において制御性T細胞が減少しCD4CD8ααT細胞が増加した.以上より,腸管上皮細胞間においてはThPOKの発現が制御性T細胞とCD4CD8ααT細胞のどちらの分化が優位に誘導されるかに関与すると考えられた.
さらに,種々の遺伝子操作マウスを用いて検討した結果,CD4陽性ナイーブT細胞が粘膜固有層におけるThPOKの発現の低下をへて,腸管上皮細胞間においてCD4CD8ααT細胞に分化することが示された.
制御性T細胞は炎症の抑制の役割をはたすが,CD4CD8ααT細胞については培養細胞を用いたin vitroの系において炎症を抑制するという報告があるのみであった10).今回,制御性T細胞の分化は誘導されずCD4CD8ααT細胞の分化が誘導されるマウスにおいて腸炎が生じなかったこと,さらに,このマウスにおいてCD4CD8ααT細胞を除去すると腸炎が誘発されたことからCD4CD8ααT細胞が炎症の抑制に影響を及ぼすと考えられた.
腸内細菌に由来する抗原あるいは食物抗原とわずかひとつの層からなる小腸上皮組織をへだてて,多くのCD4陽性T細胞が自己と非自己を識別し過剰な炎症が起こらないよう機能している.今回,CD4CD8ααT細胞という腸管上皮細胞間のみに存在するユニークな細胞が,制御性T細胞のように炎症を抑制することが示された.さらに,腸管上皮細胞間に存在するさまざまなT細胞は腸管上皮細胞間および粘膜固有層においてそれぞれ特異的に移動しており,転写因子ThPOKに依存して存在する部位をもつことも示された.腸管上皮細胞間において,制御性T細胞とCD4CD8ααT細胞は互いに補完しあいながら炎症の抑制にはたらく可能性が考えられた(図1).
しかし,これはあくまでもひとつの動物モデルにおける結果であり,ヒトにおいては粘膜固有層にも少なからずCD4CD8ααT細胞が存在すること,すべてのCD4CD8ααT細胞が制御性T細胞から分化したわけではないこと,さらに,CD4CD8ααT細胞は制御性T細胞と同様の炎症の抑制機構をもつわけではないことを十分に考えて炎症性腸疾患の病態の機構につき検討する必要がある.さらに,なぜ腸管上皮に近い部位においてThPOKの発現が低下するのかについて詳細は不明である.今後も,なぜ腸管上皮細胞間において特異的にCD4CD8ααT細胞の分化が誘導されるのか,さらには,ヒトにおけるCD4CD8ααT細胞の役割について検討していきたい.
略歴:2012年 慶應義塾大学大学院医学研究科博士課程 修了,2014年 米国Rockefeller大学Post Doctoral Fellowを経て,2016年より慶應義塾大学医学部 特任助教.
Bernardo S. Reis
米国Rockefeller大学Research Associate.
Daniel Mucida
米国Rockefeller大学Assistant Professor.
研究室URL:http://www.rockefeller.edu/research/faculty/labheads/DanielMucida/
© 2016 筋野智久・Bernardo S. Reis・Daniel Mucida Licensed under CC 表示 2.1 日本
(米国Rockefeller大学Laboratory of Mucosal Immunology)
email:筋野智久
DOI: 10.7875/first.author.2016.058
Tissue adaptation of regulatory and intraepithelial CD4+ T cells controls gut inflammation.
Tomohisa Sujino, Mariya London, David P. Hoytema van Konijnenburg, Tomiko Rendon, Thorsten Buch, Hernandez M. Silva, Juan J. Lafaille, Bernardo S. Reis, Daniel Mucida
Science, 352, 1581-1586 (2016)
要 約
腸管は外界と体内をへだてており,腸内細菌に由来する抗原や食物抗原をはじめとする多くの抗原につねにさらされる.腸管は抗原が体内に侵入するのをふせぐと同時に,過剰な免疫反応を起こすことなく栄養素などを取り込む必要があり,腸管免疫系はその絶妙なバランスにより保たれる.腸管免疫系において,T細胞は腸管上皮細胞間および粘膜固有層に存在する.CD4CD8ααT細胞はおもに腸管上皮細胞間に存在するユニークな細胞である.制御性T細胞とCD4CD8ααT細胞はともに,TGFβおよびレチノイン酸を分化に必要とするという共通点がある.制御性T細胞は転写因子ThPOKを発現し粘膜固有層に多く存在するのに対し,CD4CD8ααT細胞はThPOKを発現せず腸管上皮細胞間に多く存在する.この研究においては,CD4陽性T細胞はThPOKの発現に依存して腸管上皮細胞間および粘膜固有層に存在し,さらに,制御性T細胞とCD4CD8ααT細胞は腸管上皮細胞間における炎症の抑制の役割を相補的に担い,一部のCD4CD8ααT細胞は制御性T細胞より分化することが示された.
はじめに
腸管は腸内細菌に由来する抗原や食物抗原をはじめとする多くの抗原につねにさらされ,体内への抗原の侵入に対する最初の防衛ラインである.腸管には,おもに胸腺において教育されるナチュラルT細胞と末梢において誘導されるT細胞が存在する1).腸管の粘膜において,免疫を担当する細胞は粘膜固有層のみならず腸管上皮細胞間にも存在する.脾臓やリンパ節,あるいは,粘膜固有層とはまったく異なり,腸管上皮細胞間にはTCRγδT細胞やCD4CD8ααT細胞といったユニークな細胞が存在する.通常,脾臓,リンパ節,粘膜固有層においては,CD4陽性T細胞の約10%は炎症抑制能をもつ制御性T細胞から構成される.腸管上皮細胞間において制御性T細胞は約3~5%と少なく,CD4CD8ααT細胞がその多数をしめる一方,粘膜固有層においてCD4CD8ααT細胞は少ない(図1).CD4CD8ααT細胞はCD4およびCD8ααを発現し,T-betやRUNX3といった転写因子により分化が誘導される2,3).さらに,CD4CD8ααT細胞は,胸腺におけるCD4陽性T細胞の分化に必須の転写因子であるThPOKの発現が同時に低下することにより分化が誘導される4,5).これまで,制御性T細胞およびCD4CD8ααT細胞の分化においてはTGFβおよびレチノイン酸が必須であることが示されており2),共通点であるともいえる.しかし,制御性T細胞およびCD4CD8ααT細胞がなぜ腸管上皮細胞間および粘膜固有層においてそれぞれ多数をしめているのかについては不明であった.
1.制御性T細胞の腸管におけるダイナミズム
腸管におけるT細胞の動きを2光子顕微鏡を用いたイメージング法により解析した.その結果,TCRγδ細胞は大半が粘膜上皮にとどまり,ほぼ同数が粘膜固有層と腸管上皮細胞間とのあいだを行き来することにより恒常性が保たれることがわかった.一方,制御性T細胞は大多数が粘膜固有層にとどまり,一部が腸管上皮細胞間に移動した.粘膜固有層と腸管上皮細胞間とのあいだを移動する制御性T細胞に着目したところ,より多くの細胞が粘膜固有層から腸管上皮細胞間へと移動していた.このことは,腸管上皮細胞間には少数の制御性T細胞しか存在しないことに反していた.つまり,腸管上皮細胞間に存在する制御性T細胞は,粘膜上皮において死んでいるか,あるいは,ほかの細胞に変化している可能性が考えられた.さらには,遺伝子操作マウスを用いた解析により,粘膜固有層と腸管上皮細胞間とのあいだのダイナミズムは,転写因子ThPOKの発現と深くかかわることが示された.
2.CD4CD8ααT細胞はどのような環境において分化するのか?
これまで,CD4CD8ααT細胞の分化は転写因子T-betおよびRUNX3,さらに,インターロイキン15に依存することが示されていた.今回,無菌マウスにおいてCD4CD8ααT細胞は分化しないことが確認された.一方,制御性T細胞は,無菌マウスにおいて腸管上皮細胞間における絶対数に変化はなくその割合は上昇していた.小腸におけるこの現象は大腸における現象と逆転しており6),CD4CD8ααT細胞と制御性T細胞は腸管上皮細胞間において腸内細菌に依存してその割合を相互におぎなっていると考えられた.さらに,CD4CD8ααT細胞の生理的な分化においては腸内細菌の存在が必要であり,T細胞受容体への強いシグナルのもとでは腸内細菌に非依存的に分化されうることが確認された(図2).
3.腸管上皮細胞間に存在するCD4CD8ααT細胞の一部は制御性T細胞から分化する
これまで,制御性T細胞はきわめて安定した細胞であり,いちど分化すると変化しないと考えられてきた7).しかし,いくつかの報告においては,一部の制御性T細胞は濾胞性ヘルパーT細胞やTh17細胞のように変化するとも報告されている8,9).今回,遺伝子操作マウスを用いた解析により,腸管上皮細胞間においてのみ,一部の制御性T細胞はCD4CD8ααT細胞に分化することが判明した.粘膜固有層,脾臓,腸管リンパ節において分化は認められなかった.また,制御性T細胞からCD4CD8ααT細胞への生理的な分化は腸内細菌に依存することが確認された.
4.腸管上皮細胞間における制御性T細胞およびCD4CD8ααT細胞の分化には転写因子ThPOKが関与する
胸腺におけるCD4陽性T細胞の分化にはThPOK,CD8陽性T細胞の分化にはRUNX3やRUNX1といった転写因子の発現が必要であり,末梢におけるCD4CD8ααT細胞の分化には転写因子としてRUNX3およびT-betの発現が必要であることが示されていた.今回,遺伝子操作マウスを用いた解析により,CD4CD8ααT細胞の分化にはThPOKの発現の低下が必要であることが判明した.さらに,ThPOKの発現の低下により末梢において制御性T細胞が減少した.さらに,制御性T細胞にThPOKを発現させることにより腸管上皮細胞間において制御性T細胞が減少しCD4CD8ααT細胞が増加した.以上より,腸管上皮細胞間においてはThPOKの発現が制御性T細胞とCD4CD8ααT細胞のどちらの分化が優位に誘導されるかに関与すると考えられた.
さらに,種々の遺伝子操作マウスを用いて検討した結果,CD4陽性ナイーブT細胞が粘膜固有層におけるThPOKの発現の低下をへて,腸管上皮細胞間においてCD4CD8ααT細胞に分化することが示された.
5.腸管上皮細胞間において制御性T細胞およびCD4CD8ααT細胞は炎症の抑制の役割を担う
制御性T細胞は炎症の抑制の役割をはたすが,CD4CD8ααT細胞については培養細胞を用いたin vitroの系において炎症を抑制するという報告があるのみであった10).今回,制御性T細胞の分化は誘導されずCD4CD8ααT細胞の分化が誘導されるマウスにおいて腸炎が生じなかったこと,さらに,このマウスにおいてCD4CD8ααT細胞を除去すると腸炎が誘発されたことからCD4CD8ααT細胞が炎症の抑制に影響を及ぼすと考えられた.
おわりに
腸内細菌に由来する抗原あるいは食物抗原とわずかひとつの層からなる小腸上皮組織をへだてて,多くのCD4陽性T細胞が自己と非自己を識別し過剰な炎症が起こらないよう機能している.今回,CD4CD8ααT細胞という腸管上皮細胞間のみに存在するユニークな細胞が,制御性T細胞のように炎症を抑制することが示された.さらに,腸管上皮細胞間に存在するさまざまなT細胞は腸管上皮細胞間および粘膜固有層においてそれぞれ特異的に移動しており,転写因子ThPOKに依存して存在する部位をもつことも示された.腸管上皮細胞間において,制御性T細胞とCD4CD8ααT細胞は互いに補完しあいながら炎症の抑制にはたらく可能性が考えられた(図1).
しかし,これはあくまでもひとつの動物モデルにおける結果であり,ヒトにおいては粘膜固有層にも少なからずCD4CD8ααT細胞が存在すること,すべてのCD4CD8ααT細胞が制御性T細胞から分化したわけではないこと,さらに,CD4CD8ααT細胞は制御性T細胞と同様の炎症の抑制機構をもつわけではないことを十分に考えて炎症性腸疾患の病態の機構につき検討する必要がある.さらに,なぜ腸管上皮に近い部位においてThPOKの発現が低下するのかについて詳細は不明である.今後も,なぜ腸管上皮細胞間において特異的にCD4CD8ααT細胞の分化が誘導されるのか,さらには,ヒトにおけるCD4CD8ααT細胞の役割について検討していきたい.
文 献
- Cheroutre, H., Lambolez, F. & Mucida, D.: The light and dark sides of intestinal intraepithelial lymphocytes. Nat. Rev. Immunol., 11, 445-456 (2011)[PubMed]
- Reis, B. S., Rogoz. A., Costa-Pinto, F. A. et al.: Mutual expression of the transcription factors Runx3 and ThPOK regulates intestinal CD4+ T cell immunity. Nat. Immunol., 14, 271-280 (2013)[PubMed]
- Reis, B. S., Hoytema van Konijnenburg, D. P., Grivennikov, S. I. et al.: Transcription factor T-bet regulates intraepithelial lymphocyte functional maturation. Immunity, 41, 244-256 (2014)[PubMed]
- Mucida, D., Husain, M. M., Muroi, S. et al.: Transcriptional reprogramming of mature CD4+ helper T cells generates distinct MHC class II-restricted cytotoxic T lymphocytes. Nat. Immunol., 14, 281-289 (2013)[PubMed]
- Muroi, S., Naoe, Y., Miyamoto, C. et al.: Cascading suppression of transcriptional silencers by ThPOK seals helper T cell fate. Nat. Immunol., 9, 1113-1121 (2008)[PubMed]
- Atarashi, K., Tanoue, T., Oshima, K. et al.: Treg induction by a rationally selected mixture of Clostridia strains from the human microbiota. Nature, 500, 232-236 (2013)[PubMed]
- Rubtsov, Y. P., Rasmussen, J. P., Chi, E. Y. et al.: Regulatory T cell-derived interleukin-10 limits inflammation at environmental interfaces. Immunity, 28, 546-558 (2008)[PubMed]
- Miyao, T., Floess, S., Setoguchi, R. et al.: Plasticity of Foxp3+ T cells reflects promiscuous Foxp3 expression in conventional T cells but not reprogramming of regulatory T cells. Immunity, 36, 262-275 (2012)[PubMed] [新着論文レビュー]
- Zhou, X., Bailey-Bucktrout, S. L., Jeker, L. T. et al.: Instability of the transcription factor Foxp3 leads to the generation of pathogenic memory T cells in vivo. Nat. Immunol., 10, 1000-1007 (2009)[PubMed]
- Sarrabayrouse, G., Bossard, C., Chauvin, J. M. et al.: CD4CD8αα lymphocytes, a novel human regulatory T cell subset induced by colonic bacteria and deficient in patients with inflammatory bowel disease. PLoS Biol., 12, e1001833 (2014)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2012年 慶應義塾大学大学院医学研究科博士課程 修了,2014年 米国Rockefeller大学Post Doctoral Fellowを経て,2016年より慶應義塾大学医学部 特任助教.
Bernardo S. Reis
米国Rockefeller大学Research Associate.
Daniel Mucida
米国Rockefeller大学Assistant Professor.
研究室URL:http://www.rockefeller.edu/research/faculty/labheads/DanielMucida/
© 2016 筋野智久・Bernardo S. Reis・Daniel Mucida Licensed under CC 表示 2.1 日本