制御されたネクローシスをひき起こす新規の低分子化合物FIN56は脂質の合成を標的にする
嶋田 健一
(米国Columbia大学Department of Biological Sciences)
email:嶋田健一
DOI: 10.7875/first.author.2016.055
Global survey of cell death mechanisms reveals metabolic regulation of ferroptosis.
Kenichi Shimada, Rachid Skouta, Anna Kaplan, Wan Seok Yang, Miki Hayano, Scott J. Dixon, Lewis M. Brown, Carlos A. Valenzuela, Adam J. Wolpaw, Brent R. Stockwell
Nature Chemical Biology, 12, 497-503 (2016)
近年,アポトーシスだけではなくネクローシスのなかにも制御された細胞死,すなわち,特定のシグナル伝達経路に依存してひき起こされる細胞死のあることがわかってきた.これまでに,細胞死にはさまざまな表現型が報告されているが,個々の機構の類似点あるいは相違点,その多様性を比較した研究は少ない.筆者らは,制御されたネクローシスをひき起こす新規の低分子化合物を探索し,モジュレータープロファイリング法という手法を用いて,10個の新規の低分子化合物は3つの異なる表現型を示す細胞死をひき起こすことを発見した.さらに,そのうちのひとつに着目し,構造活性相関からフェロトーシスという細胞死を強力にひき起こす低分子化合物としてFIN56を見い出した.FIN56の作用機序として,脂質の合成においてコレステロールの合成および脂肪酸の合成をともに撹乱し,さらに,過酸化脂質の蓄積を抑制するグルタチオンペルオキシダーゼ4を分解することによりフェロトーシスがひき起こすことが示唆された.
細胞死は形態学的にアポトーシスとネクローシスに大別される.細胞の内部に存在するタンパク質やDNAの多くは通常は細胞の外には存在しない.ところが,ネクローシスにより細胞膜が破壊されてこれらが細胞の外に漏出すると炎症がひき起こされる.アポトーシスを起こした細胞は細胞質を漏出することなく断片化され近傍の細胞や食細胞により捕食されるため炎症をひき起こすことはない.このため,発生の過程のプログラムされた細胞死においては,周囲への影響の少ないアポトーシスが主流であり,ネクローシスは環境の劇的な変化に対応できないときにひき起こされる偶発的かつ不可逆的な死であると認識されてきた.しかし最近になり,ネクローシスにも特定のシグナル伝達経路の活性化によりひき起こされる“制御された細胞死”のあることがわかってきた.たとえば,生体において細胞が細菌やウイルスに感染して死ぬ際にはネクローシス様の細胞死をひき起こす.感染に対抗して免疫応答を誘導するためには細胞の内部の物質を漏出させて炎症をひき起こすネクローシスのほうが合理的だという生物学的な意義が考えられる.近年,さまざまな細胞種あるいは状況のもとひき起こされる制御された細胞死が報告されており1),筆者らの研究室も,2012年に,制御されたネクローシスのひとつとしてフェロトーシスについて報告している2,3).フェロトーシスはまだ研究の歴史は浅いが,脳室周囲白質軟化症,ハンチントン病,急性尿細管壊死など複数の疾患において重要な役割をはたすことも報告されており,病理学的な意義は大きい4,5).
このように,昨今,多様な細胞死の表現型が報告されているのをうけ,細胞死の研究を先導する研究者により組織された委員会Nomenclature Committee of Cell Deathにより細胞死の概念を体系的にとらえ直そうという努力が続けられている6).しかし実際には,これらの努力は個々の表現型の列挙にとどまるのが現状である.その原因の一端として,細胞死の研究のほとんどは特定の実験条件においてひき起こされた表現型を詳細に解析することに終始しており,どのような条件においてどのような細胞死がひき起こされるかという普遍性にまでふみ込んだ研究の少ないことがあげられる.細胞死の制御を体系的に理解するためには,同一の実験系において異なる表現型を比較する必要がある.そこで,筆者らは,低分子化合物によりひき起こされる細胞死を体系的に解析するという目的のもと,機能が未知の低分子化合物からなるライブラリーにおいて制御されたネクローシスをひき起こす新規の化合物を探索し,その細胞死の機構の解明をめざした.
さまざまな低分子化合物によりひき起こされた細胞死の表現型を同じ実験系において比較する手法として,以前に報告した,モジュレータープロファイリング法を用いた7)(図1).モジュレータープロファイリング法においては,細胞死をひき起こすような低分子化合物と,酵素活性阻害剤,イオンキレート剤,抗酸化剤など特定の細胞死を促進あるいは抑制することの知られているモジュレーターとよばれる物質を用い,個々のモジュレーターの存在のもと,細胞死をひき起こすような低分子化合物の細胞に対する効力がどのように変化するかを調べる.低分子化合物が特定のシグナル伝達経路に依存する細胞死をひき起こした場合,そのシグナル伝達経路の活性の状態により細胞の感受性は大きく変わるはずである.逆に,異なるモジュレーターの存在のもとで低分子化合物に対する細胞の感受性がいちじるしく異なる場合,その細胞死は制御された細胞死である可能性が高い.これに対し,不特定のタンパク質に共有結合する低分子化合物や界面活性剤としてはたらく低分子化合物は,処理の違いあるいは細胞種の違いに対しても細胞の感受性は変化しないと予想される.たとえば,機能が既知の低分子化合物は一部のモジュレーターにより効力が抑制されるため,機能が未知の低分子化合物と比べ,プロファイルの分散の大きいことが示されている7).これは,作用機序の知られている細胞死をひき起こすような低分子化合物は,世の中に存在する細胞死をひき起こすような低分子化合物のなかでも,特定のシグナル伝達経路により選択的に影響をおよぼすからだと考えられる.この性質を利用して,プロファイルの分散の大きい低分子化合物だけを選別することにより,制御された細胞死をひき起こす低分子化合物をスクリーニングすることができる.さらに,プロファイルをよりくわしく調べることにより,個々の細胞死の機構の特徴をとらえることもできる.たとえば,クラスタリング分析により制御された細胞死を表現型ごとにグループ化することができる.機能が未知の低分子化合物と機能が既知の低分子化合物とが同じクラスターにあれば,その表現型を予測することができる.また,どのモジュレーターが細胞死を抑制するかを確認することにより,どのシグナル伝達経路が細胞死に直接的に関連しているのかを判断することができる.
3169個の機能が未知の低分子化合物のライブラリーから,HT-1080線維肉腫細胞株あるいはBJeLR人工細胞株8) に対し制御されたネクローシスをひき起こす低分子化合物を探索した.まず,ライブラリーからアポトーシスの特徴であるカスパーゼ3を活性化しない451個の低分子化合物を選別した.このうち,構造的に多様な56個の低分子化合物に対しモジュレータープロファイリング法を適用しプロファイルの分散を調べたところ,多くの低分子化合物のプロファイルの分散は小さかったが,機能が既知の低分子化合物と同等あるいはそれ以上に大きな分散を示す10個の低分子化合物がみつかり,それらは制御されたネクローシスをひき起こすことが強く示唆された.また,階層的なクラスタリング分析により,これらの低分子化合物は機能が既知の低分子化合物とは異なる3つの独自のクラスターに分けられた.さらに,個々のクラスターにおいて細胞死を効果的に抑制するモジュレーターを調べることにより,3つのクラスターはそれぞれ,遷移金属イオンのキレート剤,制御されたネクローシスの一種であるネクロプトーシスを誘導する物質,フェロトーシスを誘導する物質,であることがわかった.
以前に,筆者らは,フェロトーシスはグルタチオンペルオキシダーゼ4が阻害されることによりひき起こされることを報告した3).グルタチオンペルオキシダーゼ4は抗酸化物質であるグルタチオンを用いて細胞毒性の高い過酸化脂質を還元しこれを無毒化することにより細胞を守る.これまでに,フェロトーシスを誘導する複数の低分子化合物がみつかっているが,これらは,グルタチオンの合成を阻害する間接的な阻害,あるいは,グルタチオンペルオキシダーゼ4に直接的に結合してその酵素活性を阻害する直接的な阻害のどちらかによりグルタチオンペルオキシダーゼ4の活性を抑制し,基質である過酸化脂質を細胞に蓄積させてフェロトーシスをひき起こすことがわかっている.過酸化脂質の蓄積はほかの細胞死においても確認されるが,とくにフェロトーシスにおいては,αトコフェロールなど脂溶性抗酸化剤の添加により細胞死が完全に抑制されることから,過酸化脂質の存在が細胞死を決定づけている.これは,ほかの細胞死の表現型とは明確に異なる点である.
モジュレータープロファイリング法によりみつかった低分子化合物のひとつに着目し,複数の類縁体を作製した.そのなかから,構造活性相関によりフェロトーシスをより強力に誘導する低分子化合物としてFIN56を見い出した.FIN56を処理した細胞においては10時間のちにグルタチオンペルオキシダーゼ4の活性が失われたが,さきに述べた2通りの機構のどちらとも異なり,グルタチオンペルオキシダーゼ4がタンパク質分解されていた.
ケモプロテオミクスによりFIN56と結合するタンパク質を探索した.FIN56をビーズに固定し,HT-1080細胞の抽出液を用いてアフィニティークロマトグラフィーを行い,FIN56と結合したタンパク質を質量分析法により同定した.その結果,FIN56により高い親和性を示す70個のタンパク質が同定された.さらに,これらをコードする遺伝子を標的にしたshRNAライブラリーを作製し,FIN56に対し感受性を示す細胞株に投与してFIN56の効力を上昇あるいは低下させるshRNAを同定した.これらの実験により,メバロン酸経路に存在するスクアレン合成酵素は,FIN56と結合するだけでなく,ノックダウンするとFIN56の効力を低下させることがわかった.
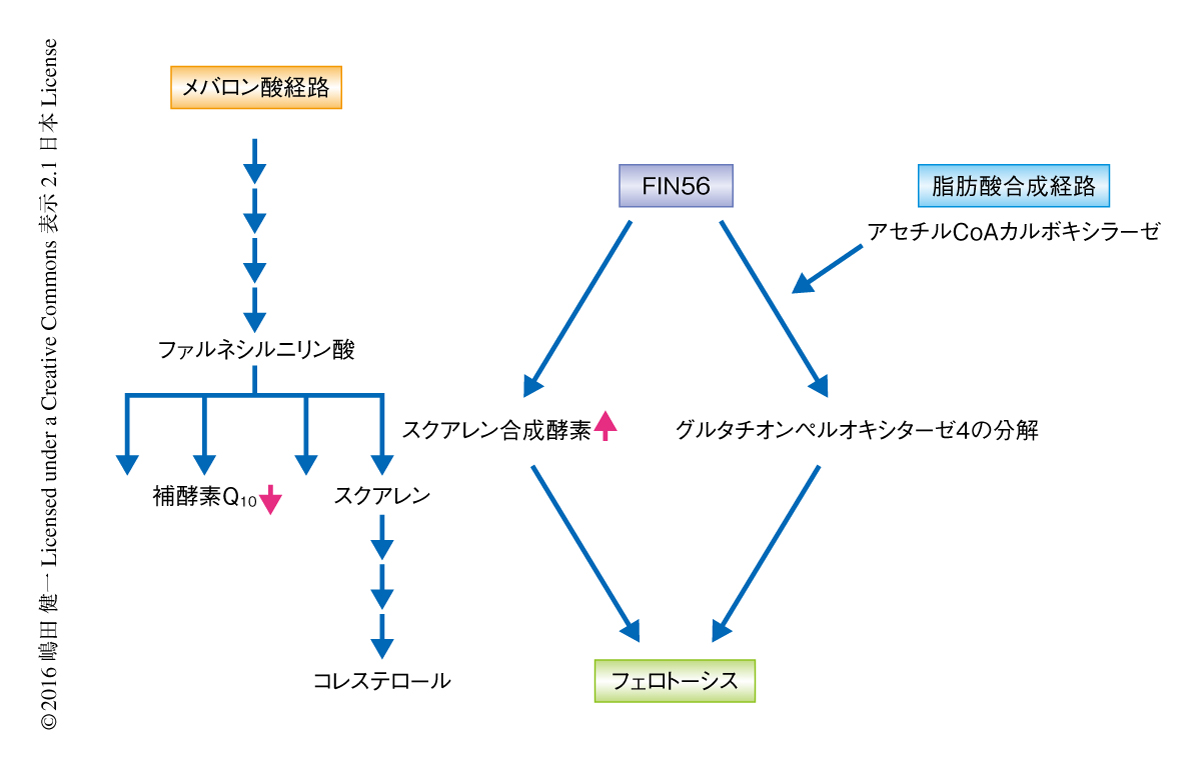
FIN56と結合するスクアレン合成酵素をノックダウンするとFIN56の効力が抑制されることから,スクアレン合成酵素はFIN56により活性化されると考えられた.スクアレン合成酵素は2分子のファルネシル二リン酸を縮合させ1分子のスクアレンを合成する.ファルネシル二リン酸はスクアレンだけでなくドリコールや補酵素Q10などの合成や,タンパク質の修飾に用いられるのに対し,スクアレンはおもにコレステロールの合成に用いられる9).そのため,スクアレン合成酵素が活性化しコレステロールの合成が異常に促進されると,ファルネシル二リン酸を用いるほかの代謝経路は抑制されると考えられた.そこで,ファルネシル二リン酸を用いるどの代謝経路がフェロトーシスと関係があるのかをみるため,メバロン酸経路の代謝産物や阻害剤を添加してFIN56の効力の変化を調べた.その結果,脂溶性抗酸化剤でもある補酵素Q10の類縁体であるイデベノンの添加によりFIN56の効力は完全に抑制された.これらの結果から,FIN56との結合によりスクアレン合成酵素が活性化されファルネシル二リン酸が不足することにより,補酵素Q10の合成が抑制されフェロトーシスに対する感受性が高まると考えられた.
ところで,スクアレン合成酵素の阻害剤をくわえるとフェロトーシスは抑制されるが,グルタチオンペルオキシダーゼ4の分解は抑制されない.このことから,FIN56によるグルタチオンペルオキシダーゼ4の分解の機構はメバロン酸経路とは別にあることが示唆された.グルタチオンペルオキシダーゼ4の分解の機構はいまだ不明であるが,脂肪酸の合成にかかわるアセチルCoA-カルボキシラーゼを化学的に阻害するとグルタチオンペルオキシダーゼ4の分解も抑制されたことから,脂肪酸の合成経路がグルタチオンペルオキシダーゼ4の発現の制御にかかわることが考えられた.
以上より,FIN56が細胞における脂質の合成の2本柱ともいえるコレステロール合成経路と脂肪酸合成経路の両方を撹乱することによりフェロトーシスがひき起こされることが示された(図2).
もともと,一連のフェロトーシスを誘導する低分子化合物はRasに対し選択的に致死性をもつ物質として化合物ライブラリーのスクリーニングにより同定された10).さらに,恒常活性型のRasを過剰に発現させた細胞株においては脂質の合成が活性化しているだけでなく,それがこの細胞株における腫瘍形成能にも重要であることが実験的に示されている11).この研究において発見されたFIN56も,フェロトーシスを誘導するほかの低分子化合物と同様に,Rasに対し選択的な致死性をもつことが確認されているが,脂質合成経路のなかでも,とくにRasによる腫瘍形成能に直接的に関係のある部分を標的にしているため,がんに選択的な致死性をもつ可能性が考えられる.いずれにしても,グルタチオンペルオキシダーゼ4の分解の機構を含め,FIN56の作用機序の全容の解明が待たれるところである.
また,この研究のように,細胞死をひき起こす低分子化合物の体系的な解析を進めることにより,制御された細胞死のさらなる表現型が発見されると考えられる.近年,抗がん剤の研究においては個別化医療(precision medicine)の実現が急速に進められているが,個々のがん細胞に効果的な抗がん剤をみつけだすためには,がんの原因となるドライバー変異の解析だけではなく,異なる制御された細胞死を誘導する抗がん剤の開発が重要になると考えられる.おのおのの細胞死の表現型は,多少の重複は認められるとしても,異なる機構により制御されるためである.ゲノムの不安定ながんは1種類の抗がん剤に対しては容易に耐性を獲得することが知られている.その点,異なる機構により制御される細胞死を誘導する抗がん剤を併用することにより,そのすべてに対し耐性を獲得するまえにがん細胞を死滅させる可能性が飛躍的にあがると考えられる.
略歴:2015年 米国Columbia大学大学院博士課程 修了,同年より米国Harvard Medical Schoolポストドクトラルフェロー.
研究テーマ:薬物による肝臓の障害における細胞間コミュニケーションのはたす役割.
抱負:システム生物学を用いて複雑な生命現象を解明したい.
© 2016 嶋田 健一 Licensed under CC 表示 2.1 日本
(米国Columbia大学Department of Biological Sciences)
email:嶋田健一
DOI: 10.7875/first.author.2016.055
Global survey of cell death mechanisms reveals metabolic regulation of ferroptosis.
Kenichi Shimada, Rachid Skouta, Anna Kaplan, Wan Seok Yang, Miki Hayano, Scott J. Dixon, Lewis M. Brown, Carlos A. Valenzuela, Adam J. Wolpaw, Brent R. Stockwell
Nature Chemical Biology, 12, 497-503 (2016)
この論文に出現する遺伝子・タンパク質のUniprot ID
要 約
近年,アポトーシスだけではなくネクローシスのなかにも制御された細胞死,すなわち,特定のシグナル伝達経路に依存してひき起こされる細胞死のあることがわかってきた.これまでに,細胞死にはさまざまな表現型が報告されているが,個々の機構の類似点あるいは相違点,その多様性を比較した研究は少ない.筆者らは,制御されたネクローシスをひき起こす新規の低分子化合物を探索し,モジュレータープロファイリング法という手法を用いて,10個の新規の低分子化合物は3つの異なる表現型を示す細胞死をひき起こすことを発見した.さらに,そのうちのひとつに着目し,構造活性相関からフェロトーシスという細胞死を強力にひき起こす低分子化合物としてFIN56を見い出した.FIN56の作用機序として,脂質の合成においてコレステロールの合成および脂肪酸の合成をともに撹乱し,さらに,過酸化脂質の蓄積を抑制するグルタチオンペルオキシダーゼ4を分解することによりフェロトーシスがひき起こすことが示唆された.
はじめに
細胞死は形態学的にアポトーシスとネクローシスに大別される.細胞の内部に存在するタンパク質やDNAの多くは通常は細胞の外には存在しない.ところが,ネクローシスにより細胞膜が破壊されてこれらが細胞の外に漏出すると炎症がひき起こされる.アポトーシスを起こした細胞は細胞質を漏出することなく断片化され近傍の細胞や食細胞により捕食されるため炎症をひき起こすことはない.このため,発生の過程のプログラムされた細胞死においては,周囲への影響の少ないアポトーシスが主流であり,ネクローシスは環境の劇的な変化に対応できないときにひき起こされる偶発的かつ不可逆的な死であると認識されてきた.しかし最近になり,ネクローシスにも特定のシグナル伝達経路の活性化によりひき起こされる“制御された細胞死”のあることがわかってきた.たとえば,生体において細胞が細菌やウイルスに感染して死ぬ際にはネクローシス様の細胞死をひき起こす.感染に対抗して免疫応答を誘導するためには細胞の内部の物質を漏出させて炎症をひき起こすネクローシスのほうが合理的だという生物学的な意義が考えられる.近年,さまざまな細胞種あるいは状況のもとひき起こされる制御された細胞死が報告されており1),筆者らの研究室も,2012年に,制御されたネクローシスのひとつとしてフェロトーシスについて報告している2,3).フェロトーシスはまだ研究の歴史は浅いが,脳室周囲白質軟化症,ハンチントン病,急性尿細管壊死など複数の疾患において重要な役割をはたすことも報告されており,病理学的な意義は大きい4,5).
このように,昨今,多様な細胞死の表現型が報告されているのをうけ,細胞死の研究を先導する研究者により組織された委員会Nomenclature Committee of Cell Deathにより細胞死の概念を体系的にとらえ直そうという努力が続けられている6).しかし実際には,これらの努力は個々の表現型の列挙にとどまるのが現状である.その原因の一端として,細胞死の研究のほとんどは特定の実験条件においてひき起こされた表現型を詳細に解析することに終始しており,どのような条件においてどのような細胞死がひき起こされるかという普遍性にまでふみ込んだ研究の少ないことがあげられる.細胞死の制御を体系的に理解するためには,同一の実験系において異なる表現型を比較する必要がある.そこで,筆者らは,低分子化合物によりひき起こされる細胞死を体系的に解析するという目的のもと,機能が未知の低分子化合物からなるライブラリーにおいて制御されたネクローシスをひき起こす新規の化合物を探索し,その細胞死の機構の解明をめざした.
1.細胞死の体系的な解析を実現するモジュレータープロファイリング法
さまざまな低分子化合物によりひき起こされた細胞死の表現型を同じ実験系において比較する手法として,以前に報告した,モジュレータープロファイリング法を用いた7)(図1).モジュレータープロファイリング法においては,細胞死をひき起こすような低分子化合物と,酵素活性阻害剤,イオンキレート剤,抗酸化剤など特定の細胞死を促進あるいは抑制することの知られているモジュレーターとよばれる物質を用い,個々のモジュレーターの存在のもと,細胞死をひき起こすような低分子化合物の細胞に対する効力がどのように変化するかを調べる.低分子化合物が特定のシグナル伝達経路に依存する細胞死をひき起こした場合,そのシグナル伝達経路の活性の状態により細胞の感受性は大きく変わるはずである.逆に,異なるモジュレーターの存在のもとで低分子化合物に対する細胞の感受性がいちじるしく異なる場合,その細胞死は制御された細胞死である可能性が高い.これに対し,不特定のタンパク質に共有結合する低分子化合物や界面活性剤としてはたらく低分子化合物は,処理の違いあるいは細胞種の違いに対しても細胞の感受性は変化しないと予想される.たとえば,機能が既知の低分子化合物は一部のモジュレーターにより効力が抑制されるため,機能が未知の低分子化合物と比べ,プロファイルの分散の大きいことが示されている7).これは,作用機序の知られている細胞死をひき起こすような低分子化合物は,世の中に存在する細胞死をひき起こすような低分子化合物のなかでも,特定のシグナル伝達経路により選択的に影響をおよぼすからだと考えられる.この性質を利用して,プロファイルの分散の大きい低分子化合物だけを選別することにより,制御された細胞死をひき起こす低分子化合物をスクリーニングすることができる.さらに,プロファイルをよりくわしく調べることにより,個々の細胞死の機構の特徴をとらえることもできる.たとえば,クラスタリング分析により制御された細胞死を表現型ごとにグループ化することができる.機能が未知の低分子化合物と機能が既知の低分子化合物とが同じクラスターにあれば,その表現型を予測することができる.また,どのモジュレーターが細胞死を抑制するかを確認することにより,どのシグナル伝達経路が細胞死に直接的に関連しているのかを判断することができる.
2.制御されたネクローシスを誘導する低分子化合物の探索
3169個の機能が未知の低分子化合物のライブラリーから,HT-1080線維肉腫細胞株あるいはBJeLR人工細胞株8) に対し制御されたネクローシスをひき起こす低分子化合物を探索した.まず,ライブラリーからアポトーシスの特徴であるカスパーゼ3を活性化しない451個の低分子化合物を選別した.このうち,構造的に多様な56個の低分子化合物に対しモジュレータープロファイリング法を適用しプロファイルの分散を調べたところ,多くの低分子化合物のプロファイルの分散は小さかったが,機能が既知の低分子化合物と同等あるいはそれ以上に大きな分散を示す10個の低分子化合物がみつかり,それらは制御されたネクローシスをひき起こすことが強く示唆された.また,階層的なクラスタリング分析により,これらの低分子化合物は機能が既知の低分子化合物とは異なる3つの独自のクラスターに分けられた.さらに,個々のクラスターにおいて細胞死を効果的に抑制するモジュレーターを調べることにより,3つのクラスターはそれぞれ,遷移金属イオンのキレート剤,制御されたネクローシスの一種であるネクロプトーシスを誘導する物質,フェロトーシスを誘導する物質,であることがわかった.
3.フェロトーシスの新たな誘導の機構
以前に,筆者らは,フェロトーシスはグルタチオンペルオキシダーゼ4が阻害されることによりひき起こされることを報告した3).グルタチオンペルオキシダーゼ4は抗酸化物質であるグルタチオンを用いて細胞毒性の高い過酸化脂質を還元しこれを無毒化することにより細胞を守る.これまでに,フェロトーシスを誘導する複数の低分子化合物がみつかっているが,これらは,グルタチオンの合成を阻害する間接的な阻害,あるいは,グルタチオンペルオキシダーゼ4に直接的に結合してその酵素活性を阻害する直接的な阻害のどちらかによりグルタチオンペルオキシダーゼ4の活性を抑制し,基質である過酸化脂質を細胞に蓄積させてフェロトーシスをひき起こすことがわかっている.過酸化脂質の蓄積はほかの細胞死においても確認されるが,とくにフェロトーシスにおいては,αトコフェロールなど脂溶性抗酸化剤の添加により細胞死が完全に抑制されることから,過酸化脂質の存在が細胞死を決定づけている.これは,ほかの細胞死の表現型とは明確に異なる点である.
モジュレータープロファイリング法によりみつかった低分子化合物のひとつに着目し,複数の類縁体を作製した.そのなかから,構造活性相関によりフェロトーシスをより強力に誘導する低分子化合物としてFIN56を見い出した.FIN56を処理した細胞においては10時間のちにグルタチオンペルオキシダーゼ4の活性が失われたが,さきに述べた2通りの機構のどちらとも異なり,グルタチオンペルオキシダーゼ4がタンパク質分解されていた.
4.FIN56と脂質合成経路
ケモプロテオミクスによりFIN56と結合するタンパク質を探索した.FIN56をビーズに固定し,HT-1080細胞の抽出液を用いてアフィニティークロマトグラフィーを行い,FIN56と結合したタンパク質を質量分析法により同定した.その結果,FIN56により高い親和性を示す70個のタンパク質が同定された.さらに,これらをコードする遺伝子を標的にしたshRNAライブラリーを作製し,FIN56に対し感受性を示す細胞株に投与してFIN56の効力を上昇あるいは低下させるshRNAを同定した.これらの実験により,メバロン酸経路に存在するスクアレン合成酵素は,FIN56と結合するだけでなく,ノックダウンするとFIN56の効力を低下させることがわかった.
FIN56と結合するスクアレン合成酵素をノックダウンするとFIN56の効力が抑制されることから,スクアレン合成酵素はFIN56により活性化されると考えられた.スクアレン合成酵素は2分子のファルネシル二リン酸を縮合させ1分子のスクアレンを合成する.ファルネシル二リン酸はスクアレンだけでなくドリコールや補酵素Q10などの合成や,タンパク質の修飾に用いられるのに対し,スクアレンはおもにコレステロールの合成に用いられる9).そのため,スクアレン合成酵素が活性化しコレステロールの合成が異常に促進されると,ファルネシル二リン酸を用いるほかの代謝経路は抑制されると考えられた.そこで,ファルネシル二リン酸を用いるどの代謝経路がフェロトーシスと関係があるのかをみるため,メバロン酸経路の代謝産物や阻害剤を添加してFIN56の効力の変化を調べた.その結果,脂溶性抗酸化剤でもある補酵素Q10の類縁体であるイデベノンの添加によりFIN56の効力は完全に抑制された.これらの結果から,FIN56との結合によりスクアレン合成酵素が活性化されファルネシル二リン酸が不足することにより,補酵素Q10の合成が抑制されフェロトーシスに対する感受性が高まると考えられた.
ところで,スクアレン合成酵素の阻害剤をくわえるとフェロトーシスは抑制されるが,グルタチオンペルオキシダーゼ4の分解は抑制されない.このことから,FIN56によるグルタチオンペルオキシダーゼ4の分解の機構はメバロン酸経路とは別にあることが示唆された.グルタチオンペルオキシダーゼ4の分解の機構はいまだ不明であるが,脂肪酸の合成にかかわるアセチルCoA-カルボキシラーゼを化学的に阻害するとグルタチオンペルオキシダーゼ4の分解も抑制されたことから,脂肪酸の合成経路がグルタチオンペルオキシダーゼ4の発現の制御にかかわることが考えられた.
以上より,FIN56が細胞における脂質の合成の2本柱ともいえるコレステロール合成経路と脂肪酸合成経路の両方を撹乱することによりフェロトーシスがひき起こされることが示された(図2).
おわりに
もともと,一連のフェロトーシスを誘導する低分子化合物はRasに対し選択的に致死性をもつ物質として化合物ライブラリーのスクリーニングにより同定された10).さらに,恒常活性型のRasを過剰に発現させた細胞株においては脂質の合成が活性化しているだけでなく,それがこの細胞株における腫瘍形成能にも重要であることが実験的に示されている11).この研究において発見されたFIN56も,フェロトーシスを誘導するほかの低分子化合物と同様に,Rasに対し選択的な致死性をもつことが確認されているが,脂質合成経路のなかでも,とくにRasによる腫瘍形成能に直接的に関係のある部分を標的にしているため,がんに選択的な致死性をもつ可能性が考えられる.いずれにしても,グルタチオンペルオキシダーゼ4の分解の機構を含め,FIN56の作用機序の全容の解明が待たれるところである.
また,この研究のように,細胞死をひき起こす低分子化合物の体系的な解析を進めることにより,制御された細胞死のさらなる表現型が発見されると考えられる.近年,抗がん剤の研究においては個別化医療(precision medicine)の実現が急速に進められているが,個々のがん細胞に効果的な抗がん剤をみつけだすためには,がんの原因となるドライバー変異の解析だけではなく,異なる制御された細胞死を誘導する抗がん剤の開発が重要になると考えられる.おのおのの細胞死の表現型は,多少の重複は認められるとしても,異なる機構により制御されるためである.ゲノムの不安定ながんは1種類の抗がん剤に対しては容易に耐性を獲得することが知られている.その点,異なる機構により制御される細胞死を誘導する抗がん剤を併用することにより,そのすべてに対し耐性を獲得するまえにがん細胞を死滅させる可能性が飛躍的にあがると考えられる.
文 献
- Vanden Berghe, T., Linkermann, A., Jouan-Lanhouet, S. et al.: Regulated necrosis: the expanding network of non-apoptotic cell death pathways. Nat. Rev. Mol. Cell Biol., 15, 135-147 (2014)[PubMed]
- Dixon, S. J., Lemberg, K. M., Lamprecht, M. R. et al.: Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell, 149, 1060-1072 (2012)[PubMed]
- Yang, W. S., SriRamaratnam, R., Welsch, M. E. et al.: Regulation of ferroptotic cancer cell death by GPX4. Cell, 156, 317-331 (2014)[PubMed]
- Dixon, S. J., Patel, D. N., Welsch, M. et al.: Pharmacological inhibition of cystine-glutamate exchange induces endoplasmic reticulum stress and ferroptosis. Elife, 3, e02523 (2014)[PubMed]
- Linkermann, A., Skouta, R., Himmerkus, N. et al.: Synchronized renal tubular cell death involves ferroptosis. Proc. Natl. Acad. Sci. USA, 111, 16836-16841 (2014)[PubMed]
- Galluzzi, L., Bravo-San Pedro, J. M., Vitale, I. et al.: Essential versus accessory aspects of cell death: recommendations of the NCCD 2015. Cell Death Differ., 22, 58-73 (2015)[PubMed]
- Wolpaw, A. J., Shimada, K., Skouta, R. et al.: Modulatory profiling identifies mechanisms of small molecule-induced cell death. Proc. Natl. Acad. Sci. USA, 108, E771-E780 (2011)[PubMed]
- Hahn, W. C., Counter, C. M., Lundberg, A. S. et al.: Creation of human tumour cells with defined genetic elements. Nature, 400, 464-468 (1999)[PubMed]
- Tansey, T. R. & Shechter, I.: Structure and regulation of mammalian squalene synthase. Biochim. Biophys. Acta, 1529, 49-62 (2000)[PubMed]
- Yagoda, N., von Rechenberg, M., Zaganjor, E. et al.: RAS-RAF-MEK-dependent oxidative cell death involving voltage-dependent anion channels. Nature, 447, 865-869 (2007)[PubMed]
- Hirsch, H. A., Iliopoulos, D., Joshi, A. et al.: A transcriptional signature and common gene networks link cancer with lipid metabolism and diverse human diseases. Cancer Cell, 17, 348-361 (2010)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2015年 米国Columbia大学大学院博士課程 修了,同年より米国Harvard Medical Schoolポストドクトラルフェロー.
研究テーマ:薬物による肝臓の障害における細胞間コミュニケーションのはたす役割.
抱負:システム生物学を用いて複雑な生命現象を解明したい.
© 2016 嶋田 健一 Licensed under CC 表示 2.1 日本