ヒトのミトコンドリアにおいて変則的な遺伝暗号の解読をつかさどる5-ホルミルシチジン修飾はNSUN3によるメチル化からはじまる
鈴木健夫・中野沙緒里・川原田礼以良・鈴木 勉
(東京大学大学院工学系研究科 化学生命工学専攻)
email:鈴木健夫,鈴木 勉
DOI: 10.7875/first.author.2016.053
NSUN3 methylase initiates 5-formylcytidine biogenesis in human mitochondrial tRNAMet.
Saori Nakano, Takeo Suzuki, Layla Kawarada, Hiroyoshi Iwata, Kana Asano, Tsutomu Suzuki
Nature Chemical Biology, 12, 546-551 (2016)
ヒトのミトコンドリアにおいては,通常ならばIleをコードするAUAがMetを指定しているが,tRNAMetがAUAを解読するためには,tRNAMetのウォブル位のシチジンが5-ホルミルシチジンに修飾されることが必要である.これまでに,5-ホルミルシチジン修飾がAUAの認識に必要であることはわかっていたが,5-ホルミルシチジンの生合成の機構や,細胞あるいは個体のレベルにおける生理機能については未解明であった.今回,筆者らは,RNAシトシンメチル化酵素ファミリーのメンバーであるNSUN3が,5-ホルミルシチジンの生合成の最初のステップであるメチル化を触媒することを見い出した.NSUN3をノックアウトした細胞においてはミトコンドリアtRNAMetにおいて5-ホルミルシチジン修飾が形成されず,ミトコンドリアタンパク質の合成能およびミトコンドリアの活性が顕著に低下した.in vitroメチル化反応により,NSUN3はS-アデノシルメチオニンに依存してミトコンドリアtRNAMetのウォブル位に5-メチルシチジンを導入する活性のあることが証明された.さらに,ヒトのミトコンドリアtRNAMetに存在する疾患に関連する点変異はNSUN3によるメチル化反応を阻害した.これらの結果から,ヒトのミトコンドリアtRNAMetにおける点変異およびNSUN3の機能の異常は,5-ホルミルシチジン修飾の低下をもたらし疾患の要因となりうることが示唆された.
RNAは転写ののちに多様な修飾をうけて成熟することにより本来の機能を発揮する.これまで,RNAにおいて140種以上の修飾がさまざまな生物種から発見されている1).歴史的には,RNAの修飾はtRNA,rRNA,snRNAなどを中心に研究されてきたが,最近は,mRNAや非コードRNAなど存在量の少ないRNAについても解析されるようになり,エピトランスクリプトームとよばれる転写後制御の主要な分子機構として,この研究分野は拡大しつづけている2).tRNAは高度に修飾されていることが知られ,これまでにみつかっているRNAの修飾の約8割はtRNAからみつかったものである.tRNAのアンチコドン1字目(ウォブル位)には多様な修飾が存在し,リボソームにおいてコドン3字目とウォブル対合を形成することにより遺伝暗号の正確で効率的な解読を可能にしている3).
ミトコンドリアは呼吸によりATPを産生するオルガネラである.ミトコンドリアには核とは独立した独自のゲノムが存在する.ヒトのミトコンドリアDNAには呼吸鎖酵素複合体のサブユニットである13種類のタンパク質と,それらを合成するための2種類のrRNAおよび22種類のtRNAがコードされている4,5).
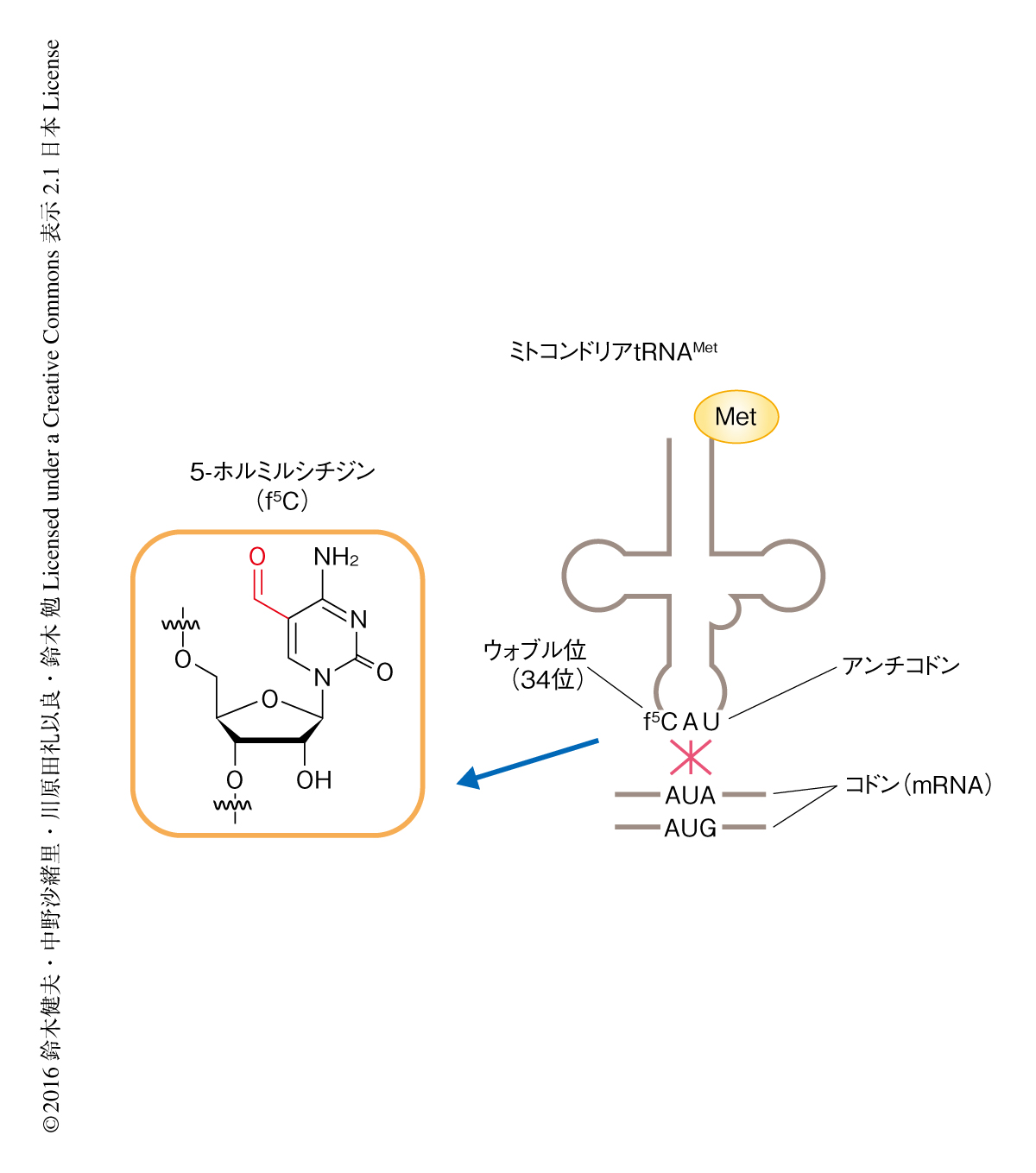
ヒトのミトコンドリアにおいては,通常の遺伝暗号表とは異なる4つの変則的な暗号が用いられ,通常はIleのコドンであるAUAはMet,終止コドンであるUGAはTrp,ArgのコドンであるAGAおよびAGGは終止コドンに,それぞれ変化している5).通常,細菌のtRNAMetは翻訳開始用と伸長用の2種類が使い分けられているが,ヒトのミトコンドリアDNAにはtRNAMetがひとつだけコードされている.このtRNAMetは翻訳の開始と伸長の両方の過程に使われており,AUGのみならずAUAもMetに解読される(図1).ヒトのミトコンドリアtRNAMetのウォブル位には5-ホルミルシチジン修飾が存在する6).in vitroタンパク質合成系により,5-ホルミルシチジン修飾はAUAの解読に必要であることが証明されている7).さらに,リボソーム30Sサブユニットの結晶構造解析の結果,A部位においてウォブル位の5-ホルミルシチジンはコドン3字目のアデニンとワトソン-クリック型のジオメトリーで対合していたことから,5位のホルミル修飾がシチジンの互変異性をイミノ型へとかたよらせることにより5-ホルミルシチジンとアデニンとの対合が可能になるという仮説が提唱されている8).以上のように,5-ホルミルシチジンはAUAを解読するために重要な修飾であるが,5-ホルミルシチジンの生合成の機構や,細胞レベルあるいは個体レベルにおける生理機能については未解明であった9).
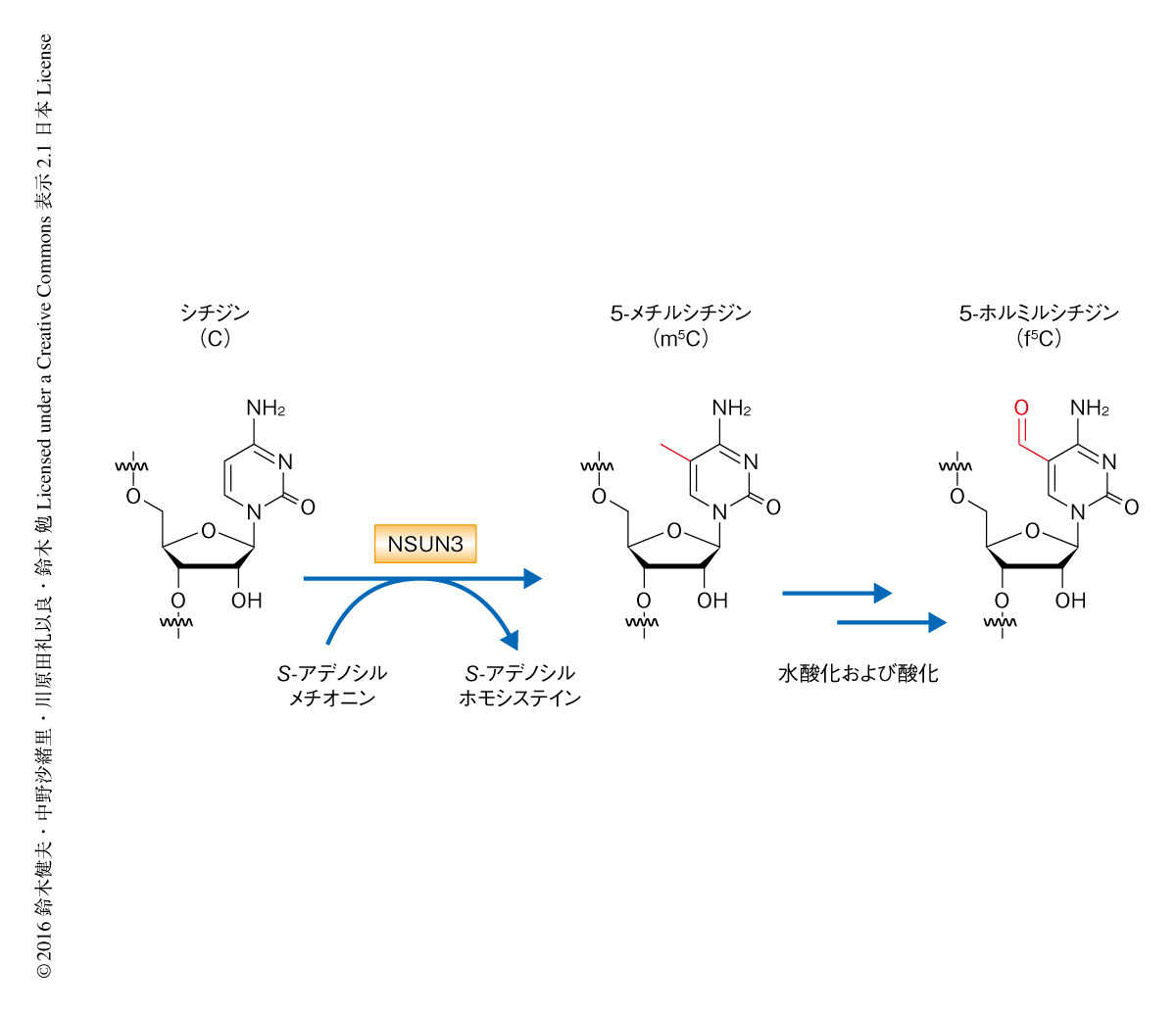
5-ホルミルシチジンの生合成の過程を探究するまえに,ホルミル基がどのような代謝経路により生合成されるかを明らかにした.生体における代謝反応においてホルミル基が形成される経路としては,セリンのβ炭素がテトラヒドロ葉酸に転移し10-ホルミルテトラヒドロ葉酸がホルミル基の供与体として使われる経路と10),DNAの修飾においてみられるように11),S-アデノシルメチオニンに依存的に生じたメチル基が水酸化および酸化をへてホルミル基へと変換される経路が知られている.そこで,5-ホルミルシチジンのホルミル基がどちらの経路により生合成されるかを調べるため,13Cにより標識したセリンあるいはメチオニンを添加した培地においてHeLa細胞を培養し,そこからミトコンドリアtRNAMetを単離して,RNaseにより消化したのち高感度な質量分析法により解析した.その結果,5-ホルミルシチジンのホルミル基の炭素原子の由来はメチオニンであると特定された.すなわち,5-ホルミルシチジン修飾は,S-アデノシルメチオニンに依存的に生じたメチル基が水酸化および酸化をへてホルミル基へと変換される,多段階の反応により形成されることが示唆された(図2).
5-ホルミルシチジン修飾の形成にはS-アデノシルメチオニンに依存したメチル化酵素のかかわることが示唆されたことから,RNAシトシンメチル化酵素ファミリーのメンバーであるNSUNに着目した.ヒトのゲノムには7つのNSUNがコードされているが,そのうち,機能が未知でありミトコンドリアに局在を示すNSUN3に着目した.HEK293T細胞を用いてCRISPR-Cas9系を利用したゲノム編集により2種類のNSUN3ノックアウト細胞を作製した.このNSUN3ノックアウト細胞から単離したミトコンドリアtRNAMetを質量分析法により解析したところ,ウォブル位の5-ホルミルシチジン修飾は完全に消失していた.さらに,NSUN3ノックアウト細胞にNSUN3を発現させたところ,5-ホルミルシチジン修飾が回復した.以上の結果から,NSUN3は5-ホルミルシチジン修飾の形成に必須であることが判明した.また,ノーザンブロット法により,NSUN3ノックアウト細胞においてミトコンドリアtRNAMetを測定したところ野生株と変わらなかったことから,5-ホルミルシチジン修飾の欠損はミトコンドリアtRNAMetの安定性には影響しないこともわかった.
ミトコンドリアの活性を評価するため,NSUN3ノックアウト細胞をグルコース培地あるいはガラクトース培地にて培養した.ガラクトースを炭素源とすると解糖系のみでエネルギーを得ることができないため,生育にはミトコンドリアにおける呼吸が必要である.野生株は両方の培地において同じ程度の増殖能を示したが,NSUN3ノックアウト細胞はガラクトース培地における増殖能が顕著に低下した.この結果から,NSUN3の欠損によりミトコンドリアの活性の低下が観察された.さらに,NSUN3ノックアウト細胞において酸素の消費量が顕著に低下していた.
ミトコンドリアにおけるタンパク質の合成能を評価するためパルスラベル実験を行った.NSUN3ノックアウト細胞および野生株をそれぞれエメチンで処理することにより,細胞質におけるタンパク質の合成を阻害した状態で培地に35Sにより標識したメチオニンをくわえると,ミトコンドリアにおいて合成されたタンパク質のみが35Sにより標識される.NSUN3ノックアウト細胞においてはミトコンドリアタンパク質の35Sによる標識の率が全般的に低く,ミトコンドリアにおけるタンパク質の合成能の顕著な低下が示された.さらに,呼吸鎖酵素複合体のいくつかのサブユニットについてウェスタンブロット法により解析したところ,ミトコンドリアDNAにコードされるND2(複合体I),ND5(複合体I),COI(複合体IV)が減少していた.また,複合体Iの核ゲノムにコードされるサブユニットも減少していたことから,NSUN3ノックアウト細胞においては複合体Iの形成能が低下していることも示唆された.
以上の結果から,NSUN3ノックアウト細胞における5-ホルミルシチジン修飾の欠損により,ミトコンドリアタンパク質の合成能の低下,および,複合体Iおよび複合体IVの形成の異常がもたらされ,ミトコンドリアの活性が低下すると考えられた.
メチル基の供与体としてS-アデノシルメチオニンを用い,in vitroにおいて転写させたミトコンドリアtRNAMetを基質として,大腸菌において発現させ精製した組換えNSUN3によるin vitroメチル化反応を行ったところ,ウォブル位においてS-アデノシルメチオニンに依存的な5-メチルシチジンの形成が認められた.また,ウォブル位に点変異をもつミトコンドリアtRNAMetにおいてはメチル化が生じなかったことから,NSUN3はウォブル位のシチジンに特異的なメチル化酵素であることも確かめられた.
ミトコンドリアtRNAMetにおける点変異との関連が報告されている遺伝性疾患は,5-ホルミルシチジン修飾の形成の異常が要因である可能性が考えられた.MITOMAP(URL:http://www.mitomap.org/MITOMAP)に収録されている8つの疾患に関連する点変異をそれぞれ導入したミトコンドリアtRNAMetをin vitroにおける転写により作製し,組換えNSUN3によるin vitroメチル化反応を行ったところ,A4435G変異およびC4437U変異においてメチル化の効率が有意に低下した.A4435G変異は母系遺伝性高血圧症やLeber遺伝性視神経症と関連があり,C4437U変異は高乳酸血症をともなう難聴などの原因となることが知られている.これらの変異をもつ患者においては,5-ホルミルシチジン修飾の低下によりミトコンドリアに機能の異常がひき起こされている可能性が示唆された.
この研究により,ヒトのミトコンドリアtRNAMetにおける5-ホルミルシチジン修飾の形成の機構は,NSUN3によるメチル化にはじまる多段階の反応であることが明らかにされた(図2).5-メチルシチジン修飾につづく水酸化および酸化を触媒する酵素の同定が,今後の研究の鍵になるであろう.
ヒトのミトコンドリアDNAにコードされる13種のmRNAにおいて,AUAはAUGの約4倍の頻度で用いられている.NSUN3ノックアウト細胞においてミトコンドリアタンパク質の合成能が全体的に低下したことから,翻訳伸長の過程における5-ホルミルシチジン修飾の重要性が示された.さらに,開始コドンにAUAを用いるmRNAが3つ,AUUを用いるmRNAが1つあり4),これらのmRNAの翻訳開始に5-ホルミルシチジン修飾の有無がどのように寄与するかも興味深い課題である.
いまのところ,NSUN3はミトコンドリアtRNAMetのウォブル位のみを標的としていることが示唆されているが,同じNSUNファミリーに属するNSUN2はさまざまなtRNAやmRNAを基質として5-メチルシチジン修飾を形成することが知られている.このような基質特異性の違いはどのような原理により説明されるのか,生化学的かつ構造生物学的なアプローチにより解明していきたい.
以前に,筆者らの研究グループは,ミトコンドリア脳筋症の代表的な病型において,ミトコンドリアtRNAのタウリン修飾が欠損することを見い出した5).この知見は,RNAの修飾の欠損が疾患の原因となることを示した最初の例であったが,この研究においても,ヒトのミトコンドリアtRNAMetにおける点変異が5-ホルミルシチジン修飾の欠損をもたらす可能性が示された.RNAの修飾の欠損を原因として生じるRNA修飾病は,想像しているよりも一般に広く存在するのかもしれない.現在,疾患と関連したエキソーム解析が世界的に行われており,今後,NSUN3遺伝子をはじめ,ほかのtRNA修飾遺伝子にも変異がみつかるであろう.
略歴:2003年 東京大学大学院工学系研究科博士課程 修了,2007年 バイオ産業情報化コンソーシアム 特別研究員,2008年 東京大学大学院工学系研究科 助教を経て,2012年より同 講師.
研究テーマ:RNAの修飾の機能.
抱負:新しい発見を積み重ねていきたい.
中野 沙緒里(Saori Nakano)
東京大学大学院医学系研究科博士課程 在学中.
川原田 礼以良(Layla Kawarada)
東京大学大学院工学系研究科修士課程 在学中.
鈴木 勉(Tsutomu Suzuki)
東京大学大学院工学系研究科 教授.
研究室URL:http://rna.chem.t.u-tokyo.ac.jp/
© 2016 鈴木健夫・中野沙緒里・川原田礼以良・鈴木 勉 Licensed under CC 表示 2.1 日本
(東京大学大学院工学系研究科 化学生命工学専攻)
email:鈴木健夫,鈴木 勉
DOI: 10.7875/first.author.2016.053
NSUN3 methylase initiates 5-formylcytidine biogenesis in human mitochondrial tRNAMet.
Saori Nakano, Takeo Suzuki, Layla Kawarada, Hiroyoshi Iwata, Kana Asano, Tsutomu Suzuki
Nature Chemical Biology, 12, 546-551 (2016)
要 約
ヒトのミトコンドリアにおいては,通常ならばIleをコードするAUAがMetを指定しているが,tRNAMetがAUAを解読するためには,tRNAMetのウォブル位のシチジンが5-ホルミルシチジンに修飾されることが必要である.これまでに,5-ホルミルシチジン修飾がAUAの認識に必要であることはわかっていたが,5-ホルミルシチジンの生合成の機構や,細胞あるいは個体のレベルにおける生理機能については未解明であった.今回,筆者らは,RNAシトシンメチル化酵素ファミリーのメンバーであるNSUN3が,5-ホルミルシチジンの生合成の最初のステップであるメチル化を触媒することを見い出した.NSUN3をノックアウトした細胞においてはミトコンドリアtRNAMetにおいて5-ホルミルシチジン修飾が形成されず,ミトコンドリアタンパク質の合成能およびミトコンドリアの活性が顕著に低下した.in vitroメチル化反応により,NSUN3はS-アデノシルメチオニンに依存してミトコンドリアtRNAMetのウォブル位に5-メチルシチジンを導入する活性のあることが証明された.さらに,ヒトのミトコンドリアtRNAMetに存在する疾患に関連する点変異はNSUN3によるメチル化反応を阻害した.これらの結果から,ヒトのミトコンドリアtRNAMetにおける点変異およびNSUN3の機能の異常は,5-ホルミルシチジン修飾の低下をもたらし疾患の要因となりうることが示唆された.
はじめに
RNAは転写ののちに多様な修飾をうけて成熟することにより本来の機能を発揮する.これまで,RNAにおいて140種以上の修飾がさまざまな生物種から発見されている1).歴史的には,RNAの修飾はtRNA,rRNA,snRNAなどを中心に研究されてきたが,最近は,mRNAや非コードRNAなど存在量の少ないRNAについても解析されるようになり,エピトランスクリプトームとよばれる転写後制御の主要な分子機構として,この研究分野は拡大しつづけている2).tRNAは高度に修飾されていることが知られ,これまでにみつかっているRNAの修飾の約8割はtRNAからみつかったものである.tRNAのアンチコドン1字目(ウォブル位)には多様な修飾が存在し,リボソームにおいてコドン3字目とウォブル対合を形成することにより遺伝暗号の正確で効率的な解読を可能にしている3).
ミトコンドリアは呼吸によりATPを産生するオルガネラである.ミトコンドリアには核とは独立した独自のゲノムが存在する.ヒトのミトコンドリアDNAには呼吸鎖酵素複合体のサブユニットである13種類のタンパク質と,それらを合成するための2種類のrRNAおよび22種類のtRNAがコードされている4,5).
ヒトのミトコンドリアにおいては,通常の遺伝暗号表とは異なる4つの変則的な暗号が用いられ,通常はIleのコドンであるAUAはMet,終止コドンであるUGAはTrp,ArgのコドンであるAGAおよびAGGは終止コドンに,それぞれ変化している5).通常,細菌のtRNAMetは翻訳開始用と伸長用の2種類が使い分けられているが,ヒトのミトコンドリアDNAにはtRNAMetがひとつだけコードされている.このtRNAMetは翻訳の開始と伸長の両方の過程に使われており,AUGのみならずAUAもMetに解読される(図1).ヒトのミトコンドリアtRNAMetのウォブル位には5-ホルミルシチジン修飾が存在する6).in vitroタンパク質合成系により,5-ホルミルシチジン修飾はAUAの解読に必要であることが証明されている7).さらに,リボソーム30Sサブユニットの結晶構造解析の結果,A部位においてウォブル位の5-ホルミルシチジンはコドン3字目のアデニンとワトソン-クリック型のジオメトリーで対合していたことから,5位のホルミル修飾がシチジンの互変異性をイミノ型へとかたよらせることにより5-ホルミルシチジンとアデニンとの対合が可能になるという仮説が提唱されている8).以上のように,5-ホルミルシチジンはAUAを解読するために重要な修飾であるが,5-ホルミルシチジンの生合成の機構や,細胞レベルあるいは個体レベルにおける生理機能については未解明であった9).
1.ホルミル基の炭素源の特定
5-ホルミルシチジンの生合成の過程を探究するまえに,ホルミル基がどのような代謝経路により生合成されるかを明らかにした.生体における代謝反応においてホルミル基が形成される経路としては,セリンのβ炭素がテトラヒドロ葉酸に転移し10-ホルミルテトラヒドロ葉酸がホルミル基の供与体として使われる経路と10),DNAの修飾においてみられるように11),S-アデノシルメチオニンに依存的に生じたメチル基が水酸化および酸化をへてホルミル基へと変換される経路が知られている.そこで,5-ホルミルシチジンのホルミル基がどちらの経路により生合成されるかを調べるため,13Cにより標識したセリンあるいはメチオニンを添加した培地においてHeLa細胞を培養し,そこからミトコンドリアtRNAMetを単離して,RNaseにより消化したのち高感度な質量分析法により解析した.その結果,5-ホルミルシチジンのホルミル基の炭素原子の由来はメチオニンであると特定された.すなわち,5-ホルミルシチジン修飾は,S-アデノシルメチオニンに依存的に生じたメチル基が水酸化および酸化をへてホルミル基へと変換される,多段階の反応により形成されることが示唆された(図2).
2.NSUN3は5-ホルミルシチジン修飾に必須である
5-ホルミルシチジン修飾の形成にはS-アデノシルメチオニンに依存したメチル化酵素のかかわることが示唆されたことから,RNAシトシンメチル化酵素ファミリーのメンバーであるNSUNに着目した.ヒトのゲノムには7つのNSUNがコードされているが,そのうち,機能が未知でありミトコンドリアに局在を示すNSUN3に着目した.HEK293T細胞を用いてCRISPR-Cas9系を利用したゲノム編集により2種類のNSUN3ノックアウト細胞を作製した.このNSUN3ノックアウト細胞から単離したミトコンドリアtRNAMetを質量分析法により解析したところ,ウォブル位の5-ホルミルシチジン修飾は完全に消失していた.さらに,NSUN3ノックアウト細胞にNSUN3を発現させたところ,5-ホルミルシチジン修飾が回復した.以上の結果から,NSUN3は5-ホルミルシチジン修飾の形成に必須であることが判明した.また,ノーザンブロット法により,NSUN3ノックアウト細胞においてミトコンドリアtRNAMetを測定したところ野生株と変わらなかったことから,5-ホルミルシチジン修飾の欠損はミトコンドリアtRNAMetの安定性には影響しないこともわかった.
3.5-ホルミルシチジン修飾の欠損はミトコンドリアの機能の低下をひき起こす
ミトコンドリアの活性を評価するため,NSUN3ノックアウト細胞をグルコース培地あるいはガラクトース培地にて培養した.ガラクトースを炭素源とすると解糖系のみでエネルギーを得ることができないため,生育にはミトコンドリアにおける呼吸が必要である.野生株は両方の培地において同じ程度の増殖能を示したが,NSUN3ノックアウト細胞はガラクトース培地における増殖能が顕著に低下した.この結果から,NSUN3の欠損によりミトコンドリアの活性の低下が観察された.さらに,NSUN3ノックアウト細胞において酸素の消費量が顕著に低下していた.
ミトコンドリアにおけるタンパク質の合成能を評価するためパルスラベル実験を行った.NSUN3ノックアウト細胞および野生株をそれぞれエメチンで処理することにより,細胞質におけるタンパク質の合成を阻害した状態で培地に35Sにより標識したメチオニンをくわえると,ミトコンドリアにおいて合成されたタンパク質のみが35Sにより標識される.NSUN3ノックアウト細胞においてはミトコンドリアタンパク質の35Sによる標識の率が全般的に低く,ミトコンドリアにおけるタンパク質の合成能の顕著な低下が示された.さらに,呼吸鎖酵素複合体のいくつかのサブユニットについてウェスタンブロット法により解析したところ,ミトコンドリアDNAにコードされるND2(複合体I),ND5(複合体I),COI(複合体IV)が減少していた.また,複合体Iの核ゲノムにコードされるサブユニットも減少していたことから,NSUN3ノックアウト細胞においては複合体Iの形成能が低下していることも示唆された.
以上の結果から,NSUN3ノックアウト細胞における5-ホルミルシチジン修飾の欠損により,ミトコンドリアタンパク質の合成能の低下,および,複合体Iおよび複合体IVの形成の異常がもたらされ,ミトコンドリアの活性が低下すると考えられた.
4.NSUN3によるin vitroメチル化反応および疾患と関連する点変異による影響
メチル基の供与体としてS-アデノシルメチオニンを用い,in vitroにおいて転写させたミトコンドリアtRNAMetを基質として,大腸菌において発現させ精製した組換えNSUN3によるin vitroメチル化反応を行ったところ,ウォブル位においてS-アデノシルメチオニンに依存的な5-メチルシチジンの形成が認められた.また,ウォブル位に点変異をもつミトコンドリアtRNAMetにおいてはメチル化が生じなかったことから,NSUN3はウォブル位のシチジンに特異的なメチル化酵素であることも確かめられた.
ミトコンドリアtRNAMetにおける点変異との関連が報告されている遺伝性疾患は,5-ホルミルシチジン修飾の形成の異常が要因である可能性が考えられた.MITOMAP(URL:http://www.mitomap.org/MITOMAP)に収録されている8つの疾患に関連する点変異をそれぞれ導入したミトコンドリアtRNAMetをin vitroにおける転写により作製し,組換えNSUN3によるin vitroメチル化反応を行ったところ,A4435G変異およびC4437U変異においてメチル化の効率が有意に低下した.A4435G変異は母系遺伝性高血圧症やLeber遺伝性視神経症と関連があり,C4437U変異は高乳酸血症をともなう難聴などの原因となることが知られている.これらの変異をもつ患者においては,5-ホルミルシチジン修飾の低下によりミトコンドリアに機能の異常がひき起こされている可能性が示唆された.
おわりに
この研究により,ヒトのミトコンドリアtRNAMetにおける5-ホルミルシチジン修飾の形成の機構は,NSUN3によるメチル化にはじまる多段階の反応であることが明らかにされた(図2).5-メチルシチジン修飾につづく水酸化および酸化を触媒する酵素の同定が,今後の研究の鍵になるであろう.
ヒトのミトコンドリアDNAにコードされる13種のmRNAにおいて,AUAはAUGの約4倍の頻度で用いられている.NSUN3ノックアウト細胞においてミトコンドリアタンパク質の合成能が全体的に低下したことから,翻訳伸長の過程における5-ホルミルシチジン修飾の重要性が示された.さらに,開始コドンにAUAを用いるmRNAが3つ,AUUを用いるmRNAが1つあり4),これらのmRNAの翻訳開始に5-ホルミルシチジン修飾の有無がどのように寄与するかも興味深い課題である.
いまのところ,NSUN3はミトコンドリアtRNAMetのウォブル位のみを標的としていることが示唆されているが,同じNSUNファミリーに属するNSUN2はさまざまなtRNAやmRNAを基質として5-メチルシチジン修飾を形成することが知られている.このような基質特異性の違いはどのような原理により説明されるのか,生化学的かつ構造生物学的なアプローチにより解明していきたい.
以前に,筆者らの研究グループは,ミトコンドリア脳筋症の代表的な病型において,ミトコンドリアtRNAのタウリン修飾が欠損することを見い出した5).この知見は,RNAの修飾の欠損が疾患の原因となることを示した最初の例であったが,この研究においても,ヒトのミトコンドリアtRNAMetにおける点変異が5-ホルミルシチジン修飾の欠損をもたらす可能性が示された.RNAの修飾の欠損を原因として生じるRNA修飾病は,想像しているよりも一般に広く存在するのかもしれない.現在,疾患と関連したエキソーム解析が世界的に行われており,今後,NSUN3遺伝子をはじめ,ほかのtRNA修飾遺伝子にも変異がみつかるであろう.
文 献
- Machnicka, M. A., Milanowska, K., Osman Oglou, O. et al.: MODOMICS: a database of RNA modification pathways: 2013 update. Nucleic Acids Res., 41, D262-D267 (2013)[PubMed]
- Frye, M., Jaffrey, S. R., Pan, T. et al.: RNA modifications: what have we learned and where are we headed? Nat. Rev. Genet., 17, 365-372 (2016)[PubMed]
- Suzuki, T.: Biosynthesis and function of tRNA wobble modifications. in Fine-Tuning of RNA Functions by Modification and Editing (Grosjean, H. ed.). pp. 23-69, Springer, Berlin (2005)
- Hallberg, B. M. & Larsson, N. G.: Making proteins in the powerhouse. Cell Metab., 20, 226-240 (2014)[PubMed]
- Suzuki, T., Nagao, A. & Suzuki, T.: Human mitochondrial tRNAs: biogenesis, function, structural aspects, and diseases. Annu. Rev. Genet., 45, 299-329 (2011)[PubMed]
- Moriya, J., Yokogawa, T., Wakita, K. et al.: A novel modified nucleoside found at the first position of the anticodon of methionine tRNA from bovine liver mitochondria. Biochemistry, 33, 2234-2239 (1994)[PubMed]
- Takemoto, C., Spremulli, L. L., Benkowski, L. A. et al.: Unconventional decoding of the AUA codon as methionine by mitochondrial tRNAMet with the anticodon f5CAU as revealed with a mitochondrial in vitro translation system. Nucleic Acids Res., 37, 1616-1627 (2009)[PubMed]
- Cantara, W. A., Murphy, F. V. 4th, Demirci, H. et al.: Expanded use of sense codons is regulated by modified cytidines in tRNA. Proc. Natl. Acad. Sci. USA, 110, 10964-10969 (2013)[PubMed]
- Suzuki, T. & Suzuki, T.: A complete landscape of post-transcriptional modifications in mammalian mitochondrial tRNAs. Nucleic Acids Res., 42, 7346-7357 (2014)[PubMed]
- Momb, J. & Appling, D. R.: Mitochondrial one-carbon metabolism and neural tube defects. Birth Defects Res. A Clin. Mol. Teratol., 100, 576-583 (2014)[PubMed]
- Ito, S., Shen, L., Dai, Q. et al.: Tet proteins can convert 5-methylcytosine to 5-formylcytosine and 5-carboxylcytosine. Science, 333, 1300-1303 (2011)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2003年 東京大学大学院工学系研究科博士課程 修了,2007年 バイオ産業情報化コンソーシアム 特別研究員,2008年 東京大学大学院工学系研究科 助教を経て,2012年より同 講師.
研究テーマ:RNAの修飾の機能.
抱負:新しい発見を積み重ねていきたい.
中野 沙緒里(Saori Nakano)
東京大学大学院医学系研究科博士課程 在学中.
川原田 礼以良(Layla Kawarada)
東京大学大学院工学系研究科修士課程 在学中.
鈴木 勉(Tsutomu Suzuki)
東京大学大学院工学系研究科 教授.
研究室URL:http://rna.chem.t.u-tokyo.ac.jp/
© 2016 鈴木健夫・中野沙緒里・川原田礼以良・鈴木 勉 Licensed under CC 表示 2.1 日本