プロテインキナーゼAはMIC60のリン酸化を介してPINK1の安定性およびParkinのミトコンドリアへのリクルートを制御する
赤羽しおり・岡 敏彦
(立教大学理学部 生命理学科)
email:赤羽しおり,岡 敏彦
DOI: 10.7875/first.author.2016.045
PKA regulates PINK1 stability and Parkin recruitment to damaged mitochondria through phosphorylation of MIC60.
Shiori Akabane, Midori Uno, Naoki Tani, Shunta Shimazaki, Natsumi Ebara, Hiroki Kato, Hidetaka Kosako, Toshihiko Oka
Molecular Cell, 62, 371-384 (2016)
セリン/スレオニンキナーゼであるPINK1およびユビキチンリガーゼであるParkinは遺伝性パーキンソン病の原因遺伝子産物として知られ,障害の蓄積したミトコンドリアの選択的な分解において重要な役割をはたす.PINK1およびParkinは膜電位の低下したミトコンドリアにリクルートされ,外膜タンパク質のユビキチン化を促進することにより障害の蓄積したミトコンドリアを分解へと導く.しかし,PINK1およびParkinが細胞における環境に応答してどのように制御されるかについては明らかにされていなかった.この研究において,PINK1およびParkinのミトコンドリアへのリクルートは細胞におけるcAMPの濃度の上昇およびプロテインキナーゼAの活性化により阻害されることが明らかにされた.さらに,ミトコンドリア内膜に局在するMIC60がプロテインキナーゼAによりリン酸化されることで,PINK1およびParkinによるミトコンドリアの分解は抑制されることが示された.この研究により,PINK1およびParkinを介したミトコンドリアの選択的な分解の機構において,細胞における環境に応じた新たな制御機構が明らかにされた.
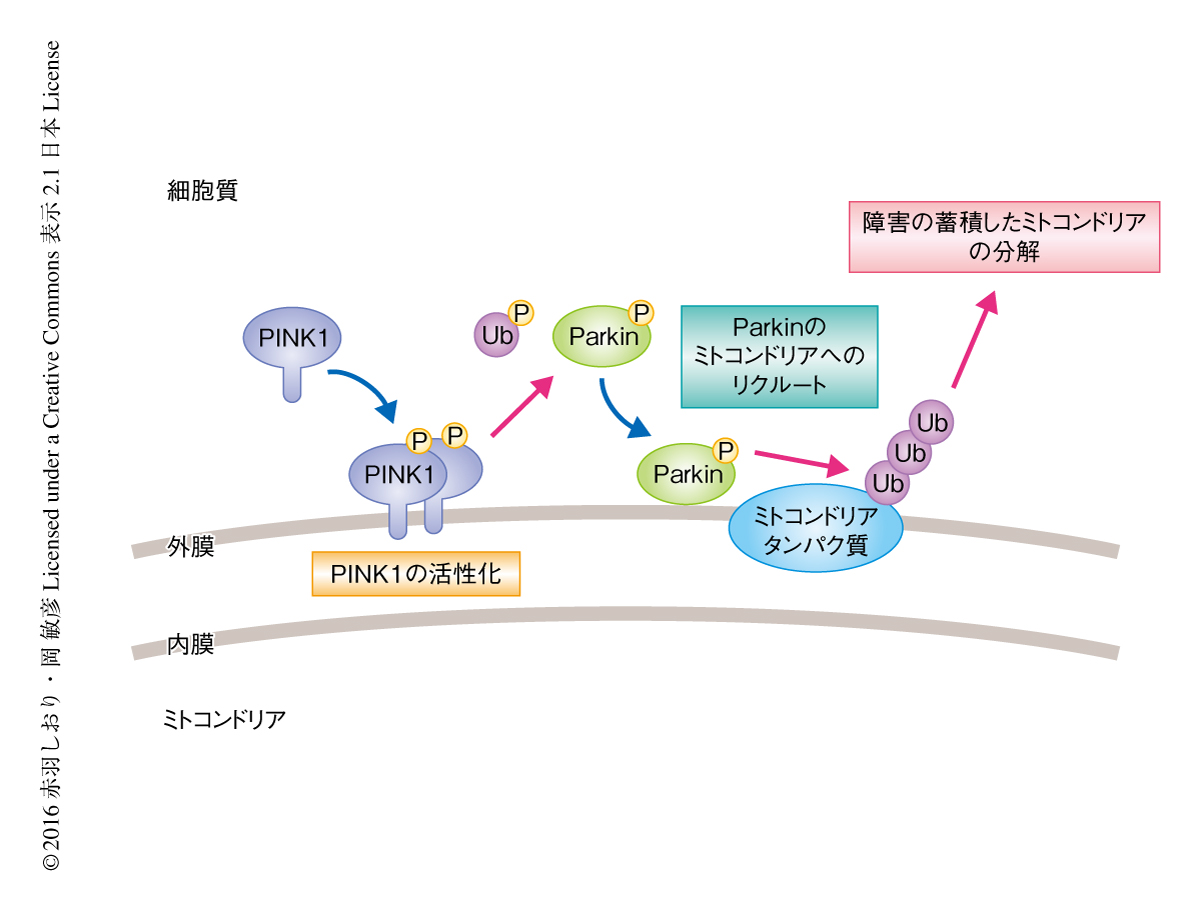
ミトコンドリアは生命活動のためのエネルギーとしてATPを供給するが,同時に,活性酸素種を産生するため,ミトコンドリアはつねに酸化ストレスにさらされている.一方で,障害の蓄積したミトコンドリアが選択的に分解されることによりミトコンドリアの品質は保たれている.遺伝性パーキンソン病の原因遺伝子産物であるPINK1およびParkinは,ミトコンドリアの品質管理機構において重要な役割をはたす1).セリン/スレオニンキナーゼであるPINK1は膜電位の低下したミトコンドリア外膜にリクルートされ,自己リン酸化にともない活性化する2).活性化されたPINK1のはたらきによりユビキチンリガーゼであるParkinがミトコンドリアにリクルートされ,活性化してミトコンドリア外膜に存在する基質タンパク質をユビキチン化する.これにより,障害の蓄積したミトコンドリアの選択的な分解が促進される3)(図1).これまで,PINK1およびParkinを介したミトコンドリアの品質管理機構においては,ミトコンドリアの膜電位の低下がおもなシグナルであると考えられてきた.一方で,正常なミトコンドリアでも一過的に膜電位の低下する場合がある.このように,一過的に膜電位の低下したミトコンドリアと障害の蓄積したミトコンドリアはどのように区別されているのかは明らかにされていなかった.
PINK1およびParkinを介したミトコンドリアの品質管理機構におけるcAMP-プロテインキナーゼAシグナル伝達系の関与について明らかにするため,アデニル酸シクラーゼを活性化する薬剤であるフォルスコリンを用いてParkinのミトコンドリアへのリクルートについて解析した.ミトコンドリアの膜電位を低下させる薬剤であるCCCPを処理すると,Parkinはミトコンドリアへとリクルートされたが,フォルスコリンの存在のもとにおいてはCCCPの処理によるParkinのリクルートは抑制された.また,プロテインキナーゼAの阻害剤であるH89を用いてParkinのミトコンドリアへのリクルートについて解析したところ,H89はParkinのリクルートを促進した.さらに,プロテインキナーゼAの触媒サブユニットを過剰に発現させたところ,フォルスコリンの効果と同様に,Parkinのミトコンドリアへのリクルートを阻害した.これらの結果から,プロテインキナーゼAの活性化はParkinのミトコンドリアへのリクルートを阻害することが示された.
膜電位の低下したミトコンドリアにおいて,PINK1は自己リン酸化をともないミトコンドリア外膜に安定に存在する1).そこで,フォルスコリンの処理がPINK1の安定性に及ぼす影響について解析した.CCCPの処理により膜電位の低下したミトコンドリアにおいてはPINK1の蓄積が検出されたが,このPINK1の蓄積はフォルスコリンの処理により減少した.また,パルスチェイス実験により,フォルスコリンの処理はCCCPの存在のもとにおいて蓄積したPINK1の分解を促進することが証明された.これらの結果から,プロテインキナーゼAの活性化は膜電位の低下したミトコンドリアにおけるPINK1の安定性を低下させることが明らかにされた.
PINK1およびParkinを介したミトコンドリアの品質管理機構に関与するプロテインキナーゼAの基質タンパク質を同定するため,プロテインキナーゼAによるリン酸化モチーフの保存されているミトコンドリアタンパク質を探索した.候補となるタンパク質のうち,ミトコンドリア内膜に局在するMIC60のノックダウンはParkinのミトコンドリアへのリクルートを阻害した.MIC60はミトコンドリア内膜に局在するMICOS複合体の主要なサブユニットとして知られ,ミトコンドリア膜の形態の維持に重要であり,外膜タンパク質との相互作用をつうじてミトコンドリア内膜とミトコンドリア外膜とをつなぎとめる役割をはたす4,5).
MIC60の細胞におけるリン酸化について調べるため,野生型のMIC60,あるいは,リン酸化部位と推定されるSer528をAlaに置換した非リン酸化変異体を過剰に発現させた.リン酸化タンパク質を特異的に分離するSDS-ポリアクリルアミドゲル電気泳動法,および,MIC60のリン酸化Ser528を特異的に認識する抗体を用いた解析において,野生型のMIC60の過剰な発現によりフォルスコリンの処理によるリン酸化のバンドが検出された.また,内在性のMIC60のリン酸化についてヒトの細胞株において解析したところ,フォルスコリンの処理に依存的なリン酸化が検出された.さらに,液体クロマトグラフィー-質量分析法により,MIC60のSer528のリン酸化について確定した.以上の結果から,MIC60のSer528はプロテインキナーゼAによりリン酸化されることが示された.
MIC60のノックダウンがParkinのミトコンドリアへのリクルートに及ぼす影響について解析した.CCCPの処理により膜電位の低下したミトコンドリアにおいて,MIC60のノックダウンはParkinのミトコンドリアへのリクルートの阻害およびPINK1の安定性の低下をひき起こした.MIC60はミトコンドリア外膜に局在するSAM複合体およびTOM複合体と相互作用することが知られている6).また,PINK1はミトコンドリア外膜においてTOM複合体を含む大きな複合体を形成する7).そこで,MIC60とPINK1との相互作用について調べるため,FLAGタグを付加したPINK1を発現させた細胞においてCCCPを計時的に処理したのち,架橋反応を起こした.CCCPのおのおのの処理時間における免疫沈降物について解析したところ,CCCPの処理から30分のちにMIC60およびSAM50はFLAGタグを付加したPINK1と共免疫沈降された.これらの結果から,PINK1はMIC60およびSAM50と一過的に相互作用することが示された.
MIC60のリン酸化がParkinのミトコンドリアへのリクルートに関与するかどうかを調べるため,MIC60のSer528をAlaに置換した非リン酸化変異体,および,AspあるいはGluに置換した擬似リン酸化変異体を用いて解析した.CCCPの処理によるParkinのミトコンドリアへのリクルートはMIC60のノックダウンにより阻害されたが,この阻害は野生型のMIC60あるいは非リン酸化変異体の発現により回復し,一方で,擬似リン酸化変異体の発現により回復しなかった.これらの結果から,MIC60のプロテインキナーゼAによるSer528のリン酸化はParkinのミトコンドリアへのリクルートを阻害することが示された.
MIC60はMICOS複合体の主要なサブユニットであり,ミトコンドリアのクリステ構造の維持に重要である4).そこで,MIC60のリン酸化がMICOS複合体の形成に及ぼす影響をクリアネイティブポリアクリルアミドゲル電気泳動法により解析したところ,MIC60のSer528のリン酸化はMICOS複合体の形成を減少させた.MIC60のリン酸化がミトコンドリア膜の構造に及ぼす影響を電子顕微鏡による解析により調べたところ,MIC60をノックダウンした細胞においてミトコンドリアのクリステ構造は消失していたが,非リン酸化変異体あるいは擬似リン酸化変異体を発現させた場合には,野生型のMIC60を発現させたときと同様に,ミトコンドリアのクリステ構造は維持されていた.
これらの結果から,MIC60のプロテインキナーゼAによるリン酸化は,ミトコンドリアの膜構造の維持とは関連せず,Parkinのミトコンドリアへのリクルートだけを抑制することが示された.
これまでに,哺乳類においてはMICOS複合体のサブユニットとしてMIC10,MIC19,MIC25,MIC26,MIC27,MIC60,QIL1の7つが知られている4,8).そこで,ParkinのミトコンドリアへのリクルートにおけるMICOS複合体のサブユニットの関与について調べたところ,MIC10,MIC25,MIC26,MIC27のノックダウンはParkinのミトコンドリアへのリクルートに影響を及ぼさなかったが,MIC19のノックダウンはParkinのリクルートを阻害した.
MIC19はプロテインキナーゼAによりリン酸化されることがすでに報告されていたことから9),MIC19のリン酸化について解析したところ,in vivoおよびin vitroにおいてMIC19のThr11におけるリン酸化が確認された.そこで,MIC19のリン酸化がParkinのミトコンドリアへのリクルートに及ぼす影響について解析した.ParkinのミトコンドリアへのリクルートはMIC19のノックダウンにより部分的に阻害されたが,この阻害は野生型のMIC19,あるいは,Thr11における非リン酸化変異体の発現により回復した.これに対し,Thr11における擬似リン酸化変異体の発現によりParkinのミトコンドリアへのリクルートは回復しなかった.
これらの結果から,MIC60と同様に,MIC19もプロテインキナーゼAによるリン酸化を介してParkinのミトコンドリアへのリクルートを制御することが明らかにされた.
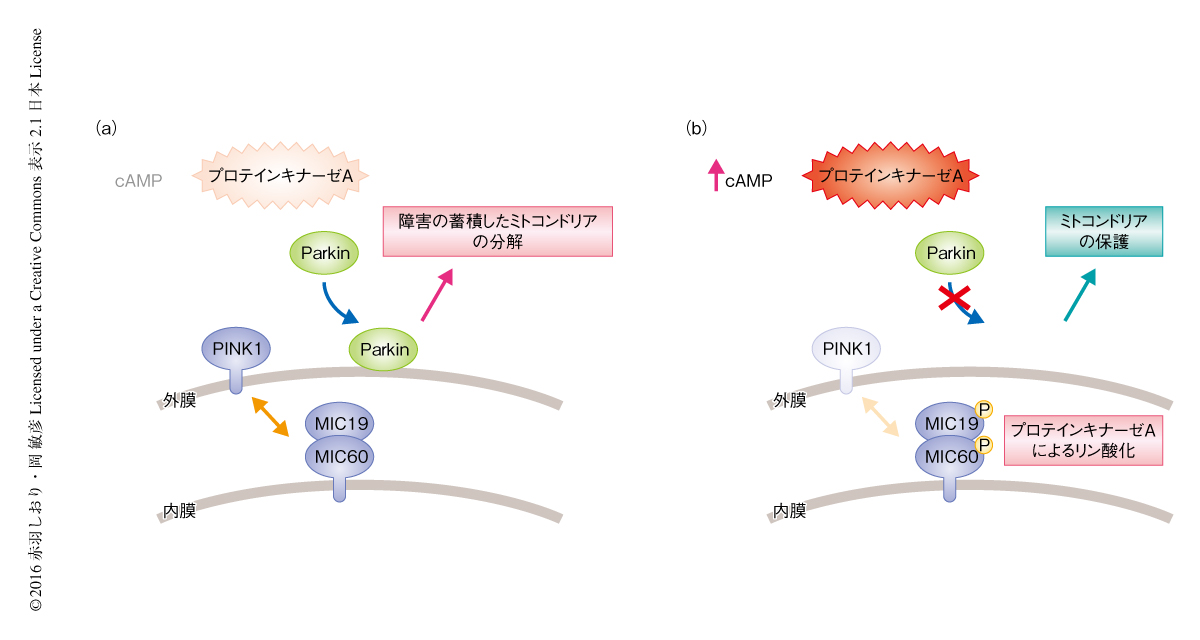
この研究により,細胞におけるcAMPの濃度の上昇およびそれにともなうプロテインキナーゼAの活性化は,PINK1およびParkinの膜電位の低下したミトコンドリアへのリクルートを阻害することが示された.さらに,MICOS複合体のサブユニットであるMIC60がプロテインキナーゼAによりリン酸化されることで,Parkinのミトコンドリアへのリクルートが抑制されることが明らかにされた.これらの結果から,PINK1およびParkinによるミトコンドリアの品質管理機構はcAMP-プロテインキナーゼAシグナル伝達系を介して負に制御されていることが証明された.
ニューロンや筋肉細胞においては,ミトコンドリアによるATPの産生が一過的に上昇し,それにともない障害に関係なくミトコンドリアの膜電位が低下する場合がある.これまで,一過的に膜電位の低下したミトコンドリアと障害の蓄積したミトコンドリアとがどのように区別されているかは明らかでなかったが,今回の研究の結果から,細胞におけるcAMPの濃度の制御により,一過的に膜電位の低下したミトコンドリアの保護,および,障害の蓄積したミトコンドリアの選択的な分解が可能であることが示された(図2).
略歴:2014年 東京大学大学院新領域創成科学研究科 修了,同年より立教大学理学部 研究員.
研究テーマ:cAMP-プロテインキナーゼAシグナル伝達系を介したミトコンドリアの品質管理機構の制御.
抱負:ポジティブな気持ちで前に進みつづけたい.
岡 敏彦(Toshihiko Oka)
立教大学理学部 教授.
研究室URL:http://www2.rikkyo.ac.jp/web/oka_lab/index.html
© 2016 赤羽しおり・岡 敏彦 Licensed under CC 表示 2.1 日本
(立教大学理学部 生命理学科)
email:赤羽しおり,岡 敏彦
DOI: 10.7875/first.author.2016.045
PKA regulates PINK1 stability and Parkin recruitment to damaged mitochondria through phosphorylation of MIC60.
Shiori Akabane, Midori Uno, Naoki Tani, Shunta Shimazaki, Natsumi Ebara, Hiroki Kato, Hidetaka Kosako, Toshihiko Oka
Molecular Cell, 62, 371-384 (2016)
要 約
セリン/スレオニンキナーゼであるPINK1およびユビキチンリガーゼであるParkinは遺伝性パーキンソン病の原因遺伝子産物として知られ,障害の蓄積したミトコンドリアの選択的な分解において重要な役割をはたす.PINK1およびParkinは膜電位の低下したミトコンドリアにリクルートされ,外膜タンパク質のユビキチン化を促進することにより障害の蓄積したミトコンドリアを分解へと導く.しかし,PINK1およびParkinが細胞における環境に応答してどのように制御されるかについては明らかにされていなかった.この研究において,PINK1およびParkinのミトコンドリアへのリクルートは細胞におけるcAMPの濃度の上昇およびプロテインキナーゼAの活性化により阻害されることが明らかにされた.さらに,ミトコンドリア内膜に局在するMIC60がプロテインキナーゼAによりリン酸化されることで,PINK1およびParkinによるミトコンドリアの分解は抑制されることが示された.この研究により,PINK1およびParkinを介したミトコンドリアの選択的な分解の機構において,細胞における環境に応じた新たな制御機構が明らかにされた.
はじめに
ミトコンドリアは生命活動のためのエネルギーとしてATPを供給するが,同時に,活性酸素種を産生するため,ミトコンドリアはつねに酸化ストレスにさらされている.一方で,障害の蓄積したミトコンドリアが選択的に分解されることによりミトコンドリアの品質は保たれている.遺伝性パーキンソン病の原因遺伝子産物であるPINK1およびParkinは,ミトコンドリアの品質管理機構において重要な役割をはたす1).セリン/スレオニンキナーゼであるPINK1は膜電位の低下したミトコンドリア外膜にリクルートされ,自己リン酸化にともない活性化する2).活性化されたPINK1のはたらきによりユビキチンリガーゼであるParkinがミトコンドリアにリクルートされ,活性化してミトコンドリア外膜に存在する基質タンパク質をユビキチン化する.これにより,障害の蓄積したミトコンドリアの選択的な分解が促進される3)(図1).これまで,PINK1およびParkinを介したミトコンドリアの品質管理機構においては,ミトコンドリアの膜電位の低下がおもなシグナルであると考えられてきた.一方で,正常なミトコンドリアでも一過的に膜電位の低下する場合がある.このように,一過的に膜電位の低下したミトコンドリアと障害の蓄積したミトコンドリアはどのように区別されているのかは明らかにされていなかった.
1.プロテインキナーゼAの活性化はParkinのミトコンドリアへのリクルートを阻害する
PINK1およびParkinを介したミトコンドリアの品質管理機構におけるcAMP-プロテインキナーゼAシグナル伝達系の関与について明らかにするため,アデニル酸シクラーゼを活性化する薬剤であるフォルスコリンを用いてParkinのミトコンドリアへのリクルートについて解析した.ミトコンドリアの膜電位を低下させる薬剤であるCCCPを処理すると,Parkinはミトコンドリアへとリクルートされたが,フォルスコリンの存在のもとにおいてはCCCPの処理によるParkinのリクルートは抑制された.また,プロテインキナーゼAの阻害剤であるH89を用いてParkinのミトコンドリアへのリクルートについて解析したところ,H89はParkinのリクルートを促進した.さらに,プロテインキナーゼAの触媒サブユニットを過剰に発現させたところ,フォルスコリンの効果と同様に,Parkinのミトコンドリアへのリクルートを阻害した.これらの結果から,プロテインキナーゼAの活性化はParkinのミトコンドリアへのリクルートを阻害することが示された.
2.プロテインキナーゼAの活性化はPINK1のミトコンドリア外膜における安定性を低下させる
膜電位の低下したミトコンドリアにおいて,PINK1は自己リン酸化をともないミトコンドリア外膜に安定に存在する1).そこで,フォルスコリンの処理がPINK1の安定性に及ぼす影響について解析した.CCCPの処理により膜電位の低下したミトコンドリアにおいてはPINK1の蓄積が検出されたが,このPINK1の蓄積はフォルスコリンの処理により減少した.また,パルスチェイス実験により,フォルスコリンの処理はCCCPの存在のもとにおいて蓄積したPINK1の分解を促進することが証明された.これらの結果から,プロテインキナーゼAの活性化は膜電位の低下したミトコンドリアにおけるPINK1の安定性を低下させることが明らかにされた.
3.MIC60はプロテインキナーゼAによりリン酸化される
PINK1およびParkinを介したミトコンドリアの品質管理機構に関与するプロテインキナーゼAの基質タンパク質を同定するため,プロテインキナーゼAによるリン酸化モチーフの保存されているミトコンドリアタンパク質を探索した.候補となるタンパク質のうち,ミトコンドリア内膜に局在するMIC60のノックダウンはParkinのミトコンドリアへのリクルートを阻害した.MIC60はミトコンドリア内膜に局在するMICOS複合体の主要なサブユニットとして知られ,ミトコンドリア膜の形態の維持に重要であり,外膜タンパク質との相互作用をつうじてミトコンドリア内膜とミトコンドリア外膜とをつなぎとめる役割をはたす4,5).
MIC60の細胞におけるリン酸化について調べるため,野生型のMIC60,あるいは,リン酸化部位と推定されるSer528をAlaに置換した非リン酸化変異体を過剰に発現させた.リン酸化タンパク質を特異的に分離するSDS-ポリアクリルアミドゲル電気泳動法,および,MIC60のリン酸化Ser528を特異的に認識する抗体を用いた解析において,野生型のMIC60の過剰な発現によりフォルスコリンの処理によるリン酸化のバンドが検出された.また,内在性のMIC60のリン酸化についてヒトの細胞株において解析したところ,フォルスコリンの処理に依存的なリン酸化が検出された.さらに,液体クロマトグラフィー-質量分析法により,MIC60のSer528のリン酸化について確定した.以上の結果から,MIC60のSer528はプロテインキナーゼAによりリン酸化されることが示された.
4.MIC60はParkinのミトコンドリアへのリクルートを制御しPINK1と一過的に相互作用する
MIC60のノックダウンがParkinのミトコンドリアへのリクルートに及ぼす影響について解析した.CCCPの処理により膜電位の低下したミトコンドリアにおいて,MIC60のノックダウンはParkinのミトコンドリアへのリクルートの阻害およびPINK1の安定性の低下をひき起こした.MIC60はミトコンドリア外膜に局在するSAM複合体およびTOM複合体と相互作用することが知られている6).また,PINK1はミトコンドリア外膜においてTOM複合体を含む大きな複合体を形成する7).そこで,MIC60とPINK1との相互作用について調べるため,FLAGタグを付加したPINK1を発現させた細胞においてCCCPを計時的に処理したのち,架橋反応を起こした.CCCPのおのおのの処理時間における免疫沈降物について解析したところ,CCCPの処理から30分のちにMIC60およびSAM50はFLAGタグを付加したPINK1と共免疫沈降された.これらの結果から,PINK1はMIC60およびSAM50と一過的に相互作用することが示された.
5.MIC60のリン酸化はParkinのミトコンドリアへのリクルートを抑制する
MIC60のリン酸化がParkinのミトコンドリアへのリクルートに関与するかどうかを調べるため,MIC60のSer528をAlaに置換した非リン酸化変異体,および,AspあるいはGluに置換した擬似リン酸化変異体を用いて解析した.CCCPの処理によるParkinのミトコンドリアへのリクルートはMIC60のノックダウンにより阻害されたが,この阻害は野生型のMIC60あるいは非リン酸化変異体の発現により回復し,一方で,擬似リン酸化変異体の発現により回復しなかった.これらの結果から,MIC60のプロテインキナーゼAによるSer528のリン酸化はParkinのミトコンドリアへのリクルートを阻害することが示された.
MIC60はMICOS複合体の主要なサブユニットであり,ミトコンドリアのクリステ構造の維持に重要である4).そこで,MIC60のリン酸化がMICOS複合体の形成に及ぼす影響をクリアネイティブポリアクリルアミドゲル電気泳動法により解析したところ,MIC60のSer528のリン酸化はMICOS複合体の形成を減少させた.MIC60のリン酸化がミトコンドリア膜の構造に及ぼす影響を電子顕微鏡による解析により調べたところ,MIC60をノックダウンした細胞においてミトコンドリアのクリステ構造は消失していたが,非リン酸化変異体あるいは擬似リン酸化変異体を発現させた場合には,野生型のMIC60を発現させたときと同様に,ミトコンドリアのクリステ構造は維持されていた.
これらの結果から,MIC60のプロテインキナーゼAによるリン酸化は,ミトコンドリアの膜構造の維持とは関連せず,Parkinのミトコンドリアへのリクルートだけを抑制することが示された.
6.MIC19もプロテインキナーゼAによるリン酸化を介してParkinのミトコンドリアへのリクルートを制御する
これまでに,哺乳類においてはMICOS複合体のサブユニットとしてMIC10,MIC19,MIC25,MIC26,MIC27,MIC60,QIL1の7つが知られている4,8).そこで,ParkinのミトコンドリアへのリクルートにおけるMICOS複合体のサブユニットの関与について調べたところ,MIC10,MIC25,MIC26,MIC27のノックダウンはParkinのミトコンドリアへのリクルートに影響を及ぼさなかったが,MIC19のノックダウンはParkinのリクルートを阻害した.
MIC19はプロテインキナーゼAによりリン酸化されることがすでに報告されていたことから9),MIC19のリン酸化について解析したところ,in vivoおよびin vitroにおいてMIC19のThr11におけるリン酸化が確認された.そこで,MIC19のリン酸化がParkinのミトコンドリアへのリクルートに及ぼす影響について解析した.ParkinのミトコンドリアへのリクルートはMIC19のノックダウンにより部分的に阻害されたが,この阻害は野生型のMIC19,あるいは,Thr11における非リン酸化変異体の発現により回復した.これに対し,Thr11における擬似リン酸化変異体の発現によりParkinのミトコンドリアへのリクルートは回復しなかった.
これらの結果から,MIC60と同様に,MIC19もプロテインキナーゼAによるリン酸化を介してParkinのミトコンドリアへのリクルートを制御することが明らかにされた.
おわりに
この研究により,細胞におけるcAMPの濃度の上昇およびそれにともなうプロテインキナーゼAの活性化は,PINK1およびParkinの膜電位の低下したミトコンドリアへのリクルートを阻害することが示された.さらに,MICOS複合体のサブユニットであるMIC60がプロテインキナーゼAによりリン酸化されることで,Parkinのミトコンドリアへのリクルートが抑制されることが明らかにされた.これらの結果から,PINK1およびParkinによるミトコンドリアの品質管理機構はcAMP-プロテインキナーゼAシグナル伝達系を介して負に制御されていることが証明された.
ニューロンや筋肉細胞においては,ミトコンドリアによるATPの産生が一過的に上昇し,それにともない障害に関係なくミトコンドリアの膜電位が低下する場合がある.これまで,一過的に膜電位の低下したミトコンドリアと障害の蓄積したミトコンドリアとがどのように区別されているかは明らかでなかったが,今回の研究の結果から,細胞におけるcAMPの濃度の制御により,一過的に膜電位の低下したミトコンドリアの保護,および,障害の蓄積したミトコンドリアの選択的な分解が可能であることが示された(図2).
文 献
- Pickrell, A. M. & Youle, R. J.: The roles of PINK1, parkin, and mitochondrial fidelity in Parkinson’s disease. Neuron, 85, 257-273 (2015)[PubMed]
- Okatsu, K., Oka, T., Iguchi, M. et al.: PINK1 autophosphorylation upon membrane potential dissipation is essential for Parkin recruitment to damaged mitochondria. Nat. Commun., 3, 1016 (2012)[PubMed]
- Narendra, D. P. & Youle, R. J.: Targeting mitochondrial dysfunction: role for PINK1 and Parkin in mitochondrial quality control. Antioxid. Redox Signal., 14, 1929-1938 (2011)[PubMed]
- Pfanner, N., van der Laan, M., Amati, P. et al.: Uniform nomenclature for the mitochondrial contact site and cristae organizing system. J. Cell Biol., 204, 1083-1086 (2014)[PubMed]
- Zerbes, R. M., van der Klei, I. J., Veenhuis, M. et al.: Mitofilin complexes: conserved organizers of mitochondrial membrane architecture. Biol. Chem., 393, 1247-1261 (2012)[PubMed]
- van der Laan, M., Bohnert, M., Wiedemann, N. et al.: Role of MINOS in mitochondrial membrane architecture and biogenesis. Trends Cell Biol., 22, 185-192 (2012)[PubMed]
- Okatsu, K., Uno, M., Koyano, F. et al.: A dimeric PINK1-containing complex on depolarized mitochondria stimulates Parkin recruitment. J. Biol. Chem., 288, 36372-36384 (2013)[PubMed]
- Guarani, V., McNeill, E. M., Paulo, J. A. et al.: QIL1 is a novel mitochondrial protein required for MICOS complex stability and cristae morphology. ELife, 4, e06265 (2015)[PubMed]
- Schauble, S., King, C. C., Darshi, M. et al.: Identification of ChChd3 as a novel substrate of the cAMP-dependent protein kinase (PKA) using an analog-sensitive catalytic subunit. J. Biol. Chem., 282, 14952-14959 (2007)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2014年 東京大学大学院新領域創成科学研究科 修了,同年より立教大学理学部 研究員.
研究テーマ:cAMP-プロテインキナーゼAシグナル伝達系を介したミトコンドリアの品質管理機構の制御.
抱負:ポジティブな気持ちで前に進みつづけたい.
岡 敏彦(Toshihiko Oka)
立教大学理学部 教授.
研究室URL:http://www2.rikkyo.ac.jp/web/oka_lab/index.html
© 2016 赤羽しおり・岡 敏彦 Licensed under CC 表示 2.1 日本