マウスの表皮においては性質の異なる2種類の幹細胞が共存する
佐田亜衣子・Tudorita Tumbar
(米国Cornell大学Department of Molecular Biology and Genetics)
email:佐田亜衣子
DOI: 10.7875/first.author.2016.040
Defining the cellular lineage hierarchy in the interfollicular epidermis of adult skin.
Aiko Sada, Fadi Jacob, Eva Leung, Sherry Wang, Brian S. White, David Shalloway, Tudorita Tumbar
Nature Cell Biology, 18, 619-631 (2016)
古典的なモデルにおいて,組織幹細胞は細胞分裂の頻度を低く抑えることにより細胞分裂にともない起こりうるがん化や老化をふせぐと提唱されていた.この研究において,新たに同定された分子マーカーを用いマウスの表皮においてこのモデルを検証したところ,細胞分裂の頻度の低い細胞だけでなく,本来は幹細胞ではないと考えられてきた細胞分裂の頻度の高い細胞も幹細胞としてはたらくことを発見した.細胞分裂の頻度の異なる2種類の表皮幹細胞は皮膚の異なる領域に局在し,異なる種類の細胞に分化した.さらに,これら2種類の表皮幹細胞は通常の状態においては独立してはたらくが,皮膚の損傷など危機的な状況におかれると互いの機能を補完しあうことも見い出された.この研究は,分子マーカーがないため長年にわたり実態が不明であったマウスの表皮幹細胞の同定およびその動態の解明にはじめて成功し,皮膚科学の基礎研究および応用研究において重要な知見となった.
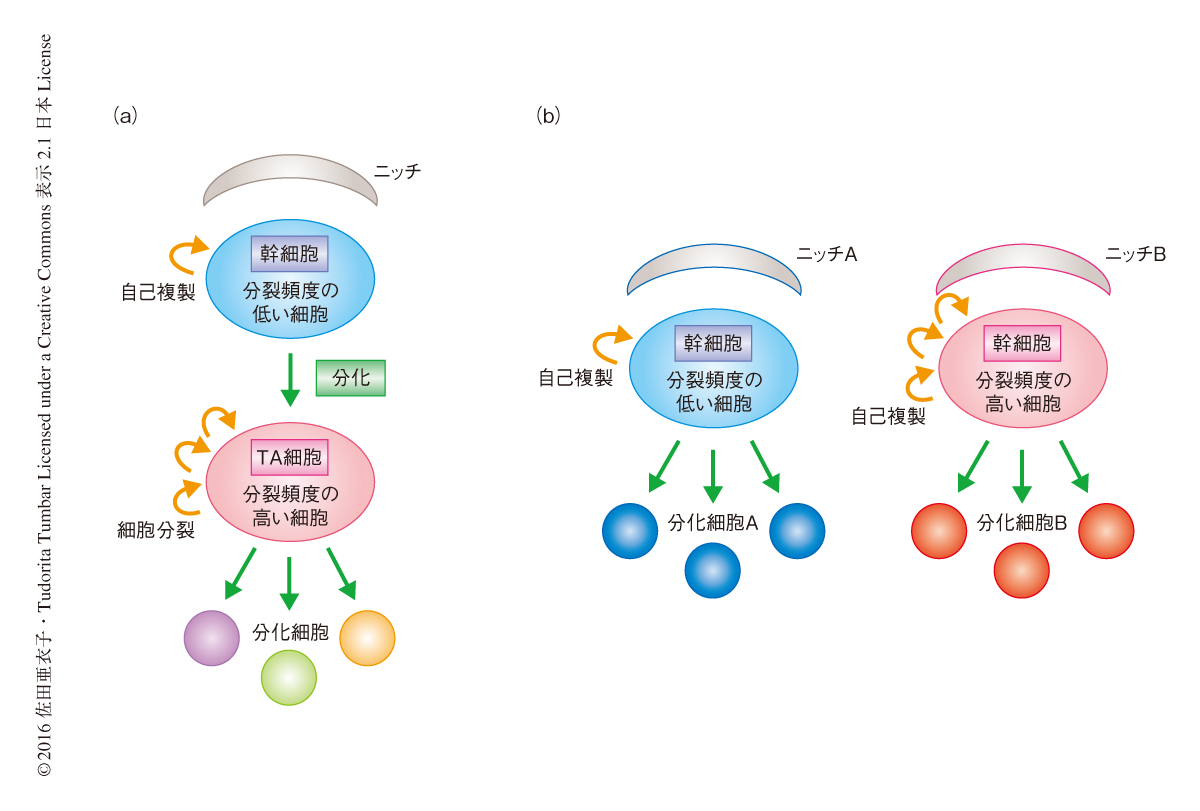
組織幹細胞は成体の臓器および組織に存在する固有の幹細胞であり,生涯にわたり自己複製をくり返しながら分化した細胞を供給する.古典的なモデルにおいて,組織幹細胞は細胞分裂の頻度を低く抑えることによりDNAの損傷やテロメアの短縮などの影響を最小限にし,がん化や老化をふせぐと考えられてきた.一方,活発に細胞分裂する細胞はTA細胞(transit-amplifying cell)とよばれ,すでに幹細胞としての能力を失った細胞であるとされていた.このような概念は“階層的な幹細胞/TA細胞モデル”として提唱され(図1a),ショウジョウバエの生殖巣やマウスの毛包などの幹細胞システムにあてはまる1-3).しかし,活発に細胞分裂する細胞が幹細胞としてはたらくマウスの小腸の例もあり4-6),細胞分裂の頻度と幹細胞の能力との関係性には疑問が残っていた.
皮膚には表皮および毛包に分化する幹細胞が存在し,皮膚のターンオーバー,毛の生え変わり,損傷した皮膚の治癒などの役割を担う.毛包に分化する毛包幹細胞は階層的な幹細胞/TA細胞モデルの典型的な例であり,細胞分裂の頻度の低い幹細胞がバルジ領域とよばれるニッチに局在する.一方,表皮は多層構造をとり,幹細胞を含む分裂細胞が最深部の表皮基底層に位置する.表皮基底層の細胞は上層へと移行するとともに増殖能を失い分化を開始する.分化へと進んだ細胞は有棘層,顆粒層,角質層をへて,最終的に皮膚の表層からはがれおちる.しかしながら,表皮幹細胞に特異的な分子マーカーが同定されていなかったため,表皮基底層の細胞のすべてが幹細胞としてはたらくのか,また,細胞分裂の頻度の異なる表皮基底層の細胞は異なる性質をもつのかは,長年にわたり議論されていた7-11).
筆者らは,先行研究において,細胞分裂の頻度の異なる細胞を可視化し単離することの可能なヒストンH2B-GFP Tet-Offマウスの系を確立した12).このマウスにおいては,ドキシサイクリンの非存在下にて上皮細胞に特異的な遺伝子プロモーターの下流において転写が活性化され,ヒストンH2BとGFPとの融合タンパク質が安定的に発現する.ドキシサイクリンを投与すると転写が抑制され,細胞に蓄積したヒストンH2BとGFPとの融合タンパク質が細胞分裂ごとに半減する.よって,細胞分裂の頻度の高い細胞はGFPを徐々に失うが,細胞分裂の頻度の低い細胞は長期にわたりGFPを高いレベルで保持する.このマウスは,毛包幹細胞や造血幹細胞の研究においては広く用いられてきたが,表皮においては詳細に解析されていなかった.
この研究においては,このヒストンH2B-GFP Tet-Offマウスを用い,表皮において細胞分裂の頻度の異なる細胞の局在について調べた.その結果,細胞分裂の頻度の低い細胞と高い細胞とは表皮の別々の領域にクラスターを形成し,規則的な局在パターンを示すことが見い出された.細胞分裂の頻度の高い表皮細胞は血管の分岐点の近傍においてより多く観察された.血管は骨髄や精巣などにおいて幹細胞ニッチとしてはたらくことが示唆されており,表皮においてもなんらかの特別な環境を形成するのかもしれない.
細胞分裂の頻度の低い表皮細胞と高い表皮細胞との性質や機能の違いを分子レベルで明らかにするために,遺伝子の発現を網羅的に解析することをめざした.しかし,表皮細胞において特異的に発現する細胞表面抗原が同定されていなかったため,毛包細胞や真皮細胞などさまざまな細胞種が混在するマウスの皮膚から表皮細胞のみを単離することは困難であった.この問題を解決するため,タモキシフェン誘導型CreマウスとCreに依存的に赤色蛍光タンパク質tdTomatoを発現するレポーターマウスを使用した.このタモキシフェン誘導型CreマウスにおいてCreを制御する遺伝子プロモーターは毛包細胞と比べ表皮細胞においてより活性が強いため,タモキシフェンの投与量を最適化することにより表皮細胞を特異的に標識することができる.このCreの系に,ヒストンH2B-GFP Tet-Offの系を組み合わせた四重トランスジェニックマウスを作製することにより,表皮基底層に位置する細胞分裂の頻度の低い細胞と高い細胞とを別々に単離することに成功した.
単離した表皮細胞からRNAを抽出しマイクロアレイ法により遺伝子の発現を解析した.その結果,細胞分裂の頻度の低い表皮細胞と高い表皮細胞とでは何千もの遺伝子が異なる発現パターンを示すことが見い出された.細胞分裂の頻度の低い表皮細胞においてはインスリンシグナル伝達経路,代謝,細胞死の制御にかかわる遺伝子が,細胞分裂の頻度の高い表皮細胞においては血管の発生,細胞周期,転写,クロマチンに関連する遺伝子が,高いレベルで発現していた.このような遺伝子の発現パターンの違いは,細胞分裂の頻度の低い表皮細胞と高い表皮細胞の機能や制御機構の違いを反映する可能性が強く示唆された.
細胞分裂の頻度の低い表皮細胞および高い表皮細胞が幹細胞であるかどうかをin vivoにおいて検証するため,マイクロアレイ法のデータをもとにそれぞれの細胞において特異的にCreを発現するタモキシフェン誘導型Creマウスを同定した.これらのマウスにタモキシフェンを投与することによりCreを発現した細胞が蛍光により標識される.もし,Creを発現した細胞が幹細胞である場合,標識された細胞は自己複製および分化をするため,表皮を構成するすべての細胞において長期にわたり蛍光が観察される.一方,Creを発現した細胞がTA細胞である場合,標識された細胞は一過的に増殖し分化するが,やがて,組織から失われる.これらの可能性を区別するため,タモキシフェンの投与の1日後から1年後まで,標識された細胞の数と局在のパターンを経時的かつ定量的に解析した.
細胞分裂の頻度の低い表皮細胞において特異的にCreを発現するタモキシフェン誘導型Creマウスを用いて細胞系譜を解析したところ,Creを発現した細胞は長期にわたり維持されたことから,細胞分裂の頻度の低い表皮細胞は幹細胞であることがわかった.細胞分裂の頻度の高い表皮細胞において特異的にCreを発現するタモキシフェン誘導型Creマウスを用いて同様に解析したところ,従来の階層的な幹細胞/TA細胞モデルに反し,細胞分裂の頻度の高い表皮細胞も幹細胞としてはたらくことが見い出された.さらに,細胞分裂の頻度の低い表皮幹細胞および高い表皮幹細胞は皮膚の別々の領域において異なる種類の表皮細胞に分化する能力を保持していた(図1b).よって,マウスの表皮には細胞分裂の頻度の異なる2種類の独立した表皮幹細胞が共存すると結論づけた.
さらに,数理モデルを用いて表皮細胞の細胞分裂および分化の挙動を解析した.その結果,表皮細胞の細胞分裂および分化の速度を定量的に解析した生物学的なデータは階層的な幹細胞/TA細胞モデルでは説明がつかず,細胞分裂の頻度の異なる2種類の表皮細胞が共存するという新しいモデルともっとも適合するという結論が得られた.これは,細胞系譜の解析の結果と一致した.
表皮幹細胞は皮膚のターンオーバーだけでなく,皮膚の損傷ののちの再生の過程においても重要な役割をはたす.そこで,細胞分裂の頻度の低い表皮幹細胞および高い表皮幹細胞が損傷ののちの組織の再生にどのように寄与するかを明らかにするため,細胞系譜の解析に用いたタモキシフェン誘導型Creマウスの皮膚に物理的な損傷をあたえ表皮幹細胞の挙動を調べた.細胞分裂の頻度の低い表皮幹細胞および高い表皮幹細胞はともに損傷の部位へと移動して増殖し,約1カ月にわたり組織の再生に寄与した.さらに,再生の過程において2種類の表皮幹細胞の相互の細胞系譜への分化の転換や異所的な部位への移動がみられた.しかし,このような応答は一過的であり,損傷の3カ月のちには細胞分裂の頻度の低い表皮幹細胞および高い表皮幹細胞はもともと局在していた皮膚の領域,すなわち,それぞれの表皮幹細胞に特異的なニッチでのみ観察されるようになった.
以上の結果から,通常の状態では細胞分裂の頻度の低い表皮細胞と高い表皮細胞は非依存的で異なる細胞に分化する幹細胞であるが,皮膚の損傷など危機的な状況におかれると互いの機能を補完しあう能力をもつことが明らかにされた.このような2種類の表皮幹細胞のあいだの相互互換性により,表皮幹細胞は損傷に対し柔軟に応答し,皮膚のより早い治癒に貢献すると考察された.また,組織の再生が進むと,細胞分裂の頻度の低い表皮幹細胞および高い表皮幹細胞は本来のニッチでのみ維持されることもわかった.この結果は,2種類の表皮幹細胞が内在的に異なる性質をもつという,この研究において得られたほかのデータを支持した.
組織幹細胞は恒常性の維持や臓器の再生に重要な役割をはたすとともに,近年では,がんや老化との関連性も示唆されている.この研究において同定されたマウスの表皮幹細胞において発現する遺伝子のなかには,ヒトの表皮基底層においても不均一な発現パターンを示すものが複数みられることから,ヒトの表皮幹細胞もヘテロな細胞集団である可能性が示唆される.今後は,マウスにおいて得られた知見を手がかりにヒトの表皮幹細胞の解析を進めることにより,より精度の高い再生医療の実現や,皮膚がんや肌の老化の予防および治療へとつながることが期待される.
略歴:2011年 総合研究大学院大学生命科学研究科博士課程 修了,同年 米国Cornell大学 博士研究員を経て,2016年より筑波大学生命領域学際研究センター 助教.
研究テーマ:組織幹細胞の同定および制御機構.
抱負:いろいろな視点から幹細胞の不思議を解き明かしたい.
Tudorita Tumbar
米国Cornell大学 准教授.
研究室URL:http://blogs.cornell.edu/tumbarlab/
© 2016 佐田亜衣子・Tudorita Tumbar Licensed under CC 表示 2.1 日本
(米国Cornell大学Department of Molecular Biology and Genetics)
email:佐田亜衣子
DOI: 10.7875/first.author.2016.040
Defining the cellular lineage hierarchy in the interfollicular epidermis of adult skin.
Aiko Sada, Fadi Jacob, Eva Leung, Sherry Wang, Brian S. White, David Shalloway, Tudorita Tumbar
Nature Cell Biology, 18, 619-631 (2016)
要 約
古典的なモデルにおいて,組織幹細胞は細胞分裂の頻度を低く抑えることにより細胞分裂にともない起こりうるがん化や老化をふせぐと提唱されていた.この研究において,新たに同定された分子マーカーを用いマウスの表皮においてこのモデルを検証したところ,細胞分裂の頻度の低い細胞だけでなく,本来は幹細胞ではないと考えられてきた細胞分裂の頻度の高い細胞も幹細胞としてはたらくことを発見した.細胞分裂の頻度の異なる2種類の表皮幹細胞は皮膚の異なる領域に局在し,異なる種類の細胞に分化した.さらに,これら2種類の表皮幹細胞は通常の状態においては独立してはたらくが,皮膚の損傷など危機的な状況におかれると互いの機能を補完しあうことも見い出された.この研究は,分子マーカーがないため長年にわたり実態が不明であったマウスの表皮幹細胞の同定およびその動態の解明にはじめて成功し,皮膚科学の基礎研究および応用研究において重要な知見となった.
はじめに
組織幹細胞は成体の臓器および組織に存在する固有の幹細胞であり,生涯にわたり自己複製をくり返しながら分化した細胞を供給する.古典的なモデルにおいて,組織幹細胞は細胞分裂の頻度を低く抑えることによりDNAの損傷やテロメアの短縮などの影響を最小限にし,がん化や老化をふせぐと考えられてきた.一方,活発に細胞分裂する細胞はTA細胞(transit-amplifying cell)とよばれ,すでに幹細胞としての能力を失った細胞であるとされていた.このような概念は“階層的な幹細胞/TA細胞モデル”として提唱され(図1a),ショウジョウバエの生殖巣やマウスの毛包などの幹細胞システムにあてはまる1-3).しかし,活発に細胞分裂する細胞が幹細胞としてはたらくマウスの小腸の例もあり4-6),細胞分裂の頻度と幹細胞の能力との関係性には疑問が残っていた.
皮膚には表皮および毛包に分化する幹細胞が存在し,皮膚のターンオーバー,毛の生え変わり,損傷した皮膚の治癒などの役割を担う.毛包に分化する毛包幹細胞は階層的な幹細胞/TA細胞モデルの典型的な例であり,細胞分裂の頻度の低い幹細胞がバルジ領域とよばれるニッチに局在する.一方,表皮は多層構造をとり,幹細胞を含む分裂細胞が最深部の表皮基底層に位置する.表皮基底層の細胞は上層へと移行するとともに増殖能を失い分化を開始する.分化へと進んだ細胞は有棘層,顆粒層,角質層をへて,最終的に皮膚の表層からはがれおちる.しかしながら,表皮幹細胞に特異的な分子マーカーが同定されていなかったため,表皮基底層の細胞のすべてが幹細胞としてはたらくのか,また,細胞分裂の頻度の異なる表皮基底層の細胞は異なる性質をもつのかは,長年にわたり議論されていた7-11).
1.細胞分裂の頻度の異なる表皮細胞は異なる領域に局在する
筆者らは,先行研究において,細胞分裂の頻度の異なる細胞を可視化し単離することの可能なヒストンH2B-GFP Tet-Offマウスの系を確立した12).このマウスにおいては,ドキシサイクリンの非存在下にて上皮細胞に特異的な遺伝子プロモーターの下流において転写が活性化され,ヒストンH2BとGFPとの融合タンパク質が安定的に発現する.ドキシサイクリンを投与すると転写が抑制され,細胞に蓄積したヒストンH2BとGFPとの融合タンパク質が細胞分裂ごとに半減する.よって,細胞分裂の頻度の高い細胞はGFPを徐々に失うが,細胞分裂の頻度の低い細胞は長期にわたりGFPを高いレベルで保持する.このマウスは,毛包幹細胞や造血幹細胞の研究においては広く用いられてきたが,表皮においては詳細に解析されていなかった.
この研究においては,このヒストンH2B-GFP Tet-Offマウスを用い,表皮において細胞分裂の頻度の異なる細胞の局在について調べた.その結果,細胞分裂の頻度の低い細胞と高い細胞とは表皮の別々の領域にクラスターを形成し,規則的な局在パターンを示すことが見い出された.細胞分裂の頻度の高い表皮細胞は血管の分岐点の近傍においてより多く観察された.血管は骨髄や精巣などにおいて幹細胞ニッチとしてはたらくことが示唆されており,表皮においてもなんらかの特別な環境を形成するのかもしれない.
2.細胞分裂の頻度の異なる表皮細胞は異なる遺伝子の発現パターンを示す
細胞分裂の頻度の低い表皮細胞と高い表皮細胞との性質や機能の違いを分子レベルで明らかにするために,遺伝子の発現を網羅的に解析することをめざした.しかし,表皮細胞において特異的に発現する細胞表面抗原が同定されていなかったため,毛包細胞や真皮細胞などさまざまな細胞種が混在するマウスの皮膚から表皮細胞のみを単離することは困難であった.この問題を解決するため,タモキシフェン誘導型CreマウスとCreに依存的に赤色蛍光タンパク質tdTomatoを発現するレポーターマウスを使用した.このタモキシフェン誘導型CreマウスにおいてCreを制御する遺伝子プロモーターは毛包細胞と比べ表皮細胞においてより活性が強いため,タモキシフェンの投与量を最適化することにより表皮細胞を特異的に標識することができる.このCreの系に,ヒストンH2B-GFP Tet-Offの系を組み合わせた四重トランスジェニックマウスを作製することにより,表皮基底層に位置する細胞分裂の頻度の低い細胞と高い細胞とを別々に単離することに成功した.
単離した表皮細胞からRNAを抽出しマイクロアレイ法により遺伝子の発現を解析した.その結果,細胞分裂の頻度の低い表皮細胞と高い表皮細胞とでは何千もの遺伝子が異なる発現パターンを示すことが見い出された.細胞分裂の頻度の低い表皮細胞においてはインスリンシグナル伝達経路,代謝,細胞死の制御にかかわる遺伝子が,細胞分裂の頻度の高い表皮細胞においては血管の発生,細胞周期,転写,クロマチンに関連する遺伝子が,高いレベルで発現していた.このような遺伝子の発現パターンの違いは,細胞分裂の頻度の低い表皮細胞と高い表皮細胞の機能や制御機構の違いを反映する可能性が強く示唆された.
3.細胞分裂の頻度の異なる表皮細胞は独立した幹細胞としてはたらく
細胞分裂の頻度の低い表皮細胞および高い表皮細胞が幹細胞であるかどうかをin vivoにおいて検証するため,マイクロアレイ法のデータをもとにそれぞれの細胞において特異的にCreを発現するタモキシフェン誘導型Creマウスを同定した.これらのマウスにタモキシフェンを投与することによりCreを発現した細胞が蛍光により標識される.もし,Creを発現した細胞が幹細胞である場合,標識された細胞は自己複製および分化をするため,表皮を構成するすべての細胞において長期にわたり蛍光が観察される.一方,Creを発現した細胞がTA細胞である場合,標識された細胞は一過的に増殖し分化するが,やがて,組織から失われる.これらの可能性を区別するため,タモキシフェンの投与の1日後から1年後まで,標識された細胞の数と局在のパターンを経時的かつ定量的に解析した.
細胞分裂の頻度の低い表皮細胞において特異的にCreを発現するタモキシフェン誘導型Creマウスを用いて細胞系譜を解析したところ,Creを発現した細胞は長期にわたり維持されたことから,細胞分裂の頻度の低い表皮細胞は幹細胞であることがわかった.細胞分裂の頻度の高い表皮細胞において特異的にCreを発現するタモキシフェン誘導型Creマウスを用いて同様に解析したところ,従来の階層的な幹細胞/TA細胞モデルに反し,細胞分裂の頻度の高い表皮細胞も幹細胞としてはたらくことが見い出された.さらに,細胞分裂の頻度の低い表皮幹細胞および高い表皮幹細胞は皮膚の別々の領域において異なる種類の表皮細胞に分化する能力を保持していた(図1b).よって,マウスの表皮には細胞分裂の頻度の異なる2種類の独立した表皮幹細胞が共存すると結論づけた.
さらに,数理モデルを用いて表皮細胞の細胞分裂および分化の挙動を解析した.その結果,表皮細胞の細胞分裂および分化の速度を定量的に解析した生物学的なデータは階層的な幹細胞/TA細胞モデルでは説明がつかず,細胞分裂の頻度の異なる2種類の表皮細胞が共存するという新しいモデルともっとも適合するという結論が得られた.これは,細胞系譜の解析の結果と一致した.
4.細胞分裂の頻度の異なる2種類の表皮幹細胞は損傷のもとでは互いの機能を補完する
表皮幹細胞は皮膚のターンオーバーだけでなく,皮膚の損傷ののちの再生の過程においても重要な役割をはたす.そこで,細胞分裂の頻度の低い表皮幹細胞および高い表皮幹細胞が損傷ののちの組織の再生にどのように寄与するかを明らかにするため,細胞系譜の解析に用いたタモキシフェン誘導型Creマウスの皮膚に物理的な損傷をあたえ表皮幹細胞の挙動を調べた.細胞分裂の頻度の低い表皮幹細胞および高い表皮幹細胞はともに損傷の部位へと移動して増殖し,約1カ月にわたり組織の再生に寄与した.さらに,再生の過程において2種類の表皮幹細胞の相互の細胞系譜への分化の転換や異所的な部位への移動がみられた.しかし,このような応答は一過的であり,損傷の3カ月のちには細胞分裂の頻度の低い表皮幹細胞および高い表皮幹細胞はもともと局在していた皮膚の領域,すなわち,それぞれの表皮幹細胞に特異的なニッチでのみ観察されるようになった.
以上の結果から,通常の状態では細胞分裂の頻度の低い表皮細胞と高い表皮細胞は非依存的で異なる細胞に分化する幹細胞であるが,皮膚の損傷など危機的な状況におかれると互いの機能を補完しあう能力をもつことが明らかにされた.このような2種類の表皮幹細胞のあいだの相互互換性により,表皮幹細胞は損傷に対し柔軟に応答し,皮膚のより早い治癒に貢献すると考察された.また,組織の再生が進むと,細胞分裂の頻度の低い表皮幹細胞および高い表皮幹細胞は本来のニッチでのみ維持されることもわかった.この結果は,2種類の表皮幹細胞が内在的に異なる性質をもつという,この研究において得られたほかのデータを支持した.
おわりに
組織幹細胞は恒常性の維持や臓器の再生に重要な役割をはたすとともに,近年では,がんや老化との関連性も示唆されている.この研究において同定されたマウスの表皮幹細胞において発現する遺伝子のなかには,ヒトの表皮基底層においても不均一な発現パターンを示すものが複数みられることから,ヒトの表皮幹細胞もヘテロな細胞集団である可能性が示唆される.今後は,マウスにおいて得られた知見を手がかりにヒトの表皮幹細胞の解析を進めることにより,より精度の高い再生医療の実現や,皮膚がんや肌の老化の予防および治療へとつながることが期待される.
文 献
- Sada, A. & Tumbar, T.: New insights into mechanisms of stem cell daughter fate determination in regenerative tissues. Int. Rev. Cell Mol. Biol., 300, 1-50 (2013)[PubMed]
- Waghmare, S. K., Bansal, R., Lee, J. et al.: Quantitative proliferation dynamics and random chromosome segregation of hair follicle stem cells. EMBO J., 27, 1309-1320 (2008)[PubMed]
- Zhang, Y. V., Cheong, J., Ciapurin, N. et al.: Distinct self-renewal and differentiation phases in the niche of infrequently dividing hair follicle stem cells. Cell Stem Cell, 5, 267-278 (2009)[PubMed]
- Barker, N., van Es, J. H., Kuipers, J. et al.: Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature, 449, 1003-1007 (2007)[PubMed]
- Buczacki, S. J., Zecchini, H. I., Nicholson, A. M. et al.: Intestinal label-retaining cells are secretory precursors expressing Lgr5. Nature, 495, 65-69 (2013)[PubMed]
- Metcalfe, C., Kljavin, N. M., Ybarra, R. et al.: Lgr5+ stem cells are indispensable for radiation-induced intestinal regeneration. Cell Stem Cell, 14, 149-159 (2014)[PubMed]
- Bickenbach, J. R.: Identification and behavior of label-retaining cells in oral mucosa and skin. J. Dent. Res., 60, 1611-1620 (1981)[PubMed]
- Clayton, E., Doupe, D. P., Klein, A. M.: et al.: A single type of progenitor cell maintains normal epidermis. Nature, 446, 185-189 (2007)[PubMed]
- Mascre, G., Dekoninck, S., Drogat, B. et al.: Distinct contribution of stem and progenitor cells to epidermal maintenance. Nature, 489, 257-262 (2012)[PubMed]
- Lim, X., Tan, S. H., Koh, W. L. et al.: Interfollicular epidermal stem cells self-renew via autocrine Wnt signaling. Science, 342, 1226-1230 (2013)[PubMed]
- Gomez, C., Chua, W., Miremadi, A. et al.: The interfollicular epidermis of adult mouse tail comprises two distinct cell lineages that are differentially regulated by Wnt, Edaradd, and Lrig1. Stem Cell Rep., 1, 19-27 (2013)[PubMed]
- Tumbar, T., Guasch, G., Greco, V. et al.: Defining the epithelial stem cell niche in skin. Science, 303, 359-363 (2004)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2011年 総合研究大学院大学生命科学研究科博士課程 修了,同年 米国Cornell大学 博士研究員を経て,2016年より筑波大学生命領域学際研究センター 助教.
研究テーマ:組織幹細胞の同定および制御機構.
抱負:いろいろな視点から幹細胞の不思議を解き明かしたい.
Tudorita Tumbar
米国Cornell大学 准教授.
研究室URL:http://blogs.cornell.edu/tumbarlab/
© 2016 佐田亜衣子・Tudorita Tumbar Licensed under CC 表示 2.1 日本