核内受容体ERRγによる膵β細胞における機能的な代謝の成熟化
吉原 栄治
(米国Salk Institute for Biological Studies,Gene Expression Laboratory)
email:吉原栄治
DOI: 10.7875/first.author.2016.039
ERRγ is required for the metabolic maturation of therapeutically functional glucose-responsive β cells.
Eiji Yoshihara, Zong Wei, Chun Shi Lin, Sungsoon Fang, Maryam Ahmadian, Yasuyuki Kida, Tiffany Tseng, Yang Dai, Ruth T. Yu, Christopher Liddle, Annette R. Atkins, Michael Downes, Ronald M. Evans
Cell Metabolism, 23, 622-634 (2016)
膵β細胞は出生ののちの機能的な成熟化の過程をへてグルコースに応答性を示す機能的な膵β細胞になることが知られているが,その機構については不明な点が多い.筆者らは,マウスの新生仔および成体の膵島における遺伝子の発現を解析し,核内受容体ERRγおよびその下流のミトコンドリア代謝経路の発現が機能的な成熟化とともに亢進することを見い出した.膵β細胞に特異的なERRγノックアウトマウスの解析により,ERRγは膵β細胞においてグルコースによる酸化的リン酸化の上昇およびインスリンの分泌応答に関与する新規の転写因子であることが明らかにされた.また,ヒトのiPS細胞より分化させた膵β“様”細胞は,ヒトの新生児の膵β細胞と同様に,グルコースによるインスリンの分泌に不全を示すことが知られていたことから,ERRγの強制発現による影響について調べた.ERRγの強制発現はiPS細胞に由来する膵β“様”細胞において膵β細胞に特異的な遺伝子の発現には影響をあたえなかったが,乳酸の産生を担う乳酸デヒドロゲナーゼの発現の低下およびミトコンドリア代謝経路に関与する遺伝子の発現の上昇をともない,ミトコンドリアにおける呼吸鎖を劇的に増強させた.また,このとき,グルコースに対するインスリンの分泌応答もみられた.さらに,ERRγを強制発現させたヒトのiPS細胞に由来する膵β“様”細胞の移植は1型糖尿病モデルマウスの血糖値を改善したことから,ERRγによる機能的な代謝の成熟化は膵β細胞の機能に寄与することが示唆された.
ヒトのiPS細胞からの,あるいは,ダイレクトリプログラミングによる機能的な分化細胞の作製は,不足する移植用の臓器の代用としてのみならず,ヒトの細胞機能や病態の解明および創薬のための材料となることが期待されている.しかし,生体外で分化させた細胞は,機能の面で初期の細胞より大きく劣ることが多い1,2).そこで,これまでのように細胞種に特異的な転写因子に着目した,どのようにして特異的な細胞種へと分化させるかという研究にくわえ,どのようにして機能的に成熟させるかという研究が注目されている.生体においては,細胞の機能的な成熟化は出生とともに増加する酸素や離乳の際の栄養代謝の変化による影響をうけた複雑な機構により制御されることが想像されるが,そのくわしい分子機構は明らかではない.とくに,膵β細胞においては,出生から成体への成長の過程において起こる機能的な成熟化にともないグルコースによるインスリンの分泌応答がいちじるしく強化されることが知られている3).筆者らは,この研究において,マウスの新生仔および成体より膵島を単離し遺伝子発現の制御機構を解析することにより膵β細胞における機能的な成熟化の過程の一端を解き明かすこと,さらに,得られた知見をもとに,ヒトのiPS細胞から生体外において分化させた膵β“様”細胞の機能の強化を目的とした.
出生ののちの膵β細胞の機能的な成熟化の機構について調べるため,2週齢の新生仔,および,6週齢および12週齢の成体のマウスの膵島における遺伝子の発現をRNA-seq法を用いて検討した.成体の膵島では,新生仔の膵島と比較して,細胞周期に関与する遺伝子の発現の顕著な低下が認められた一方,膵β細胞への分化に関与する遺伝子,および,ERRγ(estrogen receptor-related receptor γ,エストロゲン関連受容体γ)といった代謝を制御する転写因子をコードする遺伝子の発現の上昇が認められた.核内受容体であるERRγは,心筋や脳,また,褐色脂肪細胞といった代謝活性の高い臓器や,リプログラミングの際の一時的な代謝の活性化において,ミトコンドリアにおける代謝を制御することが知られている4,5).成体の膵島においては,糖代謝およびミトコンドリア代謝経路に関与する遺伝子の発現の上昇がみられた.モチーフ解析により,ミトコンドリア代謝経路に関与する遺伝子には,とくにERRγにより制御されるエストロゲン関連受容体応答配列を含むものが多くみられた.グルコースによるインスリンの分泌の促進は解糖系により産生されたピルビン酸が乳酸に変換されるのを最小限に抑え,ミトコンドリアにおいてATPの産生に利用されることにより最大のインスリンの分泌が達成されることが知られている6).これらの結果から,マウスの膵島の機能的な成熟化の過程において,膵β細胞への分化の成熟化にくわえ,解糖系およびミトコンドリアにおける酸化的リン酸化において機能的な代謝の成熟化が重要であることが推測された.
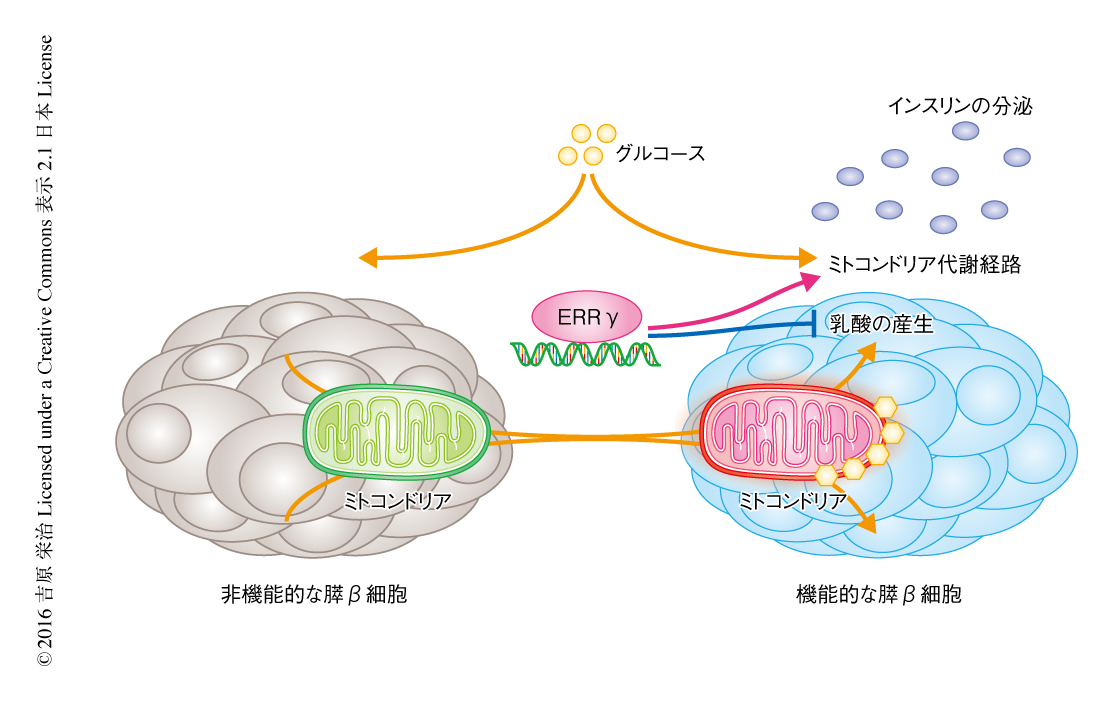
定量PCR法による発現解析により,ERRγは肝臓,白色脂肪細胞,膵外分泌細胞に比べ,心臓や膵島において発現が高く,新生仔と比べ成体の膵β細胞により多く発現していることが明らかにされた.膵β細胞の機能的な成熟化におけるERRγの役割を検討するため,膵β細胞に特異的なERRγノックアウトマウス,および,膵臓に特異的なERRγノックアウトマウスを作製した.それらのノックアウトマウスは,通常食のもとインスリンの分泌の不全をともなう耐糖能の軽度の異常を示した.マウスでは離乳により膵β細胞の機能的な成熟化が促進され,離乳の直後における高脂肪食の負荷は膵β細胞のグルコースに対する増殖能およびインスリンの分泌応答を低下させることが報告されている.膵β細胞に特異的なERRγノックアウトマウスおよび膵臓に特異的なERRγノックアウトマウスは,離乳ののちの高脂肪食の負荷により,耐糖能のより強い異常を示した.単離された膵島において,ERRγの欠損により,グルコースに対する酸素の消費の増加およびそれに付随するインスリンの分泌は顕著に低下した.さらに,電子顕微鏡による観察により,膵β細胞に特異的なERRγノックアウトマウスの膵β細胞においては,ミトコンドリアの数に変化はなかったが,クリステ構造の消失などミトコンドリアの機能の不全を示唆する変化がみられた.そこで,RNA-Seq法により遺伝子の発現を調べたところ,膵β細胞に特異的なERRγノックアウトマウスの膵島においては,野生型のマウスと比較して,ATPの合成,酸化的リン酸化,分泌小胞による輸送といった膵β細胞の機能に重要な経路に異常のあることがGOオントロジー解析により明らかにされた.また,それらの経路は新生仔から成体への成長の過程において変化のみられる経路であった.これらの結果から,核内受容体ERRγが遺伝子発現制御を介して膵β細胞の機能的な代謝の成熟化に寄与することが示唆された(図1).
ヒトの多能性幹細胞から分化されたインスリン産生細胞(膵β“様”細胞)は,その機能および遺伝子の発現において,成体の成熟した膵β細胞よりむしろ胎児あるいは新生児の膵β細胞と似ていることが報告されている7).そこで,ヒトのiPS細胞から分化させた膵β“様”細胞を用いてERRγによる機能的な代謝の成熟化について検討した.ヒトのiPS細胞から約21日の期間で約20%から70%の効率で膵β細胞に特異的な遺伝子を発現する膵β“様”細胞が分化したが,グルコースに対するインスリンの分泌応答はみられなかった.KClを用いて強制的に脱分極させるとインスリン分泌反答がみられたことから,細胞質およびミトコンドリアにおけるグルコース代謝の経路に異常があることが予想されたので,ERRγの強制発現による影響について調べた.アデノウイルスベクターを用いたERRγの強制発現は膵β細胞に特異的な遺伝子の発現には影響をあたえなかったが,酸素の消費,電子伝達系,アセチルCoA代謝経路といったミトコンドリアにおけるグルコースの代謝に特異的な遺伝子の発現を増強させた.ERRγを強制発現させた膵β“様”細胞においては,ミトコンドリアにおいて呼吸鎖が劇的に増強され,グルコース応答性のインスリンの分泌が認められた.また,ヒトのiPS細胞に由来する膵β“様”細胞においては,ヒトの初期の膵島と比較して,ミトコンドリア代謝経路に関与する遺伝子の発現が低く,乳酸の産生を担う乳酸デヒドロゲナーゼの発現が高かったが,ERRγを強制発現させた膵β“様”細胞においてはこれらの遺伝子の発現が初期の膵島と同等のレベルにまで改善された.これらの結果から,ヒトの未成熟な膵β“様”細胞において,ERRγはミトコンドリアにおける代謝の増強を介してグルコース応答性のインスリン分泌能の獲得および増強に寄与することを示唆された.
ERRγを強制発現させたヒトの膵β“様”細胞による1型糖尿病モデルマウスにおける血糖降下の作用について検討するため,ストレプトゾシンを用いて内在性の膵β細胞を除去した免疫不全マウスの腎臓被膜下に,ERRγを強制発現させた膵β“様”細胞を移植したところ,数週間以内に血糖値の降下が観察された.また,移植ののち2カ月の時点で約50%のマウスにおいて血糖値が非糖尿病レベルにまで低下し,それらのマウスにおいては生体へのグルコースの投与により,インスリンの分泌の程度を示す血中におけるヒトCペプチド値の有意な上昇がみられた.さらに,ERRγを強制発現させた膵β“様”細胞の移植により血糖値が非糖尿病レベルにまで改善した免疫不全を示す1型糖尿病モデルマウスにおいては,移植していない免疫不全を示す1型糖尿病モデルマウスに比べ,夜間のグルコース代謝の亢進をともなう糖代謝および脂質代謝の概日リズムが改善した.これらの結果から,代謝の成熟化したヒトの膵β“様”細胞は,1型糖尿病において血糖値を改善する作用のあることが示唆された.
この研究において,膵β細胞における機能的な代謝の成熟化の機構の一端が明らかにされた.膵β細胞はインスリンを産生して分泌し,生体のおおよそすべての臓器おける糖代謝および脂質代謝を包括的に制御する細胞であり,膵β細胞の機能の低下や数の減少は糖尿病の病態の発症の直接的な原因であることが知られている.そのため,多能性幹細胞からの機能的なヒトの膵β“様”細胞の大規模な作製は,インスリンに依存した状態の糖尿病における血糖値の安定化といった臨床への応用にくわえ,患者に特異的かつ効果的な創薬のスクリーニングや糖尿病の発症の機構の根本的な解明に有用であると考えられる.近年,多能性幹細胞からの機能的なヒトの膵β“様”細胞の大規模な作製は大きな成功をおさめつつあるが8,9),多能性幹細胞から作製された膵β“様”細胞はグルコースに対するインスリンの分泌応答が膵β細胞と比べゆるやかであることから,グルコースが代謝される過程の未成熟化が予想されており8),どのようにして膵β細胞と同じレベルにまで機能を成熟化させるかについては課題が多い.とりわけ,近年,従来の特異的な細胞分化にくわえ,出生ののちの機能的な成熟化が膵β細胞の機能に大きく寄与することが示唆されはじめている10-13).この研究により,ERRγを介した機能的な代謝の成熟化は多能性幹細胞から作製したヒトの膵β“様”細胞の機能に寄与することが示唆された.この結果から,従来の低分子化合物による膵β細胞への系統発生の特化および純化にくわえ,栄養,酸素,ホルモンによる機能的な代謝の成熟化がヒトの膵β細胞に近い膵β“様”細胞の作製のため考慮すべき課題となることが示唆された.また,今後,ERRγおよびその下流のシグナルの活性化されたヒトの膵β“様”細胞を精製することにより,ハイスループットな創薬スクリーニングにたえうる代謝活性をもつヒトの膵β“様”細胞の純化が可能になるかもしれない.
略歴:2011年 京都大学大学院生命科学研究科博士課程 修了,同年より米国Salk Institute for Biological StudiesにてResearch Associate.
研究テーマ:細胞および生体における代謝制御機構および病態発症機構.
抱負:ゆらぎにより形成される代謝制御機構から生命を理解したい.
© 2016 吉原 栄治 Licensed under CC 表示 2.1 日本
(米国Salk Institute for Biological Studies,Gene Expression Laboratory)
email:吉原栄治
DOI: 10.7875/first.author.2016.039
ERRγ is required for the metabolic maturation of therapeutically functional glucose-responsive β cells.
Eiji Yoshihara, Zong Wei, Chun Shi Lin, Sungsoon Fang, Maryam Ahmadian, Yasuyuki Kida, Tiffany Tseng, Yang Dai, Ruth T. Yu, Christopher Liddle, Annette R. Atkins, Michael Downes, Ronald M. Evans
Cell Metabolism, 23, 622-634 (2016)
要 約
膵β細胞は出生ののちの機能的な成熟化の過程をへてグルコースに応答性を示す機能的な膵β細胞になることが知られているが,その機構については不明な点が多い.筆者らは,マウスの新生仔および成体の膵島における遺伝子の発現を解析し,核内受容体ERRγおよびその下流のミトコンドリア代謝経路の発現が機能的な成熟化とともに亢進することを見い出した.膵β細胞に特異的なERRγノックアウトマウスの解析により,ERRγは膵β細胞においてグルコースによる酸化的リン酸化の上昇およびインスリンの分泌応答に関与する新規の転写因子であることが明らかにされた.また,ヒトのiPS細胞より分化させた膵β“様”細胞は,ヒトの新生児の膵β細胞と同様に,グルコースによるインスリンの分泌に不全を示すことが知られていたことから,ERRγの強制発現による影響について調べた.ERRγの強制発現はiPS細胞に由来する膵β“様”細胞において膵β細胞に特異的な遺伝子の発現には影響をあたえなかったが,乳酸の産生を担う乳酸デヒドロゲナーゼの発現の低下およびミトコンドリア代謝経路に関与する遺伝子の発現の上昇をともない,ミトコンドリアにおける呼吸鎖を劇的に増強させた.また,このとき,グルコースに対するインスリンの分泌応答もみられた.さらに,ERRγを強制発現させたヒトのiPS細胞に由来する膵β“様”細胞の移植は1型糖尿病モデルマウスの血糖値を改善したことから,ERRγによる機能的な代謝の成熟化は膵β細胞の機能に寄与することが示唆された.
はじめに
ヒトのiPS細胞からの,あるいは,ダイレクトリプログラミングによる機能的な分化細胞の作製は,不足する移植用の臓器の代用としてのみならず,ヒトの細胞機能や病態の解明および創薬のための材料となることが期待されている.しかし,生体外で分化させた細胞は,機能の面で初期の細胞より大きく劣ることが多い1,2).そこで,これまでのように細胞種に特異的な転写因子に着目した,どのようにして特異的な細胞種へと分化させるかという研究にくわえ,どのようにして機能的に成熟させるかという研究が注目されている.生体においては,細胞の機能的な成熟化は出生とともに増加する酸素や離乳の際の栄養代謝の変化による影響をうけた複雑な機構により制御されることが想像されるが,そのくわしい分子機構は明らかではない.とくに,膵β細胞においては,出生から成体への成長の過程において起こる機能的な成熟化にともないグルコースによるインスリンの分泌応答がいちじるしく強化されることが知られている3).筆者らは,この研究において,マウスの新生仔および成体より膵島を単離し遺伝子発現の制御機構を解析することにより膵β細胞における機能的な成熟化の過程の一端を解き明かすこと,さらに,得られた知見をもとに,ヒトのiPS細胞から生体外において分化させた膵β“様”細胞の機能の強化を目的とした.
1.マウスの膵島の機能的な成熟化はミトコンドリアにおける酸化的リン酸化の増強をともなう
出生ののちの膵β細胞の機能的な成熟化の機構について調べるため,2週齢の新生仔,および,6週齢および12週齢の成体のマウスの膵島における遺伝子の発現をRNA-seq法を用いて検討した.成体の膵島では,新生仔の膵島と比較して,細胞周期に関与する遺伝子の発現の顕著な低下が認められた一方,膵β細胞への分化に関与する遺伝子,および,ERRγ(estrogen receptor-related receptor γ,エストロゲン関連受容体γ)といった代謝を制御する転写因子をコードする遺伝子の発現の上昇が認められた.核内受容体であるERRγは,心筋や脳,また,褐色脂肪細胞といった代謝活性の高い臓器や,リプログラミングの際の一時的な代謝の活性化において,ミトコンドリアにおける代謝を制御することが知られている4,5).成体の膵島においては,糖代謝およびミトコンドリア代謝経路に関与する遺伝子の発現の上昇がみられた.モチーフ解析により,ミトコンドリア代謝経路に関与する遺伝子には,とくにERRγにより制御されるエストロゲン関連受容体応答配列を含むものが多くみられた.グルコースによるインスリンの分泌の促進は解糖系により産生されたピルビン酸が乳酸に変換されるのを最小限に抑え,ミトコンドリアにおいてATPの産生に利用されることにより最大のインスリンの分泌が達成されることが知られている6).これらの結果から,マウスの膵島の機能的な成熟化の過程において,膵β細胞への分化の成熟化にくわえ,解糖系およびミトコンドリアにおける酸化的リン酸化において機能的な代謝の成熟化が重要であることが推測された.
2.核内受容体ERRγはマウスの膵島の機能的な代謝の成熟化を制御する
定量PCR法による発現解析により,ERRγは肝臓,白色脂肪細胞,膵外分泌細胞に比べ,心臓や膵島において発現が高く,新生仔と比べ成体の膵β細胞により多く発現していることが明らかにされた.膵β細胞の機能的な成熟化におけるERRγの役割を検討するため,膵β細胞に特異的なERRγノックアウトマウス,および,膵臓に特異的なERRγノックアウトマウスを作製した.それらのノックアウトマウスは,通常食のもとインスリンの分泌の不全をともなう耐糖能の軽度の異常を示した.マウスでは離乳により膵β細胞の機能的な成熟化が促進され,離乳の直後における高脂肪食の負荷は膵β細胞のグルコースに対する増殖能およびインスリンの分泌応答を低下させることが報告されている.膵β細胞に特異的なERRγノックアウトマウスおよび膵臓に特異的なERRγノックアウトマウスは,離乳ののちの高脂肪食の負荷により,耐糖能のより強い異常を示した.単離された膵島において,ERRγの欠損により,グルコースに対する酸素の消費の増加およびそれに付随するインスリンの分泌は顕著に低下した.さらに,電子顕微鏡による観察により,膵β細胞に特異的なERRγノックアウトマウスの膵β細胞においては,ミトコンドリアの数に変化はなかったが,クリステ構造の消失などミトコンドリアの機能の不全を示唆する変化がみられた.そこで,RNA-Seq法により遺伝子の発現を調べたところ,膵β細胞に特異的なERRγノックアウトマウスの膵島においては,野生型のマウスと比較して,ATPの合成,酸化的リン酸化,分泌小胞による輸送といった膵β細胞の機能に重要な経路に異常のあることがGOオントロジー解析により明らかにされた.また,それらの経路は新生仔から成体への成長の過程において変化のみられる経路であった.これらの結果から,核内受容体ERRγが遺伝子発現制御を介して膵β細胞の機能的な代謝の成熟化に寄与することが示唆された(図1).
3.ヒトのiPS細胞に由来する膵β“様”細胞はERRγを介した機能的な代謝の成熟化により機能が増強される
ヒトの多能性幹細胞から分化されたインスリン産生細胞(膵β“様”細胞)は,その機能および遺伝子の発現において,成体の成熟した膵β細胞よりむしろ胎児あるいは新生児の膵β細胞と似ていることが報告されている7).そこで,ヒトのiPS細胞から分化させた膵β“様”細胞を用いてERRγによる機能的な代謝の成熟化について検討した.ヒトのiPS細胞から約21日の期間で約20%から70%の効率で膵β細胞に特異的な遺伝子を発現する膵β“様”細胞が分化したが,グルコースに対するインスリンの分泌応答はみられなかった.KClを用いて強制的に脱分極させるとインスリン分泌反答がみられたことから,細胞質およびミトコンドリアにおけるグルコース代謝の経路に異常があることが予想されたので,ERRγの強制発現による影響について調べた.アデノウイルスベクターを用いたERRγの強制発現は膵β細胞に特異的な遺伝子の発現には影響をあたえなかったが,酸素の消費,電子伝達系,アセチルCoA代謝経路といったミトコンドリアにおけるグルコースの代謝に特異的な遺伝子の発現を増強させた.ERRγを強制発現させた膵β“様”細胞においては,ミトコンドリアにおいて呼吸鎖が劇的に増強され,グルコース応答性のインスリンの分泌が認められた.また,ヒトのiPS細胞に由来する膵β“様”細胞においては,ヒトの初期の膵島と比較して,ミトコンドリア代謝経路に関与する遺伝子の発現が低く,乳酸の産生を担う乳酸デヒドロゲナーゼの発現が高かったが,ERRγを強制発現させた膵β“様”細胞においてはこれらの遺伝子の発現が初期の膵島と同等のレベルにまで改善された.これらの結果から,ヒトの未成熟な膵β“様”細胞において,ERRγはミトコンドリアにおける代謝の増強を介してグルコース応答性のインスリン分泌能の獲得および増強に寄与することを示唆された.
4.代謝の成熟化したヒトの膵β“様”細胞は免疫不全を示す1型糖尿病モデルマウスの血糖値を改善する
ERRγを強制発現させたヒトの膵β“様”細胞による1型糖尿病モデルマウスにおける血糖降下の作用について検討するため,ストレプトゾシンを用いて内在性の膵β細胞を除去した免疫不全マウスの腎臓被膜下に,ERRγを強制発現させた膵β“様”細胞を移植したところ,数週間以内に血糖値の降下が観察された.また,移植ののち2カ月の時点で約50%のマウスにおいて血糖値が非糖尿病レベルにまで低下し,それらのマウスにおいては生体へのグルコースの投与により,インスリンの分泌の程度を示す血中におけるヒトCペプチド値の有意な上昇がみられた.さらに,ERRγを強制発現させた膵β“様”細胞の移植により血糖値が非糖尿病レベルにまで改善した免疫不全を示す1型糖尿病モデルマウスにおいては,移植していない免疫不全を示す1型糖尿病モデルマウスに比べ,夜間のグルコース代謝の亢進をともなう糖代謝および脂質代謝の概日リズムが改善した.これらの結果から,代謝の成熟化したヒトの膵β“様”細胞は,1型糖尿病において血糖値を改善する作用のあることが示唆された.
おわりに
この研究において,膵β細胞における機能的な代謝の成熟化の機構の一端が明らかにされた.膵β細胞はインスリンを産生して分泌し,生体のおおよそすべての臓器おける糖代謝および脂質代謝を包括的に制御する細胞であり,膵β細胞の機能の低下や数の減少は糖尿病の病態の発症の直接的な原因であることが知られている.そのため,多能性幹細胞からの機能的なヒトの膵β“様”細胞の大規模な作製は,インスリンに依存した状態の糖尿病における血糖値の安定化といった臨床への応用にくわえ,患者に特異的かつ効果的な創薬のスクリーニングや糖尿病の発症の機構の根本的な解明に有用であると考えられる.近年,多能性幹細胞からの機能的なヒトの膵β“様”細胞の大規模な作製は大きな成功をおさめつつあるが8,9),多能性幹細胞から作製された膵β“様”細胞はグルコースに対するインスリンの分泌応答が膵β細胞と比べゆるやかであることから,グルコースが代謝される過程の未成熟化が予想されており8),どのようにして膵β細胞と同じレベルにまで機能を成熟化させるかについては課題が多い.とりわけ,近年,従来の特異的な細胞分化にくわえ,出生ののちの機能的な成熟化が膵β細胞の機能に大きく寄与することが示唆されはじめている10-13).この研究により,ERRγを介した機能的な代謝の成熟化は多能性幹細胞から作製したヒトの膵β“様”細胞の機能に寄与することが示唆された.この結果から,従来の低分子化合物による膵β細胞への系統発生の特化および純化にくわえ,栄養,酸素,ホルモンによる機能的な代謝の成熟化がヒトの膵β細胞に近い膵β“様”細胞の作製のため考慮すべき課題となることが示唆された.また,今後,ERRγおよびその下流のシグナルの活性化されたヒトの膵β“様”細胞を精製することにより,ハイスループットな創薬スクリーニングにたえうる代謝活性をもつヒトの膵β“様”細胞の純化が可能になるかもしれない.
文 献
- Fox, I. J., Daley, G. Q., Goldman, S. A. et al.: Use of differentiated pluripotent stem cells in replacement therapy for treating disease. Science, 345, 1247391 (2014)[PubMed]
- Xu, J., Du, Y. & Deng, H.: Direct lineage reprogramming: strategies, mechanisms, and applications. Cell Stem Cell 16, 119-134 (2015)[PubMed]
- Bliss, C. R. & Sharp, G. W.: Glucose-induced insulin release in islets of young rats: time-dependent potentiation and effects of 2-bromostearate. Am. J. Physiol., 263, E890-E896 (1992)[PubMed]
- Fan, W. & Evans, R.: PPARs and ERRs: molecular mediators of mitochondrial metabolism. Curr. Opin. Cell Biol., 33, 49-54 (2015)[PubMed]
- Kida, Y. S., Kawamura, T., Wei, Z. et al.: ERRs mediate a metabolic switch required for somatic cell reprogramming to pluripotency. Cell Stem Cell, 16, 547-555 (2015)[PubMed]
- Prentki, M., Matschinsky, F. M. & Madiraju, S. R.: Metabolic signaling in fuel-induced insulin secretion. Cell Metab., 18, 162-185 (2013)[PubMed]
- Hrvatin, S., O'Donnell, C. W., Deng, F. et al.: Differentiated human stem cells resemble fetal, not adult, β cells. Proc. Natl. Acad. Sci. USA, 111, 3038-3043 (2014)[PubMed]
- Rezania, A., Bruin, J. E., Arora, P. et al.: Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nat. Biotechnol., 32, 1121-1133 (2014)[PubMed]
- Pagliuca, F. W., Millman, J. R., Gurtler, M. et al.: Generation of functional human pancreatic β cells in vitro. Cell, 159, 428-439 (2014)[PubMed]
- Stolovich-Rain, M., Enk, J., Vikesa, J. et al.: Weaning triggers a maturation step of pancreatic β cells. Dev. Cell, 32, 535-545 (2015)[PubMed]
- Helman, A., Klochendler, A., Azazmeh, N. et al.: p16Ink4a-induced senescence of pancreatic beta cells enhances insulin secretion. Nat. Med., 22, 412-420 (2016)[PubMed]
- Jacovetti, C., Matkovich, S. J., Rodriguez-Trejo, A. et al.: Postnatal β-cell maturation is associated with islet-specific microRNA changes induced by nutrient shifts at weaning. Nat. Commun., 6, 8084 (2015)[PubMed]
- Dhawan, S., Tschen, S. I., Zeng, C. et al.: DNA methylation directs functional maturation of pancreatic β cells. J. Clin. Invest., 125, 2851-2860 (2015)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2011年 京都大学大学院生命科学研究科博士課程 修了,同年より米国Salk Institute for Biological StudiesにてResearch Associate.
研究テーマ:細胞および生体における代謝制御機構および病態発症機構.
抱負:ゆらぎにより形成される代謝制御機構から生命を理解したい.
© 2016 吉原 栄治 Licensed under CC 表示 2.1 日本