線虫の嗅覚可塑性はフェロモンシグナルによって制御されている
山田康嗣・飯野雄一
(東京大学大学院理学系研究科 生物化学専攻)
email:山田康嗣,飯野雄一
DOI: 10.7875/first.author.2010.041
Olfactory plasticity is regulated by pheromonal signaling in Caenorhabditis elegans.
Koji Yamada, Takaaki Hirotsu, Masahiro Matsuki, Rebecca A. Butcher, Masahiro Tomioka, Takeshi Ishihara, Jon Clardy, Hirofumi Kunitomo, Yuichi Iino
Science, 329, 1647-1650 (2010)
集団で生活する動物には個体群密度が高くなるとそれに応じて各個体が拡散する傾向が現れる.線虫は好きな匂いに対して誘引されるが,一定時間にわたって匂いに曝露されることによって同じ匂いを忌避するようになる.この嗅覚の可塑性が個体群密度により影響されることを発見した.個体群密度は仲間から放出されるフェロモンの量によって認識されていることがわかり,さらに詳細な分子機構を調べた.ペプチドであるSNET-1は嗅覚の可塑性を阻害し,その発現はフェロモンシグナルによって抑えられた.また,細胞外のペプチダーゼであるネプリライシンのホモログNEP-2がSNET-1の機能を抑えることが嗅覚の可塑性の現れるのに必要であった.これらの結果は,個体群密度がフェロモンシグナルとして伝えられ,生体内でペプチドシグナルが化学走性行動を制御していることを示唆した.
線虫Caenorhabditis elegansは成虫の体長が1 mmほどの土壌中に棲む動物である.302個のニューロンからなる神経系をもち,その接続はすべて明らかになっている.味,温度,匂いなどさまざまな外界の刺激を受容することから,化学走性を指標に神経や分子の機能が調べられてきた.
匂いへの応答はそのなかでもよく調べられてきた行動のひとつであり,一定時間の匂いへの曝露により化学走性の変化することが知られていた1,2).この嗅覚の可塑性は,旧来は嗅覚順応の結果ととらえられていた.しかしながら,曝露後の化学走性が誘引から忌避に変わること,餌の存在などほかの感覚ニューロンで受容された感覚情報により影響をうけることなどから3,4),近年では,連合学習としての側面もあるものと考えられている.このため,ここではまとめて嗅覚可塑性行動と表現している.筆者らは,嗅覚の可塑性が培養時に周囲に存在する仲間の数に影響をうけることを発見し,その背景に存在する分子機構について明らかにした.
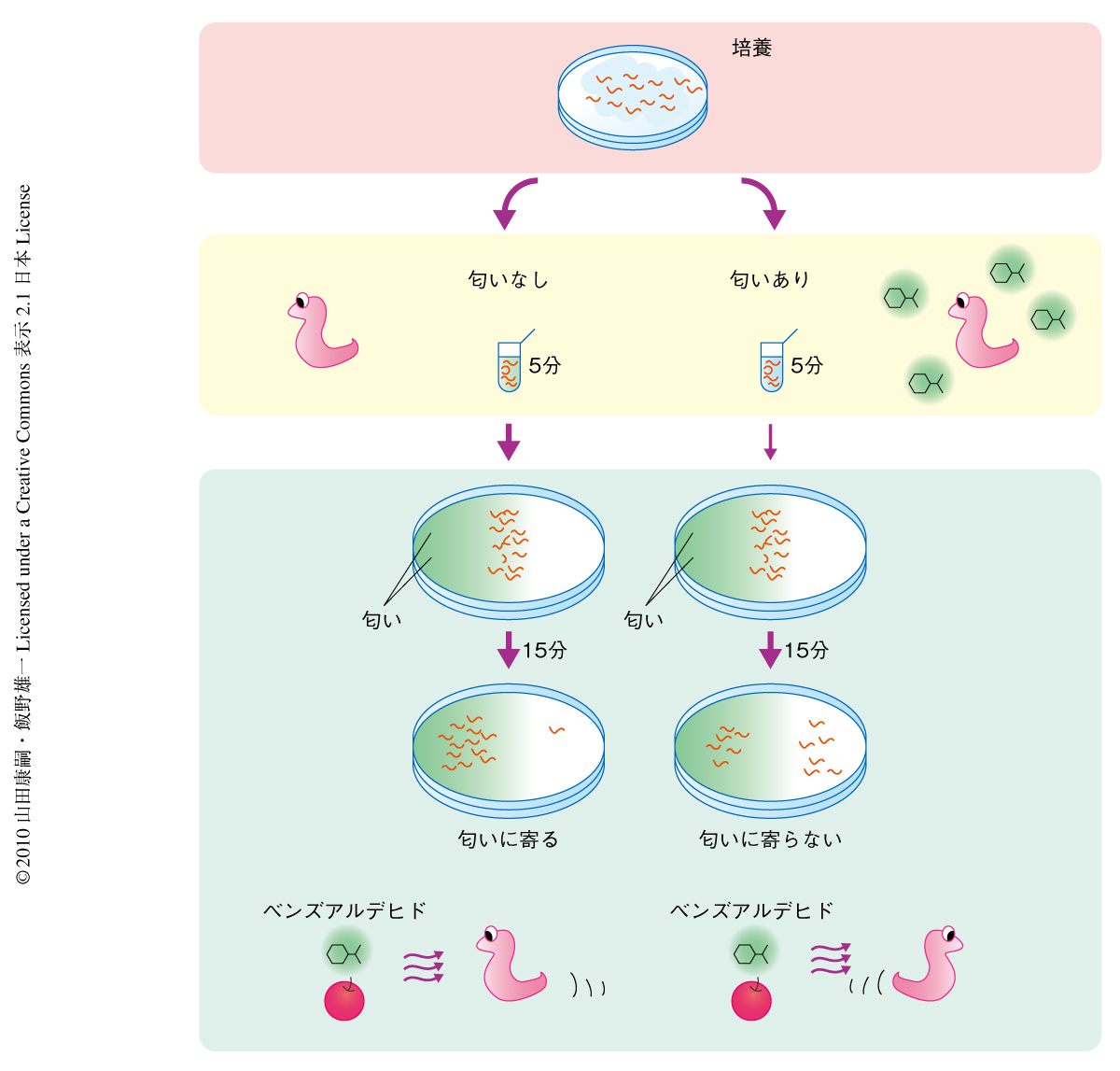
線虫はシャーレ内の寒天上で飼育されるが,この寒天上に線虫の好む匂い(この研究では,おもにベンズアルデヒドを匂いとして用いた)を置くとその匂いに近寄っていく化学走性がみられる.しかしながら,あらかじめその匂いを水溶液中で5分間嗅がせておくと匂いには寄らなくなる(図1).このような嗅覚可塑性の行動アッセイを行う際,培養時の個体群密度が低い場合にはあまり嗅覚の可塑性の現れないことを,筆者らは経験的に知っていた.あらためて調べてみると,実際に,個体群密度に応じて嗅覚の可塑性の大きさが変化し,個体群密度の低い場合はあらかじめ匂いを嗅がせておいても匂いに寄っていくことが観察された.線虫はアスカロシドという糖化合物をつねにフェロモンとして放出していて,このフェロモンの量により個体群密度を感じ幼虫期に耐性幼虫を形成するかどうかを判断している5).このため,嗅覚可塑性に対する個体群密度の影響も同様にフェロモンにより伝えられている可能性が考えられた.フェロモンを合成することができないdaf-22変異体は嗅覚の可塑性に異常があり,さらに,合成フェロモンを添加するとこの異常の回復することが確認された.以上のことから,個体群密度がフェロモンシグナルとして伝えられ嗅覚の可塑性が制御されていることが示唆された.
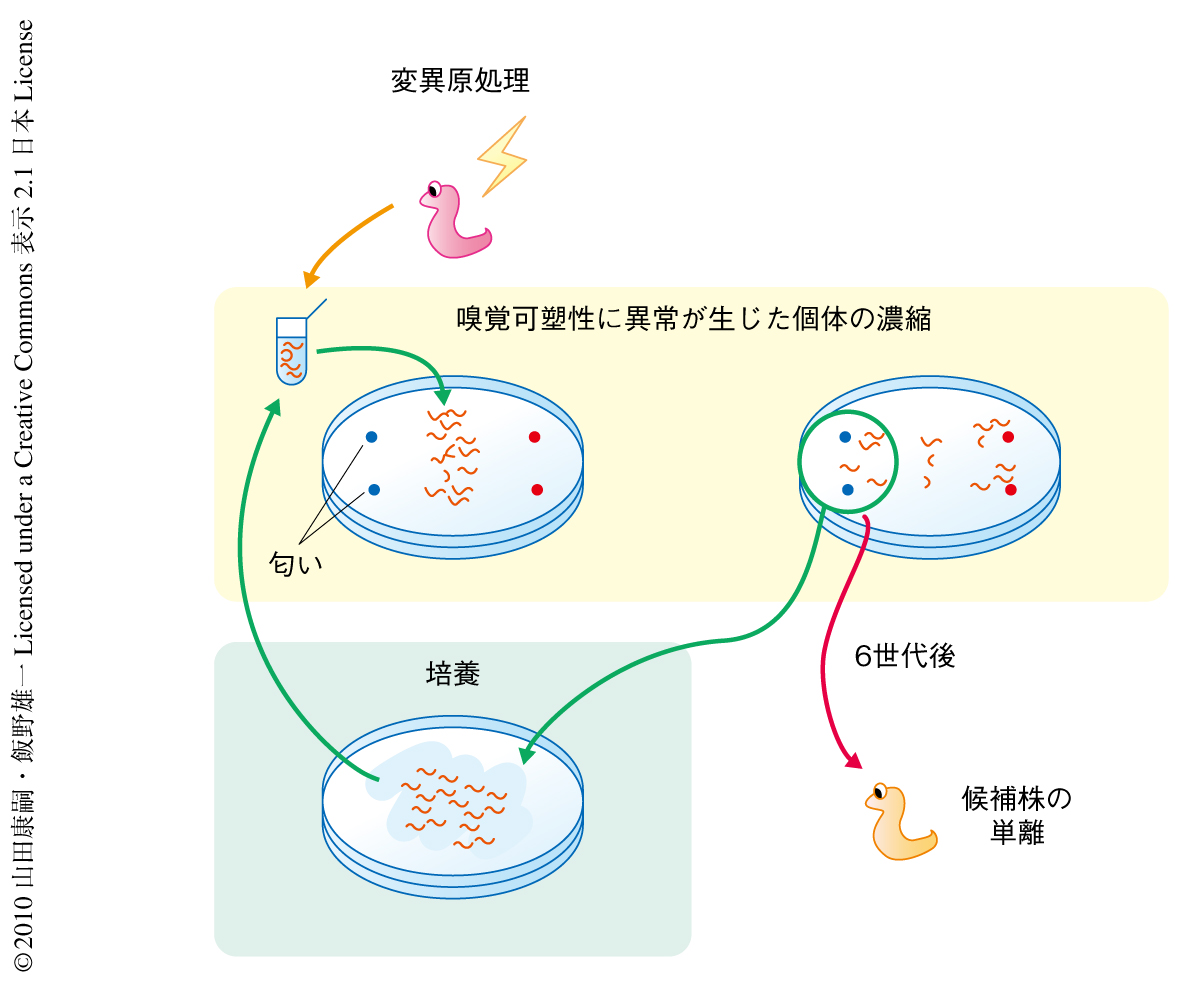
嗅覚の可塑性がフェロモンに影響される分子機構を調べるため,順遺伝学的な解析を行った.線虫は雌雄同体であり自家受精する.そのため,線虫の集団に対し変異原化学物質によって変異を導入すると,孫世代(F2世代)の集団のなかに同一の変異をホモにもつ個体が一定の割合で出現する.順遺伝学的な解析とは,このランダムに変異が導入された集団から目的の表現型を示す変異体を単離し,そののち,その表現型の原因となる変異を同定する手法である.この解析により現象に重要な遺伝子が無作為に同定できる.この研究では,嗅覚の可塑性が異常になった変異体を単離した.つまり,あらかじめ匂いを嗅がせていても依然として匂いに寄ってくる個体を濃縮し変異体として単離した(図2).そのうちのひとつについて同定した遺伝子nep-2は,哺乳類のネプリライシンと相同性のあるタンパク質をコードしていた.ネプリライシンは膜タンパク質であり,細胞外でペプチドを分解する酵素である6).nep-2遺伝子の産物であるタンパク質NEP-2はネプリライシンと全長にわたり非常によく似ており,ペプチダーゼとしてはたらく活性中心部分はとくによく保存されていた.このため,NEP-2もネプリライシンと同様に細胞外でペプチダーゼとしてはたらくことが予想された.nep-2遺伝子は筋肉やニューロンなどで発現しているが,蛍光タンパク質を融合させることによってNEP-2がそれらの細胞の表面に局在することを確認した.また,嗅覚可塑性の異常を示すnep-2変異体において,正常なnep-2遺伝子を一定数の細胞に発現させると,どの細胞に発現させても嗅覚の可塑性異常を回復した.つまり,NEP-2は特定の細胞で必要なわけではなかった.これらのことから,NEP-2がペプチドを分解する場合,その基質となるペプチドは体腔全体に広がっているホルモン様のペプチドであるものと予想された.
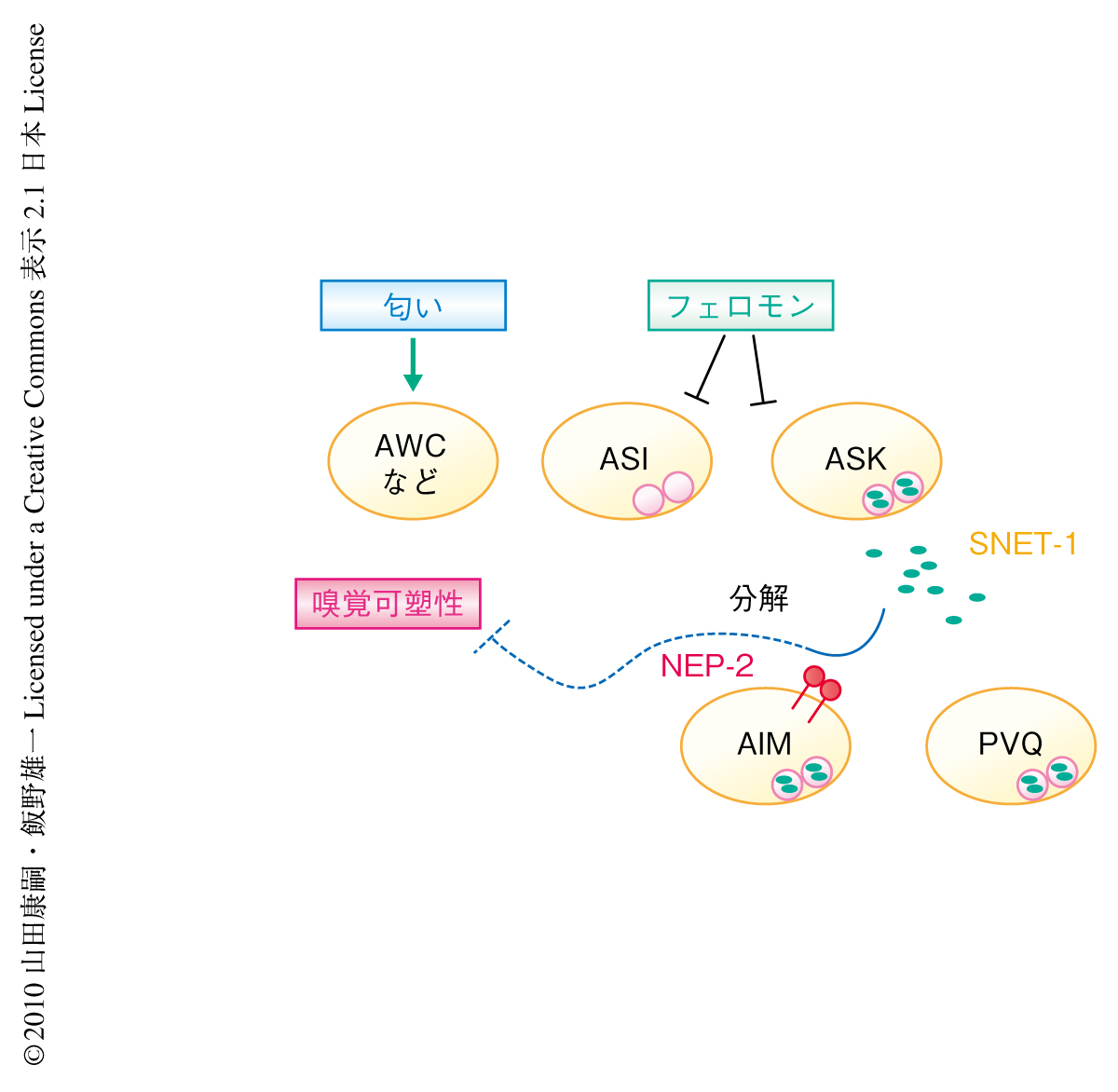
NEP-2の機能をさらにくわしく知るため,nep-2変異体の嗅覚可塑性の異常を抑圧する変異を順遺伝学的に獲得した.nep-2変異体ではNEP-2により本来は除去されるべきペプチドが分解されず蓄積していることが異常の原因となっている可能性があった.このとき,ペプチドをコードする遺伝子などが破壊されれば表現型がもとに戻るものと考えられる.さきほどの順遺伝学的なスクリーニングと同様に,今度はnep-2変異体に対して変異原処理を施し,嗅覚可塑性の異常が回復した抑圧変異体を単離した.この嗅覚可塑性異常の抑圧はC02F12.3遺伝子の欠失によることが確認され,この遺伝子をsnet-1(suppressor of nep two)と名づけた.snet-1遺伝子はアメフラシのペプチド前駆体であるL11前駆体と類似したタンパク質をコードしていた7).snet-1遺伝子に変異を導入することによりnep-2変異体の嗅覚可塑性の異常は野生型と同様の状態に回復するが,この二重変異体nep-2;snet-1に正常なsnet-1遺伝子を導入すると再び嗅覚可塑性の異常が生じた.さらに,snet-1遺伝子の各ドメインを欠失させたcDNAを発現させると,ペプチドとしてはたらくと考えられる保存された領域が残った場合に嗅覚の可塑性が阻害されることが確認された.また,蛍光タンパク質を融合させたSNET-1を発現させることによって,SNET-1がN末端に存在するシグナル配列により細胞外に放出されることを確認した.蛍光タンパク質をレポーターとして発現させることにより,snet-1遺伝子はASKニューロン,AIBニューロン,AIMニューロン,PVQニューロンなど,いくつかのニューロンで発現していることがわかった.さらに,そのいずれのニューロンで発現させても嗅覚可塑性における阻害効果を発揮することがわかった.これらの結果は,SNET-1が特定の細胞のあいだのシグナル伝達に必要なわけではなく,細胞から体腔に放出され,ホルモン様のペプチドとして分泌するニューロンとは直接的にシナプス接続していないニューロンにはたらきかけることのできることを意味した.nep-2遺伝子とsnet-1遺伝子の機能は逆向きであり,snet-1遺伝子の変異がnep-2遺伝子の変異による異常を完全に抑圧するという遺伝学的な関係から,NEP-2がSNET-1を分解することによってその機能を阻害していることが示唆された(図3).
SNET-1は嗅覚の可塑性を阻害する方向にはたらくが,野生型においてsnet-1遺伝子を過剰発現させるとそれだけで嗅覚の可塑性に異常の生じることがわかった.このことから,フェロモンによる嗅覚可塑性の制御がsnet-1遺伝子の発現量もしくはSNET-1の放出量の調整により介されている可能性が考えられた.snet-1遺伝子の発現量を定量リアルタイムPCRにより測定すると,フェロモンの合成できないdaf-22変異体では,フェロモンを外部から添加した場合に比べて,snet-1遺伝子の発現量が2倍程度に増加することが確認された.蛍光タンパク質レポーターの発現細胞を確認することにより,この発現量の増加はASIニューロンという1対の感覚ニューロンで新たにsnet-1遺伝子が発現するようになるためだとわかった.daf-22変異体には嗅覚の可塑性に異常があったが,daf-22;snet-1二重変異体とするとdaf-22変異体の嗅覚可塑性の異常が抑圧された.以上の結果から,フェロモンがsnet-1遺伝子の発現を抑えることによって嗅覚の可塑性の起こることが保障されていることが示唆された(図3).逆に,フェロモンの量が少ない条件下ではsnet-1遺伝子の発現量が増加し,放出されたSNET-1が嗅覚の可塑性を阻害するものと考えられた.
筆者らは,線虫における嗅覚の可塑性が周囲の個体群密度に影響されることを発見し,その具体的な分子機構の一端を明らかにした.線虫は餌の位置を知るための情報として匂いを利用しているものと考えられる.このため,この現象が実際の線虫にとってどのような意味があるのかを考察すると,個体群密度が大きいときには集合の原因となっている匂いからすみやかに拡散することができて,さまざまな場所での生存の可能性を探ることができるようになるものと理解できる.逆に,周囲の個体群密度が小さいときには餌場をみつけた場合にそれを独占できる可能性があり,そこにとどまることが生存の可能性を上げるだろう.このような個体群密度に依存した集合・拡散の分子機構はシミュレーションのうえでも種全体に対してメリットとなることが示されている8-10).
snet-1遺伝子のASIニューロンにおける発現量がフェロモンによって制御されることで嗅覚可塑性の制御につながることが示された.フェロモンによってASIニューロンにおける発現が影響をうける遺伝子はほかにもいくつか知られていて,SRBC-64/66というGタンパク質共役型受容体を介してフェロモンの情報が伝わりそれらの遺伝子の発現が制御されると報告されている11).しかしながら,SRBC-64/66は幼虫期での機能しかわかっておらず,成虫期に発現が制御されるsnet-1遺伝子はSRBC-64/66の機能には依存しないことがわかってきた.今後,snet-1遺伝子の発現がどのように制御されているのか,また,SNET-1がどのように嗅覚の可塑性を制御するかを明らかにすることが課題である.
略歴:2009年 東京大学大学院理学系研究科 修了,同年 同 博士研究員を経て,2010年より同 特任助教.
研究テーマ:線虫の行動,神経機能の順遺伝学的な解析.
抱負:線虫にも,神経にもこだわらずに,いろいろな研究に挑戦していきたい.
飯野 雄一(Yuichi Iino)
東京大学大学院理学系研究科 教授.
© 2010 山田康嗣・飯野雄一 Licensed under CC 表示 2.1 日本
(東京大学大学院理学系研究科 生物化学専攻)
email:山田康嗣,飯野雄一
DOI: 10.7875/first.author.2010.041
Olfactory plasticity is regulated by pheromonal signaling in Caenorhabditis elegans.
Koji Yamada, Takaaki Hirotsu, Masahiro Matsuki, Rebecca A. Butcher, Masahiro Tomioka, Takeshi Ishihara, Jon Clardy, Hirofumi Kunitomo, Yuichi Iino
Science, 329, 1647-1650 (2010)
要 約
集団で生活する動物には個体群密度が高くなるとそれに応じて各個体が拡散する傾向が現れる.線虫は好きな匂いに対して誘引されるが,一定時間にわたって匂いに曝露されることによって同じ匂いを忌避するようになる.この嗅覚の可塑性が個体群密度により影響されることを発見した.個体群密度は仲間から放出されるフェロモンの量によって認識されていることがわかり,さらに詳細な分子機構を調べた.ペプチドであるSNET-1は嗅覚の可塑性を阻害し,その発現はフェロモンシグナルによって抑えられた.また,細胞外のペプチダーゼであるネプリライシンのホモログNEP-2がSNET-1の機能を抑えることが嗅覚の可塑性の現れるのに必要であった.これらの結果は,個体群密度がフェロモンシグナルとして伝えられ,生体内でペプチドシグナルが化学走性行動を制御していることを示唆した.
はじめに
線虫Caenorhabditis elegansは成虫の体長が1 mmほどの土壌中に棲む動物である.302個のニューロンからなる神経系をもち,その接続はすべて明らかになっている.味,温度,匂いなどさまざまな外界の刺激を受容することから,化学走性を指標に神経や分子の機能が調べられてきた.
匂いへの応答はそのなかでもよく調べられてきた行動のひとつであり,一定時間の匂いへの曝露により化学走性の変化することが知られていた1,2).この嗅覚の可塑性は,旧来は嗅覚順応の結果ととらえられていた.しかしながら,曝露後の化学走性が誘引から忌避に変わること,餌の存在などほかの感覚ニューロンで受容された感覚情報により影響をうけることなどから3,4),近年では,連合学習としての側面もあるものと考えられている.このため,ここではまとめて嗅覚可塑性行動と表現している.筆者らは,嗅覚の可塑性が培養時に周囲に存在する仲間の数に影響をうけることを発見し,その背景に存在する分子機構について明らかにした.
1.線虫はフェロモンを介して周囲の個体群密度を認識し嗅覚行動を変化させる
線虫はシャーレ内の寒天上で飼育されるが,この寒天上に線虫の好む匂い(この研究では,おもにベンズアルデヒドを匂いとして用いた)を置くとその匂いに近寄っていく化学走性がみられる.しかしながら,あらかじめその匂いを水溶液中で5分間嗅がせておくと匂いには寄らなくなる(図1).このような嗅覚可塑性の行動アッセイを行う際,培養時の個体群密度が低い場合にはあまり嗅覚の可塑性の現れないことを,筆者らは経験的に知っていた.あらためて調べてみると,実際に,個体群密度に応じて嗅覚の可塑性の大きさが変化し,個体群密度の低い場合はあらかじめ匂いを嗅がせておいても匂いに寄っていくことが観察された.線虫はアスカロシドという糖化合物をつねにフェロモンとして放出していて,このフェロモンの量により個体群密度を感じ幼虫期に耐性幼虫を形成するかどうかを判断している5).このため,嗅覚可塑性に対する個体群密度の影響も同様にフェロモンにより伝えられている可能性が考えられた.フェロモンを合成することができないdaf-22変異体は嗅覚の可塑性に異常があり,さらに,合成フェロモンを添加するとこの異常の回復することが確認された.以上のことから,個体群密度がフェロモンシグナルとして伝えられ嗅覚の可塑性が制御されていることが示唆された.
2.ネプリライシンホモログNEP-2が嗅覚の可塑性に必要である
嗅覚の可塑性がフェロモンに影響される分子機構を調べるため,順遺伝学的な解析を行った.線虫は雌雄同体であり自家受精する.そのため,線虫の集団に対し変異原化学物質によって変異を導入すると,孫世代(F2世代)の集団のなかに同一の変異をホモにもつ個体が一定の割合で出現する.順遺伝学的な解析とは,このランダムに変異が導入された集団から目的の表現型を示す変異体を単離し,そののち,その表現型の原因となる変異を同定する手法である.この解析により現象に重要な遺伝子が無作為に同定できる.この研究では,嗅覚の可塑性が異常になった変異体を単離した.つまり,あらかじめ匂いを嗅がせていても依然として匂いに寄ってくる個体を濃縮し変異体として単離した(図2).そのうちのひとつについて同定した遺伝子nep-2は,哺乳類のネプリライシンと相同性のあるタンパク質をコードしていた.ネプリライシンは膜タンパク質であり,細胞外でペプチドを分解する酵素である6).nep-2遺伝子の産物であるタンパク質NEP-2はネプリライシンと全長にわたり非常によく似ており,ペプチダーゼとしてはたらく活性中心部分はとくによく保存されていた.このため,NEP-2もネプリライシンと同様に細胞外でペプチダーゼとしてはたらくことが予想された.nep-2遺伝子は筋肉やニューロンなどで発現しているが,蛍光タンパク質を融合させることによってNEP-2がそれらの細胞の表面に局在することを確認した.また,嗅覚可塑性の異常を示すnep-2変異体において,正常なnep-2遺伝子を一定数の細胞に発現させると,どの細胞に発現させても嗅覚の可塑性異常を回復した.つまり,NEP-2は特定の細胞で必要なわけではなかった.これらのことから,NEP-2がペプチドを分解する場合,その基質となるペプチドは体腔全体に広がっているホルモン様のペプチドであるものと予想された.
3.ペプチドSNET-1が嗅覚の可塑性を阻害する
NEP-2の機能をさらにくわしく知るため,nep-2変異体の嗅覚可塑性の異常を抑圧する変異を順遺伝学的に獲得した.nep-2変異体ではNEP-2により本来は除去されるべきペプチドが分解されず蓄積していることが異常の原因となっている可能性があった.このとき,ペプチドをコードする遺伝子などが破壊されれば表現型がもとに戻るものと考えられる.さきほどの順遺伝学的なスクリーニングと同様に,今度はnep-2変異体に対して変異原処理を施し,嗅覚可塑性の異常が回復した抑圧変異体を単離した.この嗅覚可塑性異常の抑圧はC02F12.3遺伝子の欠失によることが確認され,この遺伝子をsnet-1(suppressor of nep two)と名づけた.snet-1遺伝子はアメフラシのペプチド前駆体であるL11前駆体と類似したタンパク質をコードしていた7).snet-1遺伝子に変異を導入することによりnep-2変異体の嗅覚可塑性の異常は野生型と同様の状態に回復するが,この二重変異体nep-2;snet-1に正常なsnet-1遺伝子を導入すると再び嗅覚可塑性の異常が生じた.さらに,snet-1遺伝子の各ドメインを欠失させたcDNAを発現させると,ペプチドとしてはたらくと考えられる保存された領域が残った場合に嗅覚の可塑性が阻害されることが確認された.また,蛍光タンパク質を融合させたSNET-1を発現させることによって,SNET-1がN末端に存在するシグナル配列により細胞外に放出されることを確認した.蛍光タンパク質をレポーターとして発現させることにより,snet-1遺伝子はASKニューロン,AIBニューロン,AIMニューロン,PVQニューロンなど,いくつかのニューロンで発現していることがわかった.さらに,そのいずれのニューロンで発現させても嗅覚可塑性における阻害効果を発揮することがわかった.これらの結果は,SNET-1が特定の細胞のあいだのシグナル伝達に必要なわけではなく,細胞から体腔に放出され,ホルモン様のペプチドとして分泌するニューロンとは直接的にシナプス接続していないニューロンにはたらきかけることのできることを意味した.nep-2遺伝子とsnet-1遺伝子の機能は逆向きであり,snet-1遺伝子の変異がnep-2遺伝子の変異による異常を完全に抑圧するという遺伝学的な関係から,NEP-2がSNET-1を分解することによってその機能を阻害していることが示唆された(図3).
4.フェロモンによる嗅覚の可塑性の制御におけるSNET-1の機能
SNET-1は嗅覚の可塑性を阻害する方向にはたらくが,野生型においてsnet-1遺伝子を過剰発現させるとそれだけで嗅覚の可塑性に異常の生じることがわかった.このことから,フェロモンによる嗅覚可塑性の制御がsnet-1遺伝子の発現量もしくはSNET-1の放出量の調整により介されている可能性が考えられた.snet-1遺伝子の発現量を定量リアルタイムPCRにより測定すると,フェロモンの合成できないdaf-22変異体では,フェロモンを外部から添加した場合に比べて,snet-1遺伝子の発現量が2倍程度に増加することが確認された.蛍光タンパク質レポーターの発現細胞を確認することにより,この発現量の増加はASIニューロンという1対の感覚ニューロンで新たにsnet-1遺伝子が発現するようになるためだとわかった.daf-22変異体には嗅覚の可塑性に異常があったが,daf-22;snet-1二重変異体とするとdaf-22変異体の嗅覚可塑性の異常が抑圧された.以上の結果から,フェロモンがsnet-1遺伝子の発現を抑えることによって嗅覚の可塑性の起こることが保障されていることが示唆された(図3).逆に,フェロモンの量が少ない条件下ではsnet-1遺伝子の発現量が増加し,放出されたSNET-1が嗅覚の可塑性を阻害するものと考えられた.
おわりに
筆者らは,線虫における嗅覚の可塑性が周囲の個体群密度に影響されることを発見し,その具体的な分子機構の一端を明らかにした.線虫は餌の位置を知るための情報として匂いを利用しているものと考えられる.このため,この現象が実際の線虫にとってどのような意味があるのかを考察すると,個体群密度が大きいときには集合の原因となっている匂いからすみやかに拡散することができて,さまざまな場所での生存の可能性を探ることができるようになるものと理解できる.逆に,周囲の個体群密度が小さいときには餌場をみつけた場合にそれを独占できる可能性があり,そこにとどまることが生存の可能性を上げるだろう.このような個体群密度に依存した集合・拡散の分子機構はシミュレーションのうえでも種全体に対してメリットとなることが示されている8-10).
snet-1遺伝子のASIニューロンにおける発現量がフェロモンによって制御されることで嗅覚可塑性の制御につながることが示された.フェロモンによってASIニューロンにおける発現が影響をうける遺伝子はほかにもいくつか知られていて,SRBC-64/66というGタンパク質共役型受容体を介してフェロモンの情報が伝わりそれらの遺伝子の発現が制御されると報告されている11).しかしながら,SRBC-64/66は幼虫期での機能しかわかっておらず,成虫期に発現が制御されるsnet-1遺伝子はSRBC-64/66の機能には依存しないことがわかってきた.今後,snet-1遺伝子の発現がどのように制御されているのか,また,SNET-1がどのように嗅覚の可塑性を制御するかを明らかにすることが課題である.
文 献
- Colbert, H. A. & Bargmann, C. I: Odorant-specific adaptation pathways generate olfactory plasticity in C. elegans. Neuron, 14, 803-812 (1995)[PubMed]
- Hirotsu, T. & Iino, Y: Neural circuit-dependent odor adaptation in C. elegans is regulated by the Ras-MAPK pathway. Genes Cells, 10, 517-530 (2005)[PubMed]
- Law, E., Nuttley, W. M. & van der Kooy, D: Contextual taste cues modulate olfactory learning in C. elegans by an occasion-setting mechanism. Curr. Biol., 14, 1303-1308 (2004)[PubMed]
- Nuttley, W. M., Atkinson-Leadbeater, K. P. & Van Der Kooy, D: Serotonin mediates food-odor associative learning in the nematode Caenorhabditis elegans. Proc. Natl. Acad. Sci. USA, 99, 12449-12454 (2002)[PubMed]
- Butcher, R., Fujita, M., Schroeder, F. C. et al: Small-molecule pheromones that control dauer development in Caenorhabditis elegans. Nat. Chem. Biol., 3, 420-422 (2007)[PubMed]
- Iwata, N., Higuchi, M. & Saido, T: Metabolism of amyloid-β peptide and Alzheimer's disease. Pharmacol. Ther., 108, 129-148 (2005)[PubMed]
- Taussig, R., Kaldany, R. R. & Scheller, R. H: A cDNA clone encoding neuropeptides isolated from Aplysia neuron L11. Proc. Natl. Acad. Sci. USA, 81, 4988-4992 (1984)[PubMed]
- Travis, J. M. J., Murrell, D. J. & Dytham, C: Evolution of density-dependent dispersal. Proc. R. Soc. Lond. B., 266, 1837-1842 (1999)
- Poethke, H. & Hovestadt, T: Evolution of density- and patch-size-dependent dispersal rates. Proc. Biol. Sci., 269, 637-645 (2002)[PubMed]
- Bowler, D. & Benton, T: Causes and consequences of animal dispersal strategies: relating individual behaviour to spatial dynamics. Biol. Rev. Camb. Philos. Soc., 80, 205-225 (2005)[PubMed]
- Kim, K., Sato, K., Shibuya, M. et al: Two chemoreceptors mediate developmental effects of dauer pheromone in C. elegans. Science, 326, 994-998 (2009)[PubMed]
著者プロフィール
略歴:2009年 東京大学大学院理学系研究科 修了,同年 同 博士研究員を経て,2010年より同 特任助教.
研究テーマ:線虫の行動,神経機能の順遺伝学的な解析.
抱負:線虫にも,神経にもこだわらずに,いろいろな研究に挑戦していきたい.
飯野 雄一(Yuichi Iino)
東京大学大学院理学系研究科 教授.
© 2010 山田康嗣・飯野雄一 Licensed under CC 表示 2.1 日本