extendedシナプトタグミンによる細胞膜における脂質の恒常性の制御
佐伯恭範・Pietro De Camilli
(米国Yale School of Medicine,Department of Cell Biology)
email:佐伯恭範
DOI: 10.7875/first.author.2016.034
Control of plasma membrane lipid homeostasis by the extended synaptotagmins.
Yasunori Saheki, Xin Bian, Curtis M. Schauder, Yujin Sawaki, Michal A. Surma, Christian Klose, Frederic Pincet, Karin M. Reinisch, Pietro De Camilli
Nature Cell Biology, 18, 504-515 (2016)
細胞膜における脂質の組成は外的な要因やシグナル伝達により急激に変化し,そののち,脂質の組成の恒常性を維持する機構により通常の状態にもどることが知られているが,その分子機構についてはよくわかっていない.筆者らは,小胞体と細胞膜との接着タンパク質であるextendedシナプトタグミンがこの過程に関与することを示した.extendedシナプトタグミンは細胞膜のホスファチジルイノシトール4,5-ビスリン酸および細胞におけるCa2+の濃度に依存して小胞体と細胞膜とを接着する.in vitroにおいて,extendedシナプトタグミンはCa2+の濃度および脂質結合能のあるSMPドメインに依存してグリセロ脂質を輸送した.ゲノム編集によりextendedシナプトタグミンを欠損させた細胞株において,ホスファチジルイノシトール4,5-ビスリン酸の加水分解にともない産生されるジアセルグリセロールが細胞膜に蓄積した.これらの結果から,刺激によりホスファチジルイノシトール4,5-ビスリン酸の加水分解および細胞におけるCa2+濃度の上昇が亢進された状況において,extendedシナプトタグミンにより形成された小胞体と細胞膜との接着部位が細胞膜に蓄積したジアセルグリセロールを小胞体へと輸送することにより,細胞膜における脂質の組成の変化を通常の状態にもどすことが推測された.
小胞体はタンパク質の合成,Ca2+の貯蔵,脂質の合成など多様な機能をもち,小胞輸送により分泌系およびエンドサイトーシスにかかわるすべての生体膜と機能的に連携する.しかしながら,小胞体膜と融合するのは,小胞体膜どうし,あるいは,逆輸送にかかわるゴルジ体に由来する小胞の膜のみである.小胞体は細胞膜を含めほぼすべてのオルガネラと物理的な接着部位を形成している.近年の研究により,小胞体とこれらの生体膜との接着部位が,細胞におけるCa2+恒常性の制御,脂質などの物質交換,小胞体に局在する酵素によるもう一方の生体膜に存在する基質の制御など,生理学的に重要な役割をはたすことがわかってきた1-3).
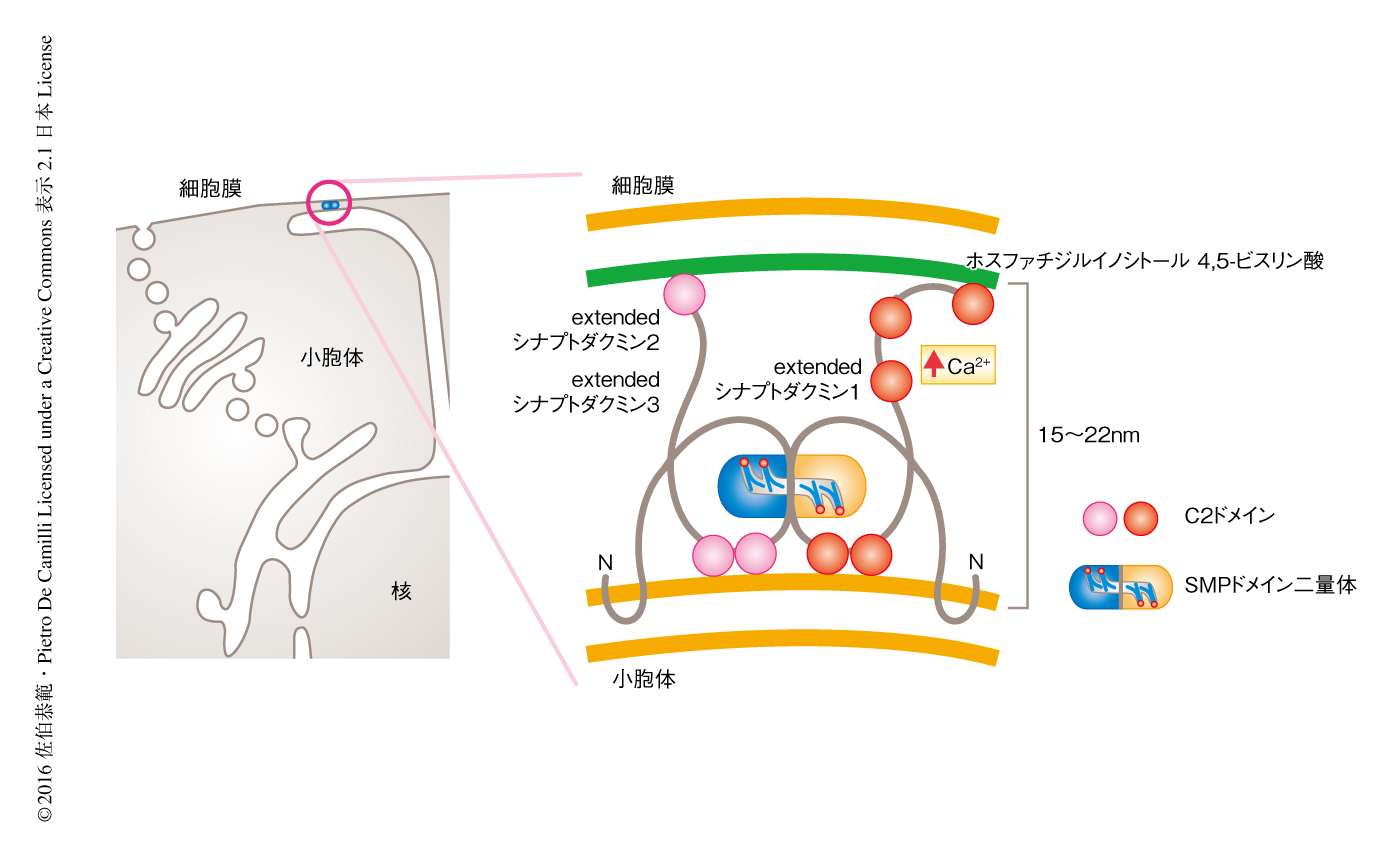
近年になり,種々のタンパク質が小胞体と細胞膜との接着に関与することが示唆されている.そのひとつがextendedシナプトタグミン(出芽酵母においては,tricalbins)である.extendedシナプトタグミン1,extendedシナプトタグミン2,extendedシナプトタグミン3はN末端側に疎水性領域,さらに,SMPドメイン,ホスホリン脂質に結合能のあるC2ドメインをもつ膜タンパク質であり,ホモ複合体およびヘテロ複合体を形成する.extendedシナプトタグミン複合体はその疎水性領域を小胞体膜にヘアピン状に挿入することにより小胞体に局在し,C2ドメインを介し細胞膜のホスファチジルイノシトール4,5-ビスリン酸と相互作用することにより小胞体と細胞膜とを接着する.さらに,extendedシナプトタグミン1のC2ドメインは細胞におけるCa2+濃度に依存して細胞膜と相互作用するため,extendedシナプトタグミン複合体は細胞におけるCa2+濃度に依存して小胞体と細胞膜との接着部位に局在しその接着を制御する4-6)(図1)
SMPドメインは脂質との結合能および脂質の輸送能をもつTULIPドメインスーパーファミリーに属する7).TULIPドメインスーパーファミリーにはSMPドメインやTULIPドメインなどが含まれ,TULIPドメインをもつタンパク質として高密度リポタンパク質と超低密度リポタンパク質とのあいだでコレステロールエステルの輸送をつかさどる細胞外タンパク質CETPがよく研究されている8,9).一方,SMPドメインを含むタンパク質は細胞の内部に局在し,その機能に関しては未知な点が多い.X線結晶構造解析により,extendedシナプトタグミンのSMPドメインは,疎水性領域をもつ細長いくぼみ(疎水性チャネル)をもつ90Åの筒状の構造をとる二量体であることが明らかにされた(図1).また,質量分析法を用いた結合脂質の同定により,SMPドメインは多種のグリセロリン脂質と非選択的に結合することが判明した10).
extendedシナプトタグミンの細胞における生理的な機能についてはよくわかっていない.SMPドメインの存在から,小胞体において合成された脂質の細胞膜への輸送,あるいは,細胞膜において産生された脂質代謝産物の小胞体への輸送にかかわることが考えられる.また,extendedシナプトタグミンによる生体膜の接着能は細胞におけるCa2+濃度に依存するので,刺激に依存して急激に変化する脂質の組成の変化に応じ,細胞膜における脂質の組成の恒常性を維持するのに重要な役割を担うのかもしれない.この研究においては,extendedシナプトタグミンの細胞膜における脂質の組成の制御に対する役割の解明を試みた.
これまで,extendedシナプトタグミンの局在は蛍光タンパク質あるいはタグとの融合タンパク質を過剰に発現させた系において解析されてきたが,内因性のextendedシナプトタグミンの局在については不明であった.内因性のextendedシナプトタグミンの局在を調べるため,extendedシナプトタグミン1に特異的な抗体を作製し,また,ゲノム編集を用いた相同組換えにより内因性のextendedシナプトタグミン1のN末端にGFPを融合させたHeLa細胞株を樹立した.これら抗体および細胞株を用いた実験により,extendedシナプトタグミンが内因性にホモ複合体およびヘテロ複合体を形成し,細胞におけるCa2+濃度に依存して小胞体と細胞膜との接着部位に局在することが再確認された.
in vitro再構築系を用いてextendedシナプトタグミンによる脂質の輸送能の確認を試みた.in vitro再構築には,蛍光色素NBDを頭部に結合させたホスファチジルエタロナミンを含む中性のドナーリポソーム,ホスファチジルイノシトール4,5-ビスリン酸およびホスファチジルセリンを含む酸性のアクセプターリポソーム,Hisタグを用い精製したN末端の疎水性領域を欠損させた可溶性extendedシナプトタグミン1を使用した.ドナーリポソームにNiを頭部に結合させたリン脂質を含有させることにより,Hisタグをもつ可溶性extendedシナプトタグミン1を膜に結合させた.NBD-ホスファチジルエタロナミンの蛍光はドナーリポソームにおいてはFRET(fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)により消光されているが,アクセプターリポソームに輸送されると蛍光強度が増加する.このin vitro再構築系を用いることにより,extendedシナプトタグミンがSMPドメイン,Ca2+濃度,脂質の濃度勾配に依存してNBD-ホスファチジルエタロナミンをドナーリポソームからアクセプターリポソームへと輸送することが示された.また,ドナーリポソームに色素を充填することにより,同様の実験系を用いてextendedシナプトタグミンは膜の融合をひき起こしてはいないことが示された.
これらの結果から,extendedシナプトタグミンが細胞の小胞体と細胞膜との接着部位において,細胞におけるCa2+濃度に依存してグリセロリン脂質の輸送にかかわることが強く示唆された.
細胞におけるextendedシナプトタグミンの機能について調べるため,ゲノム編集を用いてextendedシナプトタグミン1,extendedシナプトタグミン2,extendedシナプトタグミン3を欠損させたトリプルノックアウトHeLa細胞を作製した.以前のRNAi法を用いたトリプルノックダウン細胞4) と同様に,トリプルノックアウト細胞においては細胞におけるCa2+濃度に依存した小胞体と細胞膜との接着に異常がみられた.extendedシナプトタグミンによる細胞膜における脂質の組成の制御について調べるため,デキストランビーズを用いて細胞膜を効率的に分離する方法を用い,質量分析法により正常な細胞およびextendedシナプトタグミントリプルトリプルノックアウト細胞における脂質の組成を解析した.その結果,刺激のない定常の状態においては細胞膜におけるグリセロリン脂質の組成に大きな変化はみられなかった.in vitro再構築系においては,extendedシナプトタグミンの脂質の輸送能はCa2+濃度の上昇に依存して増強された.これらの観点から,extendedシナプトタグミンは細胞に刺激のくわわった際に細胞膜における脂質の組成の制御に関与することが示唆された.
extendedシナプトタグミンは細胞膜のホスファチジルイノシトール4,5-ビスリン酸に依存して小胞体と細胞膜との接着部位を形成する4).ホスホリパーゼCの活性化により細胞膜のホスファチジルイノシトール4,5-ビスリン酸は加水分解されるが,その量を維持する機構についてはよくわかっていない.そこで,extendedシナプトタグミンがホスファチジルイノシトール4,5-ビスリン酸のリサイクルに関与するかもしれないと考えた.しかしながら,ホスファチジルイノシトール4,5-ビスリン酸を感知する蛍光タンパク質を用いてその細胞膜における動態を調べたところ,extendedシナプトタグミンのトリプルノックアウト細胞における細胞膜のホスファチジルイノシトール4,5-ビスリン酸の動態には,正常な細胞と比べそれほどの変化はみられなかった.
ほかの可能性として,extendedシナプトタグミンがホスファチジルイノシトール4,5-ビスリン酸の代謝産物であるジアシルグリセロールの除去にかかわることが考えられた.細胞膜のジアシルグリセロールは通常の状態では非常に微量だが,刺激に依存して増加し,そののち,通常の状態にもどることが知られている11).ジアシルグリセロールを感知する蛍光タンパク質を用いて細胞膜における動態を調べた結果,ホスホリパーゼCに依存してホスファチジルイノシトール4,5-ビスリン酸の加水分解をひき起こし細胞におけるCa2+濃度を上昇させるヒスタミンによる刺激のもとにおいて,細胞膜へのジアシルグリセロールの蓄積がextendedシナプトタグミンのトリプルノックアウト細胞においては有意に長くつづいた.ホスファチジルイノシトール4,5-ビスリン酸はextendedシナプトタグミンの細胞膜へのリクルートに必要であるが,内因性のヒスタミン受容体への刺激のもとでは細胞膜のホスファチジルイノシトール4,5-ビスリン酸は枯渇しない.それゆえ,ヒスタミンによる刺激のもとでの細胞膜へのジアシルグリセロールの蓄積において,extendedシナプトタグミンは小胞体と細胞膜との接着部位に存在することが可能である.
Ca2+イオノフォアであるイオノマイシンを用いた実験においても同様の結果が得られた.extendedシナプトタグミンのトリプルノックアウト細胞におけるジアシルグリセロールの細胞膜への蓄積が長くつづくことは,extendedシナプトタグミンの再発現により消失した.また,この表現型はextendedシナプトタグミン複合体においてCa2+濃度への依存性に寄与するextendedシナプトタグミン1の再発現のみにより消失し,それには脂質輸送に関与するSMPドメインが必須であった.
これらの結果から,extendedシナプトタグミンがSMPドメインおよび細胞におけるCa2+濃度に依存して,細胞膜におけるジアシルグリセロールの動態にかかわることが強く示唆された.
in vitro再構築系を用いて,extendedシナプトタグミンがジアシルグリセロールを輸送する可能性の確認を試みた.ジアシルグリセロールは頭部をもたないことから蛍光色素による標識が困難であるため,トリチウムを用いて標識したジアシルグリセロールをin vitro再構築系に用いた.その結果,extendedシナプトタグミンがCa2+濃度およびSMPドメインに依存してジアシルグリセロールを輸送することが示された.
細胞膜からのジアシルグリセロールの除去の機構として,ジアシルグリセロールキナーゼによるホスファチジン酸への変換が知られている12).ホスホリパーゼCの活性化による細胞膜のホスファチジルイノシトール4,5-ビスリン酸の加水分解により産生されるジアシルグリセロールとホスファチジン酸により,脂質輸送タンパク質であるNir2が細胞膜にリクルートされホスファチジン酸の小胞体への輸送にかかわることが報告されている13).そこで,extendedシナプトタグミンとNir2とが協調することにより,細胞膜のホスファチジルイノシトール4,5-ビスリン酸の代謝産物の小胞体への輸送が促進されると考えた(図2).extendedシナプトタグミンによるジアシルグリセロールの除去について調べるため,ジアシルグリセロールのホスファチジン酸への変換をジアシルグリセロールキナーゼ阻害剤によりブロックし,細胞膜にジアシルグリセロールが蓄積する状態を強制的につくりだした.この状態において,Ca2+イオノフォアであるイオノマイシンによりextendedシナプトタグミンを小胞体と細胞膜との接着部位へとリクルートすると,細胞膜からジアシルグリセロールが除去された.この作用にはextendedシナプトタグミンのSMPドメインのもつ脂質結合能が必須であった.
extendedシナプトタグミンとNir2との細胞における協調について調べるため,extendedシナプトタグミンのトリプルノックアウト細胞においてNir2の動態を観察した.その結果,ノックアウト細胞においてはNir2の細胞膜へのリクルートは有意に長くつづいた.このことは,Nir2の細胞膜へのリクルートがジアシルグリセロールに依存することからも予測されたが,ジアシルグリセロールの動態に対するextendedシナプトタグミンとNir2との協調をさらに強く支持した.
この研究により,小胞体と細胞膜との接着タンパク質のひとつであるextendedシナプトタグミンの細胞における機能の一端が明らかにされた.第1に,extendedシナプトタグミンがSMPドメインを介し,脂質の頭部の構造に対し非選択的に,脂質の濃度勾配および細胞におけるCa2+濃度に依存して,グリセロリン脂質およびジアシルグリセロールの輸送に直接的にかかわることが,in vitro再構築系を用いて示された.第2に,extendedシナプトタグミンが細胞において細胞膜からのジアシルグリセロールの除去および小胞体への輸送に関与することを示唆された.第3に,extendedシナプトタグミンと脂質輸送タンパク質Nir2は細胞膜のホスファチジルイノシトール4,5-ビスリン酸の加水分解産物の動態に対し強く協調していることが示された(図2).
in vitroにおいてextendedシナプトタグミンはジアシルグリセロールのほかのグリセロリン脂質も輸送したことから,extendedシナプトタグミンの機能はジアシルグリセロールの輸送には限定されないと考えられた.また,ほかにも多く存在する脂質輸送タンパク質とextendedシナプトタグミンとが協調することが推測された.さまざまな脂質輸送タンパク質が小胞体と細胞膜との接着部位のほかにも多くある生体膜の接着部位においてどのように協調するかは,今後の研究課題であろう.
また,生体膜の接着部位の細胞種に特異的な機能に関しては不明な点が多い.脂質はニューロンにおいて神経伝達に重要なはたらきをもつ14).生体膜の接着部位のもつ機能の解明が神経疾患の病態の解明にも貢献すると考えられる.
略歴:2010年 米国Rockefeller大学大学院博士課程 修了,同年 米国Yale School of Medicineポスドクを経て,2016年よりシンガポールNanyang Technological University,Lee Kong Chian School of MedicineにてAssistant Professor.
研究テーマ:神経変性疾患の病態の機構.
抱負:基礎医学の観点から生物学の深みをみていきたい.ポスドクあるいは大学院プログラムに興味のある方はご連絡ください.
Pietro De Camilli
米国Yale School of MedicineにてProfessor.
研究室URL:https://medicine.yale.edu/lab/decamilli/
© 2016 佐伯恭範・Pietro De Camilli Licensed under CC 表示 2.1 日本
(米国Yale School of Medicine,Department of Cell Biology)
email:佐伯恭範
DOI: 10.7875/first.author.2016.034
Control of plasma membrane lipid homeostasis by the extended synaptotagmins.
Yasunori Saheki, Xin Bian, Curtis M. Schauder, Yujin Sawaki, Michal A. Surma, Christian Klose, Frederic Pincet, Karin M. Reinisch, Pietro De Camilli
Nature Cell Biology, 18, 504-515 (2016)
要 約
細胞膜における脂質の組成は外的な要因やシグナル伝達により急激に変化し,そののち,脂質の組成の恒常性を維持する機構により通常の状態にもどることが知られているが,その分子機構についてはよくわかっていない.筆者らは,小胞体と細胞膜との接着タンパク質であるextendedシナプトタグミンがこの過程に関与することを示した.extendedシナプトタグミンは細胞膜のホスファチジルイノシトール4,5-ビスリン酸および細胞におけるCa2+の濃度に依存して小胞体と細胞膜とを接着する.in vitroにおいて,extendedシナプトタグミンはCa2+の濃度および脂質結合能のあるSMPドメインに依存してグリセロ脂質を輸送した.ゲノム編集によりextendedシナプトタグミンを欠損させた細胞株において,ホスファチジルイノシトール4,5-ビスリン酸の加水分解にともない産生されるジアセルグリセロールが細胞膜に蓄積した.これらの結果から,刺激によりホスファチジルイノシトール4,5-ビスリン酸の加水分解および細胞におけるCa2+濃度の上昇が亢進された状況において,extendedシナプトタグミンにより形成された小胞体と細胞膜との接着部位が細胞膜に蓄積したジアセルグリセロールを小胞体へと輸送することにより,細胞膜における脂質の組成の変化を通常の状態にもどすことが推測された.
はじめに
小胞体はタンパク質の合成,Ca2+の貯蔵,脂質の合成など多様な機能をもち,小胞輸送により分泌系およびエンドサイトーシスにかかわるすべての生体膜と機能的に連携する.しかしながら,小胞体膜と融合するのは,小胞体膜どうし,あるいは,逆輸送にかかわるゴルジ体に由来する小胞の膜のみである.小胞体は細胞膜を含めほぼすべてのオルガネラと物理的な接着部位を形成している.近年の研究により,小胞体とこれらの生体膜との接着部位が,細胞におけるCa2+恒常性の制御,脂質などの物質交換,小胞体に局在する酵素によるもう一方の生体膜に存在する基質の制御など,生理学的に重要な役割をはたすことがわかってきた1-3).
近年になり,種々のタンパク質が小胞体と細胞膜との接着に関与することが示唆されている.そのひとつがextendedシナプトタグミン(出芽酵母においては,tricalbins)である.extendedシナプトタグミン1,extendedシナプトタグミン2,extendedシナプトタグミン3はN末端側に疎水性領域,さらに,SMPドメイン,ホスホリン脂質に結合能のあるC2ドメインをもつ膜タンパク質であり,ホモ複合体およびヘテロ複合体を形成する.extendedシナプトタグミン複合体はその疎水性領域を小胞体膜にヘアピン状に挿入することにより小胞体に局在し,C2ドメインを介し細胞膜のホスファチジルイノシトール4,5-ビスリン酸と相互作用することにより小胞体と細胞膜とを接着する.さらに,extendedシナプトタグミン1のC2ドメインは細胞におけるCa2+濃度に依存して細胞膜と相互作用するため,extendedシナプトタグミン複合体は細胞におけるCa2+濃度に依存して小胞体と細胞膜との接着部位に局在しその接着を制御する4-6)(図1)
SMPドメインは脂質との結合能および脂質の輸送能をもつTULIPドメインスーパーファミリーに属する7).TULIPドメインスーパーファミリーにはSMPドメインやTULIPドメインなどが含まれ,TULIPドメインをもつタンパク質として高密度リポタンパク質と超低密度リポタンパク質とのあいだでコレステロールエステルの輸送をつかさどる細胞外タンパク質CETPがよく研究されている8,9).一方,SMPドメインを含むタンパク質は細胞の内部に局在し,その機能に関しては未知な点が多い.X線結晶構造解析により,extendedシナプトタグミンのSMPドメインは,疎水性領域をもつ細長いくぼみ(疎水性チャネル)をもつ90Åの筒状の構造をとる二量体であることが明らかにされた(図1).また,質量分析法を用いた結合脂質の同定により,SMPドメインは多種のグリセロリン脂質と非選択的に結合することが判明した10).
extendedシナプトタグミンの細胞における生理的な機能についてはよくわかっていない.SMPドメインの存在から,小胞体において合成された脂質の細胞膜への輸送,あるいは,細胞膜において産生された脂質代謝産物の小胞体への輸送にかかわることが考えられる.また,extendedシナプトタグミンによる生体膜の接着能は細胞におけるCa2+濃度に依存するので,刺激に依存して急激に変化する脂質の組成の変化に応じ,細胞膜における脂質の組成の恒常性を維持するのに重要な役割を担うのかもしれない.この研究においては,extendedシナプトタグミンの細胞膜における脂質の組成の制御に対する役割の解明を試みた.
1.extendedシナプトタグミンの局在および脂質の輸送能
これまで,extendedシナプトタグミンの局在は蛍光タンパク質あるいはタグとの融合タンパク質を過剰に発現させた系において解析されてきたが,内因性のextendedシナプトタグミンの局在については不明であった.内因性のextendedシナプトタグミンの局在を調べるため,extendedシナプトタグミン1に特異的な抗体を作製し,また,ゲノム編集を用いた相同組換えにより内因性のextendedシナプトタグミン1のN末端にGFPを融合させたHeLa細胞株を樹立した.これら抗体および細胞株を用いた実験により,extendedシナプトタグミンが内因性にホモ複合体およびヘテロ複合体を形成し,細胞におけるCa2+濃度に依存して小胞体と細胞膜との接着部位に局在することが再確認された.
in vitro再構築系を用いてextendedシナプトタグミンによる脂質の輸送能の確認を試みた.in vitro再構築には,蛍光色素NBDを頭部に結合させたホスファチジルエタロナミンを含む中性のドナーリポソーム,ホスファチジルイノシトール4,5-ビスリン酸およびホスファチジルセリンを含む酸性のアクセプターリポソーム,Hisタグを用い精製したN末端の疎水性領域を欠損させた可溶性extendedシナプトタグミン1を使用した.ドナーリポソームにNiを頭部に結合させたリン脂質を含有させることにより,Hisタグをもつ可溶性extendedシナプトタグミン1を膜に結合させた.NBD-ホスファチジルエタロナミンの蛍光はドナーリポソームにおいてはFRET(fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)により消光されているが,アクセプターリポソームに輸送されると蛍光強度が増加する.このin vitro再構築系を用いることにより,extendedシナプトタグミンがSMPドメイン,Ca2+濃度,脂質の濃度勾配に依存してNBD-ホスファチジルエタロナミンをドナーリポソームからアクセプターリポソームへと輸送することが示された.また,ドナーリポソームに色素を充填することにより,同様の実験系を用いてextendedシナプトタグミンは膜の融合をひき起こしてはいないことが示された.
これらの結果から,extendedシナプトタグミンが細胞の小胞体と細胞膜との接着部位において,細胞におけるCa2+濃度に依存してグリセロリン脂質の輸送にかかわることが強く示唆された.
2.定常の状態における細胞膜の脂質の組成はextendedシナプトタグミンが存在しなくても大きくは変化しない
細胞におけるextendedシナプトタグミンの機能について調べるため,ゲノム編集を用いてextendedシナプトタグミン1,extendedシナプトタグミン2,extendedシナプトタグミン3を欠損させたトリプルノックアウトHeLa細胞を作製した.以前のRNAi法を用いたトリプルノックダウン細胞4) と同様に,トリプルノックアウト細胞においては細胞におけるCa2+濃度に依存した小胞体と細胞膜との接着に異常がみられた.extendedシナプトタグミンによる細胞膜における脂質の組成の制御について調べるため,デキストランビーズを用いて細胞膜を効率的に分離する方法を用い,質量分析法により正常な細胞およびextendedシナプトタグミントリプルトリプルノックアウト細胞における脂質の組成を解析した.その結果,刺激のない定常の状態においては細胞膜におけるグリセロリン脂質の組成に大きな変化はみられなかった.in vitro再構築系においては,extendedシナプトタグミンの脂質の輸送能はCa2+濃度の上昇に依存して増強された.これらの観点から,extendedシナプトタグミンは細胞に刺激のくわわった際に細胞膜における脂質の組成の制御に関与することが示唆された.
3.extendedシナプトタグミンのノックアウト細胞においてはホスホリパーゼCの活性化のもとでの細胞膜へのジアシルグリセロールの蓄積が長くつづく
extendedシナプトタグミンは細胞膜のホスファチジルイノシトール4,5-ビスリン酸に依存して小胞体と細胞膜との接着部位を形成する4).ホスホリパーゼCの活性化により細胞膜のホスファチジルイノシトール4,5-ビスリン酸は加水分解されるが,その量を維持する機構についてはよくわかっていない.そこで,extendedシナプトタグミンがホスファチジルイノシトール4,5-ビスリン酸のリサイクルに関与するかもしれないと考えた.しかしながら,ホスファチジルイノシトール4,5-ビスリン酸を感知する蛍光タンパク質を用いてその細胞膜における動態を調べたところ,extendedシナプトタグミンのトリプルノックアウト細胞における細胞膜のホスファチジルイノシトール4,5-ビスリン酸の動態には,正常な細胞と比べそれほどの変化はみられなかった.
ほかの可能性として,extendedシナプトタグミンがホスファチジルイノシトール4,5-ビスリン酸の代謝産物であるジアシルグリセロールの除去にかかわることが考えられた.細胞膜のジアシルグリセロールは通常の状態では非常に微量だが,刺激に依存して増加し,そののち,通常の状態にもどることが知られている11).ジアシルグリセロールを感知する蛍光タンパク質を用いて細胞膜における動態を調べた結果,ホスホリパーゼCに依存してホスファチジルイノシトール4,5-ビスリン酸の加水分解をひき起こし細胞におけるCa2+濃度を上昇させるヒスタミンによる刺激のもとにおいて,細胞膜へのジアシルグリセロールの蓄積がextendedシナプトタグミンのトリプルノックアウト細胞においては有意に長くつづいた.ホスファチジルイノシトール4,5-ビスリン酸はextendedシナプトタグミンの細胞膜へのリクルートに必要であるが,内因性のヒスタミン受容体への刺激のもとでは細胞膜のホスファチジルイノシトール4,5-ビスリン酸は枯渇しない.それゆえ,ヒスタミンによる刺激のもとでの細胞膜へのジアシルグリセロールの蓄積において,extendedシナプトタグミンは小胞体と細胞膜との接着部位に存在することが可能である.
Ca2+イオノフォアであるイオノマイシンを用いた実験においても同様の結果が得られた.extendedシナプトタグミンのトリプルノックアウト細胞におけるジアシルグリセロールの細胞膜への蓄積が長くつづくことは,extendedシナプトタグミンの再発現により消失した.また,この表現型はextendedシナプトタグミン複合体においてCa2+濃度への依存性に寄与するextendedシナプトタグミン1の再発現のみにより消失し,それには脂質輸送に関与するSMPドメインが必須であった.
これらの結果から,extendedシナプトタグミンがSMPドメインおよび細胞におけるCa2+濃度に依存して,細胞膜におけるジアシルグリセロールの動態にかかわることが強く示唆された.
4.extendedシナプトタグミンはin vitro再構築系においてジアシルグリセロールの輸送能を示す
in vitro再構築系を用いて,extendedシナプトタグミンがジアシルグリセロールを輸送する可能性の確認を試みた.ジアシルグリセロールは頭部をもたないことから蛍光色素による標識が困難であるため,トリチウムを用いて標識したジアシルグリセロールをin vitro再構築系に用いた.その結果,extendedシナプトタグミンがCa2+濃度およびSMPドメインに依存してジアシルグリセロールを輸送することが示された.
5.extendedシナプトタグミンの小胞体と細胞膜との接着部位への局在は細胞膜におけるジアシルグリセロールの除去にかかわる
細胞膜からのジアシルグリセロールの除去の機構として,ジアシルグリセロールキナーゼによるホスファチジン酸への変換が知られている12).ホスホリパーゼCの活性化による細胞膜のホスファチジルイノシトール4,5-ビスリン酸の加水分解により産生されるジアシルグリセロールとホスファチジン酸により,脂質輸送タンパク質であるNir2が細胞膜にリクルートされホスファチジン酸の小胞体への輸送にかかわることが報告されている13).そこで,extendedシナプトタグミンとNir2とが協調することにより,細胞膜のホスファチジルイノシトール4,5-ビスリン酸の代謝産物の小胞体への輸送が促進されると考えた(図2).extendedシナプトタグミンによるジアシルグリセロールの除去について調べるため,ジアシルグリセロールのホスファチジン酸への変換をジアシルグリセロールキナーゼ阻害剤によりブロックし,細胞膜にジアシルグリセロールが蓄積する状態を強制的につくりだした.この状態において,Ca2+イオノフォアであるイオノマイシンによりextendedシナプトタグミンを小胞体と細胞膜との接着部位へとリクルートすると,細胞膜からジアシルグリセロールが除去された.この作用にはextendedシナプトタグミンのSMPドメインのもつ脂質結合能が必須であった.
extendedシナプトタグミンとNir2との細胞における協調について調べるため,extendedシナプトタグミンのトリプルノックアウト細胞においてNir2の動態を観察した.その結果,ノックアウト細胞においてはNir2の細胞膜へのリクルートは有意に長くつづいた.このことは,Nir2の細胞膜へのリクルートがジアシルグリセロールに依存することからも予測されたが,ジアシルグリセロールの動態に対するextendedシナプトタグミンとNir2との協調をさらに強く支持した.
おわりに
この研究により,小胞体と細胞膜との接着タンパク質のひとつであるextendedシナプトタグミンの細胞における機能の一端が明らかにされた.第1に,extendedシナプトタグミンがSMPドメインを介し,脂質の頭部の構造に対し非選択的に,脂質の濃度勾配および細胞におけるCa2+濃度に依存して,グリセロリン脂質およびジアシルグリセロールの輸送に直接的にかかわることが,in vitro再構築系を用いて示された.第2に,extendedシナプトタグミンが細胞において細胞膜からのジアシルグリセロールの除去および小胞体への輸送に関与することを示唆された.第3に,extendedシナプトタグミンと脂質輸送タンパク質Nir2は細胞膜のホスファチジルイノシトール4,5-ビスリン酸の加水分解産物の動態に対し強く協調していることが示された(図2).
in vitroにおいてextendedシナプトタグミンはジアシルグリセロールのほかのグリセロリン脂質も輸送したことから,extendedシナプトタグミンの機能はジアシルグリセロールの輸送には限定されないと考えられた.また,ほかにも多く存在する脂質輸送タンパク質とextendedシナプトタグミンとが協調することが推測された.さまざまな脂質輸送タンパク質が小胞体と細胞膜との接着部位のほかにも多くある生体膜の接着部位においてどのように協調するかは,今後の研究課題であろう.
また,生体膜の接着部位の細胞種に特異的な機能に関しては不明な点が多い.脂質はニューロンにおいて神経伝達に重要なはたらきをもつ14).生体膜の接着部位のもつ機能の解明が神経疾患の病態の解明にも貢献すると考えられる.
文 献
- Stefan, C. J., Manford, A. G. & Emr, S. D.: ER-PM connections: sites of information transfer and inter-organelle communication. Curr. Opin. Cell Biol., 25, 434-442 (2013)[PubMed]
- Prinz, W. A.: Bridging the gap: membrane contact sites in signaling, metabolism, and organelle dynamics. J. Cell Biol., 205, 759-769 (2014)[PubMed]
- Mesmin, B. & Antonny, B.: The counterflow transport of sterols and PI4P. Biochim Biophys. Acta, 1861, 940-951 (2016)[PubMed]
- Giordano, F., Saheki, Y., Idevall-Hagren, O. et al.: PI(4,5)P2-dependent and Ca2+-regulated ER-PM interactions mediated by the extended synaptotagmins. Cell, 153, 1494-1509 (2013)[PubMed] [新着論文レビュー]
- Fernandez-Busnadiego, R., Saheki, Y. & De Camilli, P.: Three-dimensional architecture of extended synaptotagmin-mediated endoplasmic reticulum-plasma membrane contact sites. Proc. Natl. Acad. Sci. USA, 112, E2004-E2013 (2015)[PubMed]
- Idevall-Hagren, O., Lu, A., Xie, B. et al.: Triggered Ca2+ influx is required for extended synaptotagmin 1-induced ER-plasma membrane tethering. EMBO J., 34, 2291-2305 (2015)[PubMed]
- Reinisch, K. M. & De Camilli, P.: SMP-domain proteins at membrane contact sites: structure and function. Biochim. Biophys. Acta, 1861, 924-927 (2016)[PubMed]
- Beamer, L. J., Carroll, S. F. & Eisenberg, D.: Crystal structure of human BPI and two bound phospholipids at 2.4 angstrom resolution. Science, 276, 1861-1864 (1997)[PubMed]
- Qiu, X., Mistry, A., Ammirati, M. J. et al.: Crystal structure of cholesteryl ester transfer protein reveals a long tunnel and four bound lipid molecules. Nat. Struct. Mol. Biol., 14, 106-113 (2007)[PubMed]
- Schauder, C. M., Wu, X., Saheki, Y. et al.: Structure of a lipid-bound extended synaptotagmin indicates a role in lipid transfer. Nature, 510, 552-555 (2014)[PubMed]
- Willars, G. B., Nahorski, S. R. & Challiss, R. A.: Differential regulation of muscarinic acetylcholine receptor-sensitive polyphosphoinositide pools and consequences for signaling in human neuroblastoma cells. J. Biol. Chem., 273, 5037-5046 (1998)[PubMed]
- Merida, I., Avila-Flores, A. & Merino, E.: Diacylglycerol kinases: at the hub of cell signalling. Biochem. J., 409, 1-18 (2008)[PubMed]
- Kim, Y. J., Guzman-Hernandez, M. L., Wisniewski, E. et al.: Phosphatidylinositol-phosphatidic acid exchange by Nir2 at ER-PM contact sites maintains phosphoinositide signaling competence. Dev. Cell, 33, 549-561 (2015)[PubMed]
- Saheki, Y. & De Camilli, P.: Synaptic vesicle endocytosis. Cold Spring Harb. Perspect. Biol., 4, a005645 (2012)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2010年 米国Rockefeller大学大学院博士課程 修了,同年 米国Yale School of Medicineポスドクを経て,2016年よりシンガポールNanyang Technological University,Lee Kong Chian School of MedicineにてAssistant Professor.
研究テーマ:神経変性疾患の病態の機構.
抱負:基礎医学の観点から生物学の深みをみていきたい.ポスドクあるいは大学院プログラムに興味のある方はご連絡ください.
Pietro De Camilli
米国Yale School of MedicineにてProfessor.
研究室URL:https://medicine.yale.edu/lab/decamilli/
© 2016 佐伯恭範・Pietro De Camilli Licensed under CC 表示 2.1 日本