ヒトのES細胞およびiPS細胞の生存におけるグルタミンの代謝の役割
遠山周吾・福田恵一
(慶應義塾大学医学部 内科学教室循環器内科)
email:遠山周吾,福田恵一
DOI: 10.7875/first.author.2016.033
Glutamine oxidation is indispensable for survival of human pluripotent stem cells.
Shugo Tohyama, Jun Fujita, Takako Hishiki, Tomomi Matsuura, Fumiyuki Hattori, Rei Ohno, Hideaki Kanazawa, Tomohisa Seki, Kazuaki Nakajima, Yoshikazu Kishino, Marina Okada, Akinori Hirano, Takuya Kuroda, Satoshi Yasuda, Yoji Sato, Shinsuke Yuasa, Motoaki Sano, Makoto Suematsu, Keiichi Fukuda
Cell Metabolism, 23, 663-674 (2016)
ヒトのES細胞およびiPS細胞におけるエネルギー代謝はおもにグルコースの代謝に依存することが知られているが,アミノ酸の役割に関する報告は少ない.筆者らは,ヒトのES細胞およびiPS細胞におけるアミノ酸の代謝を解析することにより,グルタミンが重要な役割を担うことを明らかにした.ヒトのES細胞およびiPS細胞をグルコースおよびグルタミンを除去した条件において培養した場合,グルコースのみを除去した場合に比べ,ATPが短時間で著明に低下しすみやかに死滅した.また,メタボローム解析により,ヒトのES細胞およびiPS細胞はピルビン酸ではなくグルタミンを効率よく利用してATPを合成していることがわかった.その原因として,ヒトのES細胞およびiPS細胞において,アコニターゼ2およびイソクエン酸脱水素酵素2/3の発現が著明に低下していることが示唆された.一方,心筋細胞は乳酸を効率よく利用することにより生存が可能であることがわかった.この代謝の特性を利用することにより,未分化な幹細胞を完全に除去した安全性の高い心筋細胞を作製することが可能となり,今後の再生医療の実現に貢献することが期待される.
ヒトのES細胞およびiPS細胞は再生医療における魅力的な細胞源であるが,これらの細胞の特性および性質は完全には解明されていない.ES細胞およびiPS細胞におけるエネルギーの産生は解糖系に依存することが報告されている1,2).また,ペントースリン酸回路,核酸合成系,アミノ酸合成系といった代謝経路も活性化しており,細胞が増殖するために重要な代謝機構をもつ2).一方,ES細胞およびiPS細胞とアミノ酸の代謝との関係に関する報告は少ない.マウスのES細胞はスレオニンの代謝に,ヒトのES細胞およびiPS細胞はメチオニンの代謝に依存しており,スレオニンやメチオニンが枯渇するとS-アデノシルメチオニンの産生が減少し,ヒストンH3のLys4のトリメチル化が阻害されることにより多能性の維持の異常や細胞死につながることが報告されている3,4).また,ナイーブ型マウスのES細胞において,2-オキソグルタル酸がヒストンの脱メチル化を介し多能性の維持に重要な役割を担うことが報告されている5).しかし,ヒトのES細胞およびiPS細胞,また,それから分化した細胞におけるアミノ酸の代謝の役割についてはほとんど知られていない.
筆者らは,ヒトのES細胞およびiPS細胞におけるアミノ酸の代謝を詳細に解析することにより,ヒトのES細胞およびiPS細胞から心筋細胞へと分化したさまざまな細胞の集団から腫瘍の形成の原因となる未分化な幹細胞6) を完全に除去する培養条件の確立をめざした.
ヒトのES細胞およびiPS細胞の生存において重要なアミノ酸が同定するため,ヒトのES細胞において,おのおののアミノ酸の消費量を分析した.必須アミノ酸ではメチオニンおよびトリプトファンの消費が高く,非必須アミノ酸ではセリン,グルタミン,アルギニン,シスチンの消費が高かった.必須アミノ酸とは異なり,非必須アミノ酸は細胞において新たに合成することができ,その必要性は細胞種により異なるため,非必須アミノ酸に着目した.
消費の活発な非必須アミノ酸であるセリン,アルギニン,シスチン,グルタミンのヒトのES細胞およびiPS細胞の生存における役割を明らかにするため,グルコースの存在下あるいは非存在下にくわえて,非必須アミノ酸の除去を組み合わせた際のヒトのES細胞およびiPS細胞の生存率を評価した.その結果,ヒトのES細胞およびiPS細胞はグルコースおよびグルタミンを除去した条件においてもっとも短時間で死滅した.
ヒトのES細胞およびiPS細胞においてグルタミンがどのように代謝されるかを評価するため,メタボローム解析を行った.その結果,TCA回路を前半のアセチルCoA~2-オキソグルタル酸と,後半のスクシニルCoA~オキサロ酢酸とに分けた際に,後半の中間代謝産物であるコハク酸,フマル酸,リンゴ酸はグルコースの有無にかかわらずグルタミンを除去した条件において有意に減少した.この結果から,TCA回路の後半の中間代謝産物はグルコースではなくグルタミンに依存していることが予想された.また,グルタミンを除去した条件において還元型グルタチオンやATPが著明に減少した.さらに,安定同位体により標識したグルコースおよびグルタミンを用いたメタボローム解析により,TCA回路の後半の中間代謝産物はグルコースではではなくグルタミンに依存することが確認された.
ヒトのES細胞においてミトコンドリア呼吸の指標である酸素消費速度を測定したところ,グルコースの有無にかかわらずグルタミンを添加した条件において有意に高かった.また,グルタミンを除去した条件においては,グルコースの存在下に比べグルコースの非存在下において高い傾向にあった.これらの結果から,ヒトのES細胞はグルコースの存在しないときにはグルタミンの代謝を活性化させることが示唆された.
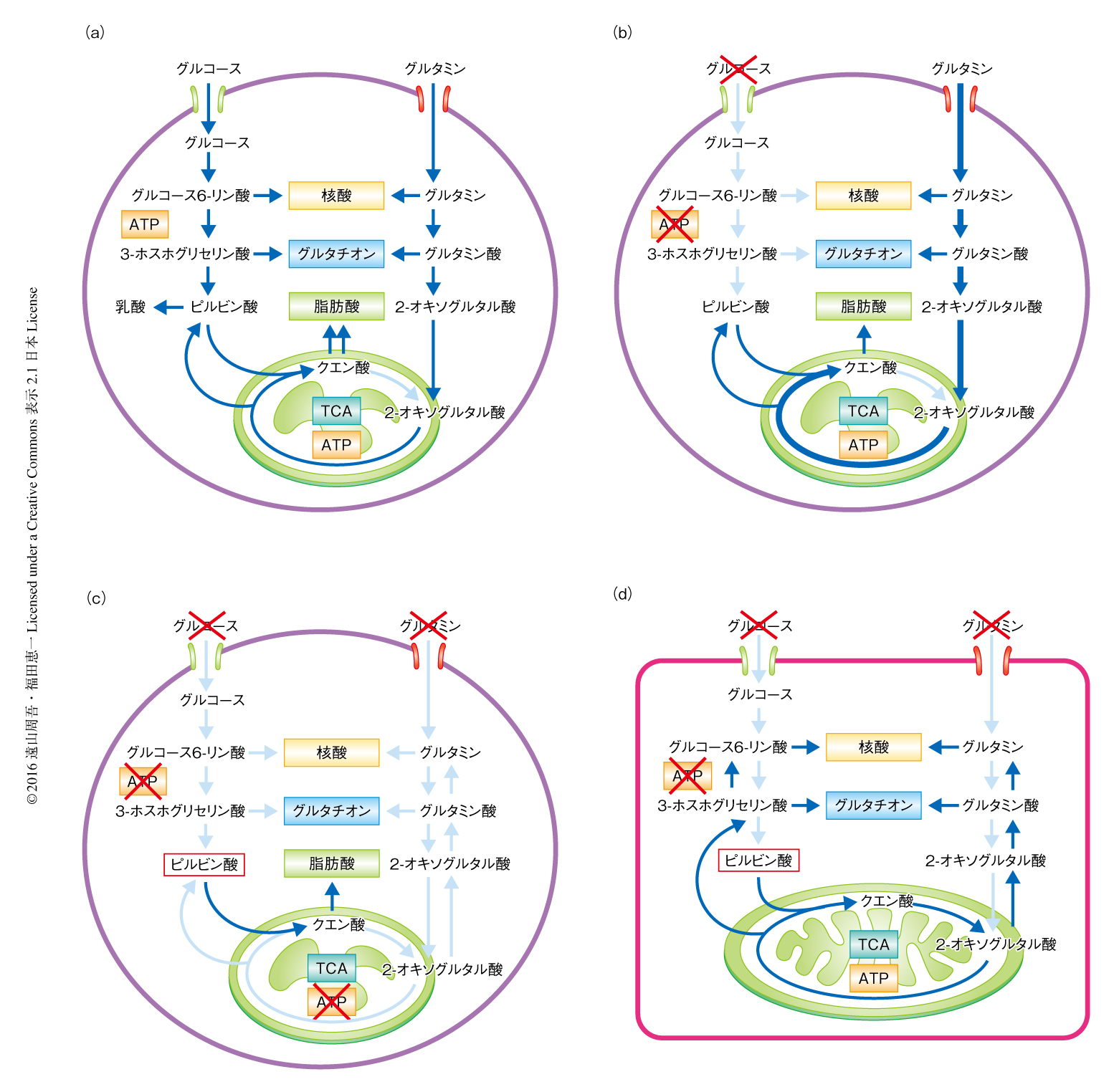
ヒトのES細胞においてグルコース存在下あるいは非存在下にてグルタミンがどのように代謝されるかを調べるため,安定同位体により標識したグルタミンを用いてメタボローム解析を行った.その結果,グルコースの非存在下において,グルタミンに由来するコハク酸,フマル酸,リンゴ酸が増加した.これらの結果から,グルコースの非存在下において,より多くのグルタミンがATPの合成のため活発に代謝されることが示唆された(図1).
ヒトのES細胞はグルコースの非存在下においてもグルタミンが存在すれば生存が可能であったが,グルタミンの代わりにほかの代謝産物を添加することにより生存が可能か検討した.その結果,ピルビン酸やリンゴ酸を添加した際には生存できなかったが,2-オキソグルタル酸を添加した際には生存できることが確認された.また,ヒトのES細胞においてグルタミンがATPの合成に寄与していることを証明するため,グルコースを除去しグルタミンを添加した条件において,ミトコンドリアにおけるATP合成酵素の阻害剤であるオリゴマイシンを投与したところすみやかに死滅したことから,グルタミンは酸化的リン酸化によるATPの合成に寄与することが示された.そのほか,パルミチン酸,N-アセチルシステイン,還元型グルタチオン,ヌクレオシドを添加した際には,ヒトのES細胞は生存できなかった.
ヒトのES細胞はグルコースおよびグルタミンを除去した条件において,ピルビン酸を添加した際には生存できず2-オキソグルタル酸を添加した際には生存が可能である理由を明らかにするため,ピルビン酸あるいは2-オキソグルタル酸を添加した際の代謝産物について評価した.ピルビン酸を添加した条件においては,クエン酸が多く産生されていたものの,コハク酸,フマル酸,リンゴ酸の産生は増加していなかった.一方,2-オキソグルタル酸を添加した条件においては,コハク酸,フマル酸,リンゴ酸の産生が著明に増加していた.これらの結果より,ヒトのES細胞においては,ミトコンドリアにおける酸化的リン酸化においてピルビン酸が利用されにくい可能性が示唆された.
ピルビン酸およびグルタミンの代謝に関連する酵素の発現を評価するため,ヒトのES細胞およびヒトのES細胞に由来する心筋細胞においてトランスクリプトーム解析を行った.その結果,TCA回路に関連する遺伝子のほとんどは,ヒトのES細胞に比べヒトのES細胞に由来する心筋細胞において発現が上昇していたが,とくに,TCA回路の前半のアコニターゼ2およびイソクエン酸デヒドロゲナーゼ2/3の発現が顕著に高かった.一方で,グルタミンの代謝に関連する遺伝子や脂質の合成に関連する遺伝子の発現は,ヒトのES細胞において著明に高かった.タンパク質のレベルにおいても,ヒトのiPS細胞において脂質の合成に関連するATPクエン酸リアーゼの発現が高く,アコニターゼ2およびイソクエン酸デヒドロゲナーゼ2の発現は著明に低下していた.また,グルコースがヒトのES細胞における脂質の合成に寄与しているかどうかを評価するため,安定同位体により標識したグルコースを用いてグルコースに由来するマロニルCoAを定量したところ,その多くはグルコースに由来することが確認された.これらの結果より,ヒトのES細胞およびiPS細胞におけるアコニターゼ2およびイソクエン酸デヒドロゲナーゼ2/3の低い発現,および,脂質の合成に関連するATPクエン酸リアーゼの高い発現により,TCA回路の前半の過程は脂質の合成に寄与することが示され,グルタミンに依存するTCA回路の後半の過程はエネルギーの産生に寄与することが示された(図1).
新生仔の心筋細胞およびES細胞およびiPS細胞に由来する心筋細胞は乳酸を主要なエネルギー源として効率的に利用することが知られていたため2),グルコースおよびアミノ酸を除去した条件に乳酸を添加することにより,ラットの新生仔の心筋細胞が生存するかどうか調べた.その結果,乳酸を添加することによりグルコースおよびグルタミンを除去したにもかかわらず生存が可能であった.しかしながら,シスチンを除去した条件では乳酸を添加しても生存できなかった.また,ヒトのES細胞はグルコースおよびグルタミンを除去した条件に乳酸を添加しても24時間で死滅した.さらに,ヒトのiPS細胞に由来する内胚葉細胞,線維芽細胞,神経幹細胞,ニューロンは,グルコースおよびグルタミンを除去した条件においてはグルコースのみを除去した場合に比べ早期に死滅し,乳酸を添加しても生存できなかった.
ヒトのiPS細胞から二次元系において心筋細胞への分化を誘導したところ,約60%がトロポニンT陽性の心筋細胞になった.それらの細胞をグルコースおよびグルタミンを除去し乳酸を添加した条件において培養したところ,2日目に94%,5日目に99%がトロポニンT陽性の心筋細胞となり,効率のよい純化が可能であることがわかった.残存する未分化な幹細胞を検出するためNANOGの発現を定量PCR法により評価したところ,純化のまえにはNANOGが検出されたものの,純化ののちには検出されなかった.さらに,残存する未分化な幹細胞をより高感度に検出するため,純化の前後の細胞をヒトのES細胞およびiPS細胞において多能性が維持される条件において培養し,Tra1-60陽性の未分化な幹細胞が出現するかどうか評価したところ7),未分化な幹細胞の残存率は0.001%未満であることが示唆された.また,純化された心筋細胞の多くは,分化ののち60日目にはほとんどが心室筋細胞へと成熟したことが示唆された.
グルコースおよびグルタミンを除去し乳酸を添加した条件において心筋細胞の生存が可能であった理由について調べるため,安定同位体により標識した乳酸を用いてメタボローム解析を行った.その結果,心筋細胞は乳酸を効率よく取り込み酸化的リン酸化によるATPの合成に用いていただけではなく,2-オキソグルタル酸を介してグルタミン酸が補充されていた.つまり,心筋細胞においてはアコニターゼ2やイソクエン酸デヒドロゲナーゼ2/3の発現が高いため,グルタミンの非存在下においても乳酸に由来するピルビン酸が効率よく利用されATPおよびグルタミン酸が補充されるため,長期にわたり生存できる可能性が示唆された.
この研究においては,ヒトのES細胞およびiPS細胞,および,それに由来する心筋細胞におけるユニークな代謝機構が明らかにされた.ヒトのES細胞およびiPS細胞はグルコースの代謝だけでなくグルタミンの代謝にも依存していた.グルタミンの代謝はグルタチオンや核酸の合成だけでなく,ATPの合成にも寄与する一方,グルコースの代謝はATPの合成だけではなく,核酸,アミノ酸,脂肪酸の合成にも寄与する.また,ヒトのES細胞およびiPS細胞はグルコースを除去した条件において,解糖系におけるATPの不足をおぎなうためグルタミンの代謝を亢進させていた.そこで,グルコースおよびグルタミンを除去した条件においてヒトのES細胞およびiPS細胞を培養すると,ミトコンドリアにおけるアコニターゼ2およびイソクエン酸デヒドロゲナーゼ2/3の発現が低くピルビン酸や乳酸が存在してもそれを効率よく利用できないため,早期に死滅した.一方,心筋細胞はアコニターゼ2およびイソクエン酸デヒドロゲナーゼ2/3の発現が高く,ピルビン酸あるいは乳酸を効率よく酸化的リン酸化に利用することができるため,長期間にわたり生存することが可能であった.
また,ヒトのES細胞およびiPS細胞は細胞質におけるアセチルCoAの産生や脂肪酸の合成にかかわるATPクエン酸リアーゼおよび脂肪酸合成酵素の発現が高い.細胞質におけるアセチルCoAは,脂肪酸合成酵素により脂肪酸の合成に寄与するだけでなく,ヒストンのアセチル化をひき起こすことにより多能性の維持に寄与する8).つまり,これらの代謝を活性化させるため,あえてミトコンドリアにおけるアコニターゼ2およびイソクエン酸デヒドロゲナーゼ2/3の発現を低く抑制している可能性が示唆された.
今回の研究により,テラトーマの形成の原因となる残存する未分化な幹細胞を効率よく除去することが可能になった.また,最近では,未分化な幹細胞のマーカーに対し陰性を示す増殖する細胞も腫瘍の形成に寄与することが報告されている9).グルコースおよびグルタミンを除去し乳酸を添加した条件は,未分化な幹細胞のみならず,線維芽細胞,内胚葉系細胞,神経幹細胞といった増殖系の細胞を除去するのにも有効であり,腫瘍の形成の抑制において有効にはたらくものと思われた.
従来の心筋細胞の純化法は,筆者らの報告も含め,FACSを用いる方法が主流であったが10-12),この技術の確立によりFACSを用いることなく,培地の成分を変えるという安価かつ簡便な方法により心筋細胞を純化することが可能になった.この研究の成果は,ヒトのiPS細胞から分化させた心筋細胞を用いて心臓の再生医療を行う際に,安全性の担保された心筋細胞を大量に得るうえできわめて重要な技術であると期待される.
略歴:2013年 慶應義塾大学大学院医学研究科博士課程 修了,同年 慶應義塾大学医学部 研究員を経て,2016年より同 特任助教.
研究テーマ:多能性幹細胞における代謝および心臓の再生医療.
抱負:ヒトのES細胞およびiPS細胞の代謝の特性を利用して,心臓の再生医療を実現することをめざしています.
福田 恵一(Keiichi Fukuda)
慶應義塾大学医学部 教授.
研究室URL:http://www.cpnet.med.keio.ac.jp/
© 2016 遠山周吾・福田恵一 Licensed under CC 表示 2.1 日本
(慶應義塾大学医学部 内科学教室循環器内科)
email:遠山周吾,福田恵一
DOI: 10.7875/first.author.2016.033
Glutamine oxidation is indispensable for survival of human pluripotent stem cells.
Shugo Tohyama, Jun Fujita, Takako Hishiki, Tomomi Matsuura, Fumiyuki Hattori, Rei Ohno, Hideaki Kanazawa, Tomohisa Seki, Kazuaki Nakajima, Yoshikazu Kishino, Marina Okada, Akinori Hirano, Takuya Kuroda, Satoshi Yasuda, Yoji Sato, Shinsuke Yuasa, Motoaki Sano, Makoto Suematsu, Keiichi Fukuda
Cell Metabolism, 23, 663-674 (2016)
要 約
ヒトのES細胞およびiPS細胞におけるエネルギー代謝はおもにグルコースの代謝に依存することが知られているが,アミノ酸の役割に関する報告は少ない.筆者らは,ヒトのES細胞およびiPS細胞におけるアミノ酸の代謝を解析することにより,グルタミンが重要な役割を担うことを明らかにした.ヒトのES細胞およびiPS細胞をグルコースおよびグルタミンを除去した条件において培養した場合,グルコースのみを除去した場合に比べ,ATPが短時間で著明に低下しすみやかに死滅した.また,メタボローム解析により,ヒトのES細胞およびiPS細胞はピルビン酸ではなくグルタミンを効率よく利用してATPを合成していることがわかった.その原因として,ヒトのES細胞およびiPS細胞において,アコニターゼ2およびイソクエン酸脱水素酵素2/3の発現が著明に低下していることが示唆された.一方,心筋細胞は乳酸を効率よく利用することにより生存が可能であることがわかった.この代謝の特性を利用することにより,未分化な幹細胞を完全に除去した安全性の高い心筋細胞を作製することが可能となり,今後の再生医療の実現に貢献することが期待される.
はじめに
ヒトのES細胞およびiPS細胞は再生医療における魅力的な細胞源であるが,これらの細胞の特性および性質は完全には解明されていない.ES細胞およびiPS細胞におけるエネルギーの産生は解糖系に依存することが報告されている1,2).また,ペントースリン酸回路,核酸合成系,アミノ酸合成系といった代謝経路も活性化しており,細胞が増殖するために重要な代謝機構をもつ2).一方,ES細胞およびiPS細胞とアミノ酸の代謝との関係に関する報告は少ない.マウスのES細胞はスレオニンの代謝に,ヒトのES細胞およびiPS細胞はメチオニンの代謝に依存しており,スレオニンやメチオニンが枯渇するとS-アデノシルメチオニンの産生が減少し,ヒストンH3のLys4のトリメチル化が阻害されることにより多能性の維持の異常や細胞死につながることが報告されている3,4).また,ナイーブ型マウスのES細胞において,2-オキソグルタル酸がヒストンの脱メチル化を介し多能性の維持に重要な役割を担うことが報告されている5).しかし,ヒトのES細胞およびiPS細胞,また,それから分化した細胞におけるアミノ酸の代謝の役割についてはほとんど知られていない.
筆者らは,ヒトのES細胞およびiPS細胞におけるアミノ酸の代謝を詳細に解析することにより,ヒトのES細胞およびiPS細胞から心筋細胞へと分化したさまざまな細胞の集団から腫瘍の形成の原因となる未分化な幹細胞6) を完全に除去する培養条件の確立をめざした.
1.ヒトのES細胞およびiPS細胞におけるアミノ酸の代謝
ヒトのES細胞およびiPS細胞の生存において重要なアミノ酸が同定するため,ヒトのES細胞において,おのおののアミノ酸の消費量を分析した.必須アミノ酸ではメチオニンおよびトリプトファンの消費が高く,非必須アミノ酸ではセリン,グルタミン,アルギニン,シスチンの消費が高かった.必須アミノ酸とは異なり,非必須アミノ酸は細胞において新たに合成することができ,その必要性は細胞種により異なるため,非必須アミノ酸に着目した.
消費の活発な非必須アミノ酸であるセリン,アルギニン,シスチン,グルタミンのヒトのES細胞およびiPS細胞の生存における役割を明らかにするため,グルコースの存在下あるいは非存在下にくわえて,非必須アミノ酸の除去を組み合わせた際のヒトのES細胞およびiPS細胞の生存率を評価した.その結果,ヒトのES細胞およびiPS細胞はグルコースおよびグルタミンを除去した条件においてもっとも短時間で死滅した.
2.ヒトのES細胞およびiPS細胞におけるグルタミンの代謝の役割
ヒトのES細胞およびiPS細胞においてグルタミンがどのように代謝されるかを評価するため,メタボローム解析を行った.その結果,TCA回路を前半のアセチルCoA~2-オキソグルタル酸と,後半のスクシニルCoA~オキサロ酢酸とに分けた際に,後半の中間代謝産物であるコハク酸,フマル酸,リンゴ酸はグルコースの有無にかかわらずグルタミンを除去した条件において有意に減少した.この結果から,TCA回路の後半の中間代謝産物はグルコースではなくグルタミンに依存していることが予想された.また,グルタミンを除去した条件において還元型グルタチオンやATPが著明に減少した.さらに,安定同位体により標識したグルコースおよびグルタミンを用いたメタボローム解析により,TCA回路の後半の中間代謝産物はグルコースではではなくグルタミンに依存することが確認された.
ヒトのES細胞においてミトコンドリア呼吸の指標である酸素消費速度を測定したところ,グルコースの有無にかかわらずグルタミンを添加した条件において有意に高かった.また,グルタミンを除去した条件においては,グルコースの存在下に比べグルコースの非存在下において高い傾向にあった.これらの結果から,ヒトのES細胞はグルコースの存在しないときにはグルタミンの代謝を活性化させることが示唆された.
ヒトのES細胞においてグルコース存在下あるいは非存在下にてグルタミンがどのように代謝されるかを調べるため,安定同位体により標識したグルタミンを用いてメタボローム解析を行った.その結果,グルコースの非存在下において,グルタミンに由来するコハク酸,フマル酸,リンゴ酸が増加した.これらの結果から,グルコースの非存在下において,より多くのグルタミンがATPの合成のため活発に代謝されることが示唆された(図1).
3.ヒトのES細胞およびiPS細胞の生存には2-オキソグルタル酸が重要である
ヒトのES細胞はグルコースの非存在下においてもグルタミンが存在すれば生存が可能であったが,グルタミンの代わりにほかの代謝産物を添加することにより生存が可能か検討した.その結果,ピルビン酸やリンゴ酸を添加した際には生存できなかったが,2-オキソグルタル酸を添加した際には生存できることが確認された.また,ヒトのES細胞においてグルタミンがATPの合成に寄与していることを証明するため,グルコースを除去しグルタミンを添加した条件において,ミトコンドリアにおけるATP合成酵素の阻害剤であるオリゴマイシンを投与したところすみやかに死滅したことから,グルタミンは酸化的リン酸化によるATPの合成に寄与することが示された.そのほか,パルミチン酸,N-アセチルシステイン,還元型グルタチオン,ヌクレオシドを添加した際には,ヒトのES細胞は生存できなかった.
ヒトのES細胞はグルコースおよびグルタミンを除去した条件において,ピルビン酸を添加した際には生存できず2-オキソグルタル酸を添加した際には生存が可能である理由を明らかにするため,ピルビン酸あるいは2-オキソグルタル酸を添加した際の代謝産物について評価した.ピルビン酸を添加した条件においては,クエン酸が多く産生されていたものの,コハク酸,フマル酸,リンゴ酸の産生は増加していなかった.一方,2-オキソグルタル酸を添加した条件においては,コハク酸,フマル酸,リンゴ酸の産生が著明に増加していた.これらの結果より,ヒトのES細胞においては,ミトコンドリアにおける酸化的リン酸化においてピルビン酸が利用されにくい可能性が示唆された.
4.ヒトのES細胞およびiPS細胞におけるピルビン酸およびグルタミンの代謝に関連する酵素の発現
ピルビン酸およびグルタミンの代謝に関連する酵素の発現を評価するため,ヒトのES細胞およびヒトのES細胞に由来する心筋細胞においてトランスクリプトーム解析を行った.その結果,TCA回路に関連する遺伝子のほとんどは,ヒトのES細胞に比べヒトのES細胞に由来する心筋細胞において発現が上昇していたが,とくに,TCA回路の前半のアコニターゼ2およびイソクエン酸デヒドロゲナーゼ2/3の発現が顕著に高かった.一方で,グルタミンの代謝に関連する遺伝子や脂質の合成に関連する遺伝子の発現は,ヒトのES細胞において著明に高かった.タンパク質のレベルにおいても,ヒトのiPS細胞において脂質の合成に関連するATPクエン酸リアーゼの発現が高く,アコニターゼ2およびイソクエン酸デヒドロゲナーゼ2の発現は著明に低下していた.また,グルコースがヒトのES細胞における脂質の合成に寄与しているかどうかを評価するため,安定同位体により標識したグルコースを用いてグルコースに由来するマロニルCoAを定量したところ,その多くはグルコースに由来することが確認された.これらの結果より,ヒトのES細胞およびiPS細胞におけるアコニターゼ2およびイソクエン酸デヒドロゲナーゼ2/3の低い発現,および,脂質の合成に関連するATPクエン酸リアーゼの高い発現により,TCA回路の前半の過程は脂質の合成に寄与することが示され,グルタミンに依存するTCA回路の後半の過程はエネルギーの産生に寄与することが示された(図1).
5.グルコースおよびグルタミンを除去し乳酸を添加した培地を用いた未分化な幹細胞の除去および心筋細胞の純化
新生仔の心筋細胞およびES細胞およびiPS細胞に由来する心筋細胞は乳酸を主要なエネルギー源として効率的に利用することが知られていたため2),グルコースおよびアミノ酸を除去した条件に乳酸を添加することにより,ラットの新生仔の心筋細胞が生存するかどうか調べた.その結果,乳酸を添加することによりグルコースおよびグルタミンを除去したにもかかわらず生存が可能であった.しかしながら,シスチンを除去した条件では乳酸を添加しても生存できなかった.また,ヒトのES細胞はグルコースおよびグルタミンを除去した条件に乳酸を添加しても24時間で死滅した.さらに,ヒトのiPS細胞に由来する内胚葉細胞,線維芽細胞,神経幹細胞,ニューロンは,グルコースおよびグルタミンを除去した条件においてはグルコースのみを除去した場合に比べ早期に死滅し,乳酸を添加しても生存できなかった.
ヒトのiPS細胞から二次元系において心筋細胞への分化を誘導したところ,約60%がトロポニンT陽性の心筋細胞になった.それらの細胞をグルコースおよびグルタミンを除去し乳酸を添加した条件において培養したところ,2日目に94%,5日目に99%がトロポニンT陽性の心筋細胞となり,効率のよい純化が可能であることがわかった.残存する未分化な幹細胞を検出するためNANOGの発現を定量PCR法により評価したところ,純化のまえにはNANOGが検出されたものの,純化ののちには検出されなかった.さらに,残存する未分化な幹細胞をより高感度に検出するため,純化の前後の細胞をヒトのES細胞およびiPS細胞において多能性が維持される条件において培養し,Tra1-60陽性の未分化な幹細胞が出現するかどうか評価したところ7),未分化な幹細胞の残存率は0.001%未満であることが示唆された.また,純化された心筋細胞の多くは,分化ののち60日目にはほとんどが心室筋細胞へと成熟したことが示唆された.
グルコースおよびグルタミンを除去し乳酸を添加した条件において心筋細胞の生存が可能であった理由について調べるため,安定同位体により標識した乳酸を用いてメタボローム解析を行った.その結果,心筋細胞は乳酸を効率よく取り込み酸化的リン酸化によるATPの合成に用いていただけではなく,2-オキソグルタル酸を介してグルタミン酸が補充されていた.つまり,心筋細胞においてはアコニターゼ2やイソクエン酸デヒドロゲナーゼ2/3の発現が高いため,グルタミンの非存在下においても乳酸に由来するピルビン酸が効率よく利用されATPおよびグルタミン酸が補充されるため,長期にわたり生存できる可能性が示唆された.
おわりに
この研究においては,ヒトのES細胞およびiPS細胞,および,それに由来する心筋細胞におけるユニークな代謝機構が明らかにされた.ヒトのES細胞およびiPS細胞はグルコースの代謝だけでなくグルタミンの代謝にも依存していた.グルタミンの代謝はグルタチオンや核酸の合成だけでなく,ATPの合成にも寄与する一方,グルコースの代謝はATPの合成だけではなく,核酸,アミノ酸,脂肪酸の合成にも寄与する.また,ヒトのES細胞およびiPS細胞はグルコースを除去した条件において,解糖系におけるATPの不足をおぎなうためグルタミンの代謝を亢進させていた.そこで,グルコースおよびグルタミンを除去した条件においてヒトのES細胞およびiPS細胞を培養すると,ミトコンドリアにおけるアコニターゼ2およびイソクエン酸デヒドロゲナーゼ2/3の発現が低くピルビン酸や乳酸が存在してもそれを効率よく利用できないため,早期に死滅した.一方,心筋細胞はアコニターゼ2およびイソクエン酸デヒドロゲナーゼ2/3の発現が高く,ピルビン酸あるいは乳酸を効率よく酸化的リン酸化に利用することができるため,長期間にわたり生存することが可能であった.
また,ヒトのES細胞およびiPS細胞は細胞質におけるアセチルCoAの産生や脂肪酸の合成にかかわるATPクエン酸リアーゼおよび脂肪酸合成酵素の発現が高い.細胞質におけるアセチルCoAは,脂肪酸合成酵素により脂肪酸の合成に寄与するだけでなく,ヒストンのアセチル化をひき起こすことにより多能性の維持に寄与する8).つまり,これらの代謝を活性化させるため,あえてミトコンドリアにおけるアコニターゼ2およびイソクエン酸デヒドロゲナーゼ2/3の発現を低く抑制している可能性が示唆された.
今回の研究により,テラトーマの形成の原因となる残存する未分化な幹細胞を効率よく除去することが可能になった.また,最近では,未分化な幹細胞のマーカーに対し陰性を示す増殖する細胞も腫瘍の形成に寄与することが報告されている9).グルコースおよびグルタミンを除去し乳酸を添加した条件は,未分化な幹細胞のみならず,線維芽細胞,内胚葉系細胞,神経幹細胞といった増殖系の細胞を除去するのにも有効であり,腫瘍の形成の抑制において有効にはたらくものと思われた.
従来の心筋細胞の純化法は,筆者らの報告も含め,FACSを用いる方法が主流であったが10-12),この技術の確立によりFACSを用いることなく,培地の成分を変えるという安価かつ簡便な方法により心筋細胞を純化することが可能になった.この研究の成果は,ヒトのiPS細胞から分化させた心筋細胞を用いて心臓の再生医療を行う際に,安全性の担保された心筋細胞を大量に得るうえできわめて重要な技術であると期待される.
文 献
- Shyh-Chang, N., Daley, G. Q. & Cantley, L. C.: Stem cell metabolism in tissue development and aging. Development, 140, 2535-2547 (2013)[PubMed]
- Tohyama, S., Hattori, F., Sano, M. et al.: Distinct metabolic flow enables large-scale purification of mouse and human pluripotent stem cell-derived cardiomyocytes. Cell Stem Cell, 12, 127-137 (2013)[PubMed] [新着論文レビュー]
- Shiraki, N., Shiraki, Y., Tsuyama, T. et al.: Methionine metabolism regulates maintenance and differentiation of human pluripotent stem cells. Cell Metab., 19, 780-794 (2014)[PubMed] [新着論文レビュー]
- Shyh-Chang, N., Locasale, J. W., Lyssiotis, C. A. et al.: Influence of threonine metabolism on S-adenosylmethionine and histone methylation. Science, 339, 222-226 (2013)[PubMed]
- Carey, B. W., Finley, L. W., Cross, J. R. et al.: Intracellular α-ketoglutarate maintains the pluripotency of embryonic stem cells. Nature, 518, 413-416 (2015)[PubMed]
- Miura, K., Okada, Y., Aoi, T. et al.: Variation in the safety of induced pluripotent stem cell lines. Nat. Biotechnol., 27, 743-745 (2009)[PubMed]
- Tano, K., Yasuda, S., Kuroda, T. et al.: A novel in vitro method for detecting undifferentiated human pluripotent stem cells as impurities in cell therapy products using a highly efficient culture system. PLoS One, 9, e110496 (2014)[PubMed]
- Moussaieff, A., Rouleau, M., Kitsberg, D. et al.: Glycolysis-mediated changes in acetyl-CoA and histone acetylation control the early differentiation of embryonic stem cells. Cell Metab., 21, 392-402 (2015)[PubMed]
- Nori, S., Okada, Y., Nishimura, S. et al.: Long-term safety issues of iPSC-based cell therapy in a spinal cord injury model: oncogenic transformation with epithelial-mesenchymal transition. Stem Cell Rep., 4, 360-373 (2015)[PubMed]
- Hattori, F., Chen, H., Yamashita, H. et al.: Nongenetic method for purifying stem cell-derived cardiomyocytes. Nat. Methods, 7, 61-66 (2010)[PubMed]
- Dubois, N. C., Craft, A. M., Sharma, P. et al.: SIRPA is a specific cell-surface marker for isolating cardiomyocytes derived from human pluripotent stem cells. Nat. Biotechnol., 29, 1011-1018 (2011)[PubMed]
- Uosaki, H., Fukushima, H, Takeuchi, A. et al.: Efficient and scalable purification of cardiomyocytes from human embryonic and induced pluripotent stem cells by VCAM1 surface expression. PLoS One, 6, e23657 (2011)[PubMed]
著者プロフィール
略歴:2013年 慶應義塾大学大学院医学研究科博士課程 修了,同年 慶應義塾大学医学部 研究員を経て,2016年より同 特任助教.
研究テーマ:多能性幹細胞における代謝および心臓の再生医療.
抱負:ヒトのES細胞およびiPS細胞の代謝の特性を利用して,心臓の再生医療を実現することをめざしています.
福田 恵一(Keiichi Fukuda)
慶應義塾大学医学部 教授.
研究室URL:http://www.cpnet.med.keio.ac.jp/
© 2016 遠山周吾・福田恵一 Licensed under CC 表示 2.1 日本