アダプタータンパク質AP-3によるToll様受容体シグナル伝達の制御機構
笹井美和・岩崎明子
(米国Yale大学School of Medicine,Department of Immunobiology)
email:笹井美和,岩崎明子
DOI: 10.7875/first.author.2010.040
Bifurcation of Toll-like Receptor 9 Signaling by Adaptor Protein 3.
Miwa Sasai, Melissa M. Linehan, Akiko Iwasaki
Science, 329, 1530-1534 (2010)
Toll様受容体(TLR)による病原体の認識は,遺伝子変換をともなう獲得免疫による生体防御機構とは異なり,病原体の生存に必須の構成成分を認識する自然免疫による生体防御機構に分類される.TLRファミリーのなかでもTLR7およびTLR9は,形質細胞様樹状細胞においてウイルスのもつ核酸を認識して炎症性サイトカインとI型インターフェロンの産生を顕著に誘導すること,また,TLR7およびTLR9のリガンドによる刺激をうけていないときには小胞体に局在するが刺激をうけると小胞体からエンドソームへ移動しその過程で部分分解されて活性化型になることが,近年,明らかになっている.しかし,2種類の異なるサイトカインの発現がどのように制御されているのか,その詳細は未解明のままであった.この研究によって,TLR7およびTLR9を介したI型インターフェロンの産生には,炎症性サイトカインの産生に関与する小胞からアダプタータンパク質AP-3を介して特異的な小胞へとTLR9が移行する必要のあることが明らかになった.この結果は,I型インターフェロンの産生に特異的な小胞の存在を示唆しており,抗ウイルス作用を効果的に誘導できる創薬開発の基礎となることが期待される.
われわれは生体が異物を認識し取り除く機構として“免疫”をもっているが,この免疫は大きく二分することができる.異物に対して臨機応変に対応し異物を記憶することのできる“獲得免疫”と,異物が普遍的に維持せざるをえない構成成分を認識している“自然免疫”である.自然免疫による異物の認識はのちの獲得免疫を励起し,異物に対して適切な免疫応答を誘導する第1の要である1).ウイルス感染に対する生体防御機構としてのI型インターフェロンの産生は,生体に感染を警告し非感染細胞に対し抗ウイルス作用を示すタンパク質の産生を誘導してウイルス感染に対し非常線を張りめぐらすものである.I型インターフェロンのなかでもインターフェロンαとインターフェロンβは非常に強い抗ウイルス作用を誘導することが知られておりウイルス感染細胞から産生される.しかし,それ以外にも形質細胞様樹状細胞(plasmacytoid dendritic cell)とよばれる特異的な細胞がインターフェロンαを非常に強く産生することが知られている2).
Toll様受容体(Toll-like receptor:TLR)はI型膜タンパク質であり,ヒトにおいては10種類,マウスにおいては13種類が報告され,それぞれ異なった病原体特異的な構成成分を認識する.なかでも,TLR3,TLR7,TLR9は,2本鎖RNA,1本鎖RNA,非メチル化CpGモチーフをもつDNAといった病原体の核酸をそれぞれ認識し,炎症性サイトカインとI型インターフェロンの両方の産生を誘導する.核酸を認識するTLRのなかでもTLR7とTLR9は形質細胞様樹状細胞に発現し,これらが活性化されると多量のインターフェロンαが産生されることから,TLR7およびTLR9の活性化機構は抗ウイルス作用の重要な要として,近年,活発に解析が進められている.
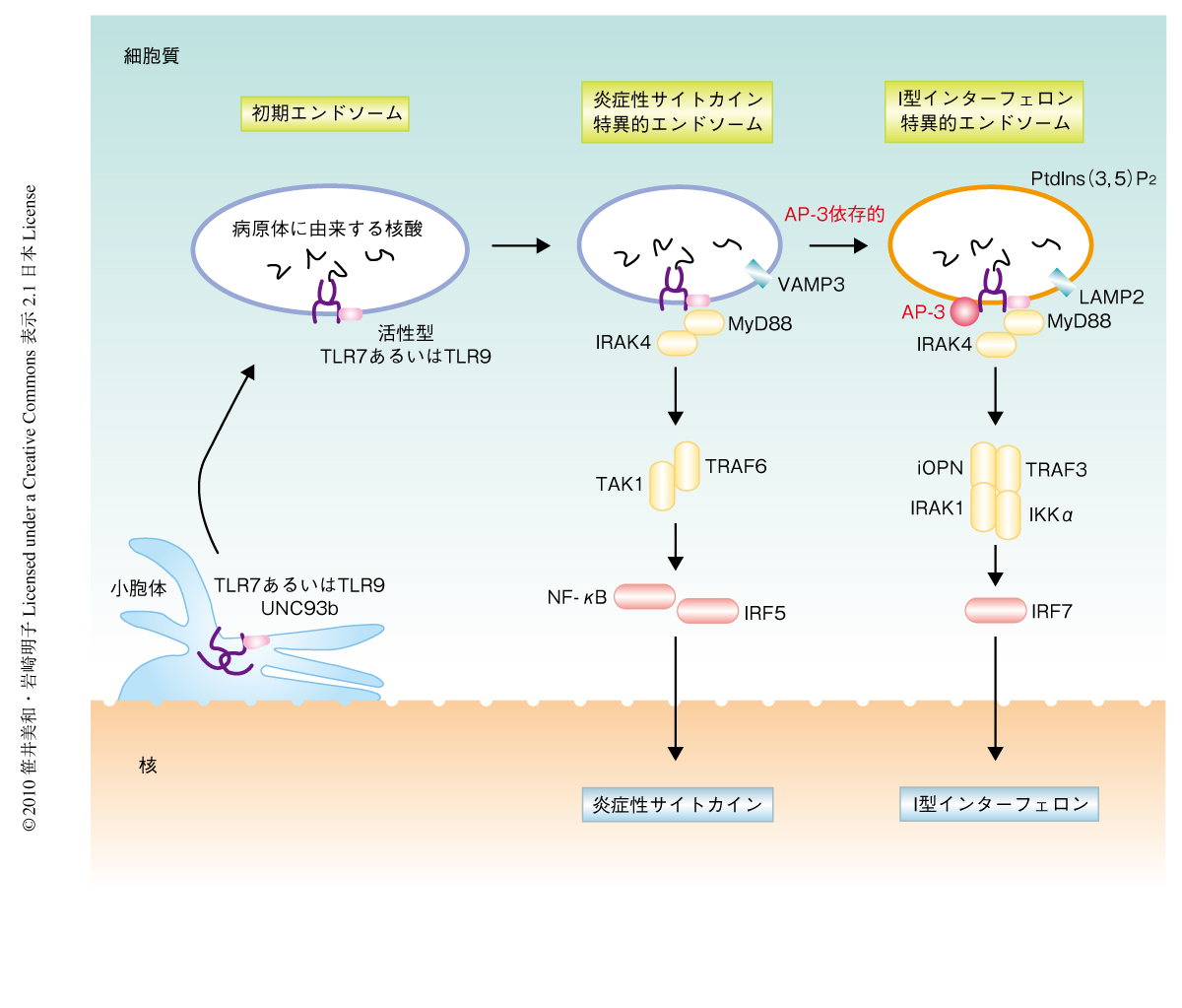
未刺激の細胞ではTLR7およびTLR9はUNC93Bという膜タンパク質と複合体を形成して小胞体に局在している(図1).しかし,細胞がいちどウイルスを感知するとTLR7およびTLR9はUNC93Bとともにまず初期エンドソームへと移行する.そして,後期エンドソームへと移動する際にカテプシンファミリーメンバーにより部分分解をうけ,シグナル伝達に必須のアダプタータンパク質であるMyD88との相互作用を示すようになり,そのシグナル伝達経路が活性化される3,4).TLR7およびTLR9が活性化されると,2つの転写因子NF-κBとIRF7とが活性化され,炎症性サイトカインの産生とI型インターフェロンの産生とをそれぞれ誘導する.TLR7およびTLR9を介したシグナル伝達に寄与しているタンパク質としてMyD88をはじめとするさまざまなタンパク質が同定されているが,なかでも,IRAK1,TRAF3,iOPN,DOCK2,IRF7はI型インターフェロン産生に特異的に関与することが報告されている5,6)(図1).TLR9の合成リガンドであるCpG-DNAにはCpG-AとCpG-Bとがあるが,CpG-Aで形質細胞様樹状細胞を刺激した場合には炎症性サイトカインと大量のI型インターフェロンの両方の産生が誘導されるのに対して,CpG-Bで刺激を行った際には炎症性サイトカインのみの産生が誘導され,I型インターフェロンの産生は誘導されない.同じTLR9を刺激しているにもかかわらず,なぜこのような違いが生じるのかは未解明であった.
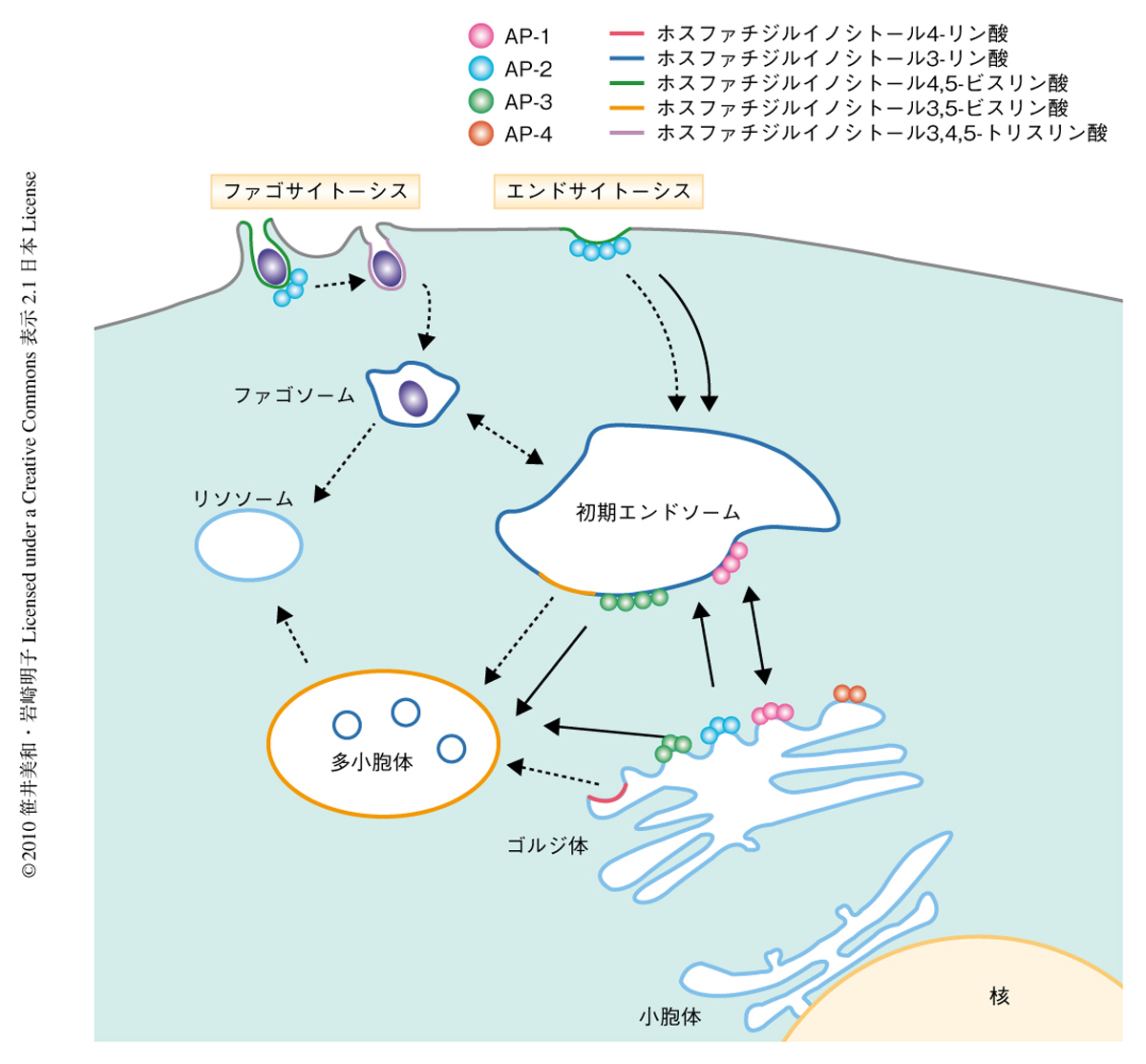
筆者らは,形質細胞様樹状細胞におけるI型インターフェロン産生の分子機構に興味をもち,内在性TLRの細胞内局在の変化に着目することでTLR9を介したI型インターフェロン産生の分子機構の解明を試みた.内在性TLRはリガンドが結合してそのシグナルが活性化されると最終的にはリソソームへと運ばれる.アダプタータンパク質は細胞内タンパク質輸送に関与するタンパク質であり,これまでAP-1からAP-4の4つが報告されている.これらは4個のサブユニットから形成される複合体であり,ひとつのサブユニットが欠損するだけでも複合体としての機能を維持できない.なかでもAP-3は4つのサブユニットδ,β3A,μ3A,σ3から構成され,エンドソームからメラノソームや多小胞体(multivesicular body:MVB)といったリソソーム様オルガネラへと積み荷を運ぶ役割を担っている7)(図2).エンドソームからリソソームへTLR7およびTLR9が移行する過程のなかにI型インターフェロン産生に関与する部分が存在するものと仮定し,その過程に存在するAP-3に着目した.
TLR9を介したサイトカインの産生に対するAP-3の機能について明確にするため,AP-3のサブユニットのひとつβ3AをノックアウトしたAP-3欠損マウスを用いて解析を行った.野生型マウスとAP-3欠損マウスのそれぞれの骨髄から誘導した形質細胞様樹状細胞をCpG-Aで刺激し,炎症性サイトカインとI型インターフェロンであるインターフェロンαの産生量について検討した.興味深いことに,AP-3欠損細胞では炎症性サイトカインの産生量については野生型と同程度または増加したにもかかわらず,インターフェロンαの産生はほとんど検出されなかった.また,同じく形質細胞様樹状細胞に発現するTLR7リガンドである小胞性口内炎ウイルスやインフルエンザウイルスの感染にともなうサイトカインの産生についても,AP-3欠損細胞においてはインターフェロンαの産生は抑制され炎症性サイトカインのみが産生された.これらの結果から,AP-3は形質細胞様樹状細胞においてTLR7およびTLR9のI型インターフェロンの産生機構に特異的に関与していることが示唆された.
I型インターフェロンの産生に特異的に関与する小胞の存在を仮定して,AP-3欠損細胞におけるTLR9の細胞内局在について解析を行った.しかし,形質細胞様樹状細胞は非常にわずかな細胞質しかもっておらず小胞を明確に分けるのは非常に困難であったため,骨髄に由来するマクロファージを用いて解析を行った.マクロファージをCpG-A単独で刺激すると炎症性サイトカインのみが誘導されI型インターフェロンの産生は認められないが,CpG-Aとカチオン性脂質DOTAPとの複合体(DOTAP CpG-A)を形成させこれで刺激するとI型インターフェロンの誘導されることが知られている8).マクロファージを用いてTLR9の細胞内局在を解析するのにさきだち,形質細胞様樹状細胞で認められた現象がAP-3欠損マクロファージにおいても保存されているかどうかを確認した.DOTAP CpG-A刺激によるサイトカインの発現誘導は,形質細胞様樹状細胞の結果と同様に,炎症性サイトカインにおいては野生型とAP-3欠損型とで同程度であったが,I型インターフェロンの発現誘導はAP-3欠損細胞において顕著に抑制され,形質細胞様樹状細胞でみられたAP-3の機能はマクロファージにおいても保存されていることが確認された.
AP-3欠損マクロファージにおけるTLR9の細胞内局在の変化を解析するため,TLR9のC末端領域にGFPを融合させたTLR9-GFPをレトロウイルベクターにより発現させ,その局在変化について解析した.未刺激の細胞ではTLR9-GFPは野生型およびAP-3欠損型の両方において,これまでの報告と同様に小胞体に局在した5).これらの細胞にDOTAP CpG-Aにより3時間の刺激をくわえると,野生型およびAP-3欠損型のどちらでもTLR9-GFPは初期エンドソームに局在することが知られているVAMP3との共局在を示した.しかし,DOTAP CpG-Aで6時間の刺激をくわえると,野生型では後期エンドソームまたはリソソーム様オルガネラのマーカーであるLAMP2との共局在を示したのに対して,AP-3欠損マクロファージではLAMP-2とは共局在を示さずVAMP3陽性小胞にとどまったままであった.これらの結果から,TLR9はDOTAP CpG-Aによる刺激ののち,初期エンドソームからLAMP2陽性のリソソーム様オルガネラへとAP-3に依存して移行し,この局在の変化がI型インターフェロンの産生に重要であることが示唆された.
つぎに,AP-3がどのようにTLR9の局在変化に関与しているのかを明確にするため,AP-3とTLR9との相互作用について解析を行った.AP-3のサブユニットのひとつμ3AにFlagタグを付加したものとTLR9-GFPとをマウスマクロファージ細胞株であるRAW264.7細胞に恒常的に発現させ,これらの相互作用について共焦点顕微鏡および免疫沈降法を用いて解析を行った.共焦点顕微鏡を用いた解析の結果,未刺激時にはTLR9とμ3Aは共局在を示さなかったが,DOTAP CpG-Aで刺激を行うと刺激30分後には凝集体を形成し共局在を示した.この共局在はI型インターフェロンの産生を誘導できないDOTAP CpG-BまたはCpG-A単独の刺激では認められなかった.さらに,免疫沈降による解析においても,DOTAP CpG-Aで細胞を刺激した場合にのみTLR9とμ3Aとの共沈降が確認され,DOTAP CpG-BまたはCpG-A単独の刺激では共沈降は起こらなかった.興味深いことに,部分分解された活性化型TLR9のみがμ3Aとの共沈降を示し,この結果は,TLR9がAP-3と相互するまえに部分分解されて活性化型となっていることが必要であることを暗示していた.
また,TLR9を介したI型インターフェロンの産生に関与していることがすでに報告されていたIRF7およびTRAF3とμ3Aとの関与について解析を行うため,ヒト胎児腎由来293細胞にこれらを強制発現し,それぞれの相互作用について免疫沈降により解析を行った.その結果,μ3AはIRF7との相互作用を示し,TRAF3とIRF7との相互作用を橋渡しするように機能している可能性が示された.これらの結果から,AP-3がTLR9と相互作用することでTLR9-TRAF3複合体をIRF7へと導き,I型インターフェロンの産生を誘導していることが示された.
ここまでの結果から,TLR9を介したI型インターフェロンの産生にはTLR9がLAMP2陽性のリソソーム様小胞へとAP-3を介して輸送されることが必要であることが示唆された.リソソーム様小胞がTLR9を介したI型インターフェロン産生に重要であることをより明確にする目的で,TLR9を介したインターフェロンαの産生に必須の転写因子であるIRF7の細胞内での局在を検討した.その結果,DOTAP-CpG-Aによる刺激から6時間後に,野生型ではIRF7は凝集体を形成し酸性オルガネラを検出するLysoTrackerおよび蛍光標識したCpG-Aとの共局在を示したのに対して,AP-3欠損細胞においてはIRF7の凝集体を認められなかった.この結果は,LAMP2陽性の酸性オルガネラがインターフェロンαの産生に重要な役割を担っていることを示唆していた.
つぎに,LAMP2陽性小胞がどのような小胞であるかに興味がもたれた.細胞内での脂質の局在は非常に制御されており,膜輸送に非常に強く関与している9).非常に興味深いことに,ホスファチジルイノシトール3,5-ビスリン酸が初期エンドソームの一部と多小胞体(リソソーム様オルガネラ)に局在しており,これはインターフェロン産生に重要ではないかと想定していた小胞と一致していた(図2).そこで,ホスファチジルイノシトール3,5-ビスリン酸に結合することがすでに報告されているCentaurinβ2のPHドメインをTRAF3に融合させ,この融合タンパク質がAP-3欠損細胞でのインターフェロンαの転写誘導を回復することができるか検討を行ったところ,予想どおり,回復することができた.これは,TLR9を介したインターフェロンαの産生にはホスファチジルイノシトール-3,5-ビスリン酸の多く存在する領域でそのシグナルタンパク質の複合体が形成されることが重要であることを暗示していた(図1).
AP-3欠損細胞において,I型インターフェロンの産生は減少するにもかかわらず炎症性サイトカインの産生は正常であることから,I型インターフェロンの産生と炎症性サイトカインの産生とは異なる小胞により行われていることが想定された.この2つの異なる小胞はそれぞれ独立に存在しているのか,それとも,炎症性サイトカインに関与する小胞がそののちI型インターフェロンの産生に関与する小胞となるのか明確にするため,形質細胞様樹状細胞をCpG-Aで刺激し,それぞれのサイトカインについて細胞内染色を行い,フローサイトメトリーにてその発現の有無を解析した.興味深いことに,インターフェロンαを産生している細胞はほぼすべて炎症性サイトカインのひとつであるTNFαも産生しており,この結果は,I型インターフェロン産生に必要な小胞となるには,さきに炎症性サイトカイン産生に関与する小胞となる必要のあることを示していた(図1).
この研究により,TLR7およびTLR9を介したサイトカインの産生は細胞内局在により強く制御されていることが明らかとなった.このことは,同じTLRを刺激しても異なるサイトカインが産生される原因のひとつなのかもしれない.シグナル伝達に関与するタンパク質が正しい時期に正しい場所で機能することによってはじめて適切な免疫応答が誘導されて,われわれは日々を過ごせているのかもしれない.
略歴:2007年 奈良先端科学技術大学院大学バイオサイエンス研究科 修了,同年より米国Yale大学School of Medicineポストドクトラルフェロー.
研究テーマ:ウイルス感染に対する生体防御機構.
岩崎 明子(Akiko Iwasaki)
米国Yale大学School of MedicineにてAssociate Professor.
© 2010 笹井美和・岩崎明子 Licensed under CC 表示 2.1 日本
(米国Yale大学School of Medicine,Department of Immunobiology)
email:笹井美和,岩崎明子
DOI: 10.7875/first.author.2010.040
Bifurcation of Toll-like Receptor 9 Signaling by Adaptor Protein 3.
Miwa Sasai, Melissa M. Linehan, Akiko Iwasaki
Science, 329, 1530-1534 (2010)
要 約
Toll様受容体(TLR)による病原体の認識は,遺伝子変換をともなう獲得免疫による生体防御機構とは異なり,病原体の生存に必須の構成成分を認識する自然免疫による生体防御機構に分類される.TLRファミリーのなかでもTLR7およびTLR9は,形質細胞様樹状細胞においてウイルスのもつ核酸を認識して炎症性サイトカインとI型インターフェロンの産生を顕著に誘導すること,また,TLR7およびTLR9のリガンドによる刺激をうけていないときには小胞体に局在するが刺激をうけると小胞体からエンドソームへ移動しその過程で部分分解されて活性化型になることが,近年,明らかになっている.しかし,2種類の異なるサイトカインの発現がどのように制御されているのか,その詳細は未解明のままであった.この研究によって,TLR7およびTLR9を介したI型インターフェロンの産生には,炎症性サイトカインの産生に関与する小胞からアダプタータンパク質AP-3を介して特異的な小胞へとTLR9が移行する必要のあることが明らかになった.この結果は,I型インターフェロンの産生に特異的な小胞の存在を示唆しており,抗ウイルス作用を効果的に誘導できる創薬開発の基礎となることが期待される.
はじめに
われわれは生体が異物を認識し取り除く機構として“免疫”をもっているが,この免疫は大きく二分することができる.異物に対して臨機応変に対応し異物を記憶することのできる“獲得免疫”と,異物が普遍的に維持せざるをえない構成成分を認識している“自然免疫”である.自然免疫による異物の認識はのちの獲得免疫を励起し,異物に対して適切な免疫応答を誘導する第1の要である1).ウイルス感染に対する生体防御機構としてのI型インターフェロンの産生は,生体に感染を警告し非感染細胞に対し抗ウイルス作用を示すタンパク質の産生を誘導してウイルス感染に対し非常線を張りめぐらすものである.I型インターフェロンのなかでもインターフェロンαとインターフェロンβは非常に強い抗ウイルス作用を誘導することが知られておりウイルス感染細胞から産生される.しかし,それ以外にも形質細胞様樹状細胞(plasmacytoid dendritic cell)とよばれる特異的な細胞がインターフェロンαを非常に強く産生することが知られている2).
Toll様受容体(Toll-like receptor:TLR)はI型膜タンパク質であり,ヒトにおいては10種類,マウスにおいては13種類が報告され,それぞれ異なった病原体特異的な構成成分を認識する.なかでも,TLR3,TLR7,TLR9は,2本鎖RNA,1本鎖RNA,非メチル化CpGモチーフをもつDNAといった病原体の核酸をそれぞれ認識し,炎症性サイトカインとI型インターフェロンの両方の産生を誘導する.核酸を認識するTLRのなかでもTLR7とTLR9は形質細胞様樹状細胞に発現し,これらが活性化されると多量のインターフェロンαが産生されることから,TLR7およびTLR9の活性化機構は抗ウイルス作用の重要な要として,近年,活発に解析が進められている.
未刺激の細胞ではTLR7およびTLR9はUNC93Bという膜タンパク質と複合体を形成して小胞体に局在している(図1).しかし,細胞がいちどウイルスを感知するとTLR7およびTLR9はUNC93Bとともにまず初期エンドソームへと移行する.そして,後期エンドソームへと移動する際にカテプシンファミリーメンバーにより部分分解をうけ,シグナル伝達に必須のアダプタータンパク質であるMyD88との相互作用を示すようになり,そのシグナル伝達経路が活性化される3,4).TLR7およびTLR9が活性化されると,2つの転写因子NF-κBとIRF7とが活性化され,炎症性サイトカインの産生とI型インターフェロンの産生とをそれぞれ誘導する.TLR7およびTLR9を介したシグナル伝達に寄与しているタンパク質としてMyD88をはじめとするさまざまなタンパク質が同定されているが,なかでも,IRAK1,TRAF3,iOPN,DOCK2,IRF7はI型インターフェロン産生に特異的に関与することが報告されている5,6)(図1).TLR9の合成リガンドであるCpG-DNAにはCpG-AとCpG-Bとがあるが,CpG-Aで形質細胞様樹状細胞を刺激した場合には炎症性サイトカインと大量のI型インターフェロンの両方の産生が誘導されるのに対して,CpG-Bで刺激を行った際には炎症性サイトカインのみの産生が誘導され,I型インターフェロンの産生は誘導されない.同じTLR9を刺激しているにもかかわらず,なぜこのような違いが生じるのかは未解明であった.
1.AP-3はTLR7およびTLR9を介したI型インターフェロンの産生に特異的に関与している
筆者らは,形質細胞様樹状細胞におけるI型インターフェロン産生の分子機構に興味をもち,内在性TLRの細胞内局在の変化に着目することでTLR9を介したI型インターフェロン産生の分子機構の解明を試みた.内在性TLRはリガンドが結合してそのシグナルが活性化されると最終的にはリソソームへと運ばれる.アダプタータンパク質は細胞内タンパク質輸送に関与するタンパク質であり,これまでAP-1からAP-4の4つが報告されている.これらは4個のサブユニットから形成される複合体であり,ひとつのサブユニットが欠損するだけでも複合体としての機能を維持できない.なかでもAP-3は4つのサブユニットδ,β3A,μ3A,σ3から構成され,エンドソームからメラノソームや多小胞体(multivesicular body:MVB)といったリソソーム様オルガネラへと積み荷を運ぶ役割を担っている7)(図2).エンドソームからリソソームへTLR7およびTLR9が移行する過程のなかにI型インターフェロン産生に関与する部分が存在するものと仮定し,その過程に存在するAP-3に着目した.
TLR9を介したサイトカインの産生に対するAP-3の機能について明確にするため,AP-3のサブユニットのひとつβ3AをノックアウトしたAP-3欠損マウスを用いて解析を行った.野生型マウスとAP-3欠損マウスのそれぞれの骨髄から誘導した形質細胞様樹状細胞をCpG-Aで刺激し,炎症性サイトカインとI型インターフェロンであるインターフェロンαの産生量について検討した.興味深いことに,AP-3欠損細胞では炎症性サイトカインの産生量については野生型と同程度または増加したにもかかわらず,インターフェロンαの産生はほとんど検出されなかった.また,同じく形質細胞様樹状細胞に発現するTLR7リガンドである小胞性口内炎ウイルスやインフルエンザウイルスの感染にともなうサイトカインの産生についても,AP-3欠損細胞においてはインターフェロンαの産生は抑制され炎症性サイトカインのみが産生された.これらの結果から,AP-3は形質細胞様樹状細胞においてTLR7およびTLR9のI型インターフェロンの産生機構に特異的に関与していることが示唆された.
2.AP-3はTLR9の細胞内局在の変化に関与している
I型インターフェロンの産生に特異的に関与する小胞の存在を仮定して,AP-3欠損細胞におけるTLR9の細胞内局在について解析を行った.しかし,形質細胞様樹状細胞は非常にわずかな細胞質しかもっておらず小胞を明確に分けるのは非常に困難であったため,骨髄に由来するマクロファージを用いて解析を行った.マクロファージをCpG-A単独で刺激すると炎症性サイトカインのみが誘導されI型インターフェロンの産生は認められないが,CpG-Aとカチオン性脂質DOTAPとの複合体(DOTAP CpG-A)を形成させこれで刺激するとI型インターフェロンの誘導されることが知られている8).マクロファージを用いてTLR9の細胞内局在を解析するのにさきだち,形質細胞様樹状細胞で認められた現象がAP-3欠損マクロファージにおいても保存されているかどうかを確認した.DOTAP CpG-A刺激によるサイトカインの発現誘導は,形質細胞様樹状細胞の結果と同様に,炎症性サイトカインにおいては野生型とAP-3欠損型とで同程度であったが,I型インターフェロンの発現誘導はAP-3欠損細胞において顕著に抑制され,形質細胞様樹状細胞でみられたAP-3の機能はマクロファージにおいても保存されていることが確認された.
AP-3欠損マクロファージにおけるTLR9の細胞内局在の変化を解析するため,TLR9のC末端領域にGFPを融合させたTLR9-GFPをレトロウイルベクターにより発現させ,その局在変化について解析した.未刺激の細胞ではTLR9-GFPは野生型およびAP-3欠損型の両方において,これまでの報告と同様に小胞体に局在した5).これらの細胞にDOTAP CpG-Aにより3時間の刺激をくわえると,野生型およびAP-3欠損型のどちらでもTLR9-GFPは初期エンドソームに局在することが知られているVAMP3との共局在を示した.しかし,DOTAP CpG-Aで6時間の刺激をくわえると,野生型では後期エンドソームまたはリソソーム様オルガネラのマーカーであるLAMP2との共局在を示したのに対して,AP-3欠損マクロファージではLAMP-2とは共局在を示さずVAMP3陽性小胞にとどまったままであった.これらの結果から,TLR9はDOTAP CpG-Aによる刺激ののち,初期エンドソームからLAMP2陽性のリソソーム様オルガネラへとAP-3に依存して移行し,この局在の変化がI型インターフェロンの産生に重要であることが示唆された.
3.AP-3はTLR9と相互作用を示すことによりそのシグナル伝達に関与している
つぎに,AP-3がどのようにTLR9の局在変化に関与しているのかを明確にするため,AP-3とTLR9との相互作用について解析を行った.AP-3のサブユニットのひとつμ3AにFlagタグを付加したものとTLR9-GFPとをマウスマクロファージ細胞株であるRAW264.7細胞に恒常的に発現させ,これらの相互作用について共焦点顕微鏡および免疫沈降法を用いて解析を行った.共焦点顕微鏡を用いた解析の結果,未刺激時にはTLR9とμ3Aは共局在を示さなかったが,DOTAP CpG-Aで刺激を行うと刺激30分後には凝集体を形成し共局在を示した.この共局在はI型インターフェロンの産生を誘導できないDOTAP CpG-BまたはCpG-A単独の刺激では認められなかった.さらに,免疫沈降による解析においても,DOTAP CpG-Aで細胞を刺激した場合にのみTLR9とμ3Aとの共沈降が確認され,DOTAP CpG-BまたはCpG-A単独の刺激では共沈降は起こらなかった.興味深いことに,部分分解された活性化型TLR9のみがμ3Aとの共沈降を示し,この結果は,TLR9がAP-3と相互するまえに部分分解されて活性化型となっていることが必要であることを暗示していた.
また,TLR9を介したI型インターフェロンの産生に関与していることがすでに報告されていたIRF7およびTRAF3とμ3Aとの関与について解析を行うため,ヒト胎児腎由来293細胞にこれらを強制発現し,それぞれの相互作用について免疫沈降により解析を行った.その結果,μ3AはIRF7との相互作用を示し,TRAF3とIRF7との相互作用を橋渡しするように機能している可能性が示された.これらの結果から,AP-3がTLR9と相互作用することでTLR9-TRAF3複合体をIRF7へと導き,I型インターフェロンの産生を誘導していることが示された.
4.特異的なリン脂質がI型インターフェロンの産生に関与している
ここまでの結果から,TLR9を介したI型インターフェロンの産生にはTLR9がLAMP2陽性のリソソーム様小胞へとAP-3を介して輸送されることが必要であることが示唆された.リソソーム様小胞がTLR9を介したI型インターフェロン産生に重要であることをより明確にする目的で,TLR9を介したインターフェロンαの産生に必須の転写因子であるIRF7の細胞内での局在を検討した.その結果,DOTAP-CpG-Aによる刺激から6時間後に,野生型ではIRF7は凝集体を形成し酸性オルガネラを検出するLysoTrackerおよび蛍光標識したCpG-Aとの共局在を示したのに対して,AP-3欠損細胞においてはIRF7の凝集体を認められなかった.この結果は,LAMP2陽性の酸性オルガネラがインターフェロンαの産生に重要な役割を担っていることを示唆していた.
つぎに,LAMP2陽性小胞がどのような小胞であるかに興味がもたれた.細胞内での脂質の局在は非常に制御されており,膜輸送に非常に強く関与している9).非常に興味深いことに,ホスファチジルイノシトール3,5-ビスリン酸が初期エンドソームの一部と多小胞体(リソソーム様オルガネラ)に局在しており,これはインターフェロン産生に重要ではないかと想定していた小胞と一致していた(図2).そこで,ホスファチジルイノシトール3,5-ビスリン酸に結合することがすでに報告されているCentaurinβ2のPHドメインをTRAF3に融合させ,この融合タンパク質がAP-3欠損細胞でのインターフェロンαの転写誘導を回復することができるか検討を行ったところ,予想どおり,回復することができた.これは,TLR9を介したインターフェロンαの産生にはホスファチジルイノシトール-3,5-ビスリン酸の多く存在する領域でそのシグナルタンパク質の複合体が形成されることが重要であることを暗示していた(図1).
AP-3欠損細胞において,I型インターフェロンの産生は減少するにもかかわらず炎症性サイトカインの産生は正常であることから,I型インターフェロンの産生と炎症性サイトカインの産生とは異なる小胞により行われていることが想定された.この2つの異なる小胞はそれぞれ独立に存在しているのか,それとも,炎症性サイトカインに関与する小胞がそののちI型インターフェロンの産生に関与する小胞となるのか明確にするため,形質細胞様樹状細胞をCpG-Aで刺激し,それぞれのサイトカインについて細胞内染色を行い,フローサイトメトリーにてその発現の有無を解析した.興味深いことに,インターフェロンαを産生している細胞はほぼすべて炎症性サイトカインのひとつであるTNFαも産生しており,この結果は,I型インターフェロン産生に必要な小胞となるには,さきに炎症性サイトカイン産生に関与する小胞となる必要のあることを示していた(図1).
おわりに
この研究により,TLR7およびTLR9を介したサイトカインの産生は細胞内局在により強く制御されていることが明らかとなった.このことは,同じTLRを刺激しても異なるサイトカインが産生される原因のひとつなのかもしれない.シグナル伝達に関与するタンパク質が正しい時期に正しい場所で機能することによってはじめて適切な免疫応答が誘導されて,われわれは日々を過ごせているのかもしれない.
文 献
- Janeway, C. A. Jr. & Medzhitov, R.: Innate immune recognition. Annu. Rev. Immunol., 20, 197-216 (2002)[PubMed]
- Taniguchi, T. & Takaoka, A: The interferon-α/β system in antiviral responses: a multimodal machinery of gene regulation by the IRF family of transcription factors. Curr. Opin. Immunol., 14, 111-116 (2002)[PubMed]
- Park, B., Brinkmann, M. M., Spooner, E. et al: Proteolytic cleavage in an endolysosomal compartment is required for activation of Toll-like receptor 9. Nat. Immunol., 9, 1407-1414 (2008)[PubMed]
- Ewald, S. E., Lee, B. L., Lau, L. et al: The ectodomain of Toll-like receptor 9 is cleaved to generate a functional receptor. Nature, 456, 658-662 (2008)[PubMed]
- Kawai, T. & Akira, S: The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors. Nat. Immunol., 11, 373-384 (2010)[PubMed]
- Gotoh, K., Tanaka, Y., Nishikimi, A. et al: Selective control of type I IFN induction by the Rac activator DOCK2 during TLR-mediated plasmacytoid dendritic cell activation. J. Exp. Med., 207, 721-730 (2010)[PubMed]
- Robinson, M. S: Adaptable adaptors for coated vesicles. Trends Cell Biol., 14, 167-174 (2004)[PubMed]
- Honda, K., Ohba, Y., Yanai, H. et al: Spatiotemporal regulation of MyD88-IRF-7 signalling for robust type-I interferon induction. Nature, 434, 1035-1040 (2005)[PubMed]
- Vicinanza, M., D'Angelo, G., Di Campli, A. et al: Function and dysfunction of the PI system in membrane trafficking. EMBO J., 27, 2457-2470 (2008)[PubMed]
著者プロフィール
略歴:2007年 奈良先端科学技術大学院大学バイオサイエンス研究科 修了,同年より米国Yale大学School of Medicineポストドクトラルフェロー.
研究テーマ:ウイルス感染に対する生体防御機構.
岩崎 明子(Akiko Iwasaki)
米国Yale大学School of MedicineにてAssociate Professor.
© 2010 笹井美和・岩崎明子 Licensed under CC 表示 2.1 日本