天敵のにおいに対する生理的な恐怖にかかわる嗅皮質の領域の同定
近藤 邦生
(米国Fred Hutchinson Cancer Research Center,Basic Sciences Division)
email:近藤邦生
DOI: 10.7875/first.author.2016.028
A specific area of olfactory cortex involved in stress hormone responses to predator odours.
Kunio Kondoh, Zhonghua Lu, Xiaolan Ye, David P. Olson, Bradford B. Lowell, Linda B. Buck
Nature, 532, 103-106 (2016)
動物が生き残るためには危険に対し恐怖を感じ適切に対応することが重要である.マウスは天敵のにおいを嗅ぐと,逃避やすくみなどの恐怖行動にくわえ,ストレスホルモンの分泌をともなう生理的な恐怖反応を示す.今回,筆者らは,においの情報を受け取る脳の領域である嗅皮質において,天敵のにおいに対するストレスホルモン応答にかかわる領域を同定した.嗅皮質の複数の領域がストレスホルモンの分泌を制御するニューロンにシグナルを伝達していたが,それらの領域のうち,扁桃体梨状皮質移行領域のみが天敵のにおいにより活性化されるニューロンを含んでいた.扁桃体梨状皮質移行領域を人為的に活性化するとストレスホルモン応答がひき起こされ,抑制すると恐怖行動に影響することなく天敵のにおいによるストレスホルモン応答が抑制された.以上の結果より,扁桃体梨状皮質移行領域が天敵のにおいに対する生理的な恐怖反応において重要な役割をはたすことが明らかにされた.
動物は身のまわりにひそむ危険を察知して恐怖を感じ,その危険からのがれるため体内の生理的な環境を変化させて行動する.恐怖を感じると動物は逃避やすくみなど状況に応じた行動,および,ストレスホルモンの分泌をともなう生理的な反応を示す.恐怖行動は危険をさける,あるいは,外敵からかくれるのに有効であるのに対し,生理的な恐怖反応は呼吸系や代謝系などを変化させ恐怖行動がより効果的に行えるようにする.恐怖により分泌されるストレスホルモンは脳の視床下部室傍核に存在するCRHニューロンにより制御されている.恐怖を感じるとCRHニューロンはCRH(corticotropin-releasing hormone,副腎皮質刺激ホルモン放出ホルモン)を分泌し,CRHは下垂体に作用して副腎皮質刺激ホルモンの分泌を促進する.副腎皮質刺激ホルモンは副腎皮質においてグルココルチコイドの分泌を促進し,その結果,呼吸系,代謝系,免疫系などにさまざまな生理的な反応がひき起こされる1).
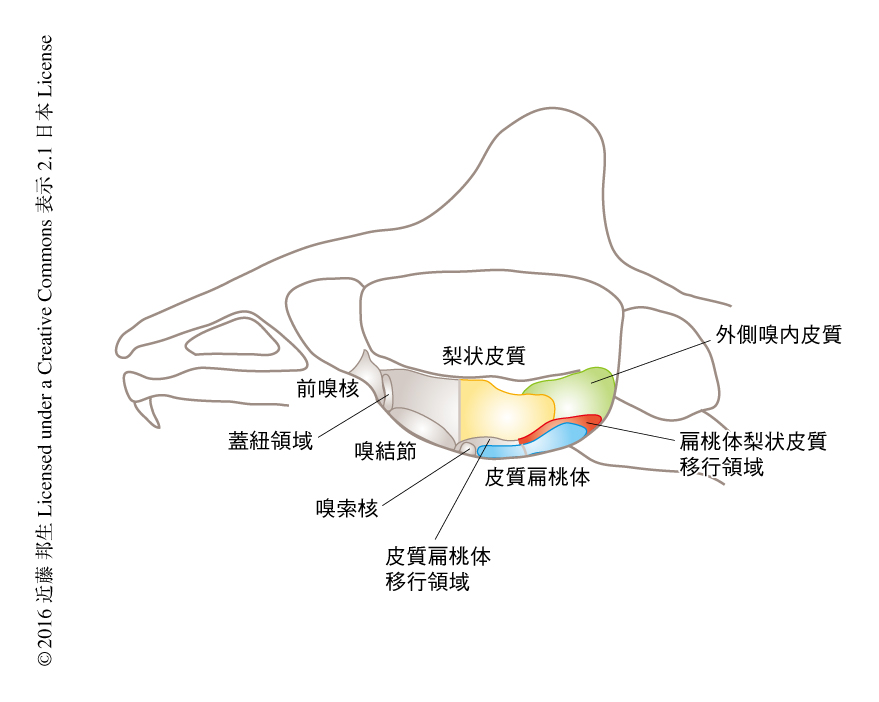
げっ歯類など多くの動物はキツネやネコなどの天敵からのにおいを感知して本能的な恐怖反応をひき起こす2).マウスは天敵のにおいを鼻の嗅上皮あるいは鋤鼻器により認識する.嗅上皮からのシグナルは嗅球へと伝達され,ついで嗅皮質へ,さらに高次の領域へと伝達される3).嗅皮質は解剖学的に区別されるさまざまな領域からなるが(図1),それぞれの領域の役割はあまりわかっていない.鋤鼻器からのシグナルは副嗅球へと伝達され,さらに鋤鼻扁桃体へとおもに伝達される.これまでの研究により,嗅球の背側の部分がある天敵のにおいに対するストレスホルモン応答に必要であることがわかっていたが4),嗅皮質のどの領域が天敵のにおいに対するストレスホルモン応答にかかわるのかはわかっていなかった.
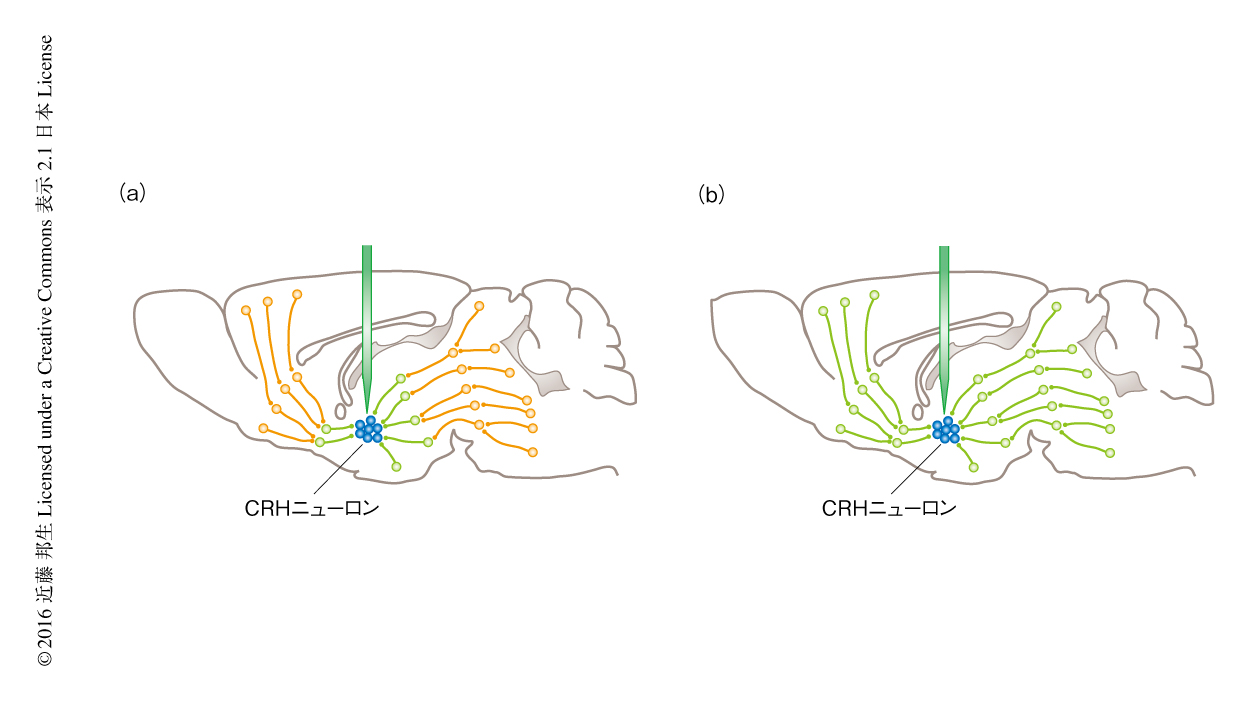
仮性狂犬病ウイルスBarth株はニューロンに感染すると増殖し,シナプスを介し上流のニューロンへと逆行的に感染する5).この性質を用いると,特定のニューロンにシナプス結合を介しシグナルを伝達する上流のニューロンを同定することが可能である.CRHニューロンの上流のニューロンを解析するため,2種類の組換え仮性狂犬病ウイルスを作製した.一方の組換え仮性狂犬病ウイルスはウイルスの増殖に必須なチミジンキナーゼを欠損しており,Creリコンビナーゼに依存的にGFPを発現する.この組換え仮性狂犬病ウイルスと,Creリコンビナーゼに依存的にチミジンキナーゼを発現する組換えレンチウイルスとをニューロンに感染させると,仮性狂犬病ウイルスはCreリコンビナーゼを発現するニューロンにおいて特異的にGFPを発現しレンチウイルスにより発現するチミジンキナーゼを用いて増殖して上流のニューロンに感染する.しかし,この上流のニューロンにはレンチウイルスは感染できずチミジンキナーゼが発現しないため,そこからさらに上流のニューロンへの感染は起こらない.すなわち,この組換え仮性狂犬病ウイルスは特定のニューロンと直接的に接続する上流のニューロンのみを同定する単シナプス性のトレーサーとして機能する(図2a).もう一方の組換え仮性狂犬病ウイルスはCreリコンビナーゼに依存的にチミジンキナーゼを発現する.この組換え仮性狂犬病ウイルスはいちどCreリコンビナーゼを発現するニューロンに感染すると恒常的にチミジンキナーゼを発現するため,シナプス結合を介して上流のニューロンに感染したのち,ふたたび増殖してさらに上流のニューロンに感染する.したがって,この組換え仮性狂犬病ウイルスは特定のニューロンと直接的あるいは間接的に接続する上流のニューロンを網羅的に同定する多シナプス性のトレーサーとして機能する(図2b).これらの単シナプス感染性の組換えウイルスおよび多シナプス感染性の組換えウイルスを併用することにより,ある特定のニューロンに直接的に接続する上流のニューロンと間接的に接続するニューロンとを区別して同定することが可能になった.
嗅皮質のどの領域がCRHニューロンにシグナルを伝達するのかを調べるため,CRHニューロンにおいて特異的にCreリコンビナーゼを発現するマウスに対し,視床下部室傍核に組換え仮性狂犬病ウイルスを注入した.CRHニューロンへの感染ののち,新たに感染した上流のニューロンは脳の多くの領域に観察された.単シナプス感染性の組換えウイルスは脳の31の領域のニューロンに感染し,そのすべては以前の報告により視床下部室傍核に投射するニューロンをもつことが報告されていた領域だった6).それらのなかには,におい以外によるストレスホルモン応答にかかわることが示唆される領域も多く含まれていた1).
嗅覚系においては,単シナプス感染性の組換えウイルスは鋤鼻扁桃体の一部である内側扁桃体にのみ感染した.このことから,内側扁桃体はCRHニューロンと直接的に接続することが示された.一方,多シナプス感染性の組換えウイルスは注入ののち4日目に嗅皮質および鋤鼻扁桃体の複数の領域に感染した(図1).注入ののち3日目に多シナプス感染性の組換えウイルスに感染した領域のほとんどは,単シナプス感染性の組換えウイルスにも感染していたことから,多シナプス感染性の組換えウイルスに感染した内側扁桃体を除くほかの領域はCRHニューロンに対し間接的に,おそらく,1つのニューロンを介してシグナルを伝達していると考えられた.
嗅上皮あるいは鋤鼻扁桃体のどの領域が天敵のにおいをCRHニューロンに伝達しているのだろうか? このことを明らかにするため,組換え仮性狂犬病ウイルスに感染したニューロンが天敵のにおいにより活性化するかどうかを調べた.ニューロンの活性化を調べる有効な方法のひとつは,c-Fosなどの神経活性化マーカーの発現の有無を調べることである.しかし,組換え仮性狂犬病ウイルスに感染してから一定時間ののちに,これらの神経活性化マーカーは神経活動とは無関係に発現したため,活性化されたニューロンを区別することは困難であった.そこで,神経活性化マーカーのひとつであるArcについて,mRNAの細胞内局在の経時的な変化を利用した.ArcのmRNAは発現が誘導されると5~15分のちには核に局在し,それから細胞質へと輸送されることが知られている7).Arcの発現が組換え仮性狂犬病ウイルスの感染により誘導されているときには,ほとんどの場合,15分以上にわたり発現が誘導されていると考えられるため,ArcのmRNAは核と細胞質の両方に存在する.一方,Arcの発現がニューロンの活性化により誘導されているときには,においによる刺激ののち5分においてArcのmRNAは核にのみ存在する.したがって,ArcのmRNAが核にのみ存在する組換え仮性狂犬病ウイルスに感染したニューロンを解析することにより,CRHニューロンの上流において天敵のにおいにより活性化するニューロンを同定することが可能になった.
CRHニューロンにおいて特異的にCreリコンビナーゼを発現するマウスに対し,多シナプス感染性の組換えウイルスを感染させ,ヤマネコの尿,あるいは,キツネに由来するにおい物質であるTMTを嗅がせた.組換え仮性狂犬病ウイルスに感染した嗅皮質あるいは鋤鼻扁桃体のニューロンを解析したところ,ArcのmRNAが核にのみ存在するニューロンの割合は扁桃体梨状皮質移行領域でのみ上昇していた.このことから,扁桃体梨状皮質移行領域は天敵のにおいのシグナルを受け取りCRHニューロンに伝達することができるニューロンを含むことが示された.
扁桃体梨状皮質移行領域のニューロンの人為的な活性化によりストレスホルモン応答をひき起こすことができるかどうか調べた.Gタンパク質共役型受容体hM3Dqは生体においては不活性な物質であるCNOと結合することにより活性化しニューロンの脱分極を促進する8).アデノ随伴ウイルスを用いてhM3Dqを扁桃体梨状皮質移行領域から投射するニューロンにおいて特異的に発現させ,腹腔にCNOを注射することにより扁桃体梨状皮質移行領域における神経活動を活性化させた.その結果,CRHニューロンにおいて神経活性化マーカーであるc-Fosの発現は上昇し,副腎皮質刺激ホルモンの血中濃度は上昇した.このことから,扁桃体梨状皮質移行領域における神経活動の活性化のみでストレスホルモン応答をひき起こすことができることが示された.
扁桃体梨状皮質移行領域が天敵のにおいによる恐怖反応にかかわるかどうかを調べた.Gタンパク質共役型受容体hM4DiはCNOと結合することによりニューロンを抑制する8).アデノ随伴ウイルスを用いてhM4Diを扁桃体梨状皮質移行領域から投射するニューロンにおいて発現させ,腹腔にCNOを注射することにより扁桃体梨状皮質移行領域における神経活動を抑制した.その結果,天敵のにおいに対する副腎皮質刺激ホルモンの血中濃度の上昇が抑制され,副腎皮質刺激ホルモンの下流のホルモンであるコルチコステロンの量,および,神経活性化マーカーであるc-Fosを発現するCRHニューロンの割合も減少した.これらの結果から,扁桃体梨状皮質移行領域は天敵のにおいによるストレスホルモン応答に必要であることが示唆された.
扁桃体梨状皮質移行領域における神経活動を抑制しても,天敵のにおいによりマウスがすくむ時間に変化はみられなかった.最近,嗅皮質の別の領域のニューロンを抑制すると天敵のにおいによりすくむ時間が減少することが報告された9).すくみは典型的な恐怖行動であり,天敵のにおいに対する恐怖行動と生理的な恐怖反応とは嗅皮質の異なる領域により担われる可能性が示唆された.
天敵のにおいに対する恐怖反応は天敵に会ったことのない実験室のマウスにも観察されることから,生まれつき備わった神経回路がかかわると考えられる.今回,筆者らは,天敵のにおいのシグナルがストレスホルモン応答までどのように伝達するかを解析し,嗅皮質の小さな領域である扁桃体梨状皮質移行領域が重要な役割を担うことを見い出した(図3).嗅上皮の複数の領域がCRHニューロンにシグナルを伝達したが,それらのうち,天敵のにおいにより活性化されたのは扁桃体梨状皮質移行領域だけであった.ほかの領域がどのような役割をはたしているのかは興味深い.マウスはほかのマウスからのにおいなどに対しても恐怖反応を示すことが知られており10),扁桃体梨状皮質移行領域のほかの領域は別の危険なにおいの認識にかかわるのかもしれない.また,恐怖によるストレスホルモン応答を抑制あるいは制御する領域の存在する可能性もある.
近年,単シナプス性のトレーサーとして,狂犬病ウイルスに由来するものが非常に広い範囲で使われている11).筆者らが作製した仮性狂犬病ウイルスに由来するトレーサーは,単シナプス性と多シナプス性とを併用することにより直接的あるいは間接的に接続するニューロンを区別して同定できるという,狂犬病ウイルスに由来するトレーサーにはない利点がある.これらのトレーサーを併用することにより,さまざまな神経回路のさらなる理解が進むことが期待される.ちなみに,名前は似ているものの,RNAウイルスである狂犬病ウイルスとDNAウイルスである仮性狂犬病ウイルスとはまったく別のウイルスである.
ヒトにおいては,ストレスホルモン応答の制御の不全がうつや不安障害といった精神疾患に関連することがわかっている.ストレスホルモン応答を制御する神経回路ネットワークを理解することにより,精神疾患の治療の向上へとつながることが期待される.
略歴:2007年 京都大学大学院生命科学研究科 修了,同年より米国Fred Hutchinson Cancer Research Center博士研究員.
研究テーマ:においによる本能的な行動のしくみ.
抱負:においに対する動物の本能的な反応を理解することにより,ヒトの感情の根底にあるしくみを理解できないかと考えています.
© 2016 近藤 邦生 Licensed under CC 表示 2.1 日本
(米国Fred Hutchinson Cancer Research Center,Basic Sciences Division)
email:近藤邦生
DOI: 10.7875/first.author.2016.028
A specific area of olfactory cortex involved in stress hormone responses to predator odours.
Kunio Kondoh, Zhonghua Lu, Xiaolan Ye, David P. Olson, Bradford B. Lowell, Linda B. Buck
Nature, 532, 103-106 (2016)
要 約
動物が生き残るためには危険に対し恐怖を感じ適切に対応することが重要である.マウスは天敵のにおいを嗅ぐと,逃避やすくみなどの恐怖行動にくわえ,ストレスホルモンの分泌をともなう生理的な恐怖反応を示す.今回,筆者らは,においの情報を受け取る脳の領域である嗅皮質において,天敵のにおいに対するストレスホルモン応答にかかわる領域を同定した.嗅皮質の複数の領域がストレスホルモンの分泌を制御するニューロンにシグナルを伝達していたが,それらの領域のうち,扁桃体梨状皮質移行領域のみが天敵のにおいにより活性化されるニューロンを含んでいた.扁桃体梨状皮質移行領域を人為的に活性化するとストレスホルモン応答がひき起こされ,抑制すると恐怖行動に影響することなく天敵のにおいによるストレスホルモン応答が抑制された.以上の結果より,扁桃体梨状皮質移行領域が天敵のにおいに対する生理的な恐怖反応において重要な役割をはたすことが明らかにされた.
はじめに
動物は身のまわりにひそむ危険を察知して恐怖を感じ,その危険からのがれるため体内の生理的な環境を変化させて行動する.恐怖を感じると動物は逃避やすくみなど状況に応じた行動,および,ストレスホルモンの分泌をともなう生理的な反応を示す.恐怖行動は危険をさける,あるいは,外敵からかくれるのに有効であるのに対し,生理的な恐怖反応は呼吸系や代謝系などを変化させ恐怖行動がより効果的に行えるようにする.恐怖により分泌されるストレスホルモンは脳の視床下部室傍核に存在するCRHニューロンにより制御されている.恐怖を感じるとCRHニューロンはCRH(corticotropin-releasing hormone,副腎皮質刺激ホルモン放出ホルモン)を分泌し,CRHは下垂体に作用して副腎皮質刺激ホルモンの分泌を促進する.副腎皮質刺激ホルモンは副腎皮質においてグルココルチコイドの分泌を促進し,その結果,呼吸系,代謝系,免疫系などにさまざまな生理的な反応がひき起こされる1).
げっ歯類など多くの動物はキツネやネコなどの天敵からのにおいを感知して本能的な恐怖反応をひき起こす2).マウスは天敵のにおいを鼻の嗅上皮あるいは鋤鼻器により認識する.嗅上皮からのシグナルは嗅球へと伝達され,ついで嗅皮質へ,さらに高次の領域へと伝達される3).嗅皮質は解剖学的に区別されるさまざまな領域からなるが(図1),それぞれの領域の役割はあまりわかっていない.鋤鼻器からのシグナルは副嗅球へと伝達され,さらに鋤鼻扁桃体へとおもに伝達される.これまでの研究により,嗅球の背側の部分がある天敵のにおいに対するストレスホルモン応答に必要であることがわかっていたが4),嗅皮質のどの領域が天敵のにおいに対するストレスホルモン応答にかかわるのかはわかっていなかった.
1.仮性狂犬病ウイルスを用いた神経回路の解析
仮性狂犬病ウイルスBarth株はニューロンに感染すると増殖し,シナプスを介し上流のニューロンへと逆行的に感染する5).この性質を用いると,特定のニューロンにシナプス結合を介しシグナルを伝達する上流のニューロンを同定することが可能である.CRHニューロンの上流のニューロンを解析するため,2種類の組換え仮性狂犬病ウイルスを作製した.一方の組換え仮性狂犬病ウイルスはウイルスの増殖に必須なチミジンキナーゼを欠損しており,Creリコンビナーゼに依存的にGFPを発現する.この組換え仮性狂犬病ウイルスと,Creリコンビナーゼに依存的にチミジンキナーゼを発現する組換えレンチウイルスとをニューロンに感染させると,仮性狂犬病ウイルスはCreリコンビナーゼを発現するニューロンにおいて特異的にGFPを発現しレンチウイルスにより発現するチミジンキナーゼを用いて増殖して上流のニューロンに感染する.しかし,この上流のニューロンにはレンチウイルスは感染できずチミジンキナーゼが発現しないため,そこからさらに上流のニューロンへの感染は起こらない.すなわち,この組換え仮性狂犬病ウイルスは特定のニューロンと直接的に接続する上流のニューロンのみを同定する単シナプス性のトレーサーとして機能する(図2a).もう一方の組換え仮性狂犬病ウイルスはCreリコンビナーゼに依存的にチミジンキナーゼを発現する.この組換え仮性狂犬病ウイルスはいちどCreリコンビナーゼを発現するニューロンに感染すると恒常的にチミジンキナーゼを発現するため,シナプス結合を介して上流のニューロンに感染したのち,ふたたび増殖してさらに上流のニューロンに感染する.したがって,この組換え仮性狂犬病ウイルスは特定のニューロンと直接的あるいは間接的に接続する上流のニューロンを網羅的に同定する多シナプス性のトレーサーとして機能する(図2b).これらの単シナプス感染性の組換えウイルスおよび多シナプス感染性の組換えウイルスを併用することにより,ある特定のニューロンに直接的に接続する上流のニューロンと間接的に接続するニューロンとを区別して同定することが可能になった.
2.ストレスホルモン応答にかかわる嗅皮質の領域の同定
嗅皮質のどの領域がCRHニューロンにシグナルを伝達するのかを調べるため,CRHニューロンにおいて特異的にCreリコンビナーゼを発現するマウスに対し,視床下部室傍核に組換え仮性狂犬病ウイルスを注入した.CRHニューロンへの感染ののち,新たに感染した上流のニューロンは脳の多くの領域に観察された.単シナプス感染性の組換えウイルスは脳の31の領域のニューロンに感染し,そのすべては以前の報告により視床下部室傍核に投射するニューロンをもつことが報告されていた領域だった6).それらのなかには,におい以外によるストレスホルモン応答にかかわることが示唆される領域も多く含まれていた1).
嗅覚系においては,単シナプス感染性の組換えウイルスは鋤鼻扁桃体の一部である内側扁桃体にのみ感染した.このことから,内側扁桃体はCRHニューロンと直接的に接続することが示された.一方,多シナプス感染性の組換えウイルスは注入ののち4日目に嗅皮質および鋤鼻扁桃体の複数の領域に感染した(図1).注入ののち3日目に多シナプス感染性の組換えウイルスに感染した領域のほとんどは,単シナプス感染性の組換えウイルスにも感染していたことから,多シナプス感染性の組換えウイルスに感染した内側扁桃体を除くほかの領域はCRHニューロンに対し間接的に,おそらく,1つのニューロンを介してシグナルを伝達していると考えられた.
3.扁桃体梨状皮質移行領域は天敵のにおいをCRHニューロンに伝達する
嗅上皮あるいは鋤鼻扁桃体のどの領域が天敵のにおいをCRHニューロンに伝達しているのだろうか? このことを明らかにするため,組換え仮性狂犬病ウイルスに感染したニューロンが天敵のにおいにより活性化するかどうかを調べた.ニューロンの活性化を調べる有効な方法のひとつは,c-Fosなどの神経活性化マーカーの発現の有無を調べることである.しかし,組換え仮性狂犬病ウイルスに感染してから一定時間ののちに,これらの神経活性化マーカーは神経活動とは無関係に発現したため,活性化されたニューロンを区別することは困難であった.そこで,神経活性化マーカーのひとつであるArcについて,mRNAの細胞内局在の経時的な変化を利用した.ArcのmRNAは発現が誘導されると5~15分のちには核に局在し,それから細胞質へと輸送されることが知られている7).Arcの発現が組換え仮性狂犬病ウイルスの感染により誘導されているときには,ほとんどの場合,15分以上にわたり発現が誘導されていると考えられるため,ArcのmRNAは核と細胞質の両方に存在する.一方,Arcの発現がニューロンの活性化により誘導されているときには,においによる刺激ののち5分においてArcのmRNAは核にのみ存在する.したがって,ArcのmRNAが核にのみ存在する組換え仮性狂犬病ウイルスに感染したニューロンを解析することにより,CRHニューロンの上流において天敵のにおいにより活性化するニューロンを同定することが可能になった.
CRHニューロンにおいて特異的にCreリコンビナーゼを発現するマウスに対し,多シナプス感染性の組換えウイルスを感染させ,ヤマネコの尿,あるいは,キツネに由来するにおい物質であるTMTを嗅がせた.組換え仮性狂犬病ウイルスに感染した嗅皮質あるいは鋤鼻扁桃体のニューロンを解析したところ,ArcのmRNAが核にのみ存在するニューロンの割合は扁桃体梨状皮質移行領域でのみ上昇していた.このことから,扁桃体梨状皮質移行領域は天敵のにおいのシグナルを受け取りCRHニューロンに伝達することができるニューロンを含むことが示された.
4.扁桃体梨状皮質移行領域は天敵のにおいによるストレスホルモン応答にかかわる
扁桃体梨状皮質移行領域のニューロンの人為的な活性化によりストレスホルモン応答をひき起こすことができるかどうか調べた.Gタンパク質共役型受容体hM3Dqは生体においては不活性な物質であるCNOと結合することにより活性化しニューロンの脱分極を促進する8).アデノ随伴ウイルスを用いてhM3Dqを扁桃体梨状皮質移行領域から投射するニューロンにおいて特異的に発現させ,腹腔にCNOを注射することにより扁桃体梨状皮質移行領域における神経活動を活性化させた.その結果,CRHニューロンにおいて神経活性化マーカーであるc-Fosの発現は上昇し,副腎皮質刺激ホルモンの血中濃度は上昇した.このことから,扁桃体梨状皮質移行領域における神経活動の活性化のみでストレスホルモン応答をひき起こすことができることが示された.
扁桃体梨状皮質移行領域が天敵のにおいによる恐怖反応にかかわるかどうかを調べた.Gタンパク質共役型受容体hM4DiはCNOと結合することによりニューロンを抑制する8).アデノ随伴ウイルスを用いてhM4Diを扁桃体梨状皮質移行領域から投射するニューロンにおいて発現させ,腹腔にCNOを注射することにより扁桃体梨状皮質移行領域における神経活動を抑制した.その結果,天敵のにおいに対する副腎皮質刺激ホルモンの血中濃度の上昇が抑制され,副腎皮質刺激ホルモンの下流のホルモンであるコルチコステロンの量,および,神経活性化マーカーであるc-Fosを発現するCRHニューロンの割合も減少した.これらの結果から,扁桃体梨状皮質移行領域は天敵のにおいによるストレスホルモン応答に必要であることが示唆された.
扁桃体梨状皮質移行領域における神経活動を抑制しても,天敵のにおいによりマウスがすくむ時間に変化はみられなかった.最近,嗅皮質の別の領域のニューロンを抑制すると天敵のにおいによりすくむ時間が減少することが報告された9).すくみは典型的な恐怖行動であり,天敵のにおいに対する恐怖行動と生理的な恐怖反応とは嗅皮質の異なる領域により担われる可能性が示唆された.
おわりに
天敵のにおいに対する恐怖反応は天敵に会ったことのない実験室のマウスにも観察されることから,生まれつき備わった神経回路がかかわると考えられる.今回,筆者らは,天敵のにおいのシグナルがストレスホルモン応答までどのように伝達するかを解析し,嗅皮質の小さな領域である扁桃体梨状皮質移行領域が重要な役割を担うことを見い出した(図3).嗅上皮の複数の領域がCRHニューロンにシグナルを伝達したが,それらのうち,天敵のにおいにより活性化されたのは扁桃体梨状皮質移行領域だけであった.ほかの領域がどのような役割をはたしているのかは興味深い.マウスはほかのマウスからのにおいなどに対しても恐怖反応を示すことが知られており10),扁桃体梨状皮質移行領域のほかの領域は別の危険なにおいの認識にかかわるのかもしれない.また,恐怖によるストレスホルモン応答を抑制あるいは制御する領域の存在する可能性もある.
近年,単シナプス性のトレーサーとして,狂犬病ウイルスに由来するものが非常に広い範囲で使われている11).筆者らが作製した仮性狂犬病ウイルスに由来するトレーサーは,単シナプス性と多シナプス性とを併用することにより直接的あるいは間接的に接続するニューロンを区別して同定できるという,狂犬病ウイルスに由来するトレーサーにはない利点がある.これらのトレーサーを併用することにより,さまざまな神経回路のさらなる理解が進むことが期待される.ちなみに,名前は似ているものの,RNAウイルスである狂犬病ウイルスとDNAウイルスである仮性狂犬病ウイルスとはまったく別のウイルスである.
ヒトにおいては,ストレスホルモン応答の制御の不全がうつや不安障害といった精神疾患に関連することがわかっている.ストレスホルモン応答を制御する神経回路ネットワークを理解することにより,精神疾患の治療の向上へとつながることが期待される.
文 献
- Ulrich-Lai, Y. M. & Herman, J. P.: Neural regulation of endocrine and autonomic stress responses. Nat. Rev. Neurosci., 10, 397-409 (2009)[PubMed]
- Takahashi, L. K.: Olfactory systems and neural circuits that modulate predator odor fear. Front. Behav. Neurosci., 8, 72 (2014)[PubMed]
- Buck, L. B. & Bargmann, C.: Smell and taste: the chemical senses. in Principles of Neuroscience, 5th Ed. (Kandel, E., Schwartz, J., Jessell, T. et al. eds.), pp.712-742, McGraw-Hill, New York (2012)
- Kobayakawa, K., Kobayakawa, R., Matsumoto, H. et al.: Innate versus learned odour processing in the mouse olfactory bulb. Nature, 450, 503-508 (2007)[PubMed]
- Card, J. P. & Enquist, L. W.: Transneuronal circuit analysis with pseudorabies viruses. Curr. Protoc. Neurosci., Chapter 1, Unit 1.5 (2001)[PubMed]
- Sawchenko, P. E. & Swanson, L. W.: The organization of forebrain afferents to the paraventricular and supraoptic nuclei of the rat. J. Comp. Neurol., 218, 121-144 (1983)[PubMed]
- Guzowski, J. F., McNaughton, B. L., Barnes, C. A. et al.: Environment-specific expression of the immediate-early gene Arc in hippocampal neuronal ensembles. Nat. Neurosci., 2, 1120-1124 (1999)[PubMed]
- Armbruster, B. N., Li, X., Pausch, M. H. et al.: Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand. Proc. Natl. Acad. Sci. USA, 104, 5163-5168 (2007)[PubMed]
- Root, C. M., Denny, C. A., Hen, R. et al.: The participation of cortical amygdala in innate, odour-driven behaviour. Nature, 515, 269-273 (2014)[PubMed]
- Brechbuhl, J., Moine, F., Klaey, M. et al.: Mouse alarm pheromone shares structural similarity with predator scents. Proc. Natl. Acad. Sci. USA, 110, 4762-4767 (2013)[PubMed]
- Callaway, E. M. & Luo, L.: Monosynaptic circuit tracing with glycoprotein-deleted rabies viruses. J. Neurosci., 35, 8979-8985 (2015)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2007年 京都大学大学院生命科学研究科 修了,同年より米国Fred Hutchinson Cancer Research Center博士研究員.
研究テーマ:においによる本能的な行動のしくみ.
抱負:においに対する動物の本能的な反応を理解することにより,ヒトの感情の根底にあるしくみを理解できないかと考えています.
© 2016 近藤 邦生 Licensed under CC 表示 2.1 日本