バイオセンサーにより解き明かすキネトコアにおける張力の伝達機構
鈴木 應志
(米国North Carolina大学Chapel Hill校Department of Biology)
email:鈴木應志
DOI: 10.7875/first.author.2016.027
How the kinetochore couples microtubule force and centromere stretch to move chromosomes.
Aussie Suzuki, Benjamin L. Badger, Julian Haase, Tomoo Ohashi, Harold P. Erickson, Edward D. Salmon, Kerry Bloom
Nature Cell Biology, 18, 382-392 (2016)
キネトコアは巨大なタンパク質構造体であり,セントロメアとよばれる染色体の特異的な配列のうえに形成され,細胞分裂において微小管との結合の土台になる.近年,多くのキネトコア関連タンパク質が同定され,その詳細な機能が精力的に解析されているが,複雑なタンパク質構造体であるキネトコアが微小管から染色体へどのように張力を伝達するのかは解明されていない.Ndc80複合体は酵母からヒトまで機能的および構造的に高度に保存され,微小管と直接に結合することにより染色体分配および紡錘体形成チェックポイントを制御する.この研究においては,出芽酵母を用いて,内在性のNdc80にFRETプローブを挿入することにより,Ndc80複合体のもつ機能を阻害することなくNdc80の担う張力をモニターできる細胞株を樹立した.このNdc80張力センサーをモニターした結果,Ndc80の担う張力は細胞分裂中期においてもっとも強く,細胞分裂後期においてもっとも低くなることがわかった.また,出芽酵母のNdc80の微小管結合部位の機能は,考えられていたより進化的に保存されていることが見い出された.さらに,in vivoおよびin silicoにおける実験結果から,キネトコアは単純な張力受容器ではなく,より複雑な張力連結器として機能していることが示唆された.
Ndc80複合体はNdc80,Nuf2,Spc24,Spc25からなるつえ型をしたヘテロ四量体である.Spc24-Spc25複合体は,CCANとよばれるインナーキネトコアタンパク質と結合することにより染色体と結合する1).Ndc80は,微小管と直接に結合するN末端テイルドメインおよびCHドメインと,微小管結合タンパク質と結合するLoopドメインをもつ2).Loopドメインは,微小管結合タンパク質であるDam1複合体(出芽酵母),Dis1(分裂酵母),Ska複合体(ヒト),あるいは,Cdt1(ヒト)のキネトコアへの局在に必須であることが報告されている3).Dam1複合体(ヒトにおいては,Ska複合体が機能的な相同体であると考えられている)は10種類のタンパク質から構成され,in vitroにおいて微小管のうえにリング状の構造を形成する4).また,in vivoにおいてDam1複合体のキネトコアへの局在はNdc80複合体に依存することが知られているが,Ndc80複合体とDam1複合体がどのようにキネトコアにおける張力に寄与するのかはよくわかっていない.
出芽酵母は,遺伝子の相同組換えが簡単であること,多くのキネトコアタンパク質が保存されていること,細胞周期が短く実験が短時間で進行することから,非常に有用なモデル生物である.出芽酵母と脊椎動物のキネトコアにおけるもっとも大きな違いは,出芽酵母がポイントセントロメアをもつのに対し,脊椎動物はタンデムリピート構造のセントロメアをもつであることである5).この違いにより,出芽酵母はひとつのキネトコアにひとつの微小管しか結合しないが,哺乳類ではひとつのキネトコアに複数の微小管が結合する.一方で,ひとつの微小管に結合するNdc80複合体の数は,出芽酵母,ニワトリ,ヒトにおいてある程度まで保存されている6).もうひとつの大きな相違点は,脊椎動物の細胞において微小管は細胞分裂期にのみキネトコアと結合するが,出芽酵母において微小管は基本的に細胞周期をとおしてキネトコアと結合する.これと一致して,Ndc80複合体は脊椎動物の細胞においてG2後期からM期にのみキネトコアに局在するが,出芽酵母においては細胞周期をとおしてキネトコアに局在する.また,出芽酵母は16本の染色体をもつが,間期においてこの16本の染色体はひとつのクラスターを形成し,また,細胞分裂期においては複製された姉妹染色体が2つのクラスターを形成する.このことから,この研究においては,ひとつのキネトコアの挙動ではなく,16個のキネトコアの平均した挙動を測定していることになる.
張力を測定する方法として,FRET(fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)を利用した.FRETはドナーおよびアクセプターとよばれる2つの蛍光体が10 nm以下の距離をへだてて存在するときに蛍光が放射されることを利用した,もっとも精度の高い測定手法のひとつである.実際に,ドナーとアクセプターのあいだの距離とFRET効率とが直線的に相関するのは,蛍光の種類にもよるが,もう少し狭い3~7 nmである.この研究の場合のように,ひとつのタンパク質がドナーとアクセプターをもつ場合にはドナーとアクセプターの分子数はつねに一対一なので,FRETの光度をドナーの光度で割ることによりFRETの変化を解析することが可能である.
Ndc80の担う張力を測定する目的で,FRETプローブを内在性のNdc80のCHドメインとLoopドメインとのあいだに挿入した細胞株を樹立した(図1a).実際には,複数の部位への挿入を試みたのだが,Ndc80複合体の機能を阻害しなかったのはこの部位のみであった.また,挿入したFRETプローブはリンカーとしてドナーとアクセプターのあいだに12アミノ酸残基の挿入がある.これも,4つの異なる長さのリンカーの挿入を試みたのだが,この12アミノ酸残基のリンカーだけが機能した.
Ndc80張力センサーが本当に張力を認識できるのか確かめるため,Ndc80複合体の別の構成タンパク質であるNuf2のC末端に同じFRETプローブを付加した細胞株を樹立した(図1b).この細胞株は,FRETプローブの一端しかNuf2と結合していないため張力を認識できない.これらの細胞株においてFRETシグナルを比較すると,Ndc80張力センサーにおいては微小管の張力をうけてドナーとアクセプターとの距離が離れ,FRETシグナルが有意に低下した.また,Nuf2のC末端にFRETプローブを導入した細胞株においてFRET効率を測定したところ,同じFRETプローブのin vitroにおけるFRET効率とほぼ一致した.
出芽酵母においてはNdc80複合体は細胞周期をとおしてキネトコアに局在することから,Ndc80張力センサーを用いて細胞周期をとおした張力をモニターした.その結果,細胞分裂中期において最小のFRETシグナル(最大の張力)が,細胞分裂後期において最大のFRETシグナル(最小の張力)が観測された.間期において細胞分裂後期よりも低いFRETシグナルが観測されたが,間期においても染色体はダイナミックに動いていることが知られているので,細胞分裂期とは異なる機構によりキネトコアに張力が生じていることが考えられた.また,Ndc80張力センサーにより測定されたFRETシグナルの変化は,異なるNdc80のあいだに起こったFRETの変化をとらえたものではなく,ひとつのNdc80のあいだで起こったFRETの変化であることが確認された.
Ndc80のN末端テイルドメインはAurora Bによるリン酸化制御をうける2).N末端テイルドメインがリン酸化されていると微小管との結合力は減少し,脱リン酸化されると微小管とより強固に結合するようになる.哺乳類の細胞においては,このN末端テイルドメインが細胞分裂に必須であることが報告されている2).しかし,出芽酵母においては,哺乳類と同様にN末端テイルドメインはAurora B(Ipl1)によりリン酸化制御をうけるにもかかわらず,細胞の生育には必須でないことが知られていた7,8).そこで,出芽酵母におけるN末端テイルドメインの機能をより詳細に解析する目的で,内在性のNdc80のもつN末端テイルドメインを完全に除去してFRETプローブを挿入した細胞株を樹立した.その結果,Ndc80張力センサーのFRETシグナルはN末端テイルドメインを除去すると,Nuf2のC末端にFRETプローブを挿入した細胞株とほぼ同等のレベルにまで上昇した.このことから,出芽酵母においてN末端テイルドメインは,哺乳類と同様に,Ndc80の担う張力に必須であることが示唆された.さらに,N末端テイルドメインを除去した細胞株では細胞分裂期の時間,とくに,細胞分裂前中期から細胞分裂中期への進行がいちじるしく遅延したことから,N末端テイルドメインは生育には必須でないものの,正常な細胞分裂に必須であることも明らかにされた.
細胞分裂中期において複製された姉妹染色体は,異なる極から伸長した微小管によりキネトコアを介して引っ張られる.このとき,姉妹染色体はコヒーシンなどのタンパク質によりつなぎとめられているため,姉妹染色体のキネトコアは0.8~0.9μmの距離を上限として引っ張られた状態を維持する9)(セントロメアストレッチ).余談ではあるが,細胞や染色体の大きさは大きく異なるにもかかわらず,酵母からヒトまで,この細胞分裂中期におけるセントロメアストレッチはほぼ変わらず1μmくらいである10).N末端テイルドメインを除去した細胞株においてNdc80の担う張力はほぼゼロに近いにもかかわらず,セントロメアストレッチはほぼ正常に維持されていた.このことから,出芽酵母においてセントロメアストレッチの維持にNdc80の担う張力は必須ではないこと,いい換えれば,Ndc80に代わりほかのタンパク質がセントロメアストレッチに必要な張力を担うことが示された.出芽酵母においてはDam1複合体がNdc80複合体と同様あるいはそれ以上にキネトコアと微小管との結合に寄与すると考えられており,Ndc80張力センサーから得られた結果はこれを強く支持した.
細胞分裂期において微小管は重合と脱重合を交互にくり返しており,これを動的不安定性とよぶ.微小管の重合阻害薬のひとつであるベノミルは,低容量では微小管の動的不安定性を5倍ほど低下させるが細胞の増殖は可能である11).ベノミルを添加した細胞株において,Ndc80張力センサーのFRETシグナルは有意に上昇した(張力の減少).この結果は,Ndc80による張力の寄与が,微小管の重合時と脱重合時において異なる可能性を示唆した.実際に,細胞分裂中期のキネトコアにおいて,Ndc80張力センサーのFRETシグナル,および,微小管の重合時に微小管のさきにより局在するStu2(XMAP215)あるいはBim1の量は平均的に変動し,その変動はベノミルの添加により有意に抑制された.
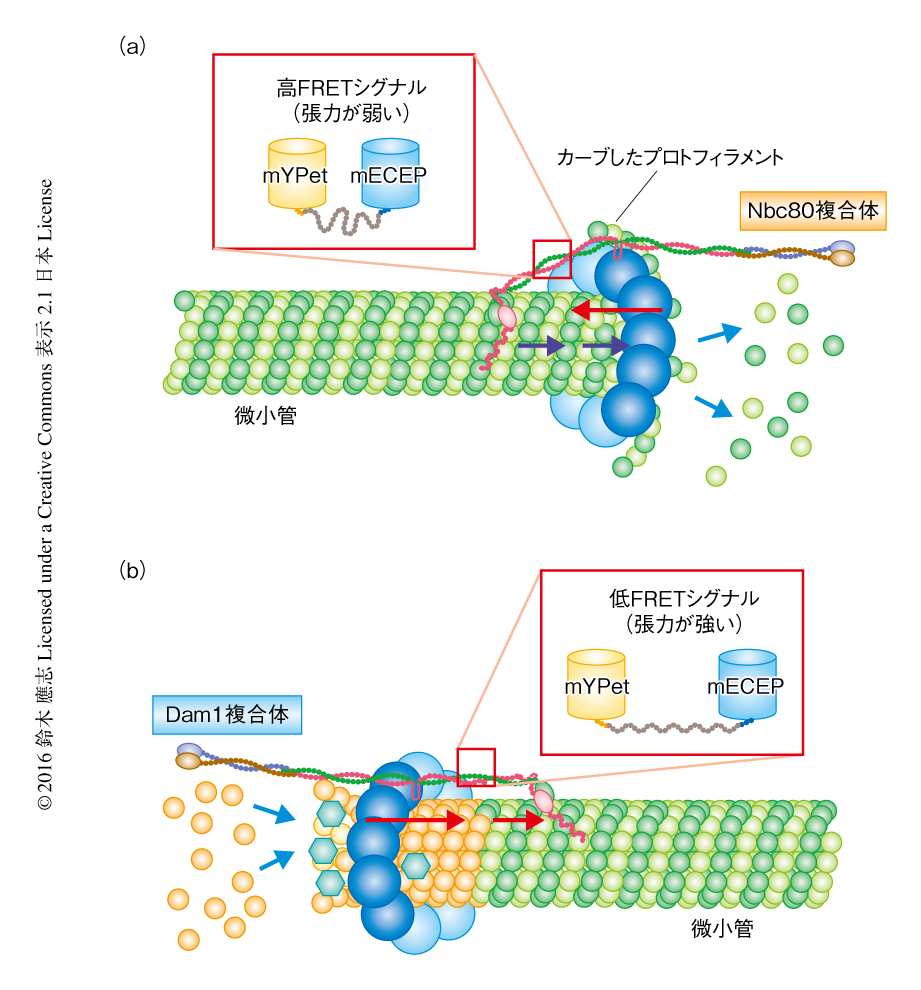
Ndc80の担う張力がどのような分子機構により微小管の動的不安定性に依存して変化するのかを明らかにするため,in vivoにおける結果をもとにコンピューターシミュレーションを構築した.その結果,微小管の重合時にはNdc80複合体およびDam1複合体がキネトコアの張力に大きく寄与する一方,脱重合時にはカーブしたプロトフィラメントによりDam1複合体が極の側に押されることで,結果的にNdc80複合体の張力への寄与がいちじるしく減少することが示唆された(図2).また,このシミュレーションは,Ndc80の牽引力をなくした際にはDam1複合体の張力によりセントロメアストレッチが維持されること,微小管の動的不安定性を低下させるとNdc80の張力が有意に減少することなど,in vivoにおける結果を支持するものであった.
さらに,シミュレーションにより得られたNdc80複合体およびDam1複合体による張力連結器モデルを検証するため,Dam1と微小管との結合が増加することが報告されているdam1-765変異体を用いて12),Ndc80の担う張力を測定した.これは,シミュレーションによりDam1の牽引力を増加すると微小管の重合時においてもDam1複合体がGTPチューブリンにスライドすることができず,結果的にNdc80の張力が有意に減少することが示唆されたためである.dam1-765変異株においてNdc80張力センサーのFRETシグナルを測定したところ,FRETシグナルは有意に上昇し(張力の減少),シミュレーションから予測された結果と一致した.
Ndc80張力センサーにより,Ndc80複合体およびDam1複合体が微小管の動的不安定性に依存して,複雑な張力連結器として機能していることが明らかにされた.しかしながら,この研究において用いたNdc80張力センサーはNdc80の担う張力のみを認識し,キネトコア全体の張力は認識できない.キネトコアにおける張力の伝達機構をより詳細に解明するためには,よりセントロメアの側に位置するタンパク質にFRETプローブを挿入したキネトコア張力バイオセンサーの樹立が必須である.また,この研究において明らかにされた出芽酵母のキネトコアにおける張力の伝達機構は,ヒトを含む高等な脊椎動物においても保存されているのか,あるいは,まったく異なる伝達機構が獲得されているのかを検証するため,高等脊椎動物の細胞における張力バイオセンサーの樹立も重要な課題である.
略歴:2010年 総合研究大学院大学生命科学研究科博士課程 修了,同年 国立遺伝学研究所分子遺伝研究部門 博士研究員を経て,2011年より米国North Carolina大学Chapel Hill校 博士研究員.
研究テーマ:染色体分配の機構.
抱負:これからもおもしろい研究をつづけていきたい.
© 2016 鈴木 應志 Licensed under CC 表示 2.1 日本
(米国North Carolina大学Chapel Hill校Department of Biology)
email:鈴木應志
DOI: 10.7875/first.author.2016.027
How the kinetochore couples microtubule force and centromere stretch to move chromosomes.
Aussie Suzuki, Benjamin L. Badger, Julian Haase, Tomoo Ohashi, Harold P. Erickson, Edward D. Salmon, Kerry Bloom
Nature Cell Biology, 18, 382-392 (2016)
要 約
キネトコアは巨大なタンパク質構造体であり,セントロメアとよばれる染色体の特異的な配列のうえに形成され,細胞分裂において微小管との結合の土台になる.近年,多くのキネトコア関連タンパク質が同定され,その詳細な機能が精力的に解析されているが,複雑なタンパク質構造体であるキネトコアが微小管から染色体へどのように張力を伝達するのかは解明されていない.Ndc80複合体は酵母からヒトまで機能的および構造的に高度に保存され,微小管と直接に結合することにより染色体分配および紡錘体形成チェックポイントを制御する.この研究においては,出芽酵母を用いて,内在性のNdc80にFRETプローブを挿入することにより,Ndc80複合体のもつ機能を阻害することなくNdc80の担う張力をモニターできる細胞株を樹立した.このNdc80張力センサーをモニターした結果,Ndc80の担う張力は細胞分裂中期においてもっとも強く,細胞分裂後期においてもっとも低くなることがわかった.また,出芽酵母のNdc80の微小管結合部位の機能は,考えられていたより進化的に保存されていることが見い出された.さらに,in vivoおよびin silicoにおける実験結果から,キネトコアは単純な張力受容器ではなく,より複雑な張力連結器として機能していることが示唆された.
はじめに
Ndc80複合体はNdc80,Nuf2,Spc24,Spc25からなるつえ型をしたヘテロ四量体である.Spc24-Spc25複合体は,CCANとよばれるインナーキネトコアタンパク質と結合することにより染色体と結合する1).Ndc80は,微小管と直接に結合するN末端テイルドメインおよびCHドメインと,微小管結合タンパク質と結合するLoopドメインをもつ2).Loopドメインは,微小管結合タンパク質であるDam1複合体(出芽酵母),Dis1(分裂酵母),Ska複合体(ヒト),あるいは,Cdt1(ヒト)のキネトコアへの局在に必須であることが報告されている3).Dam1複合体(ヒトにおいては,Ska複合体が機能的な相同体であると考えられている)は10種類のタンパク質から構成され,in vitroにおいて微小管のうえにリング状の構造を形成する4).また,in vivoにおいてDam1複合体のキネトコアへの局在はNdc80複合体に依存することが知られているが,Ndc80複合体とDam1複合体がどのようにキネトコアにおける張力に寄与するのかはよくわかっていない.
出芽酵母は,遺伝子の相同組換えが簡単であること,多くのキネトコアタンパク質が保存されていること,細胞周期が短く実験が短時間で進行することから,非常に有用なモデル生物である.出芽酵母と脊椎動物のキネトコアにおけるもっとも大きな違いは,出芽酵母がポイントセントロメアをもつのに対し,脊椎動物はタンデムリピート構造のセントロメアをもつであることである5).この違いにより,出芽酵母はひとつのキネトコアにひとつの微小管しか結合しないが,哺乳類ではひとつのキネトコアに複数の微小管が結合する.一方で,ひとつの微小管に結合するNdc80複合体の数は,出芽酵母,ニワトリ,ヒトにおいてある程度まで保存されている6).もうひとつの大きな相違点は,脊椎動物の細胞において微小管は細胞分裂期にのみキネトコアと結合するが,出芽酵母において微小管は基本的に細胞周期をとおしてキネトコアと結合する.これと一致して,Ndc80複合体は脊椎動物の細胞においてG2後期からM期にのみキネトコアに局在するが,出芽酵母においては細胞周期をとおしてキネトコアに局在する.また,出芽酵母は16本の染色体をもつが,間期においてこの16本の染色体はひとつのクラスターを形成し,また,細胞分裂期においては複製された姉妹染色体が2つのクラスターを形成する.このことから,この研究においては,ひとつのキネトコアの挙動ではなく,16個のキネトコアの平均した挙動を測定していることになる.
張力を測定する方法として,FRET(fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)を利用した.FRETはドナーおよびアクセプターとよばれる2つの蛍光体が10 nm以下の距離をへだてて存在するときに蛍光が放射されることを利用した,もっとも精度の高い測定手法のひとつである.実際に,ドナーとアクセプターのあいだの距離とFRET効率とが直線的に相関するのは,蛍光の種類にもよるが,もう少し狭い3~7 nmである.この研究の場合のように,ひとつのタンパク質がドナーとアクセプターをもつ場合にはドナーとアクセプターの分子数はつねに一対一なので,FRETの光度をドナーの光度で割ることによりFRETの変化を解析することが可能である.
1.Ndc80の担う張力の変化を細胞周期をとおしてモニターする
Ndc80の担う張力を測定する目的で,FRETプローブを内在性のNdc80のCHドメインとLoopドメインとのあいだに挿入した細胞株を樹立した(図1a).実際には,複数の部位への挿入を試みたのだが,Ndc80複合体の機能を阻害しなかったのはこの部位のみであった.また,挿入したFRETプローブはリンカーとしてドナーとアクセプターのあいだに12アミノ酸残基の挿入がある.これも,4つの異なる長さのリンカーの挿入を試みたのだが,この12アミノ酸残基のリンカーだけが機能した.
Ndc80張力センサーが本当に張力を認識できるのか確かめるため,Ndc80複合体の別の構成タンパク質であるNuf2のC末端に同じFRETプローブを付加した細胞株を樹立した(図1b).この細胞株は,FRETプローブの一端しかNuf2と結合していないため張力を認識できない.これらの細胞株においてFRETシグナルを比較すると,Ndc80張力センサーにおいては微小管の張力をうけてドナーとアクセプターとの距離が離れ,FRETシグナルが有意に低下した.また,Nuf2のC末端にFRETプローブを導入した細胞株においてFRET効率を測定したところ,同じFRETプローブのin vitroにおけるFRET効率とほぼ一致した.
出芽酵母においてはNdc80複合体は細胞周期をとおしてキネトコアに局在することから,Ndc80張力センサーを用いて細胞周期をとおした張力をモニターした.その結果,細胞分裂中期において最小のFRETシグナル(最大の張力)が,細胞分裂後期において最大のFRETシグナル(最小の張力)が観測された.間期において細胞分裂後期よりも低いFRETシグナルが観測されたが,間期においても染色体はダイナミックに動いていることが知られているので,細胞分裂期とは異なる機構によりキネトコアに張力が生じていることが考えられた.また,Ndc80張力センサーにより測定されたFRETシグナルの変化は,異なるNdc80のあいだに起こったFRETの変化をとらえたものではなく,ひとつのNdc80のあいだで起こったFRETの変化であることが確認された.
2.N末端テイルドメインの機能は考えられていたより進化的に保存されていた
Ndc80のN末端テイルドメインはAurora Bによるリン酸化制御をうける2).N末端テイルドメインがリン酸化されていると微小管との結合力は減少し,脱リン酸化されると微小管とより強固に結合するようになる.哺乳類の細胞においては,このN末端テイルドメインが細胞分裂に必須であることが報告されている2).しかし,出芽酵母においては,哺乳類と同様にN末端テイルドメインはAurora B(Ipl1)によりリン酸化制御をうけるにもかかわらず,細胞の生育には必須でないことが知られていた7,8).そこで,出芽酵母におけるN末端テイルドメインの機能をより詳細に解析する目的で,内在性のNdc80のもつN末端テイルドメインを完全に除去してFRETプローブを挿入した細胞株を樹立した.その結果,Ndc80張力センサーのFRETシグナルはN末端テイルドメインを除去すると,Nuf2のC末端にFRETプローブを挿入した細胞株とほぼ同等のレベルにまで上昇した.このことから,出芽酵母においてN末端テイルドメインは,哺乳類と同様に,Ndc80の担う張力に必須であることが示唆された.さらに,N末端テイルドメインを除去した細胞株では細胞分裂期の時間,とくに,細胞分裂前中期から細胞分裂中期への進行がいちじるしく遅延したことから,N末端テイルドメインは生育には必須でないものの,正常な細胞分裂に必須であることも明らかにされた.
3.Ndc80の担う張力はセントロメアストレッチに必須ではない
細胞分裂中期において複製された姉妹染色体は,異なる極から伸長した微小管によりキネトコアを介して引っ張られる.このとき,姉妹染色体はコヒーシンなどのタンパク質によりつなぎとめられているため,姉妹染色体のキネトコアは0.8~0.9μmの距離を上限として引っ張られた状態を維持する9)(セントロメアストレッチ).余談ではあるが,細胞や染色体の大きさは大きく異なるにもかかわらず,酵母からヒトまで,この細胞分裂中期におけるセントロメアストレッチはほぼ変わらず1μmくらいである10).N末端テイルドメインを除去した細胞株においてNdc80の担う張力はほぼゼロに近いにもかかわらず,セントロメアストレッチはほぼ正常に維持されていた.このことから,出芽酵母においてセントロメアストレッチの維持にNdc80の担う張力は必須ではないこと,いい換えれば,Ndc80に代わりほかのタンパク質がセントロメアストレッチに必要な張力を担うことが示された.出芽酵母においてはDam1複合体がNdc80複合体と同様あるいはそれ以上にキネトコアと微小管との結合に寄与すると考えられており,Ndc80張力センサーから得られた結果はこれを強く支持した.
4.キネトコアにおける張力の伝達機構
細胞分裂期において微小管は重合と脱重合を交互にくり返しており,これを動的不安定性とよぶ.微小管の重合阻害薬のひとつであるベノミルは,低容量では微小管の動的不安定性を5倍ほど低下させるが細胞の増殖は可能である11).ベノミルを添加した細胞株において,Ndc80張力センサーのFRETシグナルは有意に上昇した(張力の減少).この結果は,Ndc80による張力の寄与が,微小管の重合時と脱重合時において異なる可能性を示唆した.実際に,細胞分裂中期のキネトコアにおいて,Ndc80張力センサーのFRETシグナル,および,微小管の重合時に微小管のさきにより局在するStu2(XMAP215)あるいはBim1の量は平均的に変動し,その変動はベノミルの添加により有意に抑制された.
Ndc80の担う張力がどのような分子機構により微小管の動的不安定性に依存して変化するのかを明らかにするため,in vivoにおける結果をもとにコンピューターシミュレーションを構築した.その結果,微小管の重合時にはNdc80複合体およびDam1複合体がキネトコアの張力に大きく寄与する一方,脱重合時にはカーブしたプロトフィラメントによりDam1複合体が極の側に押されることで,結果的にNdc80複合体の張力への寄与がいちじるしく減少することが示唆された(図2).また,このシミュレーションは,Ndc80の牽引力をなくした際にはDam1複合体の張力によりセントロメアストレッチが維持されること,微小管の動的不安定性を低下させるとNdc80の張力が有意に減少することなど,in vivoにおける結果を支持するものであった.
さらに,シミュレーションにより得られたNdc80複合体およびDam1複合体による張力連結器モデルを検証するため,Dam1と微小管との結合が増加することが報告されているdam1-765変異体を用いて12),Ndc80の担う張力を測定した.これは,シミュレーションによりDam1の牽引力を増加すると微小管の重合時においてもDam1複合体がGTPチューブリンにスライドすることができず,結果的にNdc80の張力が有意に減少することが示唆されたためである.dam1-765変異株においてNdc80張力センサーのFRETシグナルを測定したところ,FRETシグナルは有意に上昇し(張力の減少),シミュレーションから予測された結果と一致した.
おわりに
Ndc80張力センサーにより,Ndc80複合体およびDam1複合体が微小管の動的不安定性に依存して,複雑な張力連結器として機能していることが明らかにされた.しかしながら,この研究において用いたNdc80張力センサーはNdc80の担う張力のみを認識し,キネトコア全体の張力は認識できない.キネトコアにおける張力の伝達機構をより詳細に解明するためには,よりセントロメアの側に位置するタンパク質にFRETプローブを挿入したキネトコア張力バイオセンサーの樹立が必須である.また,この研究において明らかにされた出芽酵母のキネトコアにおける張力の伝達機構は,ヒトを含む高等な脊椎動物においても保存されているのか,あるいは,まったく異なる伝達機構が獲得されているのかを検証するため,高等脊椎動物の細胞における張力バイオセンサーの樹立も重要な課題である.
文 献
- Perpelescu, M. & Fukagawa, T.: The ABCs of CENPs. Chromosoma, 120, 425-446 (2011)[PubMed]
- Ciferri, C., Pasqualato, S., Screpanti, E. et al.: Implications for kinetochore-microtubule attachment from the structure of an engineered Ndc80 complex. Cell, 133, 427-439 (2008)[PubMed]
- Tang, N. H. & Toda, T.: MAPping the Ndc80 loop in cancer: a possible link between Ndc80/Hec1 overproduction and cancer formation. Bioessays, 37, 248-256 (2015)[PubMed]
- Nogales, E. & Ramey, V. H.: Structure-function insights into the yeast Dam1 kinetochore complex. J. Cell Sci., 122, 3831-3836 (2009)[PubMed]
- Fukagawa, T. & Earnshaw, W. C.: The centromere: chromatin foundation for the kinetochore machinery. Dev. Cell, 30, 496-508 (2014)[PubMed]
- Suzuki, A., Badger, B. L. & Salmon, E. D.: A quantitative description of Ndc80 complex linkage to human kinetochores. Nat. Commun., 6, 8161 (2015)[PubMed]
- Akiyoshi, B., Nelson, C. R., Ranish, J. A. et al.: Analysis of Ipl1-mediated phosphorylation of the Ndc80 kinetochore protein in Saccharomyces cerevisiae. Genetics, 183, 1591-1595 (2009)[PubMed]
- Demirel, P. B., Keyes, B. E., Chaterjee, M. et al.: A redundant function for the N-terminal tail of Ndc80 in kinetochore-microtubule interaction in Saccharomyces cerevisiae. Genetics, 192, 753-756 (2012)[PubMed]
- Hirano, T.: Chromosome dynamics during mitosis. Cold Spring Harb. Perspect. Biol., 7, a015792 (2015)[PubMed]
- Bloom, K. S.: Centromeric heterochromatin: the primordial segregation machine. Annu. Rev. Genet., 48, 457-484 (2014)[PubMed]
- Pearson, C. G., Maddox, P. S., Zarzar, T. R. et al.: Yeast kinetochores do not stabilize Stu2p-dependent spindle microtubule dynamics. Mol. Biol. Cell, 14, 4181-4195 (2003)[PubMed]
- Shimogawa, M. M., Graczyk, B., Gardner, M. K. et al.: Mps1 phosphorylation of Dam1 couples kinetochores to microtubule plus ends at metaphase. Curr. Biol., 16, 1489-1501 (2006)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2010年 総合研究大学院大学生命科学研究科博士課程 修了,同年 国立遺伝学研究所分子遺伝研究部門 博士研究員を経て,2011年より米国North Carolina大学Chapel Hill校 博士研究員.
研究テーマ:染色体分配の機構.
抱負:これからもおもしろい研究をつづけていきたい.
© 2016 鈴木 應志 Licensed under CC 表示 2.1 日本