PETを分解する細菌の発見
吉田昭介1,宮本憲二1,小田耕平2
(1慶應義塾大学理工学部 生命情報学科生物機能化学研究室,2京都工芸繊維大学)
email:吉田昭介,宮本憲二,小田耕平
DOI: 10.7875/first.author.2016.023
A bacterium that degrades and assimilates poly(ethylene terephthalate).
Shosuke Yoshida, Kazumi Hiraga, Toshihiko Takehana, Ikuo Taniguchi, Hironao Yamaji, Yasuhito Maeda, Kiyotsuna Toyohara, Kenji Miyamoto, Yoshiharu Kimura, Kohei Oda
Science, 351, 1196-1199 (2016)
PETはペットボトルや衣類などの用途のため製造され,ほとんどの場合,短期間の使用ののち廃棄されている.その多くは環境へ流出するが,生物による分解をうけず蓄積する一方であると考えられてきた.筆者らは,PETの屑の混入した環境試料を採取し,結晶度の低いPETフィルムをおもな炭素源とする条件で集積培養を施した.その結果,PETフィルムを分解し資化する細菌の分離に成功し,Ideonella sakaiensis 201-F6株と名づけた.この細菌のゲノム情報を基盤としてPETを分解する酵素を探索したところ,PETからモノヒドロキシエチルテレフタレートをおもに遊離する活性をもつ酵素が同定された.さらに,遊離のモノヒドロキシエチルテレフタレートをテレフタル酸とエチレングリコールとに加水分解する活性をもつ酵素も同定された.この2つの酵素により,PETはすでに代謝経路の報告されているテレフタル酸とエチレングリコールまで効率的に分解されることが明らかにされた.
合成樹脂は頑強性,可塑性,透明性などのすぐれた性質をもち,さまざまな商品に用いられている.多くの合成樹脂は環境において安定であるが,その原因として,これら合成樹脂に作用しうる分解酵素が存在しない,あるいは,その活性が低いことが考えられる.とくに,芳香族ポリエステルの一種でペットボトルや衣類などに汎用されているPET(poly(ethylene terephthalate),ポリエチレンテレフタレート)はきわめて安定な物質として知られている1).PETの世界生産量は5600万トン(2013年)と非常に多く,その原料となるテレフタル酸およびエチレングリコールはともに石油を原料として製造されることから,PETからなる製品の廃棄は原油の過剰な採掘の一因ともいえる.
2005年を皮切りに,クチナーゼやリパーゼといった脂肪族エステル加水分解酵素によるPETの加水分解の報告があいつぐようになった2).これらの酵素はポリエステル製の衣服の風合い加工など,種々の応用が期待されている3).一方で,PETを炭素源として生育する微生物の報告はFusarium属の真菌のみであった4,5).しかも,これらの報告においては,PETの分解や微生物の生育の程度,また,分解機構については記載されていない.このように,PETの加水分解酵素の存在が明らかにされる一方でPETを分解する微生物がほぼ未発見である現状は,これら酵素の本来のはたらきが脂肪族エステル類の加水分解であり,PETの分解は副次的な反応にすぎないためと考えられた.では,実際にPETを分解し資化する微生物は存在するのだろうか.もし存在し,それを探し出すことができたなら,酵素分解や発酵といった生物的なアプローチにより廃棄されたPETを資源化する新たな可能性が生まれると考えられた.
PETを分解する微生物は,周囲にPETが豊富に存在し,さらに,容易に栄養となりうるものが少ない環境に偏在していると考えた.この仮説にもとづき,PETのリサイクル工場などにおいてPETの屑を含む土壌,堆積物,処理水などさまざまな試料を採取した.得られた試料をPETフィルムをおもな炭素源とする培地に投入して30℃において振とう培養し,目的とする微生物の集積を試みた.分解の検出感度を上げるため,比較的分解されやすいと考えられる非晶質の高いPETフィルムを用意した6).数週間後,PETの屑を含む堆積物を投入した試験管において,PETフィルムに付着する特徴的な微生物塊が見い出された.顕微鏡による観察により,そのなかには多種多様な微生物の存在が認められた.さらに,この微生物塊をPETフィルムより取り除くと,PETの分解の顕著な進行が確認された.
PETの分解に直接的に関与する微生物の分離を試みた.まず,この微生物塊をPETの分解が認められなくなる直前まで希釈することにより,微生物群集の多様性を低減させた.さらに,PETフィルムを炭素源とした集積培養により目的の微生物の濃縮を図ったのち,プレート培地において目的の微生物をコロニー化させた.その結果,単離された細菌は堺市で採取した環境試料に由来する新種であったことからIdeonella sakaiensis 201-F6株と命名した7).I. sakaiensisをPETフィルムとともに培養しその過程においてPETフィルムを観察したところ,この細菌はファイバー状の突起物を伸長し,PETフィルムと,あるいは,細菌どうしが接着しているようすが観察された.
PETの分解酵素に関する情報を得るため,I. sakaiensisのゲノム塩基配列を解読し遺伝子情報を解析した.その結果,これまでにPETの加水分解能が報告されていたThermobifida fuscaに由来する加水分解酵素TfH 8) と51%の相同性をもつORF,ISF6_4831が見い出された.組換えタンパク質を調製しPETフィルムと反応させたところ,PETフィルムに無数のクレーター状の分解痕が認められ,また,反応溶液に分解産物と考えられるテレフタル酸およびモノヒドロキシエチルテレフタレートの存在が確認された.
すでに報告されていたPETの加水分解能をもつ酵素のうち,アミノ酸配列が判明しているものを収集し進化系統樹を作製した.さらに,さまざまな種類の酵素との比較のため,この系統樹においてそれぞれ進化的に分岐していた,好熱性放線菌に由来する酵素TfH,枝葉コンポストのメタゲノムに由来する酵素LCC 9),真菌に由来する酵素FsC 10) の3種を選んだ.そして,これらの組換えタンパク質を調製し,ISF6_4831と同じ条件において活性を比較した.その結果,ISF6_4831はPETフィルムに対し,TfHの120倍,LCCの5.5倍,FsCの88倍の活性を示した.ポリエステル鎖の可動性はガラス転移点に依存する11).PETのガラス転移点は約75℃,活性を測定した温度は30℃であったので,ISF6_4831は流動性の低下したガラス状態のPETにも作用しやすいと考えられた.
TfH,LCC,FsCの本来の基質と考えられる脂肪族エステルに対する活性について,直鎖脂肪族カルボン酸と発色団p-ニトロフェノールが脱水縮合した人工基質を用いて調べた.その結果,これら3種の酵素と比べISF6_4831の活性は低かった.しかし,これら人工基質と比べたPETフィルムに対するISF6_4831の分解特異性は,TfHの380倍,LCCの48倍,FsCの400倍であった.以上の結果から,ISF6_4831は中性pH,常温の条件においてPETに対し高い活性および基質特異性を示すことが明らかにされ,この酵素をその性質からPETヒドロラーゼと命名した.
PETヒドロラーゼはPETを加水分解してモノヒドロキシエチルテレフタレートをおもに反応溶液に遊離させた.しかし,PETヒドロラーゼはモノヒドロキシエチルテレフタレートを加水分解する活性を示さなかった.その一方で,I. sakaiensisをPETフィルムとともに培養した培養液において,モノヒドロキシエチルテレフタレートはほとんど検出されなかった.これらの事実から,I. sakaiensisはモノヒドロキシエチルテレフタレート加水分解酵素をもつと考えられた.これまで,モノヒドロキシエチルテレフタレートの加水分解能はPETの加水分解活性をもつ酵素の一部で報告されていた.しかし,I. sakaiensisのドラフトゲノムにおいて,それらのホモログをコードする遺伝子はPETヒドロラーゼをコードする遺伝子のほかには存在しなかった.したがって,これらの既知の酵素とはまったく異なるタンパク質がモノヒドロキシエチルテレフタレートの加水分解を担う可能性が考えられた.
I. sakaiensisの遺伝子発現の網羅的な解析から,モノヒドロキシエチルテレフタレート加水分解酵素をコードする遺伝子の予測を試みた.I. sakaiensisをそれぞれ,マルトース,テレフタル酸,ビスヒドロキシエチルテレフタレート,PETフィルムとともに培養した.テレフタル酸およびビスヒドロキシエチルテレフタレートはPETの代謝の中間産物となりうる化合物である.マルトースはPETの代謝経路とは重複がないと考えられるためPETの代謝の陰性対照として用いた.それぞれの培地において,対数増殖期中期にある菌体からmRNAを回収し,次世代シークエンサーにより塩基配列を解読したのち,I. sakaiensisドラフトゲノムへマッピングした.それぞれの培地における遺伝子発現パターンを比較することにより,PETヒドロラーゼともっともパターンの類似したORFとしてISF6_0224が見い出された.ISF6_0224は没食子酸エステル,フェルラ酸エステル,クロロゲン酸などのエステル結合を加水分解する酵素の一群であるタンナーゼファミリーに属しており,モノヒドロキシエチルテレフタレートはこれらの化合物とエステル結合をもつ芳香族化合物という点で類似性があった.
ISF6_0224の組換えタンパク質を調製しその機能の同定を試みた.その結果,ISF6_0224はモノヒドロキシエチルテレフタレートに対し高い加水分解活性および親和性を示すことがわかった.その一方で,ISF6_0224はタンナーゼファミリーに属するタンパク質が基質とする典型的な化合物や,PETフィルム,脂肪族エステル人工基質にはまったく活性を示さなかった.これらの性質から,この酵素はモノヒドロキシエチルテレフタレートを本来の基質とする可能性が高いと考え,モノヒドロキシエチルテレフタレートヒドロラーゼと命名した.
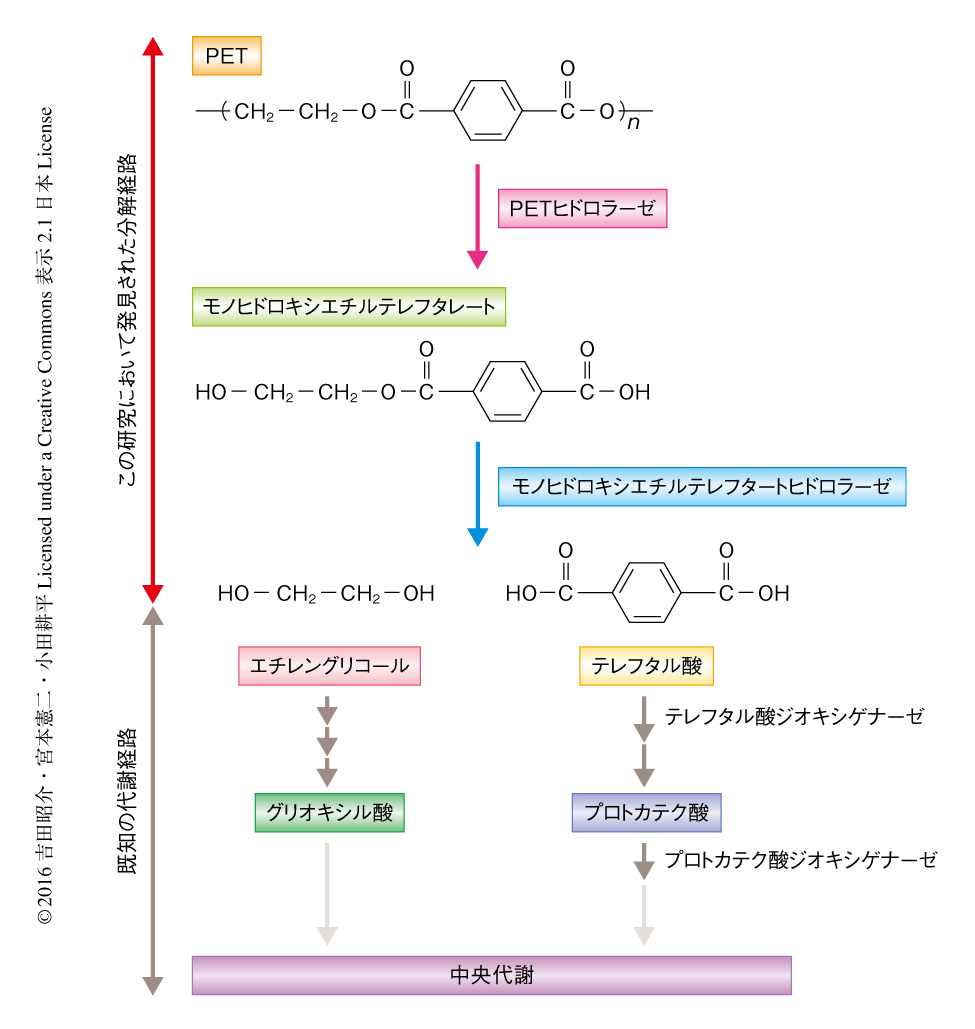
この研究において,世界ではじめてPETを分解し資化する細菌I. sakaiensisの存在が明らかにされ,PETを物質循環に組み込む生物的なルートが自然界に存在することが判明した.I. sakaiensisは炭素源としてPETフィルムをあたえると増殖し,PETフィルムへファイバー状の突起物を伸長させた.このとき,PETヒドロラーゼおよびモノヒドロキシエチルテレフタレートヒドロラーゼの発現を増大させた.PETヒドロラーゼはPETを加水分解してモノヒドロキシエチルテレフタレートを遊離し,モノヒドロキシエチルテレフタレートヒドロラーゼはこのモノヒドロキシエチルテレフタレートを迅速に加水分解することにより,すでに代謝経路の判明しているテレフタル酸とエチレングリコールとに変換した(図1).それぞれの酵素は常温で十分に高い活性をもち,それぞれの基質に対する触媒特異性は高かった.さらに,I. sakaiensisのPETフィルムを炭素源とした培養においては,テレフタル酸代謝遺伝子群の発現も大きく上昇していることもわかった.これらの結果から,I. sakaiensisは自然界においてPETを炭素源として生育するための機構をもつと考えられた.
ゲノムが明らかにされている生物において,PETヒドロラーゼ,モノヒドロキシエチルテレフタレートヒドロラーゼ,テレフタル酸ジオキシゲナーゼ,プロトカテク酸ジオキシゲナーゼといったPETの代謝に必須と考えられる特徴的な酵素のホモログをすべてもつ生物は見い出されなかった.これは,自然界にPETの代謝系をもちうる生物が非常にまれである(いない可能性もある)ことを示唆する結果であった.一方で,モノヒドロキシエチルテレフタレートヒドロラーゼのホモログをもつ92の微生物のうち33はテレフタル酸ジオキシゲナーゼおよびプロトカテク酸ジオキシゲナーゼをもっていたことから,モノヒドロキシエチルテレフタレートのアナログに対する代謝系は古くから成立しており,そののち,PETヒドロラーゼをコードする遺伝子が水平伝播によりくわわることにより代謝系の拡張がなされたと考えられた.それが正しいとするならば,ペットボトルのリサイクル工場,あるいは,実験室におけるPETフィルムを用いた集積培養が,これらの遺伝子セットを獲得した細菌の自然選択,生き残りを助長したのではないだろうか.また,このような特殊な環境により,PETヒドロラーゼやモノヒドロキシエチルテレフタレートヒドロラーゼについても同様の選択圧がはたらくことにより分子進化が加速し,それぞれの基質に対する特異性が向上した可能性が考えられた.
略歴:2008年 京都大学大学院工学研究科 修了,同年 米国Illinois大学Urbana-Champaign校 博士研究員,2011年 慶應義塾大学理工学部 助教を経て,2014年より京都大学大学院工学研究科 博士研究員.
研究テーマ:酵素を中心とした微生物の多様な機能の解明.
宮本 憲二(Kenji Miyamoto)
慶應義塾大学理工学部 准教授.
小田 耕平(Kohei Oda)
京都工芸繊維大学名誉教授.
© 2016 吉田昭介・宮本憲二・小田耕平 Licensed under CC 表示 2.1 日本
(1慶應義塾大学理工学部 生命情報学科生物機能化学研究室,2京都工芸繊維大学)
email:吉田昭介,宮本憲二,小田耕平
DOI: 10.7875/first.author.2016.023
A bacterium that degrades and assimilates poly(ethylene terephthalate).
Shosuke Yoshida, Kazumi Hiraga, Toshihiko Takehana, Ikuo Taniguchi, Hironao Yamaji, Yasuhito Maeda, Kiyotsuna Toyohara, Kenji Miyamoto, Yoshiharu Kimura, Kohei Oda
Science, 351, 1196-1199 (2016)
この論文に出現する遺伝子・タンパク質のUniprot ID
クチナーゼ(P00590), リパーゼ, TfH(Q47RJ6), ISF6_4831(A0A0K8P6T7), LCC(G9BY57), FsC(P00590), PETヒドロラーゼ(A0A0K8P6T7), モノヒドロキシエチルテレフタレート加水分解酵素(A0A0K8P8E7), ISF6_0224(A0A0K8P8E7), モノヒドロキシエチルテレフタレートヒドロラーゼ(A0A0K8P8E7), テレフタル酸ジオキシゲナーゼ, プロトカテク酸ジオキシゲナーゼ
要 約
PETはペットボトルや衣類などの用途のため製造され,ほとんどの場合,短期間の使用ののち廃棄されている.その多くは環境へ流出するが,生物による分解をうけず蓄積する一方であると考えられてきた.筆者らは,PETの屑の混入した環境試料を採取し,結晶度の低いPETフィルムをおもな炭素源とする条件で集積培養を施した.その結果,PETフィルムを分解し資化する細菌の分離に成功し,Ideonella sakaiensis 201-F6株と名づけた.この細菌のゲノム情報を基盤としてPETを分解する酵素を探索したところ,PETからモノヒドロキシエチルテレフタレートをおもに遊離する活性をもつ酵素が同定された.さらに,遊離のモノヒドロキシエチルテレフタレートをテレフタル酸とエチレングリコールとに加水分解する活性をもつ酵素も同定された.この2つの酵素により,PETはすでに代謝経路の報告されているテレフタル酸とエチレングリコールまで効率的に分解されることが明らかにされた.
はじめに
合成樹脂は頑強性,可塑性,透明性などのすぐれた性質をもち,さまざまな商品に用いられている.多くの合成樹脂は環境において安定であるが,その原因として,これら合成樹脂に作用しうる分解酵素が存在しない,あるいは,その活性が低いことが考えられる.とくに,芳香族ポリエステルの一種でペットボトルや衣類などに汎用されているPET(poly(ethylene terephthalate),ポリエチレンテレフタレート)はきわめて安定な物質として知られている1).PETの世界生産量は5600万トン(2013年)と非常に多く,その原料となるテレフタル酸およびエチレングリコールはともに石油を原料として製造されることから,PETからなる製品の廃棄は原油の過剰な採掘の一因ともいえる.
2005年を皮切りに,クチナーゼやリパーゼといった脂肪族エステル加水分解酵素によるPETの加水分解の報告があいつぐようになった2).これらの酵素はポリエステル製の衣服の風合い加工など,種々の応用が期待されている3).一方で,PETを炭素源として生育する微生物の報告はFusarium属の真菌のみであった4,5).しかも,これらの報告においては,PETの分解や微生物の生育の程度,また,分解機構については記載されていない.このように,PETの加水分解酵素の存在が明らかにされる一方でPETを分解する微生物がほぼ未発見である現状は,これら酵素の本来のはたらきが脂肪族エステル類の加水分解であり,PETの分解は副次的な反応にすぎないためと考えられた.では,実際にPETを分解し資化する微生物は存在するのだろうか.もし存在し,それを探し出すことができたなら,酵素分解や発酵といった生物的なアプローチにより廃棄されたPETを資源化する新たな可能性が生まれると考えられた.
1.PETを分解する微生物の探索
PETを分解する微生物は,周囲にPETが豊富に存在し,さらに,容易に栄養となりうるものが少ない環境に偏在していると考えた.この仮説にもとづき,PETのリサイクル工場などにおいてPETの屑を含む土壌,堆積物,処理水などさまざまな試料を採取した.得られた試料をPETフィルムをおもな炭素源とする培地に投入して30℃において振とう培養し,目的とする微生物の集積を試みた.分解の検出感度を上げるため,比較的分解されやすいと考えられる非晶質の高いPETフィルムを用意した6).数週間後,PETの屑を含む堆積物を投入した試験管において,PETフィルムに付着する特徴的な微生物塊が見い出された.顕微鏡による観察により,そのなかには多種多様な微生物の存在が認められた.さらに,この微生物塊をPETフィルムより取り除くと,PETの分解の顕著な進行が確認された.
PETの分解に直接的に関与する微生物の分離を試みた.まず,この微生物塊をPETの分解が認められなくなる直前まで希釈することにより,微生物群集の多様性を低減させた.さらに,PETフィルムを炭素源とした集積培養により目的の微生物の濃縮を図ったのち,プレート培地において目的の微生物をコロニー化させた.その結果,単離された細菌は堺市で採取した環境試料に由来する新種であったことからIdeonella sakaiensis 201-F6株と命名した7).I. sakaiensisをPETフィルムとともに培養しその過程においてPETフィルムを観察したところ,この細菌はファイバー状の突起物を伸長し,PETフィルムと,あるいは,細菌どうしが接着しているようすが観察された.
2.PETの分解酵素の探索
PETの分解酵素に関する情報を得るため,I. sakaiensisのゲノム塩基配列を解読し遺伝子情報を解析した.その結果,これまでにPETの加水分解能が報告されていたThermobifida fuscaに由来する加水分解酵素TfH 8) と51%の相同性をもつORF,ISF6_4831が見い出された.組換えタンパク質を調製しPETフィルムと反応させたところ,PETフィルムに無数のクレーター状の分解痕が認められ,また,反応溶液に分解産物と考えられるテレフタル酸およびモノヒドロキシエチルテレフタレートの存在が確認された.
すでに報告されていたPETの加水分解能をもつ酵素のうち,アミノ酸配列が判明しているものを収集し進化系統樹を作製した.さらに,さまざまな種類の酵素との比較のため,この系統樹においてそれぞれ進化的に分岐していた,好熱性放線菌に由来する酵素TfH,枝葉コンポストのメタゲノムに由来する酵素LCC 9),真菌に由来する酵素FsC 10) の3種を選んだ.そして,これらの組換えタンパク質を調製し,ISF6_4831と同じ条件において活性を比較した.その結果,ISF6_4831はPETフィルムに対し,TfHの120倍,LCCの5.5倍,FsCの88倍の活性を示した.ポリエステル鎖の可動性はガラス転移点に依存する11).PETのガラス転移点は約75℃,活性を測定した温度は30℃であったので,ISF6_4831は流動性の低下したガラス状態のPETにも作用しやすいと考えられた.
TfH,LCC,FsCの本来の基質と考えられる脂肪族エステルに対する活性について,直鎖脂肪族カルボン酸と発色団p-ニトロフェノールが脱水縮合した人工基質を用いて調べた.その結果,これら3種の酵素と比べISF6_4831の活性は低かった.しかし,これら人工基質と比べたPETフィルムに対するISF6_4831の分解特異性は,TfHの380倍,LCCの48倍,FsCの400倍であった.以上の結果から,ISF6_4831は中性pH,常温の条件においてPETに対し高い活性および基質特異性を示すことが明らかにされ,この酵素をその性質からPETヒドロラーゼと命名した.
3.モノヒドロキシエチルテレフタレート加水分解酵素の探索
PETヒドロラーゼはPETを加水分解してモノヒドロキシエチルテレフタレートをおもに反応溶液に遊離させた.しかし,PETヒドロラーゼはモノヒドロキシエチルテレフタレートを加水分解する活性を示さなかった.その一方で,I. sakaiensisをPETフィルムとともに培養した培養液において,モノヒドロキシエチルテレフタレートはほとんど検出されなかった.これらの事実から,I. sakaiensisはモノヒドロキシエチルテレフタレート加水分解酵素をもつと考えられた.これまで,モノヒドロキシエチルテレフタレートの加水分解能はPETの加水分解活性をもつ酵素の一部で報告されていた.しかし,I. sakaiensisのドラフトゲノムにおいて,それらのホモログをコードする遺伝子はPETヒドロラーゼをコードする遺伝子のほかには存在しなかった.したがって,これらの既知の酵素とはまったく異なるタンパク質がモノヒドロキシエチルテレフタレートの加水分解を担う可能性が考えられた.
I. sakaiensisの遺伝子発現の網羅的な解析から,モノヒドロキシエチルテレフタレート加水分解酵素をコードする遺伝子の予測を試みた.I. sakaiensisをそれぞれ,マルトース,テレフタル酸,ビスヒドロキシエチルテレフタレート,PETフィルムとともに培養した.テレフタル酸およびビスヒドロキシエチルテレフタレートはPETの代謝の中間産物となりうる化合物である.マルトースはPETの代謝経路とは重複がないと考えられるためPETの代謝の陰性対照として用いた.それぞれの培地において,対数増殖期中期にある菌体からmRNAを回収し,次世代シークエンサーにより塩基配列を解読したのち,I. sakaiensisドラフトゲノムへマッピングした.それぞれの培地における遺伝子発現パターンを比較することにより,PETヒドロラーゼともっともパターンの類似したORFとしてISF6_0224が見い出された.ISF6_0224は没食子酸エステル,フェルラ酸エステル,クロロゲン酸などのエステル結合を加水分解する酵素の一群であるタンナーゼファミリーに属しており,モノヒドロキシエチルテレフタレートはこれらの化合物とエステル結合をもつ芳香族化合物という点で類似性があった.
ISF6_0224の組換えタンパク質を調製しその機能の同定を試みた.その結果,ISF6_0224はモノヒドロキシエチルテレフタレートに対し高い加水分解活性および親和性を示すことがわかった.その一方で,ISF6_0224はタンナーゼファミリーに属するタンパク質が基質とする典型的な化合物や,PETフィルム,脂肪族エステル人工基質にはまったく活性を示さなかった.これらの性質から,この酵素はモノヒドロキシエチルテレフタレートを本来の基質とする可能性が高いと考え,モノヒドロキシエチルテレフタレートヒドロラーゼと命名した.
おわりに
この研究において,世界ではじめてPETを分解し資化する細菌I. sakaiensisの存在が明らかにされ,PETを物質循環に組み込む生物的なルートが自然界に存在することが判明した.I. sakaiensisは炭素源としてPETフィルムをあたえると増殖し,PETフィルムへファイバー状の突起物を伸長させた.このとき,PETヒドロラーゼおよびモノヒドロキシエチルテレフタレートヒドロラーゼの発現を増大させた.PETヒドロラーゼはPETを加水分解してモノヒドロキシエチルテレフタレートを遊離し,モノヒドロキシエチルテレフタレートヒドロラーゼはこのモノヒドロキシエチルテレフタレートを迅速に加水分解することにより,すでに代謝経路の判明しているテレフタル酸とエチレングリコールとに変換した(図1).それぞれの酵素は常温で十分に高い活性をもち,それぞれの基質に対する触媒特異性は高かった.さらに,I. sakaiensisのPETフィルムを炭素源とした培養においては,テレフタル酸代謝遺伝子群の発現も大きく上昇していることもわかった.これらの結果から,I. sakaiensisは自然界においてPETを炭素源として生育するための機構をもつと考えられた.
ゲノムが明らかにされている生物において,PETヒドロラーゼ,モノヒドロキシエチルテレフタレートヒドロラーゼ,テレフタル酸ジオキシゲナーゼ,プロトカテク酸ジオキシゲナーゼといったPETの代謝に必須と考えられる特徴的な酵素のホモログをすべてもつ生物は見い出されなかった.これは,自然界にPETの代謝系をもちうる生物が非常にまれである(いない可能性もある)ことを示唆する結果であった.一方で,モノヒドロキシエチルテレフタレートヒドロラーゼのホモログをもつ92の微生物のうち33はテレフタル酸ジオキシゲナーゼおよびプロトカテク酸ジオキシゲナーゼをもっていたことから,モノヒドロキシエチルテレフタレートのアナログに対する代謝系は古くから成立しており,そののち,PETヒドロラーゼをコードする遺伝子が水平伝播によりくわわることにより代謝系の拡張がなされたと考えられた.それが正しいとするならば,ペットボトルのリサイクル工場,あるいは,実験室におけるPETフィルムを用いた集積培養が,これらの遺伝子セットを獲得した細菌の自然選択,生き残りを助長したのではないだろうか.また,このような特殊な環境により,PETヒドロラーゼやモノヒドロキシエチルテレフタレートヒドロラーゼについても同様の選択圧がはたらくことにより分子進化が加速し,それぞれの基質に対する特異性が向上した可能性が考えられた.
文 献
- Muller, R. J., Kleeberg, I. & Deckwer, W. D.: Biodegradation of polyesters containing aromatic constituents. J. Biotechnol., 86, 87-95 (2001)[PubMed]
- Zimmermann, W. & Billig, S.: Enzymes for the biofunctionalization of poly(ethylene terephthalate). Adv. Biochem. Eng. Biotechnol., 125, 97-120 (2011)[PubMed]
- Guebitz, G. M. & Cavaco-Paulo, A.: Enzymes go big: surface hydrolysis and functionalization of synthetic polymers. Trends Biotechnol., 26, 32-38 (2008)[PubMed]
- Nimchua, T., Eveleigh, D. E., Sangwatanaroj, U. et al.: Screening of tropical fungi producing polyethylene terephthalate-hydrolyzing enzyme for fabric modification. J. Ind. Microbiol. Biotechnol., 35, 843-850 (2008)[PubMed]
- Nimchua, T., Punnapayak, H. & Zimmermann, W.: Comparison of the hydrolysis of polyethylene terephthalate fibers by a hydrolase from Fusarium oxysporum LCH I and Fusarium solani f. sp. pisi. Biotechnol. J., 2, 361-364 (2007)[PubMed]
- Vertommen, M. A., Nierstrasz, V. A., van der Veer, M. et al.: Enzymatic surface modification of poly(ethylene terephthalate). J. Biotechnol., 120, 376-386 (2005)[PubMed]
- Tanasupawat, S., Takehana, T., Yoshida, S. et al.: Ideonella sakaiensis sp. nov., isolated from a microbial consortium that degrades PET. Int. J. Syst. Evol. Microbiol., 66, 2813-2818 (2016)[PubMed]
- Muller, R. J., Schrader, H., Profe, J. et al.: Enzymatic degradation of poly(ethylene terephthalate): Rapid hydrolyse using a hydrolase from T. fusca. Macromol. Rapid Commun., 26, 1400-1405 (2005)
- Sulaiman, S., Yamato, S., Kanaya, E. et al.: Isolation of a novel cutinase homolog with polyethylene terephthalate-degrading activity from leaf-branch compost by using a metagenomic approach. Appl. Environ. Microbiol., 78, 1556-1562 (2012)[PubMed]
- Silva, C. M., Carneiro, F., O'Neill, A. et al.: Cutinase: a new tool for biomodification of synthetic fibers. J. Polym. Sci. A. Polym. Chem., 43, 2448-2450 (2005)
- Marten, E., Muller, R. J. & Deckwer, W. D.: Studies on the enzymatic hydrolysis of polyesters. II. Aliphatic-aromatic copolyesters. Polym. Degrad. Stab., 88, 371-381 (2005)
著者プロフィール
略歴:2008年 京都大学大学院工学研究科 修了,同年 米国Illinois大学Urbana-Champaign校 博士研究員,2011年 慶應義塾大学理工学部 助教を経て,2014年より京都大学大学院工学研究科 博士研究員.
研究テーマ:酵素を中心とした微生物の多様な機能の解明.
宮本 憲二(Kenji Miyamoto)
慶應義塾大学理工学部 准教授.
小田 耕平(Kohei Oda)
京都工芸繊維大学名誉教授.
© 2016 吉田昭介・宮本憲二・小田耕平 Licensed under CC 表示 2.1 日本