真核生物の翻訳開始因子eIF2Bの結晶構造
柏木一宏1・伊藤拓宏1・横山茂之2
(1理化学研究所ライフサイエンス技術基盤研究センター 翻訳因子構造解析研究ユニット,2理化学研究所 横山構造生物学研究室)
email:柏木一宏,伊藤拓宏,横山茂之
DOI: 10.7875/first.author.2016.019
Crystal structure of eukaryotic translation initiation factor 2B.
Kazuhiro Kashiwagi, Mari Takahashi, Madoka Nishimoto, Takuya B. Hiyama, Toshiaki Higo, Takashi Umehara, Kensaku Sakamoto, Takuhiro Ito, Shigeyuki Yokoyama
Nature, 531, 122-125 (2016)
ストレス環境において,真核生物ではおもに翻訳開始因子eIF2Bの活性が阻害されることによりタンパク質の生合成は全体的に抑制される.eIF2Bは翻訳開始因子eIF2に対するグアニンヌクレオチド交換因子であり,eIF2のγサブユニットと結合したGDPをGTPへと交換する.ストレス環境において,eIF2のαサブユニットがリン酸化されることによりeIF2Bのヌクレオチド交換活性は阻害される.eIF2Bはα,β,γ,δ,εの5種類のサブユニット2分子ずつから構成されるヘテロ十量体であるが,その全体構造は未知であり,eIF2Bの活性制御の具体的な分子機構は不明であった.筆者らは,分裂酵母に由来するeIF2B十量体の立体構造をX線結晶構造解析により3.0Åの分解能で決定した.さらに,非天然アミノ酸残基の導入による光架橋法により,eIF2のαサブユニットおよびγサブユニットに対するeIF2Bの結合表面が明らかにされた.これらの結果から,eIF2のリン酸化は“非生産的”なeIF2-eIF2B複合体を形成させることにより,eIF2Bのヌクレオチド交換活性をさまたげていることが示唆された.
α,β,γの3種類のサブユニットからなる翻訳開始因子eIF2は,開始tRNAをリボソームへと輸送する役割を担う.GTP結合型のeIF2はリボソームにおいて開始コドンを認識したのち,GDP結合型になり開始tRNAを残してリボソームから解離する.eIF2のγサブユニットと結合したGDPは,eIF2に対するグアニンヌクレオチド交換因子である翻訳開始因子eIF2BによりGTPへと交換され,GTP結合型になったeIF2はふたたび翻訳の開始の過程に利用される1).このように,リボソームへの開始tRNAの供給はeIF2Bのヌクレオチド交換活性の影響をうける.eIF2Bはα,β,γ,δ,εの5種類のサブユニット2分子ずつから構成されるヘテロ十量体であるが2),十分なヌクレオチド交換活性を発揮するためには,εサブユニットのC末端のHEATドメイン,εサブユニットのN末端ドメインのNFモチーフ,γサブユニットとεサブユニットから構成される触媒複合体の形成が最低限必要とされる3-5).一方,eIF2Bのαサブユニット,βサブユニット,δサブユニットは制御性複合体を形成しヌクレオチド交換活性の制御に関与する6).ストレス環境においては,eIF2のαサブユニットのSer51がリン酸化されることによりeIF2Bとの結合が強固なものとなり,eIF2Bのヌクレオチド交換活性がさまたげられる.その結果,細胞におけるGTP結合型のeIF2が減少し,全体的なタンパク質の生合成は抑制されストレス応答遺伝子が選択的に発現される7).しかしながら,eIF2Bのヌクレオチド交換活性およびeIF2のリン酸化による阻害の具体的な分子機構は不明であり,これらの解明のためにはeIF2Bの全体の構造情報が必要とされた.また,ヒトにおいては,eIF2Bのいずれかのサブユニットの変異は神経変性疾患である白質消失病の原因であることが知られている.この疾患は頭部の外傷やウイルスの感染にともなう発熱などのストレスののちに急速に症状が悪化することが特徴であり8),それゆえ,eIF2のリン酸化によるeIF2Bを介したストレス応答機構の異常との関連性が示唆されるものの,発症の機構の詳細は不明であった.eIF2Bの構造情報はこの疾患の理解に寄与することも期待された.
分裂酵母Schizossaccharomyces pombeに由来するeIF2Bを大腸菌組換え発現系を用いて5種類のサブユニットすべてを共発現することにより調製した.この組換え型eIF2BはeIF2に対するヌクレオチド交換活性をもち,eIF2のリン酸化によりその活性は阻害された.そのほか,リン酸化eIF2と安定な複合体を形成するといった内在性のeIF2Bと同様の生化学的な性質が確認された.
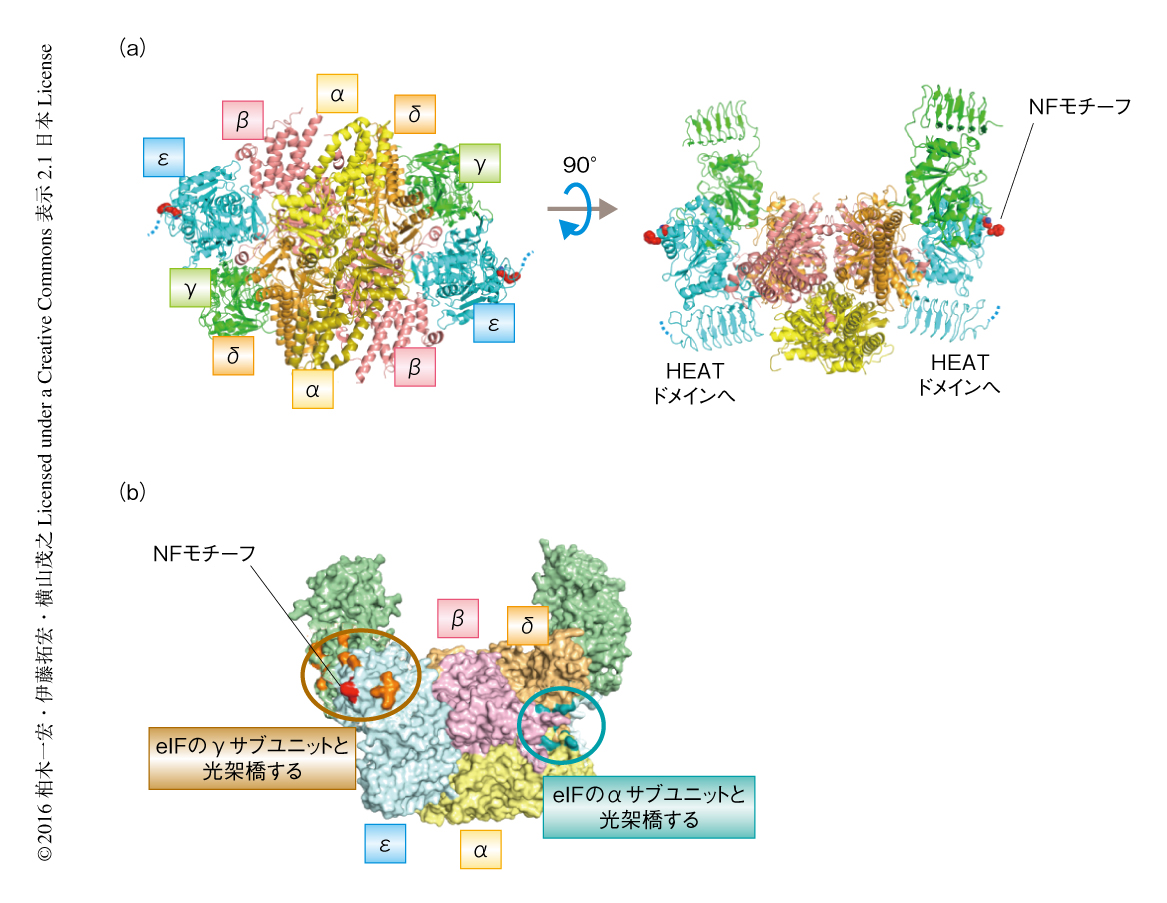
この組換えeIF2Bを結晶化し,X線結晶構造解析により3.0Åの分解能でその立体構造を決定した(PDB ID:5B04,図1a).位相の決定はセレノメチオニン置換体結晶を用いた単波長異常分散法によった.εサブユニットのC末端に存在するHEATドメインを除くほぼすべての領域について分子モデルが構築され,eIF2B十量体の全体構造がはじめて明らかにされた.eIF2B十量体の中心部にはα2β2δ2六量体から構成される制御性複合体が位置し,その両側にγε二量体からなる触媒複合体が結合するというサブユニットの配置をとり,制御性複合体および触媒複合体はおもにβサブユニット-εサブユニット間およびδサブユニット-γサブユニット間の相互作用により結合していた.これまでに,ヒトのeIF2Bをコードするおのおのの遺伝子には白質消失病の原因変異として120カ所以上のミスセンス変異が同定されていたが,制御性複合体と触媒複合体とが相互作用する面に多数の変異が確認された.
eIF2Bのヌクレオチド交換活性にはεサブユニットの2つの領域,HEATドメインおよびNFモチーフが重要であるが,NFモチーフはeIF2B十量体の外側をむいた面に位置していた(図1a).また,HEATドメインについても,その電子密度は確認されなかったものの,εサブユニットのほかの領域の配置からeIF2B十量体の外側の領域に位置すると判断された.また,eIF2B十量体の外側の面には白質消失病の原因変異も位置していた.これらのことから,eIF2のγサブユニットはeIF2B十量体の外側の面と結合し,NFモチーフおよびHEATドメインによりGDPがGTPへと交換されると考えられた.
この相互作用を直接的に検出するため,表面スキャン光架橋法により解析した.この方法は,表面のひとつのアミノ酸残基を光反応性の非天然アミノ酸であるp-ベンゾイルフェニルアラニン残基に置換した多数の変異体を作製し,標的となる分子との光架橋の有無を調べることによりその分子との結合表面を同定するものである9).eIF2B十量体の外側の面に光反応性残基を導入した32種類のeIF2B変異体を作製してeIF2と光架橋をさせたところ,eIF2BのNFモチーフの周辺においてeIF2のγサブユニットとの光架橋が確認された(図1b).eIF2のγサブユニットとの光架橋はeIF2BのNFモチーフの周辺にとどまらず,eIF2Bのγサブユニットを含む広範な領域が相互作用していることも示された.また,リン酸化eIF2と光架橋をさせたところ,NFモチーフの周辺に光反応性残基を導入したeIF2B変異体において,eIF2のγサブユニットとの光架橋の形成速度が低下した.このことから,eIF2のリン酸化によりeIF2BのNFモチーフとの相互作用は起こりにくくなると考えられた.
eIF2B十量体とリン酸化eIF2のαサブユニットとが相互作用する領域を明らかにするため,同様に,eIF2Bのαサブユニット,βサブユニット,δサブユニットの80カ所に光反応性残基を導入しリン酸化eIF2αと光架橋をさせた.その結果,リン酸化eIF2のαサブユニットとの光架橋は,αサブユニット,βサブユニット,δサブユニットのN末端ドメインに光反応性残基を導入したeIF2B変異体とのあいだに形成された.この部位はαサブユニット,βサブユニット,δサブユニットによりかこまれたeIF2B十量体の中央部のくぼんだ領域にあり,eIF2Bのαサブユニット,βサブユニット,δサブユニットのすべてがリン酸化eIF2のαサブユニットの認識に直接的に関与していることが明らかにされた(図1b).また,リン酸化されていないeIF2のαサブユニットを用いた実験においてもほとんど同様の光架橋のパターンが得られ,eIF2B十量体の中央部のくぼみはeIF2のαサブユニットとリン酸化の有無にかかわらず結合しうることがわかった.eIF2B十量体の中央部のくぼみにはeIF2のリン酸化による翻訳抑制が消失する変異残基が位置しており,この変異体においてはこの部位でのリン酸化eIF2のαサブユニットとの強固な結合がさまたげられeIF2Bによる阻害が生じなくなっていると考えられた.一方,eIF2のγサブユニットと相互作用する領域の場合とは対照的に,eIF2B十量体の中央部のくぼみには白質消失病の原因変異はほとんど位置しておらず,白質消失病の発症に関してリン酸化eIF2のαサブユニットの認識の過程における異常は主要な要因ではないと考えられた.
eIF2のαサブユニットがどのような配向でeIF2B十量体の中央部のくぼみと結合するのかを明らかにするため,eIF2のαサブユニットに光反応性残基を導入してeIF2Bと光架橋をさせた.その結果,eIF2Bと光架橋する残基はeIF2のαサブユニットのN末端ドメインの先端に位置しており,立体構造においてリン酸化残基であるSer51の近傍に位置していた.これらの光架橋の結果をもとに,eIF2Bの構造とeIF2のαサブユニットの構造10) との手動でのドッキングを試みたところ,eIF2のαサブユニットのN末端ドメインがeIF2Bのβサブユニットとδサブユニットのあいだから中央部のくぼみへと入り込むよう配置することにより,eIF2BとeIF2のαサブユニットとのあいだの光架橋の結果がよく説明されるような複合体のモデルが構築された.
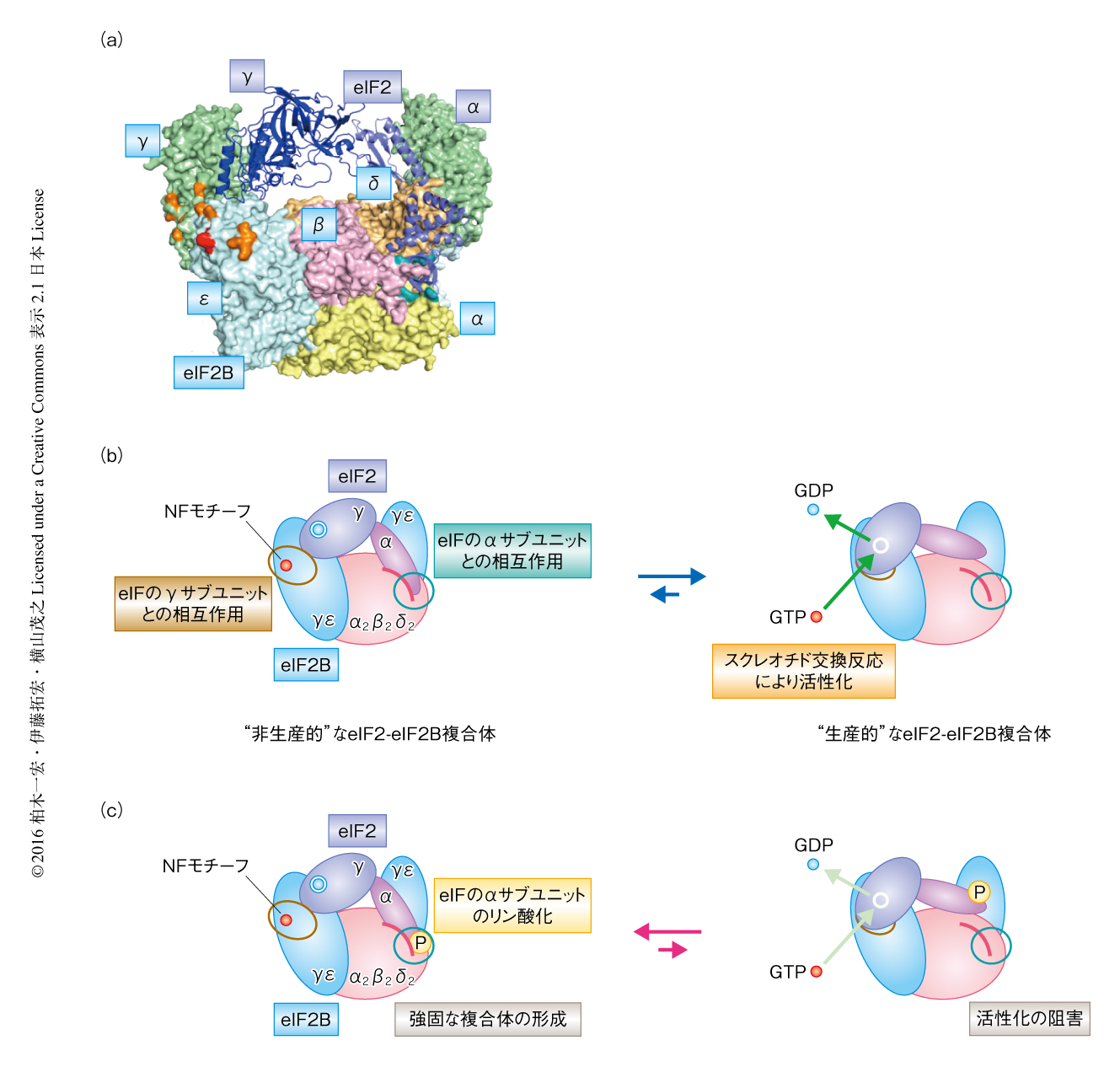
以上の結果を総合すると,eIF2のリン酸化によりeIF2のαサブユニットのN末端ドメインはeIF2B十量体の中央部のくぼみと強く結合し,eIF2のγサブユニットとeIF2BのNFモチーフとの接触は減少した.また,eIF2Bにおいて,eIF2のαサブユニットとの結合表面とeIF2のγサブユニットとの結合表面は離れて位置していた.さきのドッキングモデルとeIF2の古細菌ホモログaIF2の構造11) をもとにeIF2-eIF2B複合体のモデルを構築したところ(図2a),eIF2のαサブユニットがeIF2B十量体の中央部のくぼみに結合している状態では,eIF2のγサブユニットはeIF2BのNFモチーフの位置する外側の面まで到達することができない位置関係にあった.このことから,eIF2B十量体の中央部のくぼみにおいてeIF2のαサブユニットを介して形成されたeIF2-eIF2B複合体は,eIF2BのNFモチーフおよびHEATドメインにより効率的にヌクレオチド交換反応の起こる“生産的”な状態とは異なる,“非生産的”な状態であると考えられた.eIF2がリン酸化されていない場合には,eIF2のαサブユニットとeIF2B十量体の中央部のくぼみとの結合は安定ではないため“生産的”な状態へと移行しヌクレオチド交換反応が起こる(図2b).一方,eIF2がリン酸化されると,eIF2のαサブユニットとeIF2B十量体の中央部のくぼみとの結合が強固になるため“生産的”な状態をとりにくくなりヌクレオチド交換反応は抑制される(図2c).それにくわえ,eIF2とeIF2Bが安定な複合体を形成しているため,異なるeIF2分子がeIF2Bと結合することも抑制されると考えられた.
eIF2のリン酸化によるeIF2Bの抑制は真核生物における翻訳制御の中心的な機構として知られており,おもに遺伝学的な解析により多くの知見が蓄積されている.その一方で,構造生物学的な見地からは,これまでいくつかの部分構造が知られているのみであり,サブユニットの配置についてもさまざまな議論があった.今回のeIF2B十量体の構造解析はeIF2Bの全体像をはじめて明らかにし,eIF2Bを介した翻訳制御の分子機構について構造にもとづく議論が可能になった.今後,eIF2のαサブユニットのリン酸化によるeIF2B十量体の中央部のくぼみへの親和性の変化や,eIF2BのHEATドメインおよびNFモチーフによるヌクレオチド交換反応の分子機構といった,eIF2Bの関与する過程の詳細な理解へむけて,eIF2-eIF2B複合体の構造解析が待たれる.
略歴:2014年 東京大学大学院理学系研究科 修了,同年より理化学研究所ライフサイエンス技術基盤研究センター 特別研究員.
研究テーマ:eIF2Bを介した翻訳制御の分子機構.
伊藤 拓宏(Takuhiro Ito)
理化学研究所ライフサイエンス技術基盤研究センター ユニットリーダー.
横山 茂之(Shigeyuki Yokoyama)
理化学研究所 上席研究員.
© 2016 柏木一宏・伊藤拓宏・横山茂之 Licensed under CC 表示 2.1 日本
(1理化学研究所ライフサイエンス技術基盤研究センター 翻訳因子構造解析研究ユニット,2理化学研究所 横山構造生物学研究室)
email:柏木一宏,伊藤拓宏,横山茂之
DOI: 10.7875/first.author.2016.019
Crystal structure of eukaryotic translation initiation factor 2B.
Kazuhiro Kashiwagi, Mari Takahashi, Madoka Nishimoto, Takuya B. Hiyama, Toshiaki Higo, Takashi Umehara, Kensaku Sakamoto, Takuhiro Ito, Shigeyuki Yokoyama
Nature, 531, 122-125 (2016)
要 約
ストレス環境において,真核生物ではおもに翻訳開始因子eIF2Bの活性が阻害されることによりタンパク質の生合成は全体的に抑制される.eIF2Bは翻訳開始因子eIF2に対するグアニンヌクレオチド交換因子であり,eIF2のγサブユニットと結合したGDPをGTPへと交換する.ストレス環境において,eIF2のαサブユニットがリン酸化されることによりeIF2Bのヌクレオチド交換活性は阻害される.eIF2Bはα,β,γ,δ,εの5種類のサブユニット2分子ずつから構成されるヘテロ十量体であるが,その全体構造は未知であり,eIF2Bの活性制御の具体的な分子機構は不明であった.筆者らは,分裂酵母に由来するeIF2B十量体の立体構造をX線結晶構造解析により3.0Åの分解能で決定した.さらに,非天然アミノ酸残基の導入による光架橋法により,eIF2のαサブユニットおよびγサブユニットに対するeIF2Bの結合表面が明らかにされた.これらの結果から,eIF2のリン酸化は“非生産的”なeIF2-eIF2B複合体を形成させることにより,eIF2Bのヌクレオチド交換活性をさまたげていることが示唆された.
はじめに
α,β,γの3種類のサブユニットからなる翻訳開始因子eIF2は,開始tRNAをリボソームへと輸送する役割を担う.GTP結合型のeIF2はリボソームにおいて開始コドンを認識したのち,GDP結合型になり開始tRNAを残してリボソームから解離する.eIF2のγサブユニットと結合したGDPは,eIF2に対するグアニンヌクレオチド交換因子である翻訳開始因子eIF2BによりGTPへと交換され,GTP結合型になったeIF2はふたたび翻訳の開始の過程に利用される1).このように,リボソームへの開始tRNAの供給はeIF2Bのヌクレオチド交換活性の影響をうける.eIF2Bはα,β,γ,δ,εの5種類のサブユニット2分子ずつから構成されるヘテロ十量体であるが2),十分なヌクレオチド交換活性を発揮するためには,εサブユニットのC末端のHEATドメイン,εサブユニットのN末端ドメインのNFモチーフ,γサブユニットとεサブユニットから構成される触媒複合体の形成が最低限必要とされる3-5).一方,eIF2Bのαサブユニット,βサブユニット,δサブユニットは制御性複合体を形成しヌクレオチド交換活性の制御に関与する6).ストレス環境においては,eIF2のαサブユニットのSer51がリン酸化されることによりeIF2Bとの結合が強固なものとなり,eIF2Bのヌクレオチド交換活性がさまたげられる.その結果,細胞におけるGTP結合型のeIF2が減少し,全体的なタンパク質の生合成は抑制されストレス応答遺伝子が選択的に発現される7).しかしながら,eIF2Bのヌクレオチド交換活性およびeIF2のリン酸化による阻害の具体的な分子機構は不明であり,これらの解明のためにはeIF2Bの全体の構造情報が必要とされた.また,ヒトにおいては,eIF2Bのいずれかのサブユニットの変異は神経変性疾患である白質消失病の原因であることが知られている.この疾患は頭部の外傷やウイルスの感染にともなう発熱などのストレスののちに急速に症状が悪化することが特徴であり8),それゆえ,eIF2のリン酸化によるeIF2Bを介したストレス応答機構の異常との関連性が示唆されるものの,発症の機構の詳細は不明であった.eIF2Bの構造情報はこの疾患の理解に寄与することも期待された.
1.eIF2B十量体の立体構造
分裂酵母Schizossaccharomyces pombeに由来するeIF2Bを大腸菌組換え発現系を用いて5種類のサブユニットすべてを共発現することにより調製した.この組換え型eIF2BはeIF2に対するヌクレオチド交換活性をもち,eIF2のリン酸化によりその活性は阻害された.そのほか,リン酸化eIF2と安定な複合体を形成するといった内在性のeIF2Bと同様の生化学的な性質が確認された.
この組換えeIF2Bを結晶化し,X線結晶構造解析により3.0Åの分解能でその立体構造を決定した(PDB ID:5B04,図1a).位相の決定はセレノメチオニン置換体結晶を用いた単波長異常分散法によった.εサブユニットのC末端に存在するHEATドメインを除くほぼすべての領域について分子モデルが構築され,eIF2B十量体の全体構造がはじめて明らかにされた.eIF2B十量体の中心部にはα2β2δ2六量体から構成される制御性複合体が位置し,その両側にγε二量体からなる触媒複合体が結合するというサブユニットの配置をとり,制御性複合体および触媒複合体はおもにβサブユニット-εサブユニット間およびδサブユニット-γサブユニット間の相互作用により結合していた.これまでに,ヒトのeIF2Bをコードするおのおのの遺伝子には白質消失病の原因変異として120カ所以上のミスセンス変異が同定されていたが,制御性複合体と触媒複合体とが相互作用する面に多数の変異が確認された.
2.eIF2のγサブユニットはeIF2B十量体の外側の面において相互作用する
eIF2Bのヌクレオチド交換活性にはεサブユニットの2つの領域,HEATドメインおよびNFモチーフが重要であるが,NFモチーフはeIF2B十量体の外側をむいた面に位置していた(図1a).また,HEATドメインについても,その電子密度は確認されなかったものの,εサブユニットのほかの領域の配置からeIF2B十量体の外側の領域に位置すると判断された.また,eIF2B十量体の外側の面には白質消失病の原因変異も位置していた.これらのことから,eIF2のγサブユニットはeIF2B十量体の外側の面と結合し,NFモチーフおよびHEATドメインによりGDPがGTPへと交換されると考えられた.
この相互作用を直接的に検出するため,表面スキャン光架橋法により解析した.この方法は,表面のひとつのアミノ酸残基を光反応性の非天然アミノ酸であるp-ベンゾイルフェニルアラニン残基に置換した多数の変異体を作製し,標的となる分子との光架橋の有無を調べることによりその分子との結合表面を同定するものである9).eIF2B十量体の外側の面に光反応性残基を導入した32種類のeIF2B変異体を作製してeIF2と光架橋をさせたところ,eIF2BのNFモチーフの周辺においてeIF2のγサブユニットとの光架橋が確認された(図1b).eIF2のγサブユニットとの光架橋はeIF2BのNFモチーフの周辺にとどまらず,eIF2Bのγサブユニットを含む広範な領域が相互作用していることも示された.また,リン酸化eIF2と光架橋をさせたところ,NFモチーフの周辺に光反応性残基を導入したeIF2B変異体において,eIF2のγサブユニットとの光架橋の形成速度が低下した.このことから,eIF2のリン酸化によりeIF2BのNFモチーフとの相互作用は起こりにくくなると考えられた.
3.eIF2のαサブユニットはeIF2B十量体の中央部のくぼみにより認識される
eIF2B十量体とリン酸化eIF2のαサブユニットとが相互作用する領域を明らかにするため,同様に,eIF2Bのαサブユニット,βサブユニット,δサブユニットの80カ所に光反応性残基を導入しリン酸化eIF2αと光架橋をさせた.その結果,リン酸化eIF2のαサブユニットとの光架橋は,αサブユニット,βサブユニット,δサブユニットのN末端ドメインに光反応性残基を導入したeIF2B変異体とのあいだに形成された.この部位はαサブユニット,βサブユニット,δサブユニットによりかこまれたeIF2B十量体の中央部のくぼんだ領域にあり,eIF2Bのαサブユニット,βサブユニット,δサブユニットのすべてがリン酸化eIF2のαサブユニットの認識に直接的に関与していることが明らかにされた(図1b).また,リン酸化されていないeIF2のαサブユニットを用いた実験においてもほとんど同様の光架橋のパターンが得られ,eIF2B十量体の中央部のくぼみはeIF2のαサブユニットとリン酸化の有無にかかわらず結合しうることがわかった.eIF2B十量体の中央部のくぼみにはeIF2のリン酸化による翻訳抑制が消失する変異残基が位置しており,この変異体においてはこの部位でのリン酸化eIF2のαサブユニットとの強固な結合がさまたげられeIF2Bによる阻害が生じなくなっていると考えられた.一方,eIF2のγサブユニットと相互作用する領域の場合とは対照的に,eIF2B十量体の中央部のくぼみには白質消失病の原因変異はほとんど位置しておらず,白質消失病の発症に関してリン酸化eIF2のαサブユニットの認識の過程における異常は主要な要因ではないと考えられた.
eIF2のαサブユニットがどのような配向でeIF2B十量体の中央部のくぼみと結合するのかを明らかにするため,eIF2のαサブユニットに光反応性残基を導入してeIF2Bと光架橋をさせた.その結果,eIF2Bと光架橋する残基はeIF2のαサブユニットのN末端ドメインの先端に位置しており,立体構造においてリン酸化残基であるSer51の近傍に位置していた.これらの光架橋の結果をもとに,eIF2Bの構造とeIF2のαサブユニットの構造10) との手動でのドッキングを試みたところ,eIF2のαサブユニットのN末端ドメインがeIF2Bのβサブユニットとδサブユニットのあいだから中央部のくぼみへと入り込むよう配置することにより,eIF2BとeIF2のαサブユニットとのあいだの光架橋の結果がよく説明されるような複合体のモデルが構築された.
4.eIF2Bのヌクレオチド交換活性は“非生産的”なeIF2-eIF2B複合体の形成により阻害される
以上の結果を総合すると,eIF2のリン酸化によりeIF2のαサブユニットのN末端ドメインはeIF2B十量体の中央部のくぼみと強く結合し,eIF2のγサブユニットとeIF2BのNFモチーフとの接触は減少した.また,eIF2Bにおいて,eIF2のαサブユニットとの結合表面とeIF2のγサブユニットとの結合表面は離れて位置していた.さきのドッキングモデルとeIF2の古細菌ホモログaIF2の構造11) をもとにeIF2-eIF2B複合体のモデルを構築したところ(図2a),eIF2のαサブユニットがeIF2B十量体の中央部のくぼみに結合している状態では,eIF2のγサブユニットはeIF2BのNFモチーフの位置する外側の面まで到達することができない位置関係にあった.このことから,eIF2B十量体の中央部のくぼみにおいてeIF2のαサブユニットを介して形成されたeIF2-eIF2B複合体は,eIF2BのNFモチーフおよびHEATドメインにより効率的にヌクレオチド交換反応の起こる“生産的”な状態とは異なる,“非生産的”な状態であると考えられた.eIF2がリン酸化されていない場合には,eIF2のαサブユニットとeIF2B十量体の中央部のくぼみとの結合は安定ではないため“生産的”な状態へと移行しヌクレオチド交換反応が起こる(図2b).一方,eIF2がリン酸化されると,eIF2のαサブユニットとeIF2B十量体の中央部のくぼみとの結合が強固になるため“生産的”な状態をとりにくくなりヌクレオチド交換反応は抑制される(図2c).それにくわえ,eIF2とeIF2Bが安定な複合体を形成しているため,異なるeIF2分子がeIF2Bと結合することも抑制されると考えられた.
おわりに
eIF2のリン酸化によるeIF2Bの抑制は真核生物における翻訳制御の中心的な機構として知られており,おもに遺伝学的な解析により多くの知見が蓄積されている.その一方で,構造生物学的な見地からは,これまでいくつかの部分構造が知られているのみであり,サブユニットの配置についてもさまざまな議論があった.今回のeIF2B十量体の構造解析はeIF2Bの全体像をはじめて明らかにし,eIF2Bを介した翻訳制御の分子機構について構造にもとづく議論が可能になった.今後,eIF2のαサブユニットのリン酸化によるeIF2B十量体の中央部のくぼみへの親和性の変化や,eIF2BのHEATドメインおよびNFモチーフによるヌクレオチド交換反応の分子機構といった,eIF2Bの関与する過程の詳細な理解へむけて,eIF2-eIF2B複合体の構造解析が待たれる.
文 献
- Jackson, R. J., Hellen, C. U. T. & Pestova, T. V.: The mechanism of eukaryotic translation initiation and principles of its regulation. Nat. Rev. Mol. Cell Biol., 11, 113-127 (2010)[PubMed]
- Wortham, N. C. & Proud, C. G.: eIF2B: recent structural and functional insights into a key regulator of translation. Biochem. Soc. Trans., 43, 1234-1240 (2015)[PubMed]
- Pavitt, G. D., Ramaiah, K. V. A., Kimball, S. R. et al.: eIF2 independently binds two distinct eIF2B subcomplexes that catalyze and regulate guanine-nucleotide exchange. Genes Dev., 12, 514-526 (1998)[PubMed]
- Gomez, E., Mohammad, S. S. & Pavitt, G. D.: Characterization of the minimal catalytic domain within eIF2B: the guanine-nucleotide exchange factor for translation initiation. EMBO J., 21, 5292-5301 (2002)[PubMed]
- Gomez, E. & Pavitt, G. D.: Identification of domains and residues within the ε subunit of eukaryotic translation initiation factor 2B (eIF2Bε) required for guanine nucleotide exchange reveals a novel activation function promoted by eIF2B complex formation. Mol. Cell. Biol., 20, 3965-3976 (2000)[PubMed]
- Yang, W. & Hinnebusch, A. G.: Identification of a regulatory subcomplex in the guanine nucleotide exchange factor eIF2B that mediates inhibition by phosphorylated eIF2. Mol. Cell. Biol., 16, 6603-6616 (1996)[PubMed]
- Wek, R. C., Jiang, H. Y. & Anthony, T. G.: Coping with stress: eIF2 kinases and translational control. Biochem. Soc. Trans., 34, 7-11 (2006)[PubMed]
- Pavitt, G. D. & Proud, C. G.: Protein synthesis and its control in neuronal cells with a focus on vanishing white matter disease. Biochem. Soc. Trans., 37, 1298-1310 (2009)[PubMed]
- Mukai, T., Yanagisawa, T., Ohtake, K. et al.: Genetic-code evolution for protein synthesis with non-natural amino acids. Biochem. Biophys. Res. Commun., 411, 757-761 (2011)[PubMed]
- Ito, T., Marintchev, A. & Wagner, G.: Solution structure of human initiation factor eIF2α reveals homology to the elongation factor eEF1B. Structure, 12, 1693-1704 (2004)[PubMed]
- Yatime, L., Mechulam, Y., Blanquet, S. et al.: Structure of an archaeal heterotrimeric initiation factor 2 reveals a nucleotide state between the GTP and the GDP states. Proc. Natl. Acad. Sci. USA, 104, 18445-18450 (2007)[PubMed]
著者プロフィール
略歴:2014年 東京大学大学院理学系研究科 修了,同年より理化学研究所ライフサイエンス技術基盤研究センター 特別研究員.
研究テーマ:eIF2Bを介した翻訳制御の分子機構.
伊藤 拓宏(Takuhiro Ito)
理化学研究所ライフサイエンス技術基盤研究センター ユニットリーダー.
横山 茂之(Shigeyuki Yokoyama)
理化学研究所 上席研究員.
© 2016 柏木一宏・伊藤拓宏・横山茂之 Licensed under CC 表示 2.1 日本