ドーパミンニューロンのリン酸化プロテオミクス解析による報酬シグナルとして作用するRap1シグナルの活性化経路の同定
永井 拓1・貝淵弘三2
(名古屋大学大学院医学系研究科 1医療薬学講座,2神経情報薬理学講座)
email:永井 拓,貝淵弘三
DOI: 10.7875/first.author.2016.011
Phosphoproteomics of the dopamine pathway enables discovery of Rap1 activation as a reward signal in vivo.
Taku Nagai, Shinichi Nakamuta, Keisuke Kuroda, Sakura Nakauchi, Tomoki Nishioka, Tetsuya Takano, Xinjian Zhang, Daisuke Tsuboi, Yasuhiro Funahashi, Takashi Nakano, Junichiro Yoshimoto, Kenta Kobayashi, Motokazu Uchigashima, Masahiko Watanabe, Masami Miura, Akinori Nishi, Kazuto Kobayashi, Kiyofumi Yamada, Mutsuki Amano, Kozo Kaibuchi
Neuron, 89, 550-565 (2016)
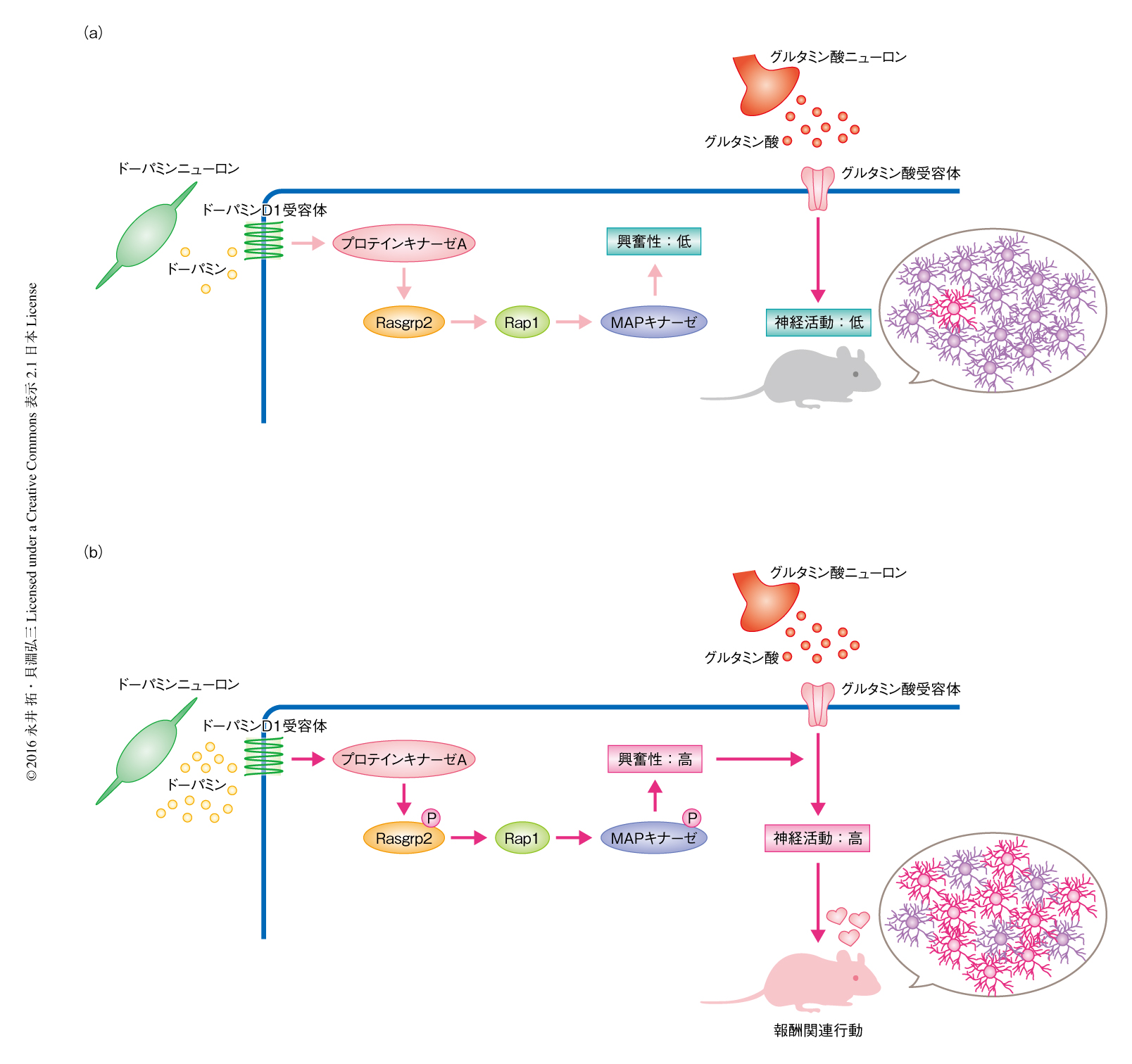
これまでの薬理学的な知見から,線条体においてドーパミンはドーパミンD1受容体を介してリン酸化酵素であるプロテインキナーゼAを活性化し,中型有棘ニューロンの興奮性および報酬関連行動を制御すると考えられてきた.しかし,この仮説を実際に証明した研究はなく,その分子機構も不明であった.筆者らは,独自に開発した高感度かつ網羅的にリン酸化タンパク質を解析する方法を用いて,ドーパミンD1受容体を発現する中型有棘ニューロンに存在するプロテインキナーゼAのリン酸化基質を100種類以上も新たに同定した.細胞レベルおよび個体レベルにおける詳細な解析により,プロテインキナーゼAはリン酸化Rrasgrp2を介してRap1-MAPキナーゼシグナルを活性化し,ドーパミンD1受容体を発現する中型有棘ニューロンの興奮性を高めて報酬関連行動を惹起することが見い出された.この研究において,ドーパミンD1受容体を発現する中型有棘ニューロンの興奮性と,それにつづく報酬関連行動を担う報酬シグナルとして,ドーパミンD1受容体-プロテインキナーゼA-Rasgrp2-Rap1-MAPキナーゼ経路の存在がリン酸化プロテオミクス解析によりはじめて明らかにされた.
ドーパミンは運動機能,意欲,快感に関連する行動を担う神経伝達物質であり,脳が興奮すると側坐核を含む線条体において大量に放出される.線条体にはドーパミンD1受容体を発現する中型有棘ニューロンおよびドーパミンD2受容体を発現する中型有棘ニューロンの異なる2種類のニューロンが存在することが知られている1).ドーパミンD1受容体はGolfと共役してアデニル酸シクラーゼを介しプロテインキナーゼAを活性化し,Giに共役するドーパミンD2受容体はアデニル酸シクラーゼを介しプロテインキナーゼAを抑制する.プロテインキナーゼAの活性化は中型有棘ニューロンの興奮性および報酬関連行動に関係することから,ドーパミンはドーパミンD1受容体を発現する中型有棘ニューロンの興奮性を高め,ドーパミンD2受容体を発現する中型有棘ニューロンの興奮性を抑制すると考えられている.たとえば,線条体のスライス標本にドーパミンを添加すると発火の頻度が上昇し,ドーパミンによる興奮性の上昇はプロテインキナーゼA阻害剤Rp-cAMPSにより抑制されることが電気生理学的な実験により示されている2).また,行動薬理学的な解析において,側坐核にプロテインキナーゼA刺激薬Sp-cAMPSを注入したラットにおいてはコカインの自己投与行動が増加し,逆に,プロテインキナーゼA阻害剤Rp-cAMPSを側坐核に注入したラットにおいてはコカインの自己投与行動が減少する3).しかしながら,これらの報告は薬理学的な実験であるためドーパミンD1受容体を発現する中型有棘ニューロンとドーパミンD2受容体を発現する中型有棘ニューロンとの特異性が乏しく,中型有棘ニューロンの機能を個別に評価するレベルにまでいたっていない.したがって,ドーパミンによるプロテインキナーゼAの活性化がドーパミンD1受容体を発現する中型有棘ニューロンの興奮やおよび報酬関連行動を亢進するのかどうかは実際には証明されておらず,その分子機構も不明である.世界中の研究者がこの問題に取り組み,プロテインキナーゼAのリン酸化基質としてDARPP-32,AMPA受容体GluR1サブユニット,NMDA受容体NR1サブユニットなどが同定されている4-6).これらのタンパク質は脱リン酸化酵素の阻害やグルタミン酸受容体の輸送を介した神経可塑性との関連などについて詳細に解析されているが,いずれのリン酸化基質もドーパミンD1受容体からニューロンの興奮性および報酬関連行動にいたるまでの過程を説明するには十分とはいいがたい.筆者らは,リン酸化タンパク質の網羅的な解析法として新たにKIOSS(kinase-oriented substrate screening)法を開発し,プロテインキナーゼAの下流においてドーパミンD1受容体を発現する中型有棘ニューロンの興奮性および報酬関連行動を制御するシグナル伝達経路の同定を試みた.
ドーパミンD1受容体シグナルのリン酸化プロテオミクス解析に使用する試料として,線条体の急性スライス標本を用いた.その理由は,線条体を構成する90%以上のニューロンが中型有棘ニューロンであること,実験条件を均一にすることが可能であり脱リン酸化の影響を最小限に抑えることのできることであった.また,網羅的かつ感度よくプロテインキナーゼAのリン酸化基質を濃縮するため,リン酸化Thrあるいはリン酸化Serと結合する14-3-3タンパク質を固相化したアフィニティビーズを作製した.プロテインキナーゼA刺激薬フォルスコリンあるいはドーパミンD1受容体作動薬SKF81297により処置したマウスの線条体のスライス標本から調製した抽出液と14-3-3アフィニティビーズを反応させ,得られたリン酸化タンパク質をトリプシンにより消化し,質量分析計にてリン酸化ペプチドを網羅的に解析した.その結果,ドーパミンD1受容体の下流に存在するプロテインキナーゼAのリン酸化基質の候補として,100種類以上のタンパク質およびそのリン酸化部位が同定された.同定されたリン酸化基質の候補の多くはドーパミンシグナルにかかわることが報告されていない新規のタンパク質およびリン酸化部位であった.このKIOSS法により得られたデータをもとにパスウェイ解析を行い,Rap1経路を含む数種類のシグナル伝達経路が同定された.
Rap1経路に関係するプロテインキナーゼAのリン酸化基質の候補には,Rap1活性化タンパク質であるRasgrp2およびRap1不活性化タンパク質であるRap1gapが含まれていた.Rap1は学習や記憶など脳の機能に重要な役割をはたすと推定されている低分子量Gタンパク質である7).そこで,Rap1経路がドーパミンD1受容体を介した神経機能に関係していると推測し,Rap1を活性化するRasgrp2に着目した.COS-7細胞を用いたin vitroにおける解析により,プロテインキナーゼAがRasgrp2のSer116,Ser117,Ser554,Ser586番目に直接的に作用すること,プロテインキナーゼAによりリン酸化されたRasgrp2がRap1を活性化することが示された.抗リン酸化抗体を作製して線条体のスライス標本においてRasgrp2のリン酸化のレベルを解析したところ,ドーパミンD1受容体作動薬あるいはフォルスコリンの処置によりRasgrp2のリン酸化のレベルは亢進し,プロテインキナーゼA阻害薬の前処置によりこのドーパミンD1受容体作動薬あるいはフォルスコリンの効果は抑制された.これらの結果から,ドーパミンがドーパミンD1受容体-プロテインキナーゼAシグナルを介してRasgrp2をリン酸化しRap1を活性化することが示唆された.また,リン酸化プロテオミクス解析の結果を支持し,ドーパミンD1受容体を発現する中型有棘ニューロンにおける新たなシグナル伝達経路の存在を裏づけた.実際に,線条体のスライス標本においてドーパミンD1受容体作動薬あるいはフォルスコリンを処置すると活性型Rap1のレベルが亢進した.
マウスの脳におけるRasgrp2の発現は側坐核を含む線条体で非常に高く,前頭皮質などほかの部位では低いことから,Rasgrp2は中型有棘ニューロンの機能の制御において重要な役割をはたす可能性があった.そこで,ドーパミンの再取り込みを阻害する作用をもつコカインをマウスに投与し,Rasgrp2がリン酸化されるかどうかを調べた.その結果,コカインを投与したマウスの側坐核においてはRasgrp2のリン酸化のレベルが亢進し,組織科学的にも,ドーパミンD1受容体を発現する中型有棘ニューロンおいてリン酸化Rasgrp2の免疫活性が観察された.側坐核の活性化型Rap1のレベルもコカインの投与により亢進したことから,コカインの投与により増加したドーパミンは側坐核のドーパミンD1受容体を発現する中型有棘ニューロンに作用してプロテインキナーゼA-Rasgrp2-Rap1シグナルを活性化すると考えられた.
薬理学的な解析によりプロテインキナーゼAがドーパミンD1受容体の下流において作用する報酬シグナルに関与することが示唆されていたが2,3),ドーパミンD1受容体を発現する中型有棘ニューロンのプロテインキナーゼAが神経の興奮性および報酬関連行動を制御することを証明した報告はなかった.そこで,ドーパミンD1受容体遺伝子のプロモーターの下流においてCreを発現するトランスジェニックマウスの側坐核に,Creに依存的に野生型あるいは恒常活性化型のプロテインキナーゼAを発現するアデノ随伴ウイルスを注入することにより,側坐核のドーパミンD1受容体を発現する中型有棘ニューロンにおいて特異的にプロテインキナーゼAの活性を制御できるマウスを作製した.野生型のマウスと比較して,恒常活性化型プロテインキナーゼAを発現するマウスではRasgrp2のリン酸化が亢進しており,ドーパミンD1受容体を発現する中型有棘ニューロンの発火の頻度やコカインの投与による条件づけ場所嗜好性も上昇した.プロテインキナーゼAの代わりに恒常活性化型のRap1をドーパミンD1受容体を発現する中型有棘ニューロンに特異的に発現するマウスにおいても,同様の結果が得られた.逆に,側坐核のドーパミンD1受容体を発現する中型有棘ニューロンにおいて特異的にRap1を欠損させたマウスにおいては,ドーパミンD1受容体を発現する中型有棘ニューロンの興奮性およびコカインの効果が野生型マウスに比べ低下した.さらに,Rap1の活性化あるいは欠損により認められた行動の変化はMAPキナーゼの共発現により回復したことから,Rap1の下流においてMAPキナーゼが作用していると考えられた.
以上の結果から,Rap1シグナルは報酬シグナルとして機能することがはじめて明らかにされた(図1).つまり,通常はドーパミンの濃度は低く,ドーパミンD1受容体を発現する中型有棘ニューロンの興奮性および神経活動は抑制されている状態にあるため,報酬関連行動は起こらない.ところが,側坐核においてドーパミンが大量に放出されると,ドーパミンD1受容体を介しプロテインキナーゼA-Rap1シグナルが活性化すると考えられた.さらに,Rap1シグナルによりニューロンの興奮性が高まると,グルタミン酸などの興奮性の入力に応答して神経活動が増加し,報酬関連行動が惹起されると推察された.
この研究において,KIOSS法によるリン酸化プロテオミクス解析の有用性が示された.筆者らは,プロテインキナーゼAのほかにも,Rhoキナーゼなどのリン酸化基質の探索やさまざまなリン酸化基質の濃縮法を利用したリン酸化プロテオミクス解析を実施しており8-11),得られた情報を蓄積してデータベースKANPHOS(Kinase-Associated Neural Phospho-Signaling Database,https://srpbsg01.unit.oist.jp/index.php?ml_lang=en)を構築中である.このKANPHOSの特徴はデータ駆動型であること,実用性にすぐれていることである.近い将来,KANPHOSは一般公開される予定であり,その際にはぜひ有効に活用してほしい.
また,ドーパミンによるドーパミンD1受容体を発現する中型有棘ニューロンの興奮性および報酬関連行動の制御にはRap1シグナルが必要であることが示された.線条体にはドーパミンD1受容体を発現する中型有棘ニューロンのほかにもドーパミンD2受容体を発現する中型有棘ニューロンが存在するが,その興奮性の制御機構は依然として不明である.今後は,Rap1シグナルとの関連性やほかの分子機構が関係しているのかどうかを調べる必要がある.さらに,ドーパミンの機能の不全はさまざまな精神神経疾患において認められる.たとえば,薬物依存症やギャンブル依存症はドーパミンによる快感を異常にもとめる状態である.ドーパミンの過剰状態は統合失調症,注意欠陥多動性障害,強迫性障害に関係する.うつ病やパーキンソン病においてはドーパミンの不足状態であることが知られている.今後は,これらの精神神経疾患とのかかわりについても明らかにしたいと考えている.
略歴:2003年 名古屋大学大学院医学系研究科 修了,同年 名古屋大学医学部附属病院 文部科学技官,2004年 金沢大学大学院自然科学研究科 助手,2006年 名古屋大学大学院医学系研究科 特任講師を経て,2010年より同 准教授.
研究テーマ:情動行動をつかさどる分子神経基盤.
抱負:ドーパミンにより生じる多彩な精神機能の動作原理を理解し,精神疾患の解明へとつなげたい.
貝淵 弘三(Kozo Kaibuchi)
名古屋大学大学院医学系研究科 教授.
© 2016 永井 拓・貝淵弘三 Licensed under CC 表示 2.1 日本
(名古屋大学大学院医学系研究科 1医療薬学講座,2神経情報薬理学講座)
email:永井 拓,貝淵弘三
DOI: 10.7875/first.author.2016.011
Phosphoproteomics of the dopamine pathway enables discovery of Rap1 activation as a reward signal in vivo.
Taku Nagai, Shinichi Nakamuta, Keisuke Kuroda, Sakura Nakauchi, Tomoki Nishioka, Tetsuya Takano, Xinjian Zhang, Daisuke Tsuboi, Yasuhiro Funahashi, Takashi Nakano, Junichiro Yoshimoto, Kenta Kobayashi, Motokazu Uchigashima, Masahiko Watanabe, Masami Miura, Akinori Nishi, Kazuto Kobayashi, Kiyofumi Yamada, Mutsuki Amano, Kozo Kaibuchi
Neuron, 89, 550-565 (2016)
要 約
これまでの薬理学的な知見から,線条体においてドーパミンはドーパミンD1受容体を介してリン酸化酵素であるプロテインキナーゼAを活性化し,中型有棘ニューロンの興奮性および報酬関連行動を制御すると考えられてきた.しかし,この仮説を実際に証明した研究はなく,その分子機構も不明であった.筆者らは,独自に開発した高感度かつ網羅的にリン酸化タンパク質を解析する方法を用いて,ドーパミンD1受容体を発現する中型有棘ニューロンに存在するプロテインキナーゼAのリン酸化基質を100種類以上も新たに同定した.細胞レベルおよび個体レベルにおける詳細な解析により,プロテインキナーゼAはリン酸化Rrasgrp2を介してRap1-MAPキナーゼシグナルを活性化し,ドーパミンD1受容体を発現する中型有棘ニューロンの興奮性を高めて報酬関連行動を惹起することが見い出された.この研究において,ドーパミンD1受容体を発現する中型有棘ニューロンの興奮性と,それにつづく報酬関連行動を担う報酬シグナルとして,ドーパミンD1受容体-プロテインキナーゼA-Rasgrp2-Rap1-MAPキナーゼ経路の存在がリン酸化プロテオミクス解析によりはじめて明らかにされた.
はじめに
ドーパミンは運動機能,意欲,快感に関連する行動を担う神経伝達物質であり,脳が興奮すると側坐核を含む線条体において大量に放出される.線条体にはドーパミンD1受容体を発現する中型有棘ニューロンおよびドーパミンD2受容体を発現する中型有棘ニューロンの異なる2種類のニューロンが存在することが知られている1).ドーパミンD1受容体はGolfと共役してアデニル酸シクラーゼを介しプロテインキナーゼAを活性化し,Giに共役するドーパミンD2受容体はアデニル酸シクラーゼを介しプロテインキナーゼAを抑制する.プロテインキナーゼAの活性化は中型有棘ニューロンの興奮性および報酬関連行動に関係することから,ドーパミンはドーパミンD1受容体を発現する中型有棘ニューロンの興奮性を高め,ドーパミンD2受容体を発現する中型有棘ニューロンの興奮性を抑制すると考えられている.たとえば,線条体のスライス標本にドーパミンを添加すると発火の頻度が上昇し,ドーパミンによる興奮性の上昇はプロテインキナーゼA阻害剤Rp-cAMPSにより抑制されることが電気生理学的な実験により示されている2).また,行動薬理学的な解析において,側坐核にプロテインキナーゼA刺激薬Sp-cAMPSを注入したラットにおいてはコカインの自己投与行動が増加し,逆に,プロテインキナーゼA阻害剤Rp-cAMPSを側坐核に注入したラットにおいてはコカインの自己投与行動が減少する3).しかしながら,これらの報告は薬理学的な実験であるためドーパミンD1受容体を発現する中型有棘ニューロンとドーパミンD2受容体を発現する中型有棘ニューロンとの特異性が乏しく,中型有棘ニューロンの機能を個別に評価するレベルにまでいたっていない.したがって,ドーパミンによるプロテインキナーゼAの活性化がドーパミンD1受容体を発現する中型有棘ニューロンの興奮やおよび報酬関連行動を亢進するのかどうかは実際には証明されておらず,その分子機構も不明である.世界中の研究者がこの問題に取り組み,プロテインキナーゼAのリン酸化基質としてDARPP-32,AMPA受容体GluR1サブユニット,NMDA受容体NR1サブユニットなどが同定されている4-6).これらのタンパク質は脱リン酸化酵素の阻害やグルタミン酸受容体の輸送を介した神経可塑性との関連などについて詳細に解析されているが,いずれのリン酸化基質もドーパミンD1受容体からニューロンの興奮性および報酬関連行動にいたるまでの過程を説明するには十分とはいいがたい.筆者らは,リン酸化タンパク質の網羅的な解析法として新たにKIOSS(kinase-oriented substrate screening)法を開発し,プロテインキナーゼAの下流においてドーパミンD1受容体を発現する中型有棘ニューロンの興奮性および報酬関連行動を制御するシグナル伝達経路の同定を試みた.
1.ドーパミンD1受容体の下流に存在するプロテインキナーゼAのリン酸化基質が新たに同定された
ドーパミンD1受容体シグナルのリン酸化プロテオミクス解析に使用する試料として,線条体の急性スライス標本を用いた.その理由は,線条体を構成する90%以上のニューロンが中型有棘ニューロンであること,実験条件を均一にすることが可能であり脱リン酸化の影響を最小限に抑えることのできることであった.また,網羅的かつ感度よくプロテインキナーゼAのリン酸化基質を濃縮するため,リン酸化Thrあるいはリン酸化Serと結合する14-3-3タンパク質を固相化したアフィニティビーズを作製した.プロテインキナーゼA刺激薬フォルスコリンあるいはドーパミンD1受容体作動薬SKF81297により処置したマウスの線条体のスライス標本から調製した抽出液と14-3-3アフィニティビーズを反応させ,得られたリン酸化タンパク質をトリプシンにより消化し,質量分析計にてリン酸化ペプチドを網羅的に解析した.その結果,ドーパミンD1受容体の下流に存在するプロテインキナーゼAのリン酸化基質の候補として,100種類以上のタンパク質およびそのリン酸化部位が同定された.同定されたリン酸化基質の候補の多くはドーパミンシグナルにかかわることが報告されていない新規のタンパク質およびリン酸化部位であった.このKIOSS法により得られたデータをもとにパスウェイ解析を行い,Rap1経路を含む数種類のシグナル伝達経路が同定された.
2.プロテインキナーゼAによるRasgrp2のリン酸化はRap1の活性化に必要である
Rap1経路に関係するプロテインキナーゼAのリン酸化基質の候補には,Rap1活性化タンパク質であるRasgrp2およびRap1不活性化タンパク質であるRap1gapが含まれていた.Rap1は学習や記憶など脳の機能に重要な役割をはたすと推定されている低分子量Gタンパク質である7).そこで,Rap1経路がドーパミンD1受容体を介した神経機能に関係していると推測し,Rap1を活性化するRasgrp2に着目した.COS-7細胞を用いたin vitroにおける解析により,プロテインキナーゼAがRasgrp2のSer116,Ser117,Ser554,Ser586番目に直接的に作用すること,プロテインキナーゼAによりリン酸化されたRasgrp2がRap1を活性化することが示された.抗リン酸化抗体を作製して線条体のスライス標本においてRasgrp2のリン酸化のレベルを解析したところ,ドーパミンD1受容体作動薬あるいはフォルスコリンの処置によりRasgrp2のリン酸化のレベルは亢進し,プロテインキナーゼA阻害薬の前処置によりこのドーパミンD1受容体作動薬あるいはフォルスコリンの効果は抑制された.これらの結果から,ドーパミンがドーパミンD1受容体-プロテインキナーゼAシグナルを介してRasgrp2をリン酸化しRap1を活性化することが示唆された.また,リン酸化プロテオミクス解析の結果を支持し,ドーパミンD1受容体を発現する中型有棘ニューロンにおける新たなシグナル伝達経路の存在を裏づけた.実際に,線条体のスライス標本においてドーパミンD1受容体作動薬あるいはフォルスコリンを処置すると活性型Rap1のレベルが亢進した.
3.コカインの投与はプロテインキナーゼA-Rasgrp2シグナルを介しRap1を活性化する
マウスの脳におけるRasgrp2の発現は側坐核を含む線条体で非常に高く,前頭皮質などほかの部位では低いことから,Rasgrp2は中型有棘ニューロンの機能の制御において重要な役割をはたす可能性があった.そこで,ドーパミンの再取り込みを阻害する作用をもつコカインをマウスに投与し,Rasgrp2がリン酸化されるかどうかを調べた.その結果,コカインを投与したマウスの側坐核においてはRasgrp2のリン酸化のレベルが亢進し,組織科学的にも,ドーパミンD1受容体を発現する中型有棘ニューロンおいてリン酸化Rasgrp2の免疫活性が観察された.側坐核の活性化型Rap1のレベルもコカインの投与により亢進したことから,コカインの投与により増加したドーパミンは側坐核のドーパミンD1受容体を発現する中型有棘ニューロンに作用してプロテインキナーゼA-Rasgrp2-Rap1シグナルを活性化すると考えられた.
4.Rap1の活性化はMAPキナーゼを介し神経の興奮性および報酬関連行動を制御する
薬理学的な解析によりプロテインキナーゼAがドーパミンD1受容体の下流において作用する報酬シグナルに関与することが示唆されていたが2,3),ドーパミンD1受容体を発現する中型有棘ニューロンのプロテインキナーゼAが神経の興奮性および報酬関連行動を制御することを証明した報告はなかった.そこで,ドーパミンD1受容体遺伝子のプロモーターの下流においてCreを発現するトランスジェニックマウスの側坐核に,Creに依存的に野生型あるいは恒常活性化型のプロテインキナーゼAを発現するアデノ随伴ウイルスを注入することにより,側坐核のドーパミンD1受容体を発現する中型有棘ニューロンにおいて特異的にプロテインキナーゼAの活性を制御できるマウスを作製した.野生型のマウスと比較して,恒常活性化型プロテインキナーゼAを発現するマウスではRasgrp2のリン酸化が亢進しており,ドーパミンD1受容体を発現する中型有棘ニューロンの発火の頻度やコカインの投与による条件づけ場所嗜好性も上昇した.プロテインキナーゼAの代わりに恒常活性化型のRap1をドーパミンD1受容体を発現する中型有棘ニューロンに特異的に発現するマウスにおいても,同様の結果が得られた.逆に,側坐核のドーパミンD1受容体を発現する中型有棘ニューロンにおいて特異的にRap1を欠損させたマウスにおいては,ドーパミンD1受容体を発現する中型有棘ニューロンの興奮性およびコカインの効果が野生型マウスに比べ低下した.さらに,Rap1の活性化あるいは欠損により認められた行動の変化はMAPキナーゼの共発現により回復したことから,Rap1の下流においてMAPキナーゼが作用していると考えられた.
以上の結果から,Rap1シグナルは報酬シグナルとして機能することがはじめて明らかにされた(図1).つまり,通常はドーパミンの濃度は低く,ドーパミンD1受容体を発現する中型有棘ニューロンの興奮性および神経活動は抑制されている状態にあるため,報酬関連行動は起こらない.ところが,側坐核においてドーパミンが大量に放出されると,ドーパミンD1受容体を介しプロテインキナーゼA-Rap1シグナルが活性化すると考えられた.さらに,Rap1シグナルによりニューロンの興奮性が高まると,グルタミン酸などの興奮性の入力に応答して神経活動が増加し,報酬関連行動が惹起されると推察された.
おわりに
この研究において,KIOSS法によるリン酸化プロテオミクス解析の有用性が示された.筆者らは,プロテインキナーゼAのほかにも,Rhoキナーゼなどのリン酸化基質の探索やさまざまなリン酸化基質の濃縮法を利用したリン酸化プロテオミクス解析を実施しており8-11),得られた情報を蓄積してデータベースKANPHOS(Kinase-Associated Neural Phospho-Signaling Database,https://srpbsg01.unit.oist.jp/index.php?ml_lang=en)を構築中である.このKANPHOSの特徴はデータ駆動型であること,実用性にすぐれていることである.近い将来,KANPHOSは一般公開される予定であり,その際にはぜひ有効に活用してほしい.
また,ドーパミンによるドーパミンD1受容体を発現する中型有棘ニューロンの興奮性および報酬関連行動の制御にはRap1シグナルが必要であることが示された.線条体にはドーパミンD1受容体を発現する中型有棘ニューロンのほかにもドーパミンD2受容体を発現する中型有棘ニューロンが存在するが,その興奮性の制御機構は依然として不明である.今後は,Rap1シグナルとの関連性やほかの分子機構が関係しているのかどうかを調べる必要がある.さらに,ドーパミンの機能の不全はさまざまな精神神経疾患において認められる.たとえば,薬物依存症やギャンブル依存症はドーパミンによる快感を異常にもとめる状態である.ドーパミンの過剰状態は統合失調症,注意欠陥多動性障害,強迫性障害に関係する.うつ病やパーキンソン病においてはドーパミンの不足状態であることが知られている.今後は,これらの精神神経疾患とのかかわりについても明らかにしたいと考えている.
文 献
- Surmeier, D. J., Ding, J., Day, M. et al.: D1 and D2 dopamine-receptor modulation of striatal glutamatergic signaling in striatal medium spiny neurons. Trends Neurosci., 30, 228-235 (2007)[PubMed]
- Hopf, F. W., Cascini, M. G., Gordon, A. S. et al.: Cooperative activation of dopamine D1 and D2 receptors increases spike firing of nucleus accumbens neurons via G-protein βγ subunits. J. Neurosci., 23, 5079-5087 (2003)[PubMed]
- Self, D. W., Genova, L. M., Hope, B. T. et al.: Involvement of cAMP-dependent protein kinase in the nucleus accumbens in cocaine self-administration and relapse of cocaine-seeking behavior. J. Neurosci., 18, 1848-1859 (1998)[PubMed]
- Nishi, A., Kuroiwa, M. & Shuto, T.: Mechanisms for the modulation of dopamine D1 receptor signaling in striatal neurons. Front. Neuroanat., 5, 43 (2011)[PubMed]
- Snyder, G. L., Allen, P. B., Fienberg, A. A. et al.: Regulation of phosphorylation of the GluR1 AMPA receptor in the neostriatum by dopamine and psychostimulants in vivo. J. Neurosci., 20, 4480-4488 (2000)[PubMed]
- Hallett, P. J., Spoelgen, R., Hyman, B. T. et al.: Dopamine D1 activation potentiates striatal NMDA receptors by tyrosine phosphorylation-dependent subunit trafficking. J. Neurosci., 26, 4690-4700 (2006)[PubMed]
- Stornetta, R. L. & Zhu, J. J.: Ras and Rap signaling in synaptic plasticity and mental disorders. Neuroscientist, 17, 54-78 (2011)[PubMed]
- Hamaguchi, T., Nakamuta, S., Funahashi, Y. et al.: In vivo screening for substrates of protein kinase A using a combination of proteomic approaches and pharmacological modulation of kinase activity. Cell Struct. Funct., 40, 1-12 (2015)[PubMed]
- Hasanuzzaman Shohag, M., Nishioka, T., Uddin Ahammad, R. et al.: Phosphoproteomic analysis using the WW and FHA domains as biological filters. Cell Struct. Funct., 40, 95-104 (2015)[PubMed]
- Amano, M., Hamaguchi, T., Shohag, M. H. et al.: Kinase-interacting substrate screening is a novel method to identify kinase substrates. J. Cell Biol., 209, 895-912 (2015)[PubMed]
- Nishioka, T., Shohag, M. H., Amano, M. et al.: Developing novel methods to search for substrates of protein kinases such as Rho-kinase. Biochim. Biophys. Acta, 1854, 1663-1666 (2015)[PubMed]
著者プロフィール
略歴:2003年 名古屋大学大学院医学系研究科 修了,同年 名古屋大学医学部附属病院 文部科学技官,2004年 金沢大学大学院自然科学研究科 助手,2006年 名古屋大学大学院医学系研究科 特任講師を経て,2010年より同 准教授.
研究テーマ:情動行動をつかさどる分子神経基盤.
抱負:ドーパミンにより生じる多彩な精神機能の動作原理を理解し,精神疾患の解明へとつなげたい.
貝淵 弘三(Kozo Kaibuchi)
名古屋大学大学院医学系研究科 教授.
© 2016 永井 拓・貝淵弘三 Licensed under CC 表示 2.1 日本