PI5P4キナーゼβは代謝応答および腫瘍の形成を制御するGTPセンサーである
竹内 恒1・千田俊哉2・佐々木敦朗3
(1産業技術総合研究所創薬分子プロファイリング研究センター 3D分子設計チーム,2高エネルギー加速器研究機構物質構造科学研究所 構造生物学研究センター,3米国Cincinnati大学College of Medicine,Department of Internal Medicine)
email:竹内 恒,千田俊哉,佐々木敦朗
DOI: 10.7875/first.author.2016.008
The lipid kinase PI5P4Kβ is an intracellular GTP sensor for metabolism and tumorigenesis.
Kazutaka Sumita, Yu-Hua Lo, Koh Takeuchi, Miki Senda, Satoshi Kofuji, Yoshiki Ikeda, Jumpei Terakawa, Mika Sasaki, Hirofumi Yoshino, Nazanin Majd, Yuxiang Zheng, Emily Rose Kahoud, Takehiro Yokota, Brooke M. Emerling, John M. Asara, Tetsuo Ishida, Jason W. Locasale, Takiko Daikoku, Dimitrios Anastasiou, Toshiya Senda, Atsuo T. Sasaki
Molecular Cell, 61, 187-198 (2016)
細胞におけるGTPの濃度は細胞の状態により変化することが知られている.これまで,細胞がどのようにGTPの濃度を検知し細胞の機能を制御しているのかは謎であった.筆者らは,PI5P4キナーゼβがGTPの濃度を脂質2次メッセンジャーのシグナル伝達に変換し,細胞における代謝応答および腫瘍の形成を制御するGTPセンサーであることを見い出した.PI5P4キナーゼβはリン酸供与基としてATPよりもGTPを優先的に用い,かつ,GTPの生理学的な濃度域に対応する活性をもっていた.PI5P4キナーゼβとヌクレオチドとの複合体の立体構造解析によりGTPに特異的な認識機構を原子レベルで解明し,この情報にもとづきGTPに非依存的なPI5P4キナーゼβの変異体を作製した.この変異体を用いることにより,PI5P4キナーゼβのGTPセンサーは腫瘍の形成にも寄与することが明らかにされた.この研究により,GTPセンサー,そして,細胞におけるGTPの濃度を起点としたシグナル伝達機構の存在が明らかにされた.今後,PI5P4キナーゼβを標的としたがんの治療や創薬への応用が期待される.
ATPやGTPなどのエネルギー分子は進化的に保存されており,細胞におけるさまざまな生理学的な反応の駆動力となる.そのため,細胞におけるエネルギー分子の濃度は環境に応じて受動的に変化するだけでなく,それ自体が細胞におけるシグナル伝達系の起点になっている.すなわち,細胞にはエネルギー分子の濃度を検知して適切な細胞応答を起こすしくみが備わっている.たとえば,細胞におけるATPの濃度の変化はAMP活性化キナーゼやmTORといった複数のATPセンサーにより感知され,代謝応答や遺伝子発現を変化させる1-3).このほかにも,細胞においてさまざまなエネルギー分子を検知するエネルギーセンサーの存在が知られている4,5).これらのエネルギーセンサーは,検知するエネルギー分子と直接的に結合する,検知するエネルギー分子の生理学的な濃度域にKm値が合致する,エネルギー分子の変化に応じシグナル伝達の強度を変化させる,といった共通の特徴をもつ.
GTPは細胞においておもにタンパク質の合成やシグナル伝達の原動力となるエネルギー分子である.そのため,細胞の増殖が活発ながん細胞や,血清タンパク質を多く産生する肝臓,膵臓,脂肪組織などは多くのGTPを必要とする.細胞におけるGTPの濃度はATPとは独立に制御されていることから,独自の制御機構の存在が考えられる.しかしながら,細胞においてGTPの濃度を検知し細胞の機能を制御するGTPセンサーはいまだ発見されておらず,細胞におけるGTPの濃度を起点としたエネルギー制御機構の存在については不明であった.
GTPセンサーの候補となるタンパク質を探索することを目的として,GTPを固定化したビーズを用いたプルダウン法により,GTPにより強く結合するシグナルタンパク質を細胞から広く探索した.その結果,Gタンパク質やこれまでGTPと結合することが知られていたSrc,カゼインキナーゼIIといったキナーゼにくわえ,PI5P4キナーゼβが同定された.PI5P4キナーゼβはホスファチジルイノシトール5-リン酸を基質としてホスファチジルイノシトール4,5-ビスリン酸を産生するイノシトールリン脂質キナーゼである6).PI5P4キナーゼβはATPあるいはm7GTPを固定化したビーズに比べGTPを固定化したビーズにより強く結合した.溶液NMR法を用いた固定化していない条件における検討においても同様の傾向がみられ,さらに,GTPとATPはPI5P4キナーゼβにおいて結合部位を競合していた.PI5P4キナーゼβにおいて,GTPをリン酸供与基とするホスファチジルイノシトール5-リン酸のリン酸化活性は,同じ濃度のATPをリン酸供与基とする活性に比べ数倍も強かった.これまで,PI5P4キナーゼβはがんや糖尿病との関連が示されていたが7-11),その機能の詳細は明らかでなかった.また,ヒトの細胞にある約500種類のキナーゼと同様に,PI5P4キナーゼβはATPをホスファチジルイノシトール5-リン酸のリン酸化に用いると考えられていた.しかし,PI5P4キナーゼβはGTPをリン酸供与基として用いるユニークなGTPキナーゼであることが明らかにされた.
PI5P4キナーゼβのもつホスファチジルイノシトール5-リン酸のリン酸化活性について,ATPあるいはGTPに対する濃度依存性をより詳細に解析した結果,ホスファチジルイノシトール5-リン酸の濃度や配位金属の種類にかかわらず,GTPに依存的な活性はATPに依存的な活性に比べつねに強いことが明らかにされた.さらに,GTPの生理学的な濃度域においてPI5P4キナーゼβの活性は大きく変化したのに対し,ATPの生理学的な濃度域におけるPI5P4キナーゼβの活性はほとんど飽和しておりその変化量はわずかであった.また,生理学的な濃度のATPおよびGTPを共存させた状態においても,キナーゼ反応の大半はGTPに依存的であり,細胞におけるPI5P4キナーゼβの活性はGTPの濃度変化に依存して大きく変化した.この特性により,PI5P4キナーゼβが細胞におけるGTPセンサーである可能性がより強く支持された.
PI5P4キナーゼβはGTPの濃度に依存してリン酸化活性を変化させたが,ATPに依存した基底的な活性を保持していたため,ノックアウトあるいはノックダウンといった通常の遺伝学的な手法により,PI5P4キナーゼβのもつGTPに依存的な活性の生物学的な意義について明らかにすることは困難であった.そこで,GTPに依存的な活性を失ってはいるもののATPに依存的な機能は保持したGTP非依存的PI5P4キナーゼβ変異体を作製することを考えた.そのため,PI5P4キナーゼβとヌクレオチドとの複合体の立体構造を解析し,PI5P4キナーゼβがGTPと特異的に結合する分子機構について明らかにした.GTPアナログあるいはATPアナログとPI5P4キナーゼβとの複合体の立体構造を得た結果,PI5P4キナーゼβのThr201,Asn203,Phe205はGTPの認識にのみかかわっていることが示された.そこで,これらの残基に変異を導入し,その活性をNMR法および生化学的な実験により検証したところ,Phe205をLeuに置換した変異体はGTPに依存的な活性を失う一方,野生型と同様のATPに依存的な活性を保持していることが確認され,もとめるGTP非依存的PI5P4キナーゼβ変異体の作製に成功した.
PI5P4キナーゼβを欠損した細胞にGTP非依存的PI5P4キナーゼβ変異体あるいは野生型のPI5P4キナーゼβを再導入し,ミコフェノール酸を処理することにより細胞におけるGTPの濃度を特異的に減少させた.野生型PI5P4キナーゼβを発現させた細胞においては,GTPの枯渇によりPI5P4キナーゼβのGTPに依存的な活性が大幅に低下した結果,基質であるホスファチジルイノシトール5-リン酸の蓄積がみられた.一方,GTP非依存的PI5P4キナーゼβ変異体を発現させた細胞においては,GTPを枯渇させるまえからホスファチジルイノシトール5-リン酸の蓄積量が多く,GTPの枯渇によってもその量に変化はみられなかった.また,GTP非依存的PI5P4キナーゼβ変異体を発現させた細胞と野生型PI5P4キナーゼβを発現させた細胞とでは,ほかの代謝産物に関してもその多くがGTPの枯渇により変化する量が異なっており,PI5P4キナーゼβがGTPに対する濃度依存性を失ったことにより,GTPの濃度変化に対する代謝応答に異常の起こることが明らかにされた.このことから,PI5P4キナーゼβが細胞においてGTPの濃度を検知し,脂質2次メッセンジャーのシグナルを介して細胞の応答を制御するGTPセンサーであることが示唆された.
がん化には多くのエネルギーを必要とし,がん細胞は正常な細胞とは異なる代謝パターンを示すことが知られている.一方,PI5P4キナーゼは複数の種類のがんにおいて腫瘍の形成を促進することが明らかにされている7-10).そこで,PI5P4キナーゼβのGTPセンサーが腫瘍の形成の促進に関連するかどうかについて,GTP非依存的PI5P4キナーゼβ変異体を用いて検証した.その結果,GTP非依存的PI5P4キナーゼβ変異体を発現させた細胞の軟寒天プレートにおける増殖は,野生型PI5P4キナーゼβを発現させた細胞に比べ有意に抑制された.さらに,野生型PI5P4キナーゼβを発現させた細胞をヌードマウスに移植したところ半数が生着し腫瘍を形成したのに対し,GTP非依存的PI5P4キナーゼβ変異体を発現させた細胞はヌードマウスに移植しても腫瘍をまったく形成しなかった.よって,PI5P4キナーゼβのGTPセンサーは腫瘍の形成に寄与することが明らかにされた.
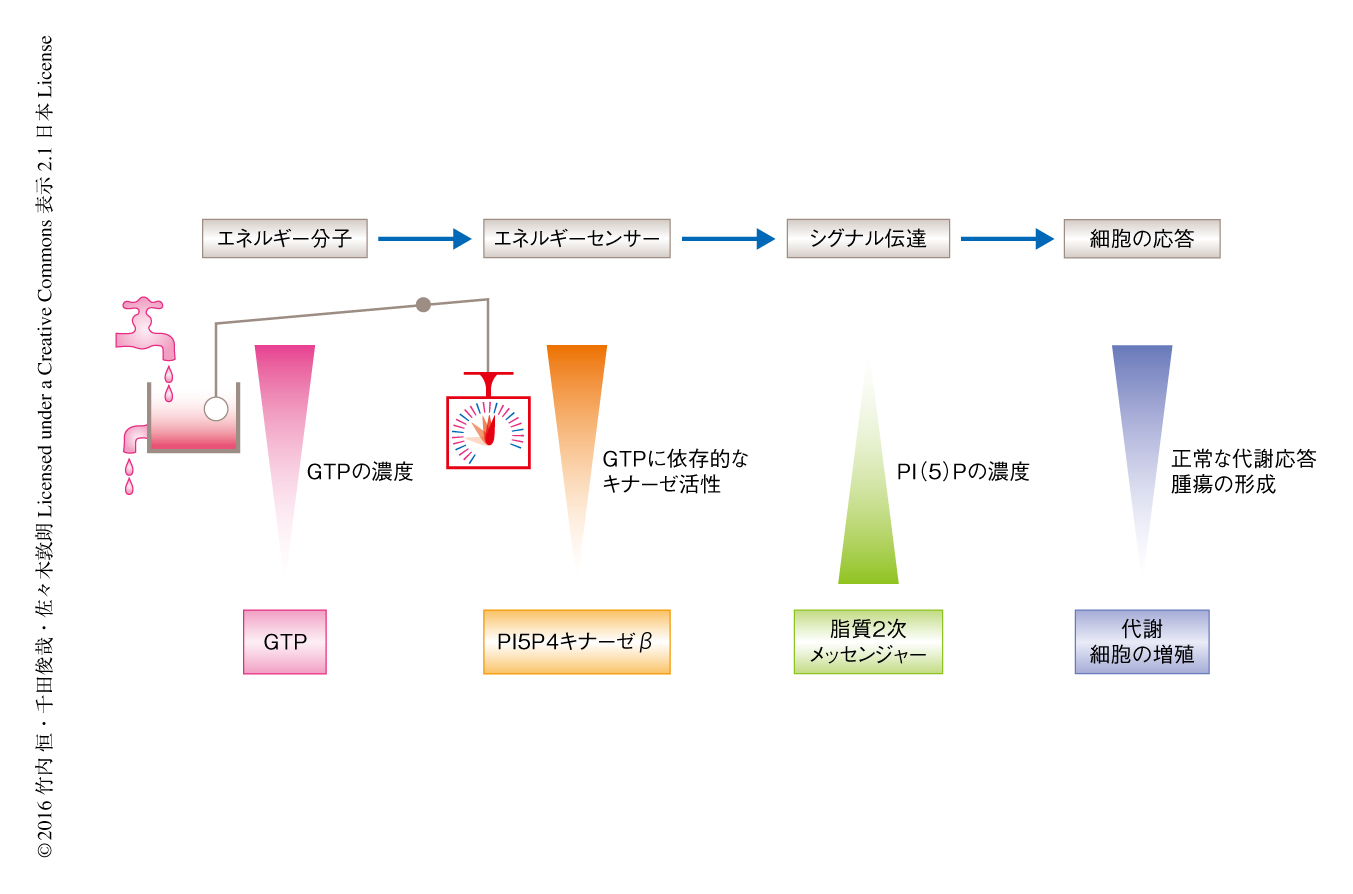
今回の研究により,細胞がGTPの濃度を感知し応答するしくみがはじめて明らかにされた(図1).また,この細胞の応答を担うしくみは腫瘍の形成の促進にも使われていた.細胞におけるGTPの濃度を起点としたエネルギー制御機構については,GTPセンサーが不明であったこともありほとんど研究が進んでいなかったが,今回の研究を契機に多くの研究者が参画しより深い理解の進んでいくことが期待される.ほかのキナーゼと同様に,PI5P4キナーゼβはリン酸供与基としてATPを利用すると考えられていた.このような思い込みがPI5P4キナーゼβの生理機能の解明,ひいては,GTPの濃度を起点としたエネルギー制御機構の発見を遅らせてきたことは示唆的である.この研究により,GTPが本来のリン酸供与基であることが明らかにされた.今後,関連するがんや代謝疾患などの新たな治療法が見い出され,より豊かな社会の実現につながることを期待したい.
略歴:2004年 東京大学大学院薬学系研究科博士課程 修了,同年 同 博士研究員,2005年 米国Harvard Medical School博士研究員,2010年 産業技術総合研究所バイオメディシナル情報研究センター 研究員を経て,2013年より産業技術総合研究所創薬分子プロファイリング研究センター 主任研究員.
研究テーマ:構造生物学.
関心事:タンパク質などの立体構造にもとづく生命現象の理解.
千田 俊哉(Toshiya Senda)
高エネルギー加速器研究機構物質構造科学研究所 教授.
佐々木 敦朗(Atsuo T. Sasaki)
米国Cincinnati大学College of Medicine助教授.
© 2016 竹内 恒・千田俊哉・佐々木敦朗 Licensed under CC 表示 2.1 日本
(1産業技術総合研究所創薬分子プロファイリング研究センター 3D分子設計チーム,2高エネルギー加速器研究機構物質構造科学研究所 構造生物学研究センター,3米国Cincinnati大学College of Medicine,Department of Internal Medicine)
email:竹内 恒,千田俊哉,佐々木敦朗
DOI: 10.7875/first.author.2016.008
The lipid kinase PI5P4Kβ is an intracellular GTP sensor for metabolism and tumorigenesis.
Kazutaka Sumita, Yu-Hua Lo, Koh Takeuchi, Miki Senda, Satoshi Kofuji, Yoshiki Ikeda, Jumpei Terakawa, Mika Sasaki, Hirofumi Yoshino, Nazanin Majd, Yuxiang Zheng, Emily Rose Kahoud, Takehiro Yokota, Brooke M. Emerling, John M. Asara, Tetsuo Ishida, Jason W. Locasale, Takiko Daikoku, Dimitrios Anastasiou, Toshiya Senda, Atsuo T. Sasaki
Molecular Cell, 61, 187-198 (2016)
要 約
細胞におけるGTPの濃度は細胞の状態により変化することが知られている.これまで,細胞がどのようにGTPの濃度を検知し細胞の機能を制御しているのかは謎であった.筆者らは,PI5P4キナーゼβがGTPの濃度を脂質2次メッセンジャーのシグナル伝達に変換し,細胞における代謝応答および腫瘍の形成を制御するGTPセンサーであることを見い出した.PI5P4キナーゼβはリン酸供与基としてATPよりもGTPを優先的に用い,かつ,GTPの生理学的な濃度域に対応する活性をもっていた.PI5P4キナーゼβとヌクレオチドとの複合体の立体構造解析によりGTPに特異的な認識機構を原子レベルで解明し,この情報にもとづきGTPに非依存的なPI5P4キナーゼβの変異体を作製した.この変異体を用いることにより,PI5P4キナーゼβのGTPセンサーは腫瘍の形成にも寄与することが明らかにされた.この研究により,GTPセンサー,そして,細胞におけるGTPの濃度を起点としたシグナル伝達機構の存在が明らかにされた.今後,PI5P4キナーゼβを標的としたがんの治療や創薬への応用が期待される.
はじめに
ATPやGTPなどのエネルギー分子は進化的に保存されており,細胞におけるさまざまな生理学的な反応の駆動力となる.そのため,細胞におけるエネルギー分子の濃度は環境に応じて受動的に変化するだけでなく,それ自体が細胞におけるシグナル伝達系の起点になっている.すなわち,細胞にはエネルギー分子の濃度を検知して適切な細胞応答を起こすしくみが備わっている.たとえば,細胞におけるATPの濃度の変化はAMP活性化キナーゼやmTORといった複数のATPセンサーにより感知され,代謝応答や遺伝子発現を変化させる1-3).このほかにも,細胞においてさまざまなエネルギー分子を検知するエネルギーセンサーの存在が知られている4,5).これらのエネルギーセンサーは,検知するエネルギー分子と直接的に結合する,検知するエネルギー分子の生理学的な濃度域にKm値が合致する,エネルギー分子の変化に応じシグナル伝達の強度を変化させる,といった共通の特徴をもつ.
GTPは細胞においておもにタンパク質の合成やシグナル伝達の原動力となるエネルギー分子である.そのため,細胞の増殖が活発ながん細胞や,血清タンパク質を多く産生する肝臓,膵臓,脂肪組織などは多くのGTPを必要とする.細胞におけるGTPの濃度はATPとは独立に制御されていることから,独自の制御機構の存在が考えられる.しかしながら,細胞においてGTPの濃度を検知し細胞の機能を制御するGTPセンサーはいまだ発見されておらず,細胞におけるGTPの濃度を起点としたエネルギー制御機構の存在については不明であった.
1.PI5P4キナーゼβはリン酸供与基としてGTPを用いる
GTPセンサーの候補となるタンパク質を探索することを目的として,GTPを固定化したビーズを用いたプルダウン法により,GTPにより強く結合するシグナルタンパク質を細胞から広く探索した.その結果,Gタンパク質やこれまでGTPと結合することが知られていたSrc,カゼインキナーゼIIといったキナーゼにくわえ,PI5P4キナーゼβが同定された.PI5P4キナーゼβはホスファチジルイノシトール5-リン酸を基質としてホスファチジルイノシトール4,5-ビスリン酸を産生するイノシトールリン脂質キナーゼである6).PI5P4キナーゼβはATPあるいはm7GTPを固定化したビーズに比べGTPを固定化したビーズにより強く結合した.溶液NMR法を用いた固定化していない条件における検討においても同様の傾向がみられ,さらに,GTPとATPはPI5P4キナーゼβにおいて結合部位を競合していた.PI5P4キナーゼβにおいて,GTPをリン酸供与基とするホスファチジルイノシトール5-リン酸のリン酸化活性は,同じ濃度のATPをリン酸供与基とする活性に比べ数倍も強かった.これまで,PI5P4キナーゼβはがんや糖尿病との関連が示されていたが7-11),その機能の詳細は明らかでなかった.また,ヒトの細胞にある約500種類のキナーゼと同様に,PI5P4キナーゼβはATPをホスファチジルイノシトール5-リン酸のリン酸化に用いると考えられていた.しかし,PI5P4キナーゼβはGTPをリン酸供与基として用いるユニークなGTPキナーゼであることが明らかにされた.
2.PI5P4キナーゼβのリン酸化活性はGTPの濃度に依存して変化する
PI5P4キナーゼβのもつホスファチジルイノシトール5-リン酸のリン酸化活性について,ATPあるいはGTPに対する濃度依存性をより詳細に解析した結果,ホスファチジルイノシトール5-リン酸の濃度や配位金属の種類にかかわらず,GTPに依存的な活性はATPに依存的な活性に比べつねに強いことが明らかにされた.さらに,GTPの生理学的な濃度域においてPI5P4キナーゼβの活性は大きく変化したのに対し,ATPの生理学的な濃度域におけるPI5P4キナーゼβの活性はほとんど飽和しておりその変化量はわずかであった.また,生理学的な濃度のATPおよびGTPを共存させた状態においても,キナーゼ反応の大半はGTPに依存的であり,細胞におけるPI5P4キナーゼβの活性はGTPの濃度変化に依存して大きく変化した.この特性により,PI5P4キナーゼβが細胞におけるGTPセンサーである可能性がより強く支持された.
3.立体構造解析にもとづくGTP非依存的PI5P4キナーゼβ変異体の作製
PI5P4キナーゼβはGTPの濃度に依存してリン酸化活性を変化させたが,ATPに依存した基底的な活性を保持していたため,ノックアウトあるいはノックダウンといった通常の遺伝学的な手法により,PI5P4キナーゼβのもつGTPに依存的な活性の生物学的な意義について明らかにすることは困難であった.そこで,GTPに依存的な活性を失ってはいるもののATPに依存的な機能は保持したGTP非依存的PI5P4キナーゼβ変異体を作製することを考えた.そのため,PI5P4キナーゼβとヌクレオチドとの複合体の立体構造を解析し,PI5P4キナーゼβがGTPと特異的に結合する分子機構について明らかにした.GTPアナログあるいはATPアナログとPI5P4キナーゼβとの複合体の立体構造を得た結果,PI5P4キナーゼβのThr201,Asn203,Phe205はGTPの認識にのみかかわっていることが示された.そこで,これらの残基に変異を導入し,その活性をNMR法および生化学的な実験により検証したところ,Phe205をLeuに置換した変異体はGTPに依存的な活性を失う一方,野生型と同様のATPに依存的な活性を保持していることが確認され,もとめるGTP非依存的PI5P4キナーゼβ変異体の作製に成功した.
4.GTP非依存的PI5P4キナーゼβ変異体はGTPの枯渇に対する正常な細胞応答を失わせる
PI5P4キナーゼβを欠損した細胞にGTP非依存的PI5P4キナーゼβ変異体あるいは野生型のPI5P4キナーゼβを再導入し,ミコフェノール酸を処理することにより細胞におけるGTPの濃度を特異的に減少させた.野生型PI5P4キナーゼβを発現させた細胞においては,GTPの枯渇によりPI5P4キナーゼβのGTPに依存的な活性が大幅に低下した結果,基質であるホスファチジルイノシトール5-リン酸の蓄積がみられた.一方,GTP非依存的PI5P4キナーゼβ変異体を発現させた細胞においては,GTPを枯渇させるまえからホスファチジルイノシトール5-リン酸の蓄積量が多く,GTPの枯渇によってもその量に変化はみられなかった.また,GTP非依存的PI5P4キナーゼβ変異体を発現させた細胞と野生型PI5P4キナーゼβを発現させた細胞とでは,ほかの代謝産物に関してもその多くがGTPの枯渇により変化する量が異なっており,PI5P4キナーゼβがGTPに対する濃度依存性を失ったことにより,GTPの濃度変化に対する代謝応答に異常の起こることが明らかにされた.このことから,PI5P4キナーゼβが細胞においてGTPの濃度を検知し,脂質2次メッセンジャーのシグナルを介して細胞の応答を制御するGTPセンサーであることが示唆された.
5.PI5P4キナーゼβのGTPセンサーは腫瘍の形成に寄与する
がん化には多くのエネルギーを必要とし,がん細胞は正常な細胞とは異なる代謝パターンを示すことが知られている.一方,PI5P4キナーゼは複数の種類のがんにおいて腫瘍の形成を促進することが明らかにされている7-10).そこで,PI5P4キナーゼβのGTPセンサーが腫瘍の形成の促進に関連するかどうかについて,GTP非依存的PI5P4キナーゼβ変異体を用いて検証した.その結果,GTP非依存的PI5P4キナーゼβ変異体を発現させた細胞の軟寒天プレートにおける増殖は,野生型PI5P4キナーゼβを発現させた細胞に比べ有意に抑制された.さらに,野生型PI5P4キナーゼβを発現させた細胞をヌードマウスに移植したところ半数が生着し腫瘍を形成したのに対し,GTP非依存的PI5P4キナーゼβ変異体を発現させた細胞はヌードマウスに移植しても腫瘍をまったく形成しなかった.よって,PI5P4キナーゼβのGTPセンサーは腫瘍の形成に寄与することが明らかにされた.
おわりに
今回の研究により,細胞がGTPの濃度を感知し応答するしくみがはじめて明らかにされた(図1).また,この細胞の応答を担うしくみは腫瘍の形成の促進にも使われていた.細胞におけるGTPの濃度を起点としたエネルギー制御機構については,GTPセンサーが不明であったこともありほとんど研究が進んでいなかったが,今回の研究を契機に多くの研究者が参画しより深い理解の進んでいくことが期待される.ほかのキナーゼと同様に,PI5P4キナーゼβはリン酸供与基としてATPを利用すると考えられていた.このような思い込みがPI5P4キナーゼβの生理機能の解明,ひいては,GTPの濃度を起点としたエネルギー制御機構の発見を遅らせてきたことは示唆的である.この研究により,GTPが本来のリン酸供与基であることが明らかにされた.今後,関連するがんや代謝疾患などの新たな治療法が見い出され,より豊かな社会の実現につながることを期待したい.
文 献
- Oakhill, J. S., Steel, R., Chen, Z. P. et al.: AMPK is a direct adenylate charge-regulated protein kinase. Science, 332, 1433-1435 (2011)[PubMed]
- Hardie, D. G., Ross, F. A. & Hawley, S. A.: AMPK: a nutrient and energy sensor that maintains energy homeostasis. Nat. Rev. Mol. Cell Biol., 13, 251-262 (2012)[PubMed]
- Dennis, P. B., Jaeschke, A., Saitoh, M. et al.: Mammalian TOR: a homeostatic ATP sensor. Science, 294, 1102-1105 (2001)[PubMed]
- Schofield, C. J. & Ratcliffe, P. J.: Oxygen sensing by HIF hydroxylases. Nat. Rev. Mol. Cell Biol., 5, 343-354 (2004)[PubMed]
- Wang, S., Tsun, Z. Y., Wolfson, R. L. et al.: Lysosomal amino acid transporter SLC38A9 signals arginine sufficiency to mTORC1. Science, 347, 188-194 (2015)[PubMed]
- Rameh, L. E., Tolias, K. F., Duckworth, B. C. et al.: A new pathway for synthesis of phosphatidylinositol-4,5-bisphosphate. Nature, 390, 192-196 (1997)[PubMed]
- Emerling, B. M., Hurov, J. B., Poulogiannis, G. et al.: Depletion of a putatively druggable class of phosphatidylinositol kinases inhibits growth of p53-null tumors. Cell, 155, 844-857 (2013)[PubMed]
- Jude, J. G., Spencer, G. J., Huang, X. et al.: A targeted knockdown screen of genes coding for phosphoinositide modulators identifies PIP4K2A as required for acute myeloid leukemia cell proliferation and survival. Oncogene, 34, 1253-1262 (2015)[PubMed]
- Keune, W. -J., Sims, A. H., Jones, D. R. et al.: Low PIP4K2B expression in human breast tumors correlates with reduced patient survival: A role for PIP4K2B in the regulation of E-cadherin expression. Cancer Res., 73, 6913-6925 (2013)[PubMed]
- Luoh, S. W., Venkatesan, N. & Tripathi, R.: Overexpression of the amplified Pip4k2β gene from 17q11-12 in breast cancer cells confers proliferation advantage. Oncogene, 23, 1354-1363 (2004)[PubMed]
- Lamia, K. A., Peroni, O. D., Kim, Y. B. et al.: Increased insulin sensitivity and reduced adiposity in phosphatidylinositol 5-phosphate 4-kinase β-/- mice. Mol. Cell. Biol., 24, 5080-5087 (2004)[PubMed]
著者プロフィール
略歴:2004年 東京大学大学院薬学系研究科博士課程 修了,同年 同 博士研究員,2005年 米国Harvard Medical School博士研究員,2010年 産業技術総合研究所バイオメディシナル情報研究センター 研究員を経て,2013年より産業技術総合研究所創薬分子プロファイリング研究センター 主任研究員.
研究テーマ:構造生物学.
関心事:タンパク質などの立体構造にもとづく生命現象の理解.
千田 俊哉(Toshiya Senda)
高エネルギー加速器研究機構物質構造科学研究所 教授.
佐々木 敦朗(Atsuo T. Sasaki)
米国Cincinnati大学College of Medicine助教授.
© 2016 竹内 恒・千田俊哉・佐々木敦朗 Licensed under CC 表示 2.1 日本