血中タンパク質AIMは尿細管の管腔に蓄積した死細胞を除去することにより急性腎障害の治癒を促進する
新井郷子・北田研人・宮崎 徹
(東京大学大学院医学系研究科 疾患生命工学センター分子病態医科学部門)
email:新井郷子,宮崎 徹
DOI: 10.7875/first.author.2016.007
Apoptosis inhibitor of macrophage protein enhances intraluminal debris clearance and ameliorates acute kidney injury in mice.
Satoko Arai, Kento Kitada, Tomoko Yamazaki, Ryosuke Takai, Xizhong Zhang, Yoji Tsugawa, Ryoichi Sugisawa, Ayaka Matsumoto, Mayumi Mori, Yasunori Yoshihara, Kent Doi, Natsumi Maehara, Shunsuke Kusunoki, Akiko Takahata, Eisei Noiri, Yusuke Suzuki, Naoki Yahagi, Akira Nishiyama, Lakshman Gunaratnam, Tomoko Takano, Toru Miyazaki
Nature Medicine, 22, 183-193 (2016)
現在のところ,急性腎障害に有効な治療法はなく革新的な治療法の開発が待たれている.今回,筆者らは,急性腎障害により傷害をうけた近位尿細管において,血中タンパク質であるAIMが治癒を促進することを見い出した.AIMは尿細管の管腔に蓄積した死細胞に付着し,傷害をうけた近位尿細管の上皮細胞が発現するスカベンジャー受容体のひとつKIM-1を介し貪食されることにより,死細胞の除去を促進した.AIMノックアウトマウスに人為的に急性腎障害をひき起こしたところ,死細胞が除去されず蓄積することで炎症が持続し,腎臓の機能が極度に低下し死にいたった.また,AIMの投与により,AIMノックアウトマウスはもちろん,野生型のマウスにおいても急性腎障害の治癒が促進されたことから,AIMによる急性腎障害の新規の治療法の可能性が示された.
腎臓における血流の障害,敗血症,尿毒素など,さまざまな原因により誘発される急性腎障害は,腎臓の機能が急激に低下する疾患であり,近年,患者の数は増加の傾向にある.多くの場合,適切な処置を施すことにより治癒がみこめるが,罹患により慢性腎臓病や末期腎不全のリスクが生じることは否定できない.しかしながら,急性腎障害はその病態の進行機序の複雑さから有効な根本療法がみつかっていない.
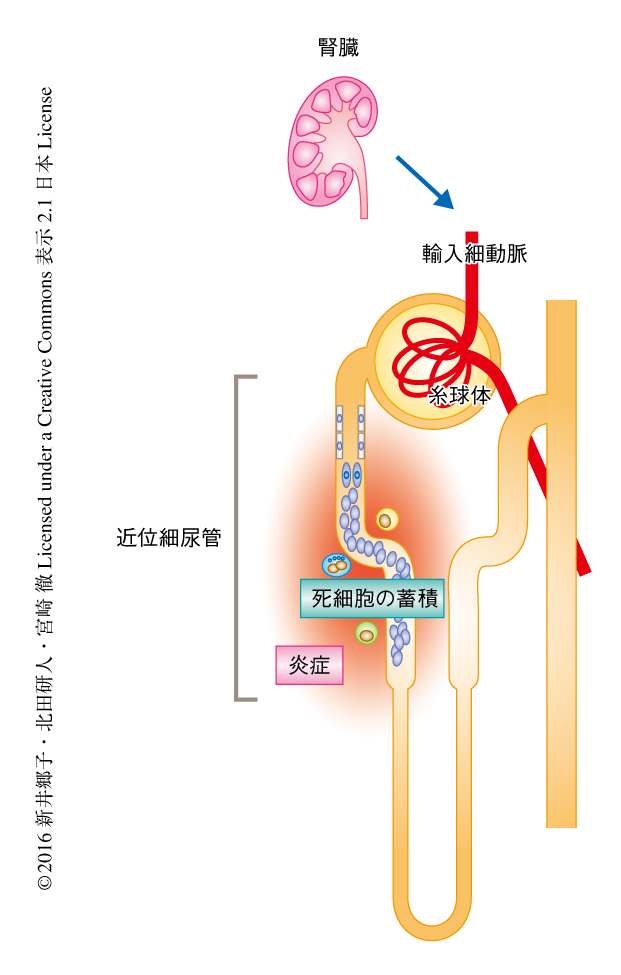
急性腎障害のもっとも重要な病理所見は,アポトーシスあるいはネクローシスによる尿細管の上皮細胞の死により基底膜からの脱落した死細胞のかたまりによる尿細管の閉塞である(図1).これらの細胞死は,とくに腎臓の皮髄境界部に存在する近位尿細管において起こり,つづいて,糸球体における濾過の量の低下,傷害された上皮細胞からの炎症メディエーターの放出とそれによる免疫細胞の浸潤および炎症により,さらに障害が悪化する.急性腎障害の治癒には,尿細管に蓄積した死細胞が効率的に除去され生き残った尿細管の上皮細胞が増殖することにより,構造的および機能的に正常な尿細管が再生することが必要である.このような,傷害により生じた死細胞をすみやかに除去することが治癒および機能的な回復に必要であるという概念は,急性腎障害だけでなくさまざまな組織で起こる傷害において共通する.
通常,死細胞の除去はプロフェッショナルな貪食細胞であるマクロファージや樹状細胞によるが,ときに,おのおのの組織の上皮細胞もセミプロフェッショナルな貪食細胞として傷害により生じた死細胞の除去を補助することがある.たとえば,腎臓が傷害をうけたときには,尿細管の上皮細胞が管腔側に急激かつ非常に強くKIM-1を発現することによりセミプロフェッショナルな貪食細胞へと脱分化する1).KIM-1はスカベンジャー受容体の一種であり,アポトーシスをした細胞の表面に露出するホスファチジルセリンや酸化したリポタンパク質を認識することにより死細胞の除去に寄与する.尿細管の管腔にはマクロファージや樹状細胞はほとんど存在しないため,KIM-1を発現することによりセミプロフェッショナルな貪食細胞になった上皮細胞が死細胞の除去において非常に重要な役割をはたす.そのため,KIM-1の機能が不全となったマウスにおいては急性腎障害の治癒が障害される2,3).
AIMは組織マクロファージにより産生される分泌型の血中タンパク質であり,ヒトおよびマウスにおいて比較的高い濃度で血中に存在する4,5).通常,AIMは血中において免疫グロブリンM五量体と結合して安定化しているため,血中のAIMの濃度は免疫グロブリンMの濃度に依存する5-7).免疫グロブリンM五量体は500 kDaをこえる巨大なタンパク質複合体であるため,それに結合しているかぎりAIMも糸球体を通過して尿へと移行することはなく高い血中濃度が保たれるが,免疫グロブリンMから解離するとAIMはすみやかに尿へと排泄される.AIMは,リポ多糖,免疫グロブリンM,補体制御因子,細胞質においては脂肪酸合成酵素など,さまざまな分子と結合するという特徴を持ち,また,スカベンジャー受容体を介してマクロファージ,脂肪細胞,肝細胞などさまざまな細胞にエンドサイトーシスされる.このような特徴から,これまで,AIMは肥満やインスリン抵抗性8,9),動脈硬化6),非アルコール性脂肪性肝炎10) など,さまざまな疾患における病態の進行に関与することが明らかにされている.
急性腎障害の原因のひとつである腎臓虚血再灌流障害を人為的に起こすことにより,野生型のマウスおよびAIMノックアウトマウスに急性腎障害をひき起こし経過をおった.野生型マウスは時間の経過とともに快方にむかったが,AIMノックアウトマウスは死亡率がいちじるしく高く,また,かろうじて生存した個体においても腎臓の機能の極度の悪化がみられ,全身の健康状態がいちじるしく損なわれていた.以上より,急性腎障害の治癒にはAIMが必要である可能性が示唆された.
AIMの欠失が急性腎障害の治癒にどのように影響するのか,急性腎障害のおもな特徴である近位尿細管の上皮細胞の細胞死とそれによる管腔の閉塞について解析した.人為的に腎臓虚血再灌流障害を起こしたマウスにおいて近位尿細管の集中する腎臓の皮髄境界部を観察した.野生型のマウスにおいては,いったん死細胞の領域が生じたが,そののち,時間の経過とともに死細胞が除去され減少したのに対し,AIMノックアウトマウスにおいては死細胞の領域の減少はみられず残存したままだった.また,野生型マウスにおいては尿細管の上皮細胞の再生にともない刷子縁が復活したが,AIMノックアウトマウスにおいては刷子縁の復活も抑制されていた.さらに,死細胞の蓄積は炎症性マクロファージの浸潤およびそれにともなう炎症性サイトカインの産生を促進することにより炎症をひき起こすが,AIMノックアウトマウスにおいては野生型マウスと比較して炎症が持続する傾向がみられた.以上より,AIMノックアウトマウスにおいては,急性腎障害によりひき起こされた細胞死により蓄積した死細胞が除去されないために炎症が持続し,組織の正常な再生がさまたげられることにより腎臓の機能が致死的に悪化することが明らかにされた.
AIMが欠失すると尿細管の管腔において死細胞が除去されないのはなぜだろうか.スカベンジャー受容体のひとつKIM-1に注目した.KIM-1は急性腎障害をうけたときに近位尿細管の上皮細胞の管腔側に急激かつ非常に強く発現することによりセミプロフェッショナルな貪食細胞へと変化させ死細胞の除去に寄与する1).KIM-1の発現について調べたところ,KIM-1はAIMの有無にかかわらず人為的な腎臓虚血再灌流障害により発現が強く誘導された.回復期にある野生型のマウスにおいてKIM-1の発現は減弱したが,傷害の持続するAIMノックアウトマウスにおいてはKIM-1の発現は強いままであり,AIMの欠損がKIM-1の発現をさまたげることはなかった.
詳細な検討をつづけると,野生型マウスの尿細管の管腔に蓄積した死細胞においてAIMが顕著に蓄積していることが見い出された.同様に,急性腎障害の患者の腎臓においても管腔を閉塞する死細胞にAIMの蓄積が認められた.そこで,KIM-1を介する尿細管の上皮細胞による死細胞の貪食にはAIMの付着が必要ではないかと考えた.この仮説を検証するため,AIMとKIM-1との相互作用についてin vitroにおいて解析したところ,KIM-1を強制発現させた293T細胞においてAIMのKIM-1への結合および細胞への取り込みがみられ,尿細管の管腔においてAIMはKIM-1のリガンドであることが示唆された.したがって,人為的な腎臓虚血再灌流障害により尿細管の管腔に蓄積した死細胞は,AIMが付着することによりKIM-1に認識され,尿細管の上皮細胞による貪食が促進されることによりすみやかに除去されることが示唆された.
人為的に腎臓虚血再灌流障害を起こしたマウスの腎臓において免疫染色によりAIMおよびKIM-1の局在を確認したところ,KIM-1を発現する近位尿細管の上皮細胞が,AIMの付着した管腔の死細胞をとりかこみ,死細胞の一部は細胞に取り込まれているようすが観察された.急性腎障害の患者の腎臓の検体においても同様の現象が観察され,尿細管の上皮細胞はKIM-1を介してAIMが付着した死細胞を貪食することが示唆された.
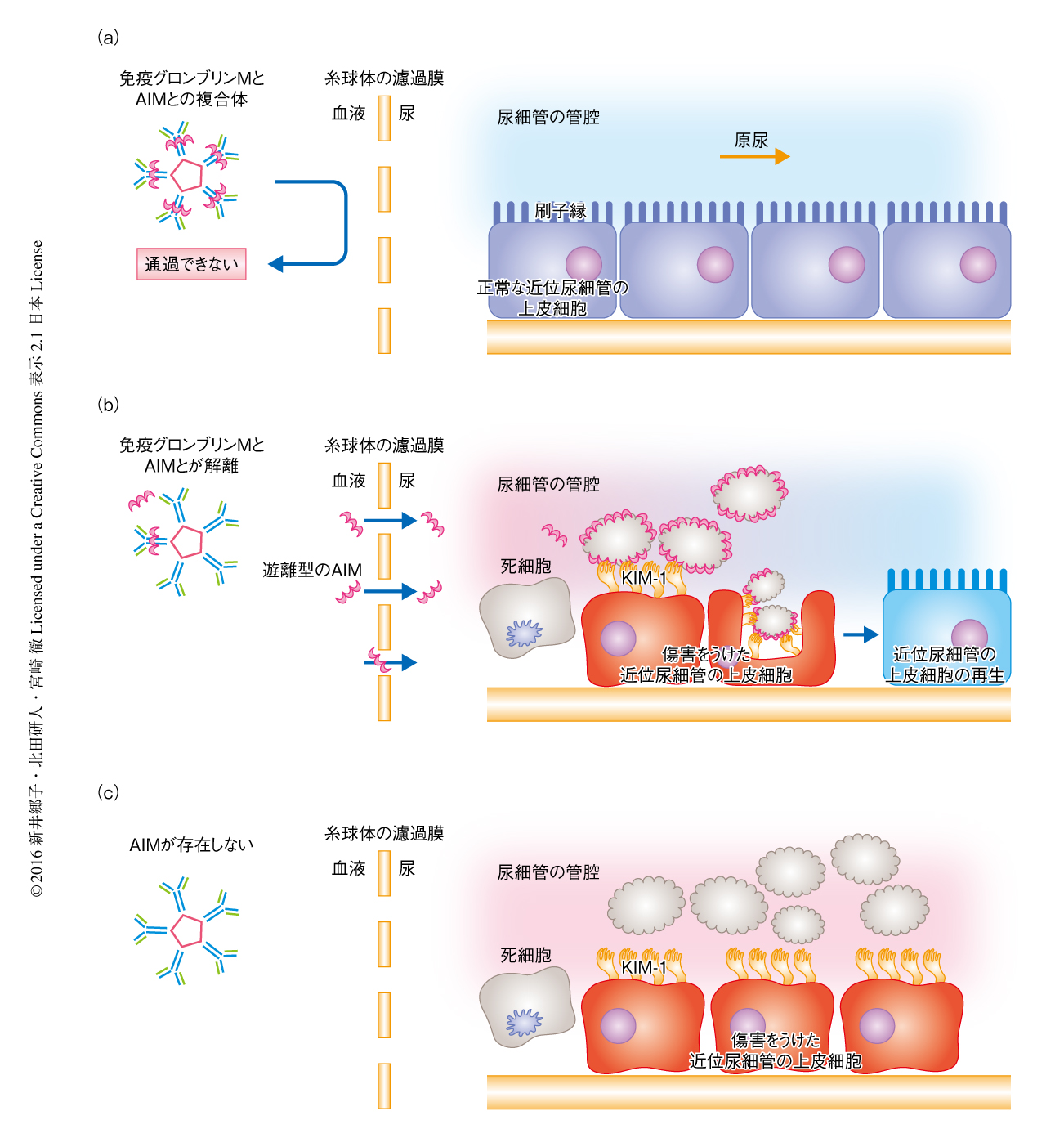
AIMによるKIM-1を介した貪食の促進効果について,マウスの近位尿細管の上皮細胞の細胞株であるmProx24細胞を用いたin vitroにおける実験により確かめた.mProx24細胞を加熱して壊死させたのち粉砕しAIMと混合することによりAIMが付着した死細胞を調製した.貪食細胞として生きたmProx24細胞にKIM-1を強制発現させ,そこへ蛍光標識した死細胞をくわえたところ,AIMが付着している死細胞はAIMのない死細胞よりも効率よくmProx24に貪食された.AIMの付着の有無にかかわらずKIM-1の発現そのものにより貪食の効率は上昇するが1),死細胞にAIMが付着することにより貪食の効率はさらにいちじるしく上昇した.また,この貪食の効率の上昇は,ヒトのKIM-1およびヒトのAIMにおいても確かめられた.さらに,AIMの付着による死細胞の除去の促進はin vivoにおいても検証された.すなわち,人為的に腎臓虚血再灌流障害を起こしたAIMノックアウトマウスにAIMを静脈投与することにより,尿細管の管腔に蓄積した死細胞にはAIMが付着し,そののち,すみやかに除去された(図2).
以上の解析により,KIM-1とAIMとの相互作用は死細胞の除去を促進することが明らかにされたが,この相互作用が急性腎障害の治癒に必須であるかどうか,KIM-1ノックアウトマウスを用いて検証した.これまでの報告にもあったように,KIM-1の機能が不全になると,人為的な腎臓虚血再灌流障害を起こしたマウスにおいて尿細管の管腔の死細胞は除去されず病態は悪化する2,3).実際に,人為的に腎臓虚血再灌流障害を起こしたKIM-1ノックアウトマウスの尿細管に蓄積した死細胞について調べたところ,野生型のマウスと同様に,AIMが強く付着しているにもかかわらず除去されず残存していた.また,KIM-1ノックアウトマウスにAIMを投与しても尿細管の管腔に蓄積した死細胞の量は減少しなかった.これらのことから,人為的な腎臓虚血再灌流障害により生じた尿細管の死細胞の除去にはAIMおよびKIM-1が必要であることが示された.
尿細管の管腔に蓄積する死細胞の除去にはAIMの付着が必要であることが明らかにされたが,AIMはどこからやってくるのだろうか.血管は管腔にはつうじていないため,なんらかの作用機序により血中のAIMが糸球体を通過して尿へと移行して,尿細管の管腔の死細胞に付着するのではないかと考えた.そこで,野生型のマウスおよびヒトにおいて,尿中のAIMの濃度をELISA法により測定した.その結果,通常の状態のマウスの尿においてAIMはほとんど検出されなかったが,人為的な腎臓虚血再灌流障害により尿中のAIMは顕著に増加し,回復期にはふたたびほぼゼロまで減少した.ヒトにおいても同様であり,健常者の尿にAIMはほとんど存在しなかったが,急性腎障害の患者の尿からはAIMが検出され,また,回復期にある急性腎障害の患者の尿においてAIMは減少していた.
マウスおよびヒトとも,通常,AIMは血中において免疫グロブリンM五量体と結合している.免疫グロブリンM五量体は巨大なタンパク質複合体であるため,それに結合しているかぎり,AIMは糸球体を通過して尿へと移行することはない7).ウェスタンブロット法により,正常なマウスあるいは健常人の血中のAIMはそのほとんどが免疫グロブリンM五量体と結合しているため600 kDa以上のバンドとして検出され,約40 kDaの遊離型のAIMはほとんど検出されなかった.一方,急性腎障害を起こしているマウスおよびヒトの血清を調べたところ,予想どおり,遊離型のAIMの顕著な増加がみられた.また,とくに急性腎障害の患者においては血清のクレアチニン値と遊離型のAIMの量に正の相関があり,腎臓の障害が重症であるほど遊離型のAIMの量が増加することが示唆された.これらのことから,以下のような仮説が考えられた.すなわち,急性腎障害の際には,その機序は不明であるが,免疫グロブリンMとAIMとの複合体からAIMが解離し,血中において遊離型のAIMが増加する.遊離型のAIMは糸球体を通過するため,すみやかに尿へと移行し,尿細管の管腔に蓄積した死細胞に付着することによりその排除を促進する(図2).実際に,尿細管の管腔の死細胞に集積したAIMには免疫グロブリンMは結合していなかったことからも,この仮説は支持された.
AIMの投与による急性腎障害の治療について検討した.人為的な腎臓虚血再灌流障害を起こしたAIMノックアウトマウスに対し,1日目から3日目までの3日間,1回1 mgの精製AIMを静脈投与したところ,対照となるマウスは7日目までに約60%が死にいたったのに対し,AIMを投与したマウスは100%が生存し,また,AIMの投与により腎臓の機能が回復していた.腎臓の組織を観察したところ,AIMを投与したマウスでは尿細管の管腔の死細胞が顕著に減少しており,刷子縁の顕著な回復も認められた.また,野生型のマウスに対しさらに厳しい条件で人為的な腎臓虚血再灌流障害を起こしたところ,対照となるマウスは3日目までにはすべての個体が死にいたったが,AIMの投与により致死率は20%まで軽減された.また,同様に,尿細管の管腔における死細胞の蓄積の減少,組織の再生および回復がみられたことから,AIMの量を増加させることによっても治療効果のあることが示された.すなわち,AIMの投与による急性腎障害の治療の可能性が示された.
この研究において,急性腎障害の治癒におけるAIMの重要な役割が示された(図2).そして,急性腎障害の際には,AIMはそれまで結合していた免疫グロブリンM五量体から解離し尿へと移行することにより尿細管に蓄積した死細胞に付着した.しかしながら,急性腎障害になるとなぜAIMは免疫グロブリンM五量体から解離するのか,その分子機構は不明であり解明が待たれる.さらに,AIMはKIM-1のリガンドであることが見い出された.すでに,KIM-1はアポトーシスをした細胞のeat-meシグナルを認識することにより死細胞を除去することについては報告があったが,アポトーシスとネクローシスとをとわず,死細胞にAIMが付着することによりKIM-1を介した貪食の効率がいちじるしく向上することが明らかにされた.AIMがどのように死細胞に付着するのかについては未解明であるが,AIMの存在は,KIM-1が単独のときより強力に死細胞の貪食をひき起こし,急性腎障害の治癒に大きく貢献すると考えられる.今後,急性腎障害のさまざまなモデルにおいてAIMの効果を確かめることにより,AIMを用いた急性腎障害の治療法の基盤が構築されることが期待される.
略歴:2004年 東京大学大学院農学生命科学研究科 修了,同年 米国Texas大学Southwestern Medical Center博士研究員,2005年 東京大学大学院医学系研究科 助教,同 講師を経て,2014年より同 特任准教授(現 准教授).
研究テーマ:AIMの血中における安定性の解明,および,疾患の治療への応用.
北田 研人(Kento Kitada)
米国Vanderbilt大学School of Medicine研究員.
宮崎 徹(Toru Miyazaki)
東京大学大学院医学系研究科 教授.
研究室URL:http://tmlab.m.u-tokyo.ac.jp/index.html
© 2016 新井郷子・北田研人・宮崎 徹 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 疾患生命工学センター分子病態医科学部門)
email:新井郷子,宮崎 徹
DOI: 10.7875/first.author.2016.007
Apoptosis inhibitor of macrophage protein enhances intraluminal debris clearance and ameliorates acute kidney injury in mice.
Satoko Arai, Kento Kitada, Tomoko Yamazaki, Ryosuke Takai, Xizhong Zhang, Yoji Tsugawa, Ryoichi Sugisawa, Ayaka Matsumoto, Mayumi Mori, Yasunori Yoshihara, Kent Doi, Natsumi Maehara, Shunsuke Kusunoki, Akiko Takahata, Eisei Noiri, Yusuke Suzuki, Naoki Yahagi, Akira Nishiyama, Lakshman Gunaratnam, Tomoko Takano, Toru Miyazaki
Nature Medicine, 22, 183-193 (2016)
この論文に出現する遺伝子・タンパク質のUniprot ID
要 約
現在のところ,急性腎障害に有効な治療法はなく革新的な治療法の開発が待たれている.今回,筆者らは,急性腎障害により傷害をうけた近位尿細管において,血中タンパク質であるAIMが治癒を促進することを見い出した.AIMは尿細管の管腔に蓄積した死細胞に付着し,傷害をうけた近位尿細管の上皮細胞が発現するスカベンジャー受容体のひとつKIM-1を介し貪食されることにより,死細胞の除去を促進した.AIMノックアウトマウスに人為的に急性腎障害をひき起こしたところ,死細胞が除去されず蓄積することで炎症が持続し,腎臓の機能が極度に低下し死にいたった.また,AIMの投与により,AIMノックアウトマウスはもちろん,野生型のマウスにおいても急性腎障害の治癒が促進されたことから,AIMによる急性腎障害の新規の治療法の可能性が示された.
はじめに
腎臓における血流の障害,敗血症,尿毒素など,さまざまな原因により誘発される急性腎障害は,腎臓の機能が急激に低下する疾患であり,近年,患者の数は増加の傾向にある.多くの場合,適切な処置を施すことにより治癒がみこめるが,罹患により慢性腎臓病や末期腎不全のリスクが生じることは否定できない.しかしながら,急性腎障害はその病態の進行機序の複雑さから有効な根本療法がみつかっていない.
急性腎障害のもっとも重要な病理所見は,アポトーシスあるいはネクローシスによる尿細管の上皮細胞の死により基底膜からの脱落した死細胞のかたまりによる尿細管の閉塞である(図1).これらの細胞死は,とくに腎臓の皮髄境界部に存在する近位尿細管において起こり,つづいて,糸球体における濾過の量の低下,傷害された上皮細胞からの炎症メディエーターの放出とそれによる免疫細胞の浸潤および炎症により,さらに障害が悪化する.急性腎障害の治癒には,尿細管に蓄積した死細胞が効率的に除去され生き残った尿細管の上皮細胞が増殖することにより,構造的および機能的に正常な尿細管が再生することが必要である.このような,傷害により生じた死細胞をすみやかに除去することが治癒および機能的な回復に必要であるという概念は,急性腎障害だけでなくさまざまな組織で起こる傷害において共通する.
通常,死細胞の除去はプロフェッショナルな貪食細胞であるマクロファージや樹状細胞によるが,ときに,おのおのの組織の上皮細胞もセミプロフェッショナルな貪食細胞として傷害により生じた死細胞の除去を補助することがある.たとえば,腎臓が傷害をうけたときには,尿細管の上皮細胞が管腔側に急激かつ非常に強くKIM-1を発現することによりセミプロフェッショナルな貪食細胞へと脱分化する1).KIM-1はスカベンジャー受容体の一種であり,アポトーシスをした細胞の表面に露出するホスファチジルセリンや酸化したリポタンパク質を認識することにより死細胞の除去に寄与する.尿細管の管腔にはマクロファージや樹状細胞はほとんど存在しないため,KIM-1を発現することによりセミプロフェッショナルな貪食細胞になった上皮細胞が死細胞の除去において非常に重要な役割をはたす.そのため,KIM-1の機能が不全となったマウスにおいては急性腎障害の治癒が障害される2,3).
AIMは組織マクロファージにより産生される分泌型の血中タンパク質であり,ヒトおよびマウスにおいて比較的高い濃度で血中に存在する4,5).通常,AIMは血中において免疫グロブリンM五量体と結合して安定化しているため,血中のAIMの濃度は免疫グロブリンMの濃度に依存する5-7).免疫グロブリンM五量体は500 kDaをこえる巨大なタンパク質複合体であるため,それに結合しているかぎりAIMも糸球体を通過して尿へと移行することはなく高い血中濃度が保たれるが,免疫グロブリンMから解離するとAIMはすみやかに尿へと排泄される.AIMは,リポ多糖,免疫グロブリンM,補体制御因子,細胞質においては脂肪酸合成酵素など,さまざまな分子と結合するという特徴を持ち,また,スカベンジャー受容体を介してマクロファージ,脂肪細胞,肝細胞などさまざまな細胞にエンドサイトーシスされる.このような特徴から,これまで,AIMは肥満やインスリン抵抗性8,9),動脈硬化6),非アルコール性脂肪性肝炎10) など,さまざまな疾患における病態の進行に関与することが明らかにされている.
1.AIMノックアウトマウスにおいては急性腎障害の治癒がさまたげられる
急性腎障害の原因のひとつである腎臓虚血再灌流障害を人為的に起こすことにより,野生型のマウスおよびAIMノックアウトマウスに急性腎障害をひき起こし経過をおった.野生型マウスは時間の経過とともに快方にむかったが,AIMノックアウトマウスは死亡率がいちじるしく高く,また,かろうじて生存した個体においても腎臓の機能の極度の悪化がみられ,全身の健康状態がいちじるしく損なわれていた.以上より,急性腎障害の治癒にはAIMが必要である可能性が示唆された.
2.AIMノックアウトマウスにおいては尿細管の管腔に蓄積する死細胞の除去がさまたげられる
AIMの欠失が急性腎障害の治癒にどのように影響するのか,急性腎障害のおもな特徴である近位尿細管の上皮細胞の細胞死とそれによる管腔の閉塞について解析した.人為的に腎臓虚血再灌流障害を起こしたマウスにおいて近位尿細管の集中する腎臓の皮髄境界部を観察した.野生型のマウスにおいては,いったん死細胞の領域が生じたが,そののち,時間の経過とともに死細胞が除去され減少したのに対し,AIMノックアウトマウスにおいては死細胞の領域の減少はみられず残存したままだった.また,野生型マウスにおいては尿細管の上皮細胞の再生にともない刷子縁が復活したが,AIMノックアウトマウスにおいては刷子縁の復活も抑制されていた.さらに,死細胞の蓄積は炎症性マクロファージの浸潤およびそれにともなう炎症性サイトカインの産生を促進することにより炎症をひき起こすが,AIMノックアウトマウスにおいては野生型マウスと比較して炎症が持続する傾向がみられた.以上より,AIMノックアウトマウスにおいては,急性腎障害によりひき起こされた細胞死により蓄積した死細胞が除去されないために炎症が持続し,組織の正常な再生がさまたげられることにより腎臓の機能が致死的に悪化することが明らかにされた.
3.AIMはスカベンジャー受容体KIM-1のリガンドである
AIMが欠失すると尿細管の管腔において死細胞が除去されないのはなぜだろうか.スカベンジャー受容体のひとつKIM-1に注目した.KIM-1は急性腎障害をうけたときに近位尿細管の上皮細胞の管腔側に急激かつ非常に強く発現することによりセミプロフェッショナルな貪食細胞へと変化させ死細胞の除去に寄与する1).KIM-1の発現について調べたところ,KIM-1はAIMの有無にかかわらず人為的な腎臓虚血再灌流障害により発現が強く誘導された.回復期にある野生型のマウスにおいてKIM-1の発現は減弱したが,傷害の持続するAIMノックアウトマウスにおいてはKIM-1の発現は強いままであり,AIMの欠損がKIM-1の発現をさまたげることはなかった.
詳細な検討をつづけると,野生型マウスの尿細管の管腔に蓄積した死細胞においてAIMが顕著に蓄積していることが見い出された.同様に,急性腎障害の患者の腎臓においても管腔を閉塞する死細胞にAIMの蓄積が認められた.そこで,KIM-1を介する尿細管の上皮細胞による死細胞の貪食にはAIMの付着が必要ではないかと考えた.この仮説を検証するため,AIMとKIM-1との相互作用についてin vitroにおいて解析したところ,KIM-1を強制発現させた293T細胞においてAIMのKIM-1への結合および細胞への取り込みがみられ,尿細管の管腔においてAIMはKIM-1のリガンドであることが示唆された.したがって,人為的な腎臓虚血再灌流障害により尿細管の管腔に蓄積した死細胞は,AIMが付着することによりKIM-1に認識され,尿細管の上皮細胞による貪食が促進されることによりすみやかに除去されることが示唆された.
4.AIMとKIM-1との相互作用は尿細管の上皮細胞による死細胞の貪食を促進する
人為的に腎臓虚血再灌流障害を起こしたマウスの腎臓において免疫染色によりAIMおよびKIM-1の局在を確認したところ,KIM-1を発現する近位尿細管の上皮細胞が,AIMの付着した管腔の死細胞をとりかこみ,死細胞の一部は細胞に取り込まれているようすが観察された.急性腎障害の患者の腎臓の検体においても同様の現象が観察され,尿細管の上皮細胞はKIM-1を介してAIMが付着した死細胞を貪食することが示唆された.
AIMによるKIM-1を介した貪食の促進効果について,マウスの近位尿細管の上皮細胞の細胞株であるmProx24細胞を用いたin vitroにおける実験により確かめた.mProx24細胞を加熱して壊死させたのち粉砕しAIMと混合することによりAIMが付着した死細胞を調製した.貪食細胞として生きたmProx24細胞にKIM-1を強制発現させ,そこへ蛍光標識した死細胞をくわえたところ,AIMが付着している死細胞はAIMのない死細胞よりも効率よくmProx24に貪食された.AIMの付着の有無にかかわらずKIM-1の発現そのものにより貪食の効率は上昇するが1),死細胞にAIMが付着することにより貪食の効率はさらにいちじるしく上昇した.また,この貪食の効率の上昇は,ヒトのKIM-1およびヒトのAIMにおいても確かめられた.さらに,AIMの付着による死細胞の除去の促進はin vivoにおいても検証された.すなわち,人為的に腎臓虚血再灌流障害を起こしたAIMノックアウトマウスにAIMを静脈投与することにより,尿細管の管腔に蓄積した死細胞にはAIMが付着し,そののち,すみやかに除去された(図2).
以上の解析により,KIM-1とAIMとの相互作用は死細胞の除去を促進することが明らかにされたが,この相互作用が急性腎障害の治癒に必須であるかどうか,KIM-1ノックアウトマウスを用いて検証した.これまでの報告にもあったように,KIM-1の機能が不全になると,人為的な腎臓虚血再灌流障害を起こしたマウスにおいて尿細管の管腔の死細胞は除去されず病態は悪化する2,3).実際に,人為的に腎臓虚血再灌流障害を起こしたKIM-1ノックアウトマウスの尿細管に蓄積した死細胞について調べたところ,野生型のマウスと同様に,AIMが強く付着しているにもかかわらず除去されず残存していた.また,KIM-1ノックアウトマウスにAIMを投与しても尿細管の管腔に蓄積した死細胞の量は減少しなかった.これらのことから,人為的な腎臓虚血再灌流障害により生じた尿細管の死細胞の除去にはAIMおよびKIM-1が必要であることが示された.
5.急性腎障害の際にはAIMは免疫グロブリンM五量体から解離し尿へと移行する
尿細管の管腔に蓄積する死細胞の除去にはAIMの付着が必要であることが明らかにされたが,AIMはどこからやってくるのだろうか.血管は管腔にはつうじていないため,なんらかの作用機序により血中のAIMが糸球体を通過して尿へと移行して,尿細管の管腔の死細胞に付着するのではないかと考えた.そこで,野生型のマウスおよびヒトにおいて,尿中のAIMの濃度をELISA法により測定した.その結果,通常の状態のマウスの尿においてAIMはほとんど検出されなかったが,人為的な腎臓虚血再灌流障害により尿中のAIMは顕著に増加し,回復期にはふたたびほぼゼロまで減少した.ヒトにおいても同様であり,健常者の尿にAIMはほとんど存在しなかったが,急性腎障害の患者の尿からはAIMが検出され,また,回復期にある急性腎障害の患者の尿においてAIMは減少していた.
マウスおよびヒトとも,通常,AIMは血中において免疫グロブリンM五量体と結合している.免疫グロブリンM五量体は巨大なタンパク質複合体であるため,それに結合しているかぎり,AIMは糸球体を通過して尿へと移行することはない7).ウェスタンブロット法により,正常なマウスあるいは健常人の血中のAIMはそのほとんどが免疫グロブリンM五量体と結合しているため600 kDa以上のバンドとして検出され,約40 kDaの遊離型のAIMはほとんど検出されなかった.一方,急性腎障害を起こしているマウスおよびヒトの血清を調べたところ,予想どおり,遊離型のAIMの顕著な増加がみられた.また,とくに急性腎障害の患者においては血清のクレアチニン値と遊離型のAIMの量に正の相関があり,腎臓の障害が重症であるほど遊離型のAIMの量が増加することが示唆された.これらのことから,以下のような仮説が考えられた.すなわち,急性腎障害の際には,その機序は不明であるが,免疫グロブリンMとAIMとの複合体からAIMが解離し,血中において遊離型のAIMが増加する.遊離型のAIMは糸球体を通過するため,すみやかに尿へと移行し,尿細管の管腔に蓄積した死細胞に付着することによりその排除を促進する(図2).実際に,尿細管の管腔の死細胞に集積したAIMには免疫グロブリンMは結合していなかったことからも,この仮説は支持された.
6.AIMの投与により急性腎障害の治療が可能である
AIMの投与による急性腎障害の治療について検討した.人為的な腎臓虚血再灌流障害を起こしたAIMノックアウトマウスに対し,1日目から3日目までの3日間,1回1 mgの精製AIMを静脈投与したところ,対照となるマウスは7日目までに約60%が死にいたったのに対し,AIMを投与したマウスは100%が生存し,また,AIMの投与により腎臓の機能が回復していた.腎臓の組織を観察したところ,AIMを投与したマウスでは尿細管の管腔の死細胞が顕著に減少しており,刷子縁の顕著な回復も認められた.また,野生型のマウスに対しさらに厳しい条件で人為的な腎臓虚血再灌流障害を起こしたところ,対照となるマウスは3日目までにはすべての個体が死にいたったが,AIMの投与により致死率は20%まで軽減された.また,同様に,尿細管の管腔における死細胞の蓄積の減少,組織の再生および回復がみられたことから,AIMの量を増加させることによっても治療効果のあることが示された.すなわち,AIMの投与による急性腎障害の治療の可能性が示された.
おわりに
この研究において,急性腎障害の治癒におけるAIMの重要な役割が示された(図2).そして,急性腎障害の際には,AIMはそれまで結合していた免疫グロブリンM五量体から解離し尿へと移行することにより尿細管に蓄積した死細胞に付着した.しかしながら,急性腎障害になるとなぜAIMは免疫グロブリンM五量体から解離するのか,その分子機構は不明であり解明が待たれる.さらに,AIMはKIM-1のリガンドであることが見い出された.すでに,KIM-1はアポトーシスをした細胞のeat-meシグナルを認識することにより死細胞を除去することについては報告があったが,アポトーシスとネクローシスとをとわず,死細胞にAIMが付着することによりKIM-1を介した貪食の効率がいちじるしく向上することが明らかにされた.AIMがどのように死細胞に付着するのかについては未解明であるが,AIMの存在は,KIM-1が単独のときより強力に死細胞の貪食をひき起こし,急性腎障害の治癒に大きく貢献すると考えられる.今後,急性腎障害のさまざまなモデルにおいてAIMの効果を確かめることにより,AIMを用いた急性腎障害の治療法の基盤が構築されることが期待される.
文 献
- Ichimura, T., Asseldonk, E. J., Humphreys, B. D. et al.: Kidney injury molecule-1 is a phosphatidylserine receptor that confers a phagocytic phenotype on epithelial cells. J. Clin. Invest., 118, 1657-1668 (2008)[PubMed]
- Yang, L., Brooks, C. R., Xiao, S. et al.: KIM-1-mediated phagocytosis reduces acute injury to the kidney. J. Clin. Invest., 125, 1620-1636 (2015)[PubMed]
- Ismail, O. Z., Zhang, X., Wei, J. et al.: Kidney injury molecule-1 protects against Gα12 activation and tissue damage in renal ischemia-reperfusion injury. Am. J. Pathol., 185, 1207-1215 (2015)[PubMed]
- Miyazaki, T., Hirokami, Y., Matsuhashi, N. et al.: Increased susceptibility of thymocytes to apoptosis in mice lacking AIM, a novel murine macrophage-derived soluble factor belonging to the scavenger receptor cysteine-rich domain superfamily. J. Exp. Med., 189, 412-422 (1999)[PubMed]
- Yamazaki, T., Mori, M., Arai, S. et al.: Circulating AIM as an indicator of liver damage and hepatocellular carcinoma in humans. PLoS One, 9, e109123 (2014)[PubMed]
- Arai, S., Shelton, J. M., Chen, M. et al.: A role for the apoptosis inhibitory factor AIM/Spα/Api6 in atherosclerosis development. Cell Metab., 1, 201-213 (2005)[PubMed]
- Arai, S., Maehara, N., Iwamura, Y. et al.: Obesity-associated autoantibody production requires AIM to retain the immunoglobulin M immune complex on follicular dendritic cells. Cell Rep., 3, 1187-1198 (2013)[PubMed]
- Kurokawa, J., Arai, S., Nakashima, K. et al.: Macrophage-derived AIM is endocytosed into adipocytes and decreases lipid droplets via inhibition of fatty acid synthase activity. Cell Metab., 11, 479-792 (2010)[PubMed]
- Kurokawa, J., Nagano, H., Ohara, O. et al.: Apoptosis inhibitor of macrophage (AIM) is required for obesity-associated recruitment of inflammatory macrophages into adipose tissue. Proc. Natl. Acad. Sci. USA, 108, 12072-12077 (2011)[PubMed]
- Maehara, N., Arai, S., Mori, M. et al.: Circulating AIM prevents hepatocellular carcinoma through complement activation. Cell Rep., 9, 61-74 (2014)[PubMed]
著者プロフィール
略歴:2004年 東京大学大学院農学生命科学研究科 修了,同年 米国Texas大学Southwestern Medical Center博士研究員,2005年 東京大学大学院医学系研究科 助教,同 講師を経て,2014年より同 特任准教授(現 准教授).
研究テーマ:AIMの血中における安定性の解明,および,疾患の治療への応用.
北田 研人(Kento Kitada)
米国Vanderbilt大学School of Medicine研究員.
宮崎 徹(Toru Miyazaki)
東京大学大学院医学系研究科 教授.
研究室URL:http://tmlab.m.u-tokyo.ac.jp/index.html
© 2016 新井郷子・北田研人・宮崎 徹 Licensed under CC 表示 2.1 日本