選択的なオートファジーに機能する線虫におけるAtg8のホモログLGG-1とLGG-2の構造および機能の違い
渡邊康紀・野田展生
(微生物化学研究所 分子構造解析部)
email:野田展生
DOI: 10.7875/first.author.2016.005
Structural basis of the differential function of the two C. elegans Atg8 homologs, LGG-1 and LGG-2, in autophagy.
Fan Wu, Yasunori Watanabe, Xiang-Yang Guo, Xin Qi, Peng Wang, Hong-Yu Zhao, Zheng Wang, Yuko Fujioka, Hui Zhang, Jin-Qi Ren, Tian-Cheng Fang, Yu-Xian Shen, Wei Feng, Jun-Jie Hu, Nobuo N. Noda, Hong Zhang
Molecular Cell, 60, 914-929 (2015)
オートファジーに必須なタンパク質のひとつであるAtg8は出芽酵母には1つしか存在しないが哺乳類には少なくとも7種類が存在し,それらは大きくGABARAPファミリーとLC3ファミリーとに分けられる.線虫にはAtg8のホモログとしてLGG-1およびLGG-2の2つが存在し,それぞれ,GABARAPファミリーおよびLC3ファミリーに類似する.筆者らは,LGG-1およびLGG-2について,いくつかの結合ペプチドとの複合体の結晶構造を決定した.これまでに報告されたAtg8のホモログの構造との比較により,N末端領域の構造につき,LGG-1およびGABARAPファミリーはクローズ型,LGG-2およびLC3ファミリーはオープン型をとることが見い出された.また,ペプチドと結合する領域の構造が異なり,in vivoおよびin vitroにおける解析により,LGG-1とLGG-2は基質特異性が異なること,凝集体の選択的なオートファジーにおいて異なる役割を担うことが明らかにされた.さらに,リポソームを用いた解析から,LGG-1は膜の凝集活性および融合活性をもつが,LGG-2は膜の凝集活性しかもたないことが明らかにされた.
オートファジーは酵母からヒトにいたる真核生物において広く保存された大規模な細胞内分解系である.オートファジーが誘導されるとサイトゾルに隔離膜とよばれる膜構造体が出現し,分解の対象をかこみながら伸長したのち,閉じてオートファゴソームとよばれる二重膜構造が形成される.そののち,オートファゴソームの外膜がリソソーム(出芽酵母では,液胞)と融合し,その中身が内膜ごと分解される.オートファジーは飢餓状態におちいると誘導され細胞質の成分を無作為に分解するが,飢餓状態になくとも状況に応じ,異常なオルガネラ,凝集体,細胞に侵入した細菌などの選択的な分解も担う.そのため,オートファジーの破綻は神経変性疾患,がん,感染症などの疾病に関与すると考えられている.
オートファジーには多くのAtgタンパク質が関与しており1),そのうち,ユビキチン様のタンパク質であるAtg8は複数のステップにおいて重要な役割を担う.Atg8はAtg7およびAtg3のはたらきによりリン脂質であるホスファチジルエタノールアミンと共有結合する2,3).この共有結合体は膜小胞どうしを凝集する機能をもち,隔離膜の伸長およびオートファゴソームの閉鎖を担う.また,選択的なオートファジーにおいて,Atg8とホスファチジルエタノールアミンの共有結合体は分解の対象と結合した受容体タンパク質とAtg8結合モチーフあるいはLC3相互作用領域を介して結合し,分解の対象と隔離膜とをつなぐことによりオートファゴソームと分解の対象との選択的な結合を実現している4,5).
Atg8は出芽酵母には1つしか存在しないが,哺乳類には少なくとも7種類が存在し,それらは大きくGABARAPファミリーとLC3ファミリーとに分けられる.LC3ファミリーは隔離膜の伸長に,GABARAPファミリーはオートファゴソームの閉鎖に関与することが示唆されている6).しかし,それらの詳細な機能の分担やその分子機構に関しては不明な点が多い.線虫にはAtg8のホモログとしてLGG-1およびLGG-2の2つが存在し,それぞれ,GABARAPファミリーおよびLC3ファミリーに類似するため,それらのあいだの機能の違いを調べるのに適している.筆者らは,LGG-1およびLGG-2に着目し,LC3相互作用領域をもつ複数のペプチドとの複合体の結晶構造を解析した.
なお,出芽酵母におけるオートファジーの研究については,荒木保弘・大隅良典, 領域融合レビュー, 1, e005, 2012,Atgタンパク質の構造と分子機能については,野田展生・稲垣冬彦, 領域融合レビュー, 3, e012, 2014,オートファジーと疾患に関しては,蔭山 俊・小松雅明, 領域融合レビュー, 3, e006, 2014 を参照されたい.
LGG-1は単体では結晶を得ることはできなかったが,典型的なLC3相互作用領域であるペプチドTrp-Glu-Glu-Leuとの複合体の結晶化に成功し,1.6Å分解能で構造を決定した(PDB ID:5AZF).LGG-2については,ほかのAtg8ホモログには保存されておらず機能に必須ではないN末端側の15残基を欠損させたコンストラクトを用い,単体およびペプチドTrp-Glu-Glu-Leuとの複合体の結晶化に成功し,それぞれ,2.1Å分解能(PDB ID:5E6N)および1.8Å分解能(PDB ID:5E6O)で構造を決定した.LGG-1およびLGG-2はN末端側に2本のαヘリックスをもち,そのC末端側にユビキチンフォールドをもつ既知のAtg8ホモログに似たフォールドをとっていた.ペプチドTrp-Glu-Glu-LeuのTrpおよびLeuは,LGG-1およびLGG-2において,それぞれ,W部位およびL部位に結合しており,既知のAtg8ホモログとペプチドTrp-Glu-Glu-Leuとの複合体の構造と同様の結合様式であった4).
LGG-1,LGG-2,これまでに報告されているAtg8ホモログの構造を詳細に比較したところ,N末端領域の構造が異なることが見い出された(図1a).LGG-1およびGABARAPファミリーのN末端領域では,Met1および3番目の保存された芳香族残基(LGG-1では,Trp3)の側鎖がAla108の側鎖と疎水性相互作用することにより,N末端領域がユビキチンフォールドに近づいて閉じた構造(クローズ型)をとっていた(図1b).LGG-1のクローズ型の形成に寄与するTrp3およびAla108に変異を導入した線虫においては,オートファジーにより除去されるはずの凝集体の蓄積が観察されたことから,クローズ型の構造の形成がLGG-1の機能において重要であることが明らかにされた.一方,LGG-2およびLC3ファミリーのN末端領域には保存された芳香族残基は存在せず,LGG-1のAla108に相当する残基はValあるいはThrになっており,N末端領域はユビキチンフォールドからはなれて開いた構造(オープン型)をとっていた(図1c).
線虫においてオートファジーにより除去される凝集体として,哺乳類におけるオートファジーの基質として知られているp62のホモログであるSQST-1,および,発生の過程において体細胞で除去されるPGL顆粒がある7).線虫においてlgg-1変異体およびlgg-2変異体を作製し,発生の段階において凝集体の蓄積について調べたところ,lgg-1変異体においては細胞増殖期から形態形成期までSQST-1の蓄積が観察された.一方,lgg-2変異体においては,SQST-1の蓄積量は細胞増殖期ではlgg-1変異体と同じ程度であったが,細胞増殖期のおわりからそれ以降の形態形成期においてSQST-1の蓄積は少なかった.また,lgg-2変異体の幼虫期におけるSQST-1の蓄積について調べたところ,L1期ではSQST-1の蓄積が観察されたが,L2期以降ではSQST-1の凝集体はすみやかに消失した.このlgg-2変異体における凝集体の減少はPGL顆粒については観察されなかった.以上の結果から,LGG-2はSQST-1のオートファジーによる除去について,とくに細胞増殖期において機能することが明らかにされた.
Atg8ホモログはオートファジーの基質およびいくつかのAtgタンパク質と結合することが知られている.それらはAtg8結合モチーフあるいはLC3相互作用領域とよばれるコンセンサス配列をもち,その0位に位置する残基の側鎖はAtg8のW部位と結合し,+3位に位置する残基はL部位と結合する4).LGG-1およびLGG-2と結合するSQST-1およびPGL顆粒の受容体タンパク質であるSEPA-1について7),結合様式を詳細に調べるためLC3相互作用領域の候補となる配列を探索し,各種の変異フラグメントを用いてプルダウンアッセイを行った.その結果,SQST-1およびSEPA-1はLC3相互作用領域を介してLGG-1およびLGG-2と結合すること,SQST-1には2カ所,SEPA-1には4カ所のLC3相互作用領域が存在すること,LGG-1とLGG-2にはLC3相互作用領域の配列の好みに違いのあることが示唆された.
出芽酵母や哺乳類において,Atg8とAtg1,および,Atg8とAtg12-Atg5-Atg16複合体との結合がオートファジーに必須であることが知られている.そこで,LGG-1あるいはLGG-2と線虫のAtg1あるいはAtg12-Atg5-Atg16複合体との結合をプルダウンアッセイにより検証した.Atg1およびAtg12としては,それぞれ,線虫におけるホモログであるUNC-51およびLGG-3を用いた.その結果,LGG-1はUNC-51と結合するが,LGG-3との結合はみられなかった.一方,LGG-2はLGG-3と結合したが,UNC-51との結合はみられなかった.UNC-51およびLGG-3はLC3相互作用領域の候補となる配列をもっていたが,その領域における変異体との結合を検証したところ,UNC-51およびLGG-3はLC3相互作用領域を介して,それぞれ,LGG-1およびLGG-2と結合することが明らかにされた.
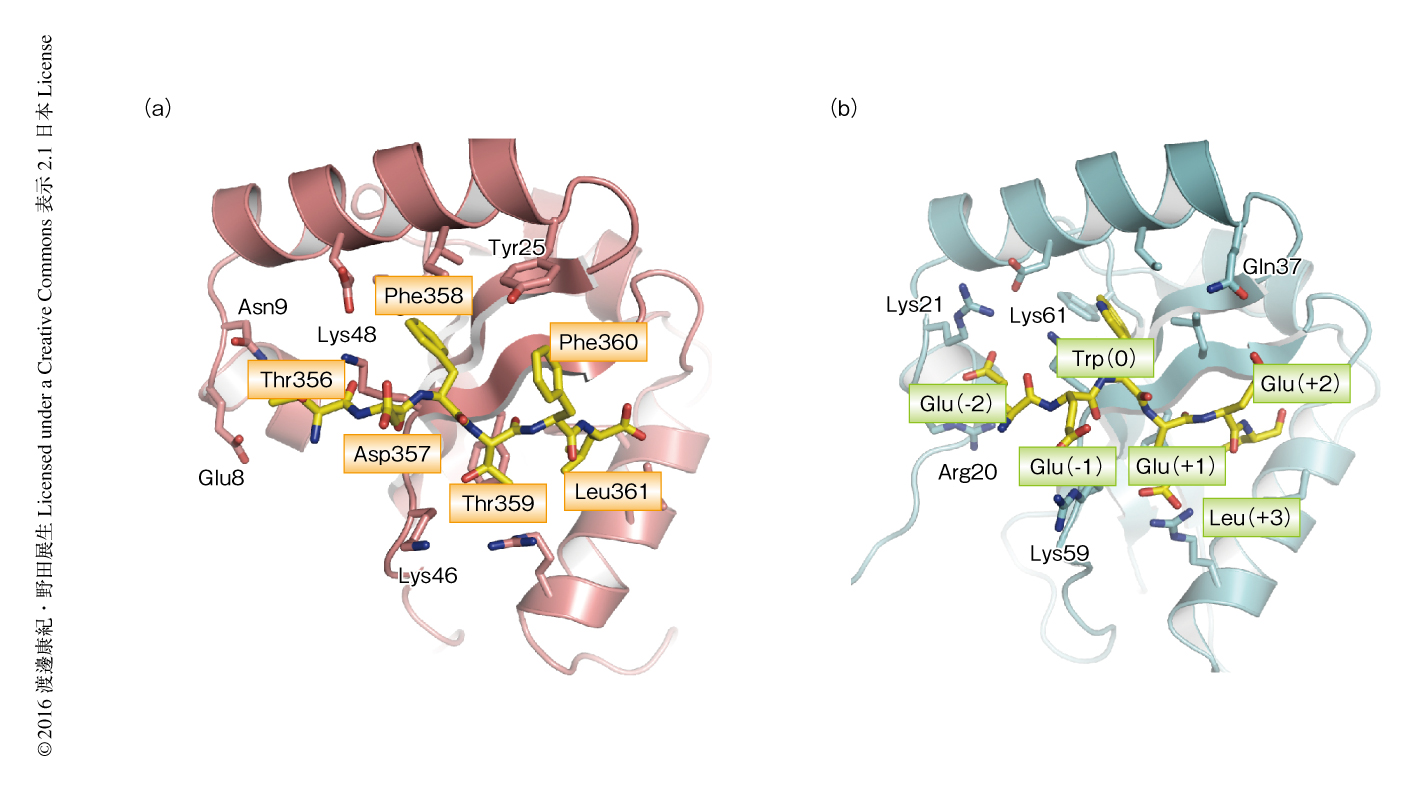
LGG-1とLGG-2とではペプチドの認識特異性が異なっていたが,ペプチドTrp-Glu-Glu-Leuとの複合体の構造からはその違いが説明できなかったことから,LC3相互作用領域をもつ各種のペプチドとの共結晶化を試みた.LGG-1についてはUNC-51のLC3相互作用領域との複合体について1.8Å分解能で構造を決定した(PDB ID:5AZG,図2a).一方,LGG-2はLC3相互作用領域をもつどのペプチドを用いても共結晶を得ることができなかったが,典型的なLC3相互作用領域であるGlu-Glu-Glu-Trp-Glu-Glu-LeuをN末端に融合させたLGG-2の結晶化に成功し,2.3Å分解能で構造を決定した(PDB ID:5AZH,図2b).
UNC-51のLC3相互作用領域の0位および+3位に位置するPhe358およびLeu361は,それぞれ,LGG-1のW部位およびL部位と結合しており,ペプチドTrp-Glu-Glu-LeuのTrpおよびLeuと似た結合様式であった.また,+2位に位置するPhe360はLGG-1のTyr25と疎水性相互作用を形成しており,LGG-1と結合するLC3相互作用領域の+2位に位置する残基として疎水性残基も許容されることがわかった.一方,LGG-2においてLGG-1のTyr25に相当する残基はGln37であり,LGG-2は+2位に疎水性残基をもつLC3相互作用領域とは結合が弱くなると考えられた.実際に,等温滴定型カロリメトリーを用いてUNC-51のLC3相互作用領域との親和性を調べたところ,LGG-1はLGG-2より10倍も高い親和性を示した.また,SQST-1は+2位が疎水性残基であるLC3相互作用領域と+2位が酸性残基であるLC3相互作用領域をもつ.LGG-1およびLGG-2との親和性を調べたところ,+2位が酸性残基であるLC3相互作用領域については親和性に約2倍の差しかなかったのに対し,+2位が疎水性残基であるLC3相互作用領域はLGG-1に対しLGG-2より40倍も高い親和性を示した.
ペプチドGlu-Glu-Glu-Trp-Glu-Glu-LeuおよびペプチドTrp-Glu-Glu-LeuとLGG-1およびLGG-2との親和性を調べたところ,N末端側に酸性残基をもつGlu-Glu-Glu-Trp-Glu-Glu-Leuのほうが15~30倍も高い親和性を示し,0位よりN末端側の配列もLGG-1およびLGG-2との結合に重要であることがわかった.Glu-Glu-Glu-Trp-Glu-Glu-LeuをN末端に融合させたLGG-2の結晶構造においては,融合させたペプチドはとなりのLGG-2分子と分子間相互作用をしていた.このペプチドのN末端側はLGG-2の4つの塩基性残基Arg20,Arg21,Arg59,Lys61にかこまれており,-2位に位置するGluはArg21と塩橋を形成し,-1位に位置するGluもArg59の近くに位置していた.Glu-Glu-Glu-Trp-Glu-Glu-LeuのN末端側の認識に関与していたLGG-2のArg20およびArg21に相当する塩基性残基はLGG-1にはなかったことから,LC3相互作用領域のN末端側の配列を認識する領域も基質特異性の相違に関与することが示唆された.
これまでの研究により,in vitroにおいてホスファチジルエタノールアミンと結合して膜に局在したAtg8ホモログは膜の凝集活性および融合活性をもつことが知られている8).そこで,LGG-1あるいはLGG-2にも膜の凝集活性および融合活性があるかどうかリポソームを用いたアッセイにより検証した.本来,LGG-1およびLGG-2はC末端のGlyを介し酵素反応によりホスファチジルエタノールアミンとアミド結合するが,今回は簡略化のため,C末端のGlyをCysと置換し,このCysとマレイミド基と結合させたホスファチジルエタノールアミンとを化学的に結合させたLGG-1およびLGG-2を用いた.その結果,LGG-1はリポソームの凝集活性および融合活性をもつが,LGG-2はリポソームの凝集活性のみをもつことが明らかにされた.また,LGG-1のクローズ型の形成に寄与していたTrp3をGlyと置換すると融合活性のみ顕著に低下した.このことから,LGG-1のクローズ型の構造は膜の融合活性に重要であることが示唆された.
オートファゴソームの形態への影響についても調べた.通常,細胞増殖期の線虫のオートファゴソームの大きさは約510 nmであるのに対し,lgg-2変異体では約280 nmと小さくなっており,LGG-2はオートファゴソームの大きさを制御する機能をもつことが示唆された.LGG-2と同様にオープン型の構造をもつAtg8ホモログであるLC3およびAtg8についても,オートファゴソームの大きさを制御する機能をもつことが示されている6,9).以上のことから,オープン型の構造がオートファゴソームの大きさの制御に重要な役割を担う可能性が示唆された.
Atg8ホモログのGABARAPファミリーおよびLC3ファミリーは互いに異なる機能を担うことが示唆されてきたが,これまで,構造の差異は見い出されておらず,異なる機能を担う分子機構はよくわかっていなかった.今回,線虫のAtg8ホモログの構造解析をとおして構造の相違,すなわち,GABARAPファミリーはクローズ型,LC3ファミリーはオープン型をとることを見い出した.しかし,オープン型をとるLC3ファミリーがなぜオートファゴソームの大きさの制御にかかわるのかなど,構造の違いがどのような機序により機能の違いに結びつくのかは明らかにされていない.また,LGG-1とLGG-2のリポソームの凝集活性および融合活性の違いについてもオートファジーに対しどのような役割をもつのかは不明であり,今後の課題である.Atg8ホモログにおける構造の差異の発見が,今後のAtg8ホモログの機能の分担およびその分子機構の解明の足がかりになることを期待している.
略歴:2013年 北海道大学大学院生命科学院博士課程 修了,同年 名古屋大学大学院理学研究科 博士研究員を経て,2014年より京都産業大学総合生命科学部 研究員.
抱負:研究に関しても生活に関してもつねに自分のphilosophyをもち,ぶれない人生を歩んでいきたい.
野田 展生(Nobuo N. Noda)
微生物化学研究所 主席研究員.
© 2016 渡邊康紀・野田展生 Licensed under CC 表示 2.1 日本
(微生物化学研究所 分子構造解析部)
email:野田展生
DOI: 10.7875/first.author.2016.005
Structural basis of the differential function of the two C. elegans Atg8 homologs, LGG-1 and LGG-2, in autophagy.
Fan Wu, Yasunori Watanabe, Xiang-Yang Guo, Xin Qi, Peng Wang, Hong-Yu Zhao, Zheng Wang, Yuko Fujioka, Hui Zhang, Jin-Qi Ren, Tian-Cheng Fang, Yu-Xian Shen, Wei Feng, Jun-Jie Hu, Nobuo N. Noda, Hong Zhang
Molecular Cell, 60, 914-929 (2015)
要 約
オートファジーに必須なタンパク質のひとつであるAtg8は出芽酵母には1つしか存在しないが哺乳類には少なくとも7種類が存在し,それらは大きくGABARAPファミリーとLC3ファミリーとに分けられる.線虫にはAtg8のホモログとしてLGG-1およびLGG-2の2つが存在し,それぞれ,GABARAPファミリーおよびLC3ファミリーに類似する.筆者らは,LGG-1およびLGG-2について,いくつかの結合ペプチドとの複合体の結晶構造を決定した.これまでに報告されたAtg8のホモログの構造との比較により,N末端領域の構造につき,LGG-1およびGABARAPファミリーはクローズ型,LGG-2およびLC3ファミリーはオープン型をとることが見い出された.また,ペプチドと結合する領域の構造が異なり,in vivoおよびin vitroにおける解析により,LGG-1とLGG-2は基質特異性が異なること,凝集体の選択的なオートファジーにおいて異なる役割を担うことが明らかにされた.さらに,リポソームを用いた解析から,LGG-1は膜の凝集活性および融合活性をもつが,LGG-2は膜の凝集活性しかもたないことが明らかにされた.
はじめに
オートファジーは酵母からヒトにいたる真核生物において広く保存された大規模な細胞内分解系である.オートファジーが誘導されるとサイトゾルに隔離膜とよばれる膜構造体が出現し,分解の対象をかこみながら伸長したのち,閉じてオートファゴソームとよばれる二重膜構造が形成される.そののち,オートファゴソームの外膜がリソソーム(出芽酵母では,液胞)と融合し,その中身が内膜ごと分解される.オートファジーは飢餓状態におちいると誘導され細胞質の成分を無作為に分解するが,飢餓状態になくとも状況に応じ,異常なオルガネラ,凝集体,細胞に侵入した細菌などの選択的な分解も担う.そのため,オートファジーの破綻は神経変性疾患,がん,感染症などの疾病に関与すると考えられている.
オートファジーには多くのAtgタンパク質が関与しており1),そのうち,ユビキチン様のタンパク質であるAtg8は複数のステップにおいて重要な役割を担う.Atg8はAtg7およびAtg3のはたらきによりリン脂質であるホスファチジルエタノールアミンと共有結合する2,3).この共有結合体は膜小胞どうしを凝集する機能をもち,隔離膜の伸長およびオートファゴソームの閉鎖を担う.また,選択的なオートファジーにおいて,Atg8とホスファチジルエタノールアミンの共有結合体は分解の対象と結合した受容体タンパク質とAtg8結合モチーフあるいはLC3相互作用領域を介して結合し,分解の対象と隔離膜とをつなぐことによりオートファゴソームと分解の対象との選択的な結合を実現している4,5).
Atg8は出芽酵母には1つしか存在しないが,哺乳類には少なくとも7種類が存在し,それらは大きくGABARAPファミリーとLC3ファミリーとに分けられる.LC3ファミリーは隔離膜の伸長に,GABARAPファミリーはオートファゴソームの閉鎖に関与することが示唆されている6).しかし,それらの詳細な機能の分担やその分子機構に関しては不明な点が多い.線虫にはAtg8のホモログとしてLGG-1およびLGG-2の2つが存在し,それぞれ,GABARAPファミリーおよびLC3ファミリーに類似するため,それらのあいだの機能の違いを調べるのに適している.筆者らは,LGG-1およびLGG-2に着目し,LC3相互作用領域をもつ複数のペプチドとの複合体の結晶構造を解析した.
なお,出芽酵母におけるオートファジーの研究については,荒木保弘・大隅良典, 領域融合レビュー, 1, e005, 2012,Atgタンパク質の構造と分子機能については,野田展生・稲垣冬彦, 領域融合レビュー, 3, e012, 2014,オートファジーと疾患に関しては,蔭山 俊・小松雅明, 領域融合レビュー, 3, e006, 2014 を参照されたい.
1.LGG-1はクローズ型,LGG-2はオープン型の構造をとる
LGG-1は単体では結晶を得ることはできなかったが,典型的なLC3相互作用領域であるペプチドTrp-Glu-Glu-Leuとの複合体の結晶化に成功し,1.6Å分解能で構造を決定した(PDB ID:5AZF).LGG-2については,ほかのAtg8ホモログには保存されておらず機能に必須ではないN末端側の15残基を欠損させたコンストラクトを用い,単体およびペプチドTrp-Glu-Glu-Leuとの複合体の結晶化に成功し,それぞれ,2.1Å分解能(PDB ID:5E6N)および1.8Å分解能(PDB ID:5E6O)で構造を決定した.LGG-1およびLGG-2はN末端側に2本のαヘリックスをもち,そのC末端側にユビキチンフォールドをもつ既知のAtg8ホモログに似たフォールドをとっていた.ペプチドTrp-Glu-Glu-LeuのTrpおよびLeuは,LGG-1およびLGG-2において,それぞれ,W部位およびL部位に結合しており,既知のAtg8ホモログとペプチドTrp-Glu-Glu-Leuとの複合体の構造と同様の結合様式であった4).
LGG-1,LGG-2,これまでに報告されているAtg8ホモログの構造を詳細に比較したところ,N末端領域の構造が異なることが見い出された(図1a).LGG-1およびGABARAPファミリーのN末端領域では,Met1および3番目の保存された芳香族残基(LGG-1では,Trp3)の側鎖がAla108の側鎖と疎水性相互作用することにより,N末端領域がユビキチンフォールドに近づいて閉じた構造(クローズ型)をとっていた(図1b).LGG-1のクローズ型の形成に寄与するTrp3およびAla108に変異を導入した線虫においては,オートファジーにより除去されるはずの凝集体の蓄積が観察されたことから,クローズ型の構造の形成がLGG-1の機能において重要であることが明らかにされた.一方,LGG-2およびLC3ファミリーのN末端領域には保存された芳香族残基は存在せず,LGG-1のAla108に相当する残基はValあるいはThrになっており,N末端領域はユビキチンフォールドからはなれて開いた構造(オープン型)をとっていた(図1c).
2.LGG-2はオートファジーにおいて基質および発生の段階に特異的に機能する
線虫においてオートファジーにより除去される凝集体として,哺乳類におけるオートファジーの基質として知られているp62のホモログであるSQST-1,および,発生の過程において体細胞で除去されるPGL顆粒がある7).線虫においてlgg-1変異体およびlgg-2変異体を作製し,発生の段階において凝集体の蓄積について調べたところ,lgg-1変異体においては細胞増殖期から形態形成期までSQST-1の蓄積が観察された.一方,lgg-2変異体においては,SQST-1の蓄積量は細胞増殖期ではlgg-1変異体と同じ程度であったが,細胞増殖期のおわりからそれ以降の形態形成期においてSQST-1の蓄積は少なかった.また,lgg-2変異体の幼虫期におけるSQST-1の蓄積について調べたところ,L1期ではSQST-1の蓄積が観察されたが,L2期以降ではSQST-1の凝集体はすみやかに消失した.このlgg-2変異体における凝集体の減少はPGL顆粒については観察されなかった.以上の結果から,LGG-2はSQST-1のオートファジーによる除去について,とくに細胞増殖期において機能することが明らかにされた.
3.LGG-1とLGG-2とでは結合するペプチドが異なる
Atg8ホモログはオートファジーの基質およびいくつかのAtgタンパク質と結合することが知られている.それらはAtg8結合モチーフあるいはLC3相互作用領域とよばれるコンセンサス配列をもち,その0位に位置する残基の側鎖はAtg8のW部位と結合し,+3位に位置する残基はL部位と結合する4).LGG-1およびLGG-2と結合するSQST-1およびPGL顆粒の受容体タンパク質であるSEPA-1について7),結合様式を詳細に調べるためLC3相互作用領域の候補となる配列を探索し,各種の変異フラグメントを用いてプルダウンアッセイを行った.その結果,SQST-1およびSEPA-1はLC3相互作用領域を介してLGG-1およびLGG-2と結合すること,SQST-1には2カ所,SEPA-1には4カ所のLC3相互作用領域が存在すること,LGG-1とLGG-2にはLC3相互作用領域の配列の好みに違いのあることが示唆された.
出芽酵母や哺乳類において,Atg8とAtg1,および,Atg8とAtg12-Atg5-Atg16複合体との結合がオートファジーに必須であることが知られている.そこで,LGG-1あるいはLGG-2と線虫のAtg1あるいはAtg12-Atg5-Atg16複合体との結合をプルダウンアッセイにより検証した.Atg1およびAtg12としては,それぞれ,線虫におけるホモログであるUNC-51およびLGG-3を用いた.その結果,LGG-1はUNC-51と結合するが,LGG-3との結合はみられなかった.一方,LGG-2はLGG-3と結合したが,UNC-51との結合はみられなかった.UNC-51およびLGG-3はLC3相互作用領域の候補となる配列をもっていたが,その領域における変異体との結合を検証したところ,UNC-51およびLGG-3はLC3相互作用領域を介して,それぞれ,LGG-1およびLGG-2と結合することが明らかにされた.
4.LGG-1とLGG-2の基質特異性の違い
LGG-1とLGG-2とではペプチドの認識特異性が異なっていたが,ペプチドTrp-Glu-Glu-Leuとの複合体の構造からはその違いが説明できなかったことから,LC3相互作用領域をもつ各種のペプチドとの共結晶化を試みた.LGG-1についてはUNC-51のLC3相互作用領域との複合体について1.8Å分解能で構造を決定した(PDB ID:5AZG,図2a).一方,LGG-2はLC3相互作用領域をもつどのペプチドを用いても共結晶を得ることができなかったが,典型的なLC3相互作用領域であるGlu-Glu-Glu-Trp-Glu-Glu-LeuをN末端に融合させたLGG-2の結晶化に成功し,2.3Å分解能で構造を決定した(PDB ID:5AZH,図2b).
UNC-51のLC3相互作用領域の0位および+3位に位置するPhe358およびLeu361は,それぞれ,LGG-1のW部位およびL部位と結合しており,ペプチドTrp-Glu-Glu-LeuのTrpおよびLeuと似た結合様式であった.また,+2位に位置するPhe360はLGG-1のTyr25と疎水性相互作用を形成しており,LGG-1と結合するLC3相互作用領域の+2位に位置する残基として疎水性残基も許容されることがわかった.一方,LGG-2においてLGG-1のTyr25に相当する残基はGln37であり,LGG-2は+2位に疎水性残基をもつLC3相互作用領域とは結合が弱くなると考えられた.実際に,等温滴定型カロリメトリーを用いてUNC-51のLC3相互作用領域との親和性を調べたところ,LGG-1はLGG-2より10倍も高い親和性を示した.また,SQST-1は+2位が疎水性残基であるLC3相互作用領域と+2位が酸性残基であるLC3相互作用領域をもつ.LGG-1およびLGG-2との親和性を調べたところ,+2位が酸性残基であるLC3相互作用領域については親和性に約2倍の差しかなかったのに対し,+2位が疎水性残基であるLC3相互作用領域はLGG-1に対しLGG-2より40倍も高い親和性を示した.
ペプチドGlu-Glu-Glu-Trp-Glu-Glu-LeuおよびペプチドTrp-Glu-Glu-LeuとLGG-1およびLGG-2との親和性を調べたところ,N末端側に酸性残基をもつGlu-Glu-Glu-Trp-Glu-Glu-Leuのほうが15~30倍も高い親和性を示し,0位よりN末端側の配列もLGG-1およびLGG-2との結合に重要であることがわかった.Glu-Glu-Glu-Trp-Glu-Glu-LeuをN末端に融合させたLGG-2の結晶構造においては,融合させたペプチドはとなりのLGG-2分子と分子間相互作用をしていた.このペプチドのN末端側はLGG-2の4つの塩基性残基Arg20,Arg21,Arg59,Lys61にかこまれており,-2位に位置するGluはArg21と塩橋を形成し,-1位に位置するGluもArg59の近くに位置していた.Glu-Glu-Glu-Trp-Glu-Glu-LeuのN末端側の認識に関与していたLGG-2のArg20およびArg21に相当する塩基性残基はLGG-1にはなかったことから,LC3相互作用領域のN末端側の配列を認識する領域も基質特異性の相違に関与することが示唆された.
5.LGG-1は膜の凝集活性および融合活性をもち,LGG-2は膜の凝集活性のみをもつ
これまでの研究により,in vitroにおいてホスファチジルエタノールアミンと結合して膜に局在したAtg8ホモログは膜の凝集活性および融合活性をもつことが知られている8).そこで,LGG-1あるいはLGG-2にも膜の凝集活性および融合活性があるかどうかリポソームを用いたアッセイにより検証した.本来,LGG-1およびLGG-2はC末端のGlyを介し酵素反応によりホスファチジルエタノールアミンとアミド結合するが,今回は簡略化のため,C末端のGlyをCysと置換し,このCysとマレイミド基と結合させたホスファチジルエタノールアミンとを化学的に結合させたLGG-1およびLGG-2を用いた.その結果,LGG-1はリポソームの凝集活性および融合活性をもつが,LGG-2はリポソームの凝集活性のみをもつことが明らかにされた.また,LGG-1のクローズ型の形成に寄与していたTrp3をGlyと置換すると融合活性のみ顕著に低下した.このことから,LGG-1のクローズ型の構造は膜の融合活性に重要であることが示唆された.
オートファゴソームの形態への影響についても調べた.通常,細胞増殖期の線虫のオートファゴソームの大きさは約510 nmであるのに対し,lgg-2変異体では約280 nmと小さくなっており,LGG-2はオートファゴソームの大きさを制御する機能をもつことが示唆された.LGG-2と同様にオープン型の構造をもつAtg8ホモログであるLC3およびAtg8についても,オートファゴソームの大きさを制御する機能をもつことが示されている6,9).以上のことから,オープン型の構造がオートファゴソームの大きさの制御に重要な役割を担う可能性が示唆された.
おわりに
Atg8ホモログのGABARAPファミリーおよびLC3ファミリーは互いに異なる機能を担うことが示唆されてきたが,これまで,構造の差異は見い出されておらず,異なる機能を担う分子機構はよくわかっていなかった.今回,線虫のAtg8ホモログの構造解析をとおして構造の相違,すなわち,GABARAPファミリーはクローズ型,LC3ファミリーはオープン型をとることを見い出した.しかし,オープン型をとるLC3ファミリーがなぜオートファゴソームの大きさの制御にかかわるのかなど,構造の違いがどのような機序により機能の違いに結びつくのかは明らかにされていない.また,LGG-1とLGG-2のリポソームの凝集活性および融合活性の違いについてもオートファジーに対しどのような役割をもつのかは不明であり,今後の課題である.Atg8ホモログにおける構造の差異の発見が,今後のAtg8ホモログの機能の分担およびその分子機構の解明の足がかりになることを期待している.
文 献
- Mizushima, N., Yoshimori, T. & Ohsumi, Y.: The role of Atg proteins in autophagosome formation. Annu. Rev. Cell Dev. Biol., 27, 107-132 (2011)[PubMed]
- Mizushima, N., Noda, T., Yoshimori, T. et al.: A protein conjugation system essential for autophagy. Nature, 395, 395-398 (1998)[PubMed]
- Ichimura, Y., Kirisako, T., Takao, T. et al.: A ubiquitin like system mediates protein lipidation. Nature, 408, 488-492 (2000)[PubMed]
- Noda, N. N., Ohsumi, Y., & Inagaki, F.: Atg8-family interacting motif crucial for selective autophagy. FEBS Lett., 584, 1379-1385 (2010)[PubMed]
- Birgisdottir, A. B., Lamark, T. & Johansen, T.: The LIR motif: crucial for selective autophagy. J. Cell Sci., 126, 3237-3247 (2013)[PubMed]
- Weidverg, H., Shvets, E., Shpilka, T. et al.: LC3 and GATE-16/GABARAP subfamilies are both essential yet act differently in autophagosome biogenesis. EMBO J., 29, 1792-1802 (2010)[PubMed]
- Lu, Q., Wu, F. & Zhang, H.: Aggrephagy: lesson from C. elegans. Biochem. J., 452, 381-390 (2013)[PubMed]
- Weidberg, H., Shpilka, T., Shvets, E. et al.: LC3 and GATE-16 N termini mediate membrane fusion processes required for autophagosome biogenesis. Dev. Cell, 20, 444-454 (2011)[PubMed]
- Xie, Z., Nair, U. & Klionsky, D. J.: Atg8 controls phagophore expansion during autophagosome formation. Mol. Biol. Cell, 19, 3290-3298 (2008)[PubMed]
著者プロフィール
略歴:2013年 北海道大学大学院生命科学院博士課程 修了,同年 名古屋大学大学院理学研究科 博士研究員を経て,2014年より京都産業大学総合生命科学部 研究員.
抱負:研究に関しても生活に関してもつねに自分のphilosophyをもち,ぶれない人生を歩んでいきたい.
野田 展生(Nobuo N. Noda)
微生物化学研究所 主席研究員.
© 2016 渡邊康紀・野田展生 Licensed under CC 表示 2.1 日本