プリオン様のタンパク質凝集体による抗ウイルス作用
鈴木元治郎・田中元雅
(理化学研究所脳科学総合研究センター タンパク質構造疾患研究チーム)
email:鈴木元治郎,田中元雅
DOI: 10.7875/first.author.2015.140
[KIL-d] protein element confers antiviral activity via catastrophic viral mutagenesis.
Genjiro Suzuki, Jonathan S. Weissman, Motomasa Tanaka
Molecular Cell, 60, 651-660 (2015)
出芽酵母はキラーウイルスに感染するとキラー毒素とよばれるキラーウイルスに由来する毒素を分泌するようになり,周囲のキラーウイルスをもたない出芽酵母を殺すキラー活性,および,自らおよび周囲のキラーウイルスをもつ出芽酵母の分泌するキラー毒素から身を守るレジスタンス活性をもつようになる.[KIL-d]因子をもつ出芽酵母はキラーウイルスに感染した際にキラー活性およびレジスタンス活性を示さないあるいは弱いことが知られていたが,[KIL-d]因子の性質やその分子機構については不明であった.筆者らは,遺伝学的な解析や次世代シークエンサーを用いた解析により,[KIL-d]因子は,プリオン様のタンパク質凝集体であること,キラーウイルスのゲノムへの変異の導入を促進すること,エラーカタストロフィーという現象によりキラーウイルスを不活性化させること,を発見した.このことから,プリオン様のタンパク質凝集体は侵入してきたキラーウイルスに対する抗ウイルス作用という新たな機能をもつことが明らかにされた.
細胞はつねにウイルスの感染の危険にさらされている.もっとも原始的な真核生物である出芽酵母にもキラー毒素遺伝子をゲノムにもつキラーウイルスとよばれる2本鎖RNAウイルスが感染する.キラーウイルスに感染した出芽酵母はキラーウイルスに由来するキラー毒素を分泌することにより,周囲のキラーウイルスをもたない出芽酵母を殺すキラー活性,および,自らおよび周囲のキラーウイルスをもつ出芽酵母の分泌するキラー毒素から身を守るレジスタンス活性をもつようになる.一方で,キラーウイルスに感染していない出芽酵母はキラー活性およびレジスタンス活性をもたない.キラーウイルスにはM1,M2などいくつかの種類があり,それぞれ分泌するキラー毒素の異なることが知られている.また,キラーウイルスのゲノムはLAウイルスというヘルパーウイルスのコードするRNAポリメラーゼにより複製されるため,キラーウイルスの複製および増殖はLAウイルスに依存する.
これまでに,キラーウイルスに感染しているがキラー活性およびレジスタンス活性を示さないあるいは弱い変異株が多く単離されてきた.なかでも,[KIL-d]因子をもつ出芽酵母はキラー活性およびレジスタンス活性がさまざまな程度に低下するという特徴を示すことが知られていた1,2).しかし,[KIL-d]因子の性質やその分子機構については明らかにされていなかった.
プリオンはタンパク質からなる細胞質性の遺伝因子であり,その構造の変化により細胞あるいは個体のあいだを伝播すると考えられている.哺乳動物においては,ウシ海綿状脳症病やクロイツフェルトヤコブ病などのプリオン病はプリオンの構造の変化によりひき起こされると考えられている.一方で,出芽酵母にはSup35など約10種類のプリオンが知られており,哺乳動物のプリオンと1次配列は異なるものの同様の挙動を示す.近年,出芽酵母のプリオンついての研究により,細胞はタンパク質をプリオン化する(構造を変化させる)ことにより周辺の環境にすばやく応答している可能性が高いことが示された3,4).この研究においては,[KIL-d]因子が出芽酵母のプリオンである可能性について検討し,プリオン様のタンパク質凝集体が抗ウイルス作用という新たな機能をはたすことについて検討した.
[KIL-d]因子の性質を調べるため,野生型の出芽酵母に対し,さまざまな処理をした[KIL-d]因子をもつ出芽酵母の細胞抽出液を感染させた.また,対照として,出芽酵母のプリオンとして知られる[PSI+]をもつ出芽酵母についても同様に実験した.その結果,[KIL-d]因子の感染効率はプロテナーゼ処理や煮沸処理などタンパク質分解処理によりいちじるしく低下したが,DNase処理やRNase処理などの核酸分解処理ではほとんど変わらなかった.また,[KIL-d]因子はおもに凝集画分に存在した.この傾向は[PSI+]因子と同様であったことから,[KIL-d]因子はプリオン様のタンパク質凝集体であると考えられた.
[KIL-d]因子をもつ出芽酵母において,キラー活性やレジスタンス活性がなくなるあるいは弱まる分子機構について調べた.その結果,[KIL-d]因子をもつ出芽酵母からもキラー毒素は分泌されていた.[KIL-d]因子をもつ出芽酵母に感染しているキラーウイルスのゲノム塩基配列を調べたところ,キラー毒素をコードする遺伝子に変異が導入されており,その変異がキラー活性を喪失あるいは低下させていた.そこで,[KIL-d]因子をもつ出芽酵母においてキラー活性あるいはレジスタンス活性に多様性の生じる分子機構について調べたところ,キラー毒素をコードする遺伝子における変異の箇所,さらには,出芽酵母における野生型のキラーウイルスと変異型のキラーウイルスの存在比の関与が明らかにされた.
[KIL-d]因子をもつ出芽酵母から高温での培養によりキラーウイルスを取り除き,キラーウイルスをもたない[KIL-d]因子をもつ出芽酵母と,野生型のキラーウイルスをもつ野生型の出芽酵母とをかけあわせ,[KIL-d]因子および野生型のキラーウイルスを保持する2倍体の出芽酵母を作製した.まず,キラー活性の低下した変異型のキラーウイルスをもつ出芽酵母は選択的に増殖することが確認された.よって,2倍体の出芽酵母のもつキラーウイルスに変異が導入されれば,そのキラーウイルスをもつ出芽酵母は選択的に増殖することが期待された.この2倍体の出芽酵母を継続的に培養したところ,[KIL-d]因子をもつ出芽酵母でのみキラーウイルスに変異が導入された.また,[KIL-d]因子はキラーウイルスのうちM1だけでなくM2にも変異を導入した.さらに,[KIL-d]因子はLAウイルスの存在には依存しなかったことから,[KIL-d]因子をもつ出芽酵母にみられる現象はRNAポリメラーゼの異常によるのではないことが明らかにされた.また,[KIL-d]因子は非メンデル則により遺伝する細胞質性の遺伝因子であったことから,[KIL-d]因子はプリオン様のタンパク質凝集体であることが支持された.
次世代シークエンサーを用いて,[KIL-d]因子をもつ出芽酵母と野生型の出芽酵母とのあいだで,キラーウイルスのゲノムにおける変異率を比較した.すると,野生型の出芽酵母においては約0.03%であった変異率が,[KIL-d]因子をもつ出芽酵母では約0.09%へと上昇していた.一方で,出芽酵母のゲノムにおける変異率に差はみられなかった.また,キラーウイルスと同じRNAポリメラーゼにより複製されるLAウイルスにおいても変異率に差はみられなかった.これらのことから,[KIL-d]因子はキラーウイルスのゲノムにおいて特異的に変異率を上昇させていることが明らかにされた.
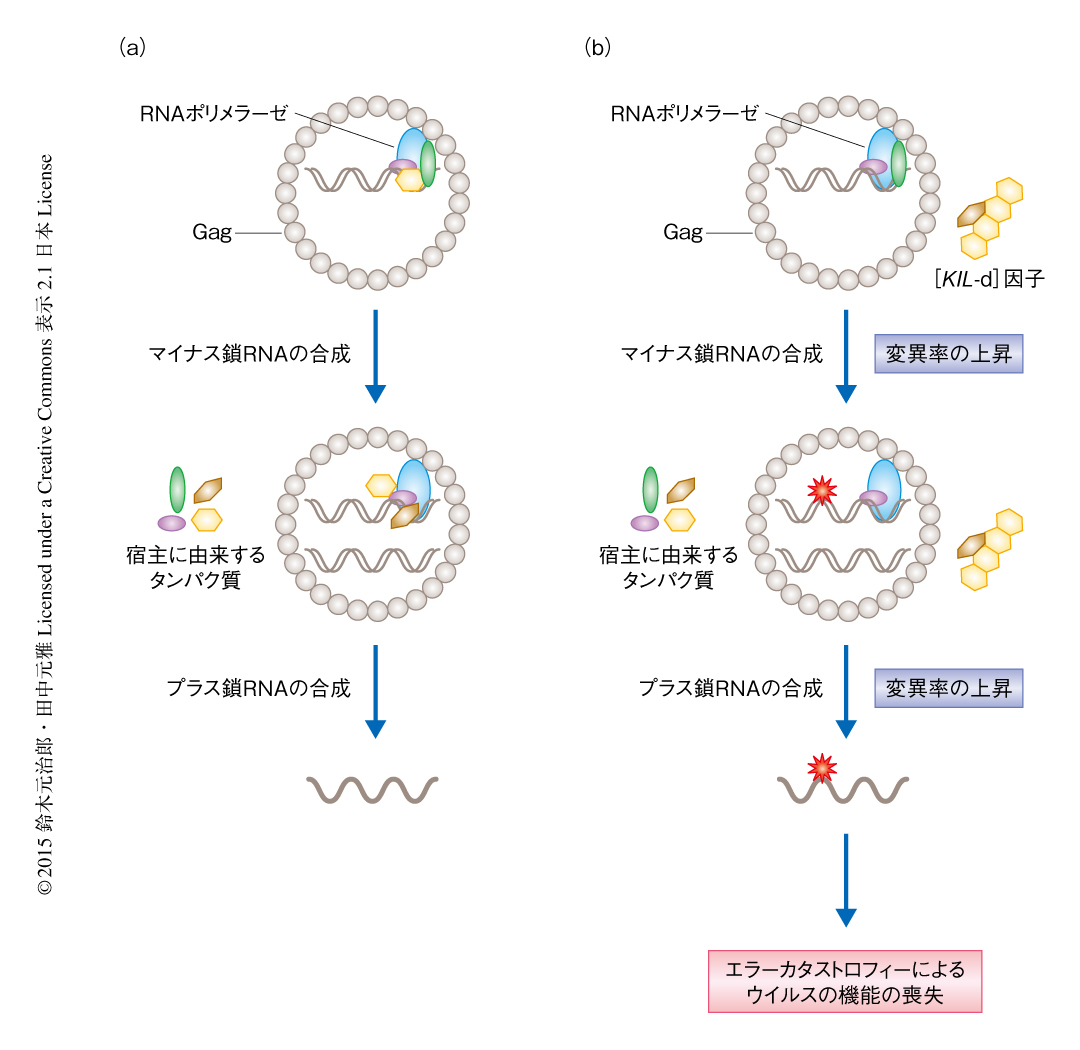
以上の結果から,[KIL-d]因子をもつ出芽酵母においては,プリオン様のタンパク質凝集体がキラーウイルスの複製の機構に作用しそのゲノムに新規な変異を導入することにより,レジスタンス活性を保持するがキラー活性を失ったあるいは弱くなったキラーウイルスが出現したと考えられた.変異型のキラーウイルスをもつ出芽酵母は,自らおよび周囲の出芽酵母の分泌するキラー毒素から身を守る機能が高いため,選択的に増殖すると考えられた.また,これら一連の過程は,RNAウイルスなどにおいてわずかな変異率の上昇によりウイルスが機能不全におちいるエラーカタストロフィーとよばれる現象に似ていた5).よって,[KIL-d]因子はエラーカタストロフィーを起こすことによりキラー毒素を無毒化するなどキラーウイルスの機能不全をひき起こし,ウイルスの感染をふせぐ抗ウイルス作用をもつプリオン様のタンパク質凝集体ではないかと考えられた(図1).
インフルエンザウイルスやHIVなどに代表されるRNAウイルスは,ゲノムが正確に複製されないと宿主細胞において増殖できない.一方で,複製の正確性が高すぎると宿主細胞の免疫系からの攻撃など外界の変化に対する順応性が低下する.そのため,RNAウイルスにおける複製の正確性は境界にあり,その正確性がわずかに低下することによりエラーカタストロフィーが起こり,ウイルスの機能不全がひき起こされると考えられている.世界的な流行が危惧されているエボラウイルスに対する効果があると話題となった抗ウイルス薬ファビピラビルはRNA依存性RNAポリメラーゼの阻害剤である.抗インフルエンザ薬として開発されたこの薬剤は,RNAウイルスの変異率を約0.02%から約0.1%へとわずかに上昇させることによりエラーカタストロフィーを起こし,ノロウイルスやエボラウイルスなどRNAウイルスに対する抗ウイルス作用を発揮すると考えられている6).今回,おそらく出芽酵母にコードされるタンパク質の凝集体からなる[KIL-d]因子がキラーウイルスの複製の正確性をわずかに低下させ,それにより出芽酵母に抗ウイルス活性を付与するという巧妙な対ウイルス戦略が明らかにされた.現在まで,[KIL-d]因子がどのタンパク質の凝集体であるかはわかっていないが,宿主細胞にコードされたタンパク質がウイルスの複製の正確性に寄与することが示唆される.よって,この研究の成果は,RNAウイルスの複製の過程における正確性の保証に宿主細胞にコードされたタンパク質が関与することを示しており,さらなる研究により,エラーカタストロフィーを考慮した新規な抗ウイルス薬の開発などにも道を拓くものと考えられる.また,プリオン様のタンパク質凝集体の新たな機能の発見は,遺伝学,細胞生物学,医学などさまざまな分野に対する波及効果が期待される.
略歴:2006年 東京大学大学院新領域創成科学研究科 修了,同年 理化学研究所脳科学総合研究センター 研究員を経て,2014年より東京都医学総合研究所 研究員.
関心事:プリオン様のタンパク質凝集体の性質.
田中 元雅(Motomasa Tanaka)
理化学研究所脳科学総合研究センター チームリーダー.
研究室URL:http://www.motomasalab.brain.riken.jp/
© 2015 鈴木元治郎・田中元雅 Licensed under CC 表示 2.1 日本
(理化学研究所脳科学総合研究センター タンパク質構造疾患研究チーム)
email:鈴木元治郎,田中元雅
DOI: 10.7875/first.author.2015.140
[KIL-d] protein element confers antiviral activity via catastrophic viral mutagenesis.
Genjiro Suzuki, Jonathan S. Weissman, Motomasa Tanaka
Molecular Cell, 60, 651-660 (2015)
要 約
出芽酵母はキラーウイルスに感染するとキラー毒素とよばれるキラーウイルスに由来する毒素を分泌するようになり,周囲のキラーウイルスをもたない出芽酵母を殺すキラー活性,および,自らおよび周囲のキラーウイルスをもつ出芽酵母の分泌するキラー毒素から身を守るレジスタンス活性をもつようになる.[KIL-d]因子をもつ出芽酵母はキラーウイルスに感染した際にキラー活性およびレジスタンス活性を示さないあるいは弱いことが知られていたが,[KIL-d]因子の性質やその分子機構については不明であった.筆者らは,遺伝学的な解析や次世代シークエンサーを用いた解析により,[KIL-d]因子は,プリオン様のタンパク質凝集体であること,キラーウイルスのゲノムへの変異の導入を促進すること,エラーカタストロフィーという現象によりキラーウイルスを不活性化させること,を発見した.このことから,プリオン様のタンパク質凝集体は侵入してきたキラーウイルスに対する抗ウイルス作用という新たな機能をもつことが明らかにされた.
はじめに
細胞はつねにウイルスの感染の危険にさらされている.もっとも原始的な真核生物である出芽酵母にもキラー毒素遺伝子をゲノムにもつキラーウイルスとよばれる2本鎖RNAウイルスが感染する.キラーウイルスに感染した出芽酵母はキラーウイルスに由来するキラー毒素を分泌することにより,周囲のキラーウイルスをもたない出芽酵母を殺すキラー活性,および,自らおよび周囲のキラーウイルスをもつ出芽酵母の分泌するキラー毒素から身を守るレジスタンス活性をもつようになる.一方で,キラーウイルスに感染していない出芽酵母はキラー活性およびレジスタンス活性をもたない.キラーウイルスにはM1,M2などいくつかの種類があり,それぞれ分泌するキラー毒素の異なることが知られている.また,キラーウイルスのゲノムはLAウイルスというヘルパーウイルスのコードするRNAポリメラーゼにより複製されるため,キラーウイルスの複製および増殖はLAウイルスに依存する.
これまでに,キラーウイルスに感染しているがキラー活性およびレジスタンス活性を示さないあるいは弱い変異株が多く単離されてきた.なかでも,[KIL-d]因子をもつ出芽酵母はキラー活性およびレジスタンス活性がさまざまな程度に低下するという特徴を示すことが知られていた1,2).しかし,[KIL-d]因子の性質やその分子機構については明らかにされていなかった.
プリオンはタンパク質からなる細胞質性の遺伝因子であり,その構造の変化により細胞あるいは個体のあいだを伝播すると考えられている.哺乳動物においては,ウシ海綿状脳症病やクロイツフェルトヤコブ病などのプリオン病はプリオンの構造の変化によりひき起こされると考えられている.一方で,出芽酵母にはSup35など約10種類のプリオンが知られており,哺乳動物のプリオンと1次配列は異なるものの同様の挙動を示す.近年,出芽酵母のプリオンついての研究により,細胞はタンパク質をプリオン化する(構造を変化させる)ことにより周辺の環境にすばやく応答している可能性が高いことが示された3,4).この研究においては,[KIL-d]因子が出芽酵母のプリオンである可能性について検討し,プリオン様のタンパク質凝集体が抗ウイルス作用という新たな機能をはたすことについて検討した.
1.[KIL-d]因子はプリオン様のタンパク質凝集体である
[KIL-d]因子の性質を調べるため,野生型の出芽酵母に対し,さまざまな処理をした[KIL-d]因子をもつ出芽酵母の細胞抽出液を感染させた.また,対照として,出芽酵母のプリオンとして知られる[PSI+]をもつ出芽酵母についても同様に実験した.その結果,[KIL-d]因子の感染効率はプロテナーゼ処理や煮沸処理などタンパク質分解処理によりいちじるしく低下したが,DNase処理やRNase処理などの核酸分解処理ではほとんど変わらなかった.また,[KIL-d]因子はおもに凝集画分に存在した.この傾向は[PSI+]因子と同様であったことから,[KIL-d]因子はプリオン様のタンパク質凝集体であると考えられた.
2.[KIL-d]因子はキラーウイルスのゲノムに変異を導入する
[KIL-d]因子をもつ出芽酵母において,キラー活性やレジスタンス活性がなくなるあるいは弱まる分子機構について調べた.その結果,[KIL-d]因子をもつ出芽酵母からもキラー毒素は分泌されていた.[KIL-d]因子をもつ出芽酵母に感染しているキラーウイルスのゲノム塩基配列を調べたところ,キラー毒素をコードする遺伝子に変異が導入されており,その変異がキラー活性を喪失あるいは低下させていた.そこで,[KIL-d]因子をもつ出芽酵母においてキラー活性あるいはレジスタンス活性に多様性の生じる分子機構について調べたところ,キラー毒素をコードする遺伝子における変異の箇所,さらには,出芽酵母における野生型のキラーウイルスと変異型のキラーウイルスの存在比の関与が明らかにされた.
[KIL-d]因子をもつ出芽酵母から高温での培養によりキラーウイルスを取り除き,キラーウイルスをもたない[KIL-d]因子をもつ出芽酵母と,野生型のキラーウイルスをもつ野生型の出芽酵母とをかけあわせ,[KIL-d]因子および野生型のキラーウイルスを保持する2倍体の出芽酵母を作製した.まず,キラー活性の低下した変異型のキラーウイルスをもつ出芽酵母は選択的に増殖することが確認された.よって,2倍体の出芽酵母のもつキラーウイルスに変異が導入されれば,そのキラーウイルスをもつ出芽酵母は選択的に増殖することが期待された.この2倍体の出芽酵母を継続的に培養したところ,[KIL-d]因子をもつ出芽酵母でのみキラーウイルスに変異が導入された.また,[KIL-d]因子はキラーウイルスのうちM1だけでなくM2にも変異を導入した.さらに,[KIL-d]因子はLAウイルスの存在には依存しなかったことから,[KIL-d]因子をもつ出芽酵母にみられる現象はRNAポリメラーゼの異常によるのではないことが明らかにされた.また,[KIL-d]因子は非メンデル則により遺伝する細胞質性の遺伝因子であったことから,[KIL-d]因子はプリオン様のタンパク質凝集体であることが支持された.
3.[KIL-d]因子はキラーウイルスのゲノムにおける変異率を上昇させる
次世代シークエンサーを用いて,[KIL-d]因子をもつ出芽酵母と野生型の出芽酵母とのあいだで,キラーウイルスのゲノムにおける変異率を比較した.すると,野生型の出芽酵母においては約0.03%であった変異率が,[KIL-d]因子をもつ出芽酵母では約0.09%へと上昇していた.一方で,出芽酵母のゲノムにおける変異率に差はみられなかった.また,キラーウイルスと同じRNAポリメラーゼにより複製されるLAウイルスにおいても変異率に差はみられなかった.これらのことから,[KIL-d]因子はキラーウイルスのゲノムにおいて特異的に変異率を上昇させていることが明らかにされた.
以上の結果から,[KIL-d]因子をもつ出芽酵母においては,プリオン様のタンパク質凝集体がキラーウイルスの複製の機構に作用しそのゲノムに新規な変異を導入することにより,レジスタンス活性を保持するがキラー活性を失ったあるいは弱くなったキラーウイルスが出現したと考えられた.変異型のキラーウイルスをもつ出芽酵母は,自らおよび周囲の出芽酵母の分泌するキラー毒素から身を守る機能が高いため,選択的に増殖すると考えられた.また,これら一連の過程は,RNAウイルスなどにおいてわずかな変異率の上昇によりウイルスが機能不全におちいるエラーカタストロフィーとよばれる現象に似ていた5).よって,[KIL-d]因子はエラーカタストロフィーを起こすことによりキラー毒素を無毒化するなどキラーウイルスの機能不全をひき起こし,ウイルスの感染をふせぐ抗ウイルス作用をもつプリオン様のタンパク質凝集体ではないかと考えられた(図1).
おわりに
インフルエンザウイルスやHIVなどに代表されるRNAウイルスは,ゲノムが正確に複製されないと宿主細胞において増殖できない.一方で,複製の正確性が高すぎると宿主細胞の免疫系からの攻撃など外界の変化に対する順応性が低下する.そのため,RNAウイルスにおける複製の正確性は境界にあり,その正確性がわずかに低下することによりエラーカタストロフィーが起こり,ウイルスの機能不全がひき起こされると考えられている.世界的な流行が危惧されているエボラウイルスに対する効果があると話題となった抗ウイルス薬ファビピラビルはRNA依存性RNAポリメラーゼの阻害剤である.抗インフルエンザ薬として開発されたこの薬剤は,RNAウイルスの変異率を約0.02%から約0.1%へとわずかに上昇させることによりエラーカタストロフィーを起こし,ノロウイルスやエボラウイルスなどRNAウイルスに対する抗ウイルス作用を発揮すると考えられている6).今回,おそらく出芽酵母にコードされるタンパク質の凝集体からなる[KIL-d]因子がキラーウイルスの複製の正確性をわずかに低下させ,それにより出芽酵母に抗ウイルス活性を付与するという巧妙な対ウイルス戦略が明らかにされた.現在まで,[KIL-d]因子がどのタンパク質の凝集体であるかはわかっていないが,宿主細胞にコードされたタンパク質がウイルスの複製の正確性に寄与することが示唆される.よって,この研究の成果は,RNAウイルスの複製の過程における正確性の保証に宿主細胞にコードされたタンパク質が関与することを示しており,さらなる研究により,エラーカタストロフィーを考慮した新規な抗ウイルス薬の開発などにも道を拓くものと考えられる.また,プリオン様のタンパク質凝集体の新たな機能の発見は,遺伝学,細胞生物学,医学などさまざまな分野に対する波及効果が期待される.
文 献
- Wickner, R. B.: Mutants of the killer plasmid of Saccharomyces cerevisiae dependent on chromosomal diploidy for expression and maintenance. Genetics, 82, 273-285 (1976)[PubMed]
- Talloczy, Z., Menon, S., Neigeborn, L. et al.: The [KIL-d] cytoplasmic genetic element of yeast results in epigenetic regulation of viral M double-stranded RNA gene expression. Genetics, 150, 21-30 (1998)[PubMed]
- Suzuki, G. & Tanaka, M.: Active conversion to the prion state as a molecular switch for cellular adaptation to environmental stress. Bioessays, 35, 12-16 (2013)[PubMed]
- Suzuki, G., Shimazu, N. & Tanaka, M.: A yeast prion, Mod5, promotes acquired drug resistance and cell survival under environmental stress. Science, 336, 355-359 (2012)[PubMed] [新着論文レビュー]
- Crotty, S., Cameron, C. E. & Andino, R.: RNA virus error catastrophe: direct molecular test by using ribavirin. Proc. Natl. Acad. Sci. USA, 98, 6895-6900 (2001)[PubMed]
- Arias, A., Thorne, L. & Goodfellow, I.: Favipiravir elicits antiviral mutagenesis during virus replication in vivo. Elife, 3, e03679 (2014)[PubMed]
著者プロフィール
略歴:2006年 東京大学大学院新領域創成科学研究科 修了,同年 理化学研究所脳科学総合研究センター 研究員を経て,2014年より東京都医学総合研究所 研究員.
関心事:プリオン様のタンパク質凝集体の性質.
田中 元雅(Motomasa Tanaka)
理化学研究所脳科学総合研究センター チームリーダー.
研究室URL:http://www.motomasalab.brain.riken.jp/
© 2015 鈴木元治郎・田中元雅 Licensed under CC 表示 2.1 日本