代謝によるグルタミン酸の輸送と放出の制御
森山 芳則
(岡山大学大学院医歯薬学総合研究科 生体膜機能生化学研究室)
email:森山芳則
DOI: 10.7875/first.author.2010.038
Metabolic control of vesicular glutamate transport and release.
Narinobu Juge, John A. Gray, Hiroshi Omote, Takaaki Miyaji, Tsuyoshi Inoue, Chiaki Hara, Hisayuki Uneyama, Robert H. Edwards, Roger A. Nicoll, Yoshinori Moriyama
Neuron, 68, 99-112 (2010)
飢餓がてんかん発作に有効なことは旧約聖書の時代から知られていたが,その機構は不明であった.小胞型グルタミン酸トランスポーターはシナプス小胞におけるグルタミン酸の濃縮をつかさどるトランスポーターであり,Cl-により活性の制御されることがわかっていた.筆者らは,精製した小胞型グルタミン酸トランスポーターを埋め込んだ再構成リポソームを用いた解析から,Cl-が小胞型グルタミン酸トランスポーターのアロステリック活性化因子として機能していることを見い出した.飢餓により体内で発生するケトン体がCl-と小胞型グルタミン酸トランスポーターの結合部位において競合し,グルタミン酸の輸送を阻害した.さらに,ケトン体の一種であるアセト酢酸はニューロンからのグルタミン酸の量子的な放出を阻害し,脳内に投与した4-アミノピリジンにより誘導されたけいれん発作を抑制した.これらの結果は,興奮性化学伝達が代謝により小胞型グルタミン酸トランスポーターを介し制御されていることを示していた.
てんかんは世界人口の約1%の発症する神経疾患である.その多くは抗てんかん薬で治療できるが,約30%の患者は抗てんかん薬が無効のいわゆる難治性てんかんである.その治療には飢餓やケトン食(高脂肪,低タンパク質,低炭水化物食)が有効であることが旧約聖書の時代から知られていた.飢餓やケトン食を摂取すると脂肪が酸化され体内にケトン体(とくに,アセト酢酸とβヒドロキシ酪酸)が増加する.これらは血液を介してニューロンに取り込まれエネルギー源として消費される.通常の生理的な条件下でのケトン体の濃度は0.3 mM程度であるが,飢餓状態やケトン食により約10 mMにまで達する.さらに,ケトン体にはけいれんを抑制する効果が認められた.このことから,ケトン体が抗てんかん作用の有効成分であるものと考えられている.ケトン体はどのようにしててんかんを抑制するのだろう? ケトン体は興奮性化学伝達を抑制するのかもしれないし,あるいは,抑制性化学伝達を亢進するのかもしれない.有史以来,この疑問を解くために多くの研究がなされてきたが,いまだ解明されていない1-3).
興奮性化学伝達において小胞型グルタミン酸トランスポーター(vesicular glutamate transporter:VGLUT)はグルタミン酸がシナプス小胞に濃縮される過程をつかさどっている.小胞型グルタミン酸トランスポーターにはVGLUT1,VGLUT2,VGLUT3という3つのアイソフォームがあり,いずれも液胞型プロトンポンプ(V-ATPase)の形成する膜電位差を用いてグルタミン酸を能動輸送している.小胞型グルタミン酸トランスポーターの欠失によりグルタミン酸の化学伝達は失われ,その結果,脳機能には大きな影響が現われる4).このように,小胞型グルタミン酸トランスポーターはグルタミン酸の化学伝達に本質的に重要であるが,その構造と機能・制御についてはよく知られていない.
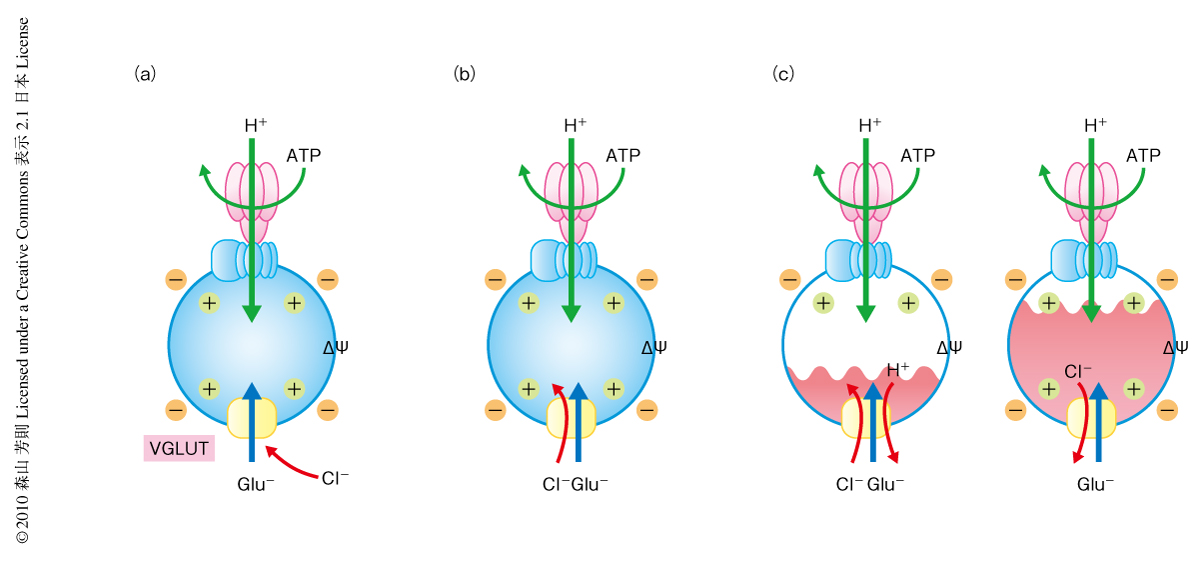
小胞型グルタミン酸トランスポーターがもつユニークな性質のひとつがCl-要求性である.シナプス小胞を用いた研究から,小胞型グルタミン酸トランスポーターはCl-に対して2相性を示すことがわかっている.すなわち,Cl-は低濃度(mMレベル)では小胞型グルタミン酸トランスポーターを活性化するのに対し,10 mM以上になるとこれが抑制に転じる.筆者らは,精製したVGLUT2と大腸菌のプロトンポンプ(F-ATPase)とをリポソームに組み込みATP依存性のグルタミン酸輸送を再構成した.その結果,この2相性が極端になり,Cl-がないと活性は検出限界以下になった5).このCl-要求性を説明する機構については,これまでに3つの説が提出されている(図1).すなわち,1)Cl-はアロステリック因子であり小胞型グルタミン酸トランスポーターの結合部位と結合することで活性化するというアロステリック因子説6,7).2)小胞型グルタミン酸トランスポーターによるグルタミン酸輸送にともないCl-が輸送されるためみかけのうえで活性化したようにみえるとするコンダクタンス説8).3)コンダクタンス説をより複雑にしたもので,2009年,Takamoriらが,精製VGLUT1と好熱菌F-ATPaseとの共再構成系を用い提唱したもの9).すなわち,VGLUT1には少なくとも2つの輸送モードがあって,通常の条件下ではグルタミン酸はCl-と共輸送されておりカウンターイオンとしてH+が逆輸送される.その一方で,小胞の内部に高濃度のCl-が存在するとき,たとえば,シナプス小胞がリサイクルされ細胞膜より陥入した直後などには,VGLUT1はグルタミン酸とCl-との電気的に中性(つまり,1対1)の逆輸送をするようなるという.さらに,高濃度のCl-で阻害されるのは駆動力が低下するためではなく,グルタミン酸とCl-とが結合部位で競合するからであると説明した.したがって,彼らの説によれば,駆動力である膜電位差を一定に保っても高濃度のCl-の存在下ではグルタミン酸の輸送は低下するはずである.しかしながら,彼らはもっとも重要な点,すなわち,グルタミン酸の輸送にともないCl-が実際に輸送されるのかどうかを確かめていなかった.
筆者らは,この論文において,Cl-による小胞型グルタミン酸トランスポーターの活性化機構を詳細に解析した.その解析の途上,Cl-の活性化とケトン体によるけいれんの抑制効果とのあいだに予想外の,しかし,明確な関連があることに気づいたのである.
単離シナプス小胞やこれまでのリポソームを用いた解析には,輸送の1次ポンプとしてV-ATPaseやF-ATPaseが必要であった.このため,Cl-の濃度を変化させると輸送の駆動力である膜電位差も変化してしまい,一定の駆動力のもとでCl-の活性化効果だけを解析することが困難であった.そこで,単一タンパク質にまで精製したVGLUT2のみをリポソームに組み込み,もっとも単純な測定系をつくった.膜電位差はK+-バリノマイシンで,pH勾配はpHジャンプで形成した.小胞型グルタミン酸トランスポーターによるグルタミン酸の輸送は膜電位差で駆動された.一定の膜電位差(約90 mV)の存在下,グルタミン酸の輸送をさまざまなCl-濃度下で測定した.2 mMまではまったく活性はないが,2 mMから5 mMにかけて指数関数的に活性化され,そのまま飽和して,以後,100 mM以上になっても活性は低下せず維持された.すなわち,F-ATPaseを除くことによりこれまでの実験系で観察されていた高濃度Cl-における活性の低下現象は消失した.これまでの報告における高濃度Cl-条件下での輸送活性の低下はF-ATPaseによる2次的な効果であるものと考えられた.活性が0から100%までに変化する狭いCl-濃度域におけるHill係数は3.3であり,非常に強い正の協調性があった.Takamoriらの報告と異なり,小胞内部に封入したCl-は活性化にはなんら寄与しなかった.Cl-は小胞外部にくわえたときのみ有効であった.
VGLUT2がグルタミン酸を輸送する際,Cl-は輸送されるのかどうかをCl-の放射性同位体や蛍光プローブを用いて調べた.小胞型GABAトランスポーターは1分子のGABAと2分子のCl-を共輸送する10).この小胞型GABAトランスポーターを陽性対照,ただのリポソームを陰性対照として用い,結果の信頼性に万全を期した.VGLUT2によるCl-輸送はまったく検出できなかった.Cl-はVGLUT2の輸送基質ではなく,アロステリック活性化因子であると結論した.
この結論をさらに強化するため,Cl-のアロステリック能に影響をあたえる生体成分を探索した.そのような物質はCl-と結合部位おいて競合しCl-の効果を変化させる可能性がある.30以上の代謝成分をスクリーニングした結果,ケトン体がグルタミン酸輸送を阻害することを見い出した.なかでも,アセト酢酸がもっとも強力であった(50%阻害濃度が0.2 mM).この阻害は予想どおり,アセト酢酸により小胞型グルタミン酸トランスポーターがCl-要求性を変化させたことによるものであった.アセト酢酸の効果は可逆的であった.さらに,アセト酢酸とCl-は小胞上のVGLUT2の外側からのみ有効であり,競合実験により同じ部位に結合することが判明した.以上の結果より,ケトン体,とくに,アセト酢酸がVGLUT2のCl-要求性を調節する生体因子であると結論した.
小胞型グルタミン酸トランスポーター以外に,これまで5種の小胞型神経伝達物質トランスポーターが知られている.すなわち,小胞型ヌクレオチドトランスポーター,小胞型興奮性アミノ酸トランスポーター,小胞型GABAトランスポーター,小胞型アセチルコリントランスポーター,小胞型モノアミントランスポーターである.これらのトランスポーターにCl-要求性とケトン体感受性が備わっているかどうか調べることは重要である.そこで,これらのトランスポーターを精製しVGLUT2と同様にリポソームに再構成して輸送活性を測定した.その結果,VGLUT1とVGLUT3にはもちろん,小胞型ヌクレオチドトランスポーターと小胞型興奮性アミノ酸トランスポーターにもVGLUT2とほぼ同様のCl-要求性とケトン体感受性の備わっていることが判明した.VGLUT2と同様にCl-を輸送する能力はなかった.小胞型GABAトランスポーターは前述のようにCl-を輸送するためCl-要求性は認められるが,ケトン体感受性は認められなかった.小胞型アセチルコリントランスポーターと小胞型モノアミントランスポーターはCl-要求性とケトン体感受性のいずれも備わってはいなかった.小胞型グルタミン酸トランスポーター,小胞型ヌクレオチドトランスポーター,小胞型興奮性アミノ酸トランスポーターは同じSLC17ファミリーに属するトランスポーターであるため,Cl-要求性とケトン体感受性はこのファミリーに共通する特性であるものと考えられた.さらに,ショウジョウバエの小胞型興奮性アミノ酸トランスポーターにも同様の性質があることがわかった.Cl-要求性とケトン体感受性という性質は広く動物全般に共通した性質であるものと考えられた.
ケトン体はin vivoでも小胞型グルタミン酸トランスポーターの活性を抑制するだろうか? もしもそうであるなら,小胞型グルタミン酸トランスポーターにある結合部位を介してグルタミン酸の化学伝達を制御できる可能性がある.この仮説を実証するため,海馬よりニューロンとアストロサイトとを単離・培養し,グルタミン酸のエキソサイトーシスにおけるケトン体の効果を調べた.10 mMのアセト酢酸によって脱分極により誘導されるグルタミン酸のエキソサイトーシスはほぼ完全に阻害された.アセト酢酸を培養液から除去すると阻害効果もなくなった.一方,アセト酢酸はアストロサイトからのグルタミン酸の放出には無効であった.
さらに,海馬の切片標本を用いて,グルタミン酸の量子的な放出におけるアセト酢酸の効果を電気生理学的に調べた.10 mMのアセト酢酸により微小興奮性シナプス後電流が抑制された.アセト酢酸はさらにその頻度も低下させた.その一方で,アセト酢酸はグルタミン酸の放出増強にはまったく影響をあたえず,AMPA受容体とNMDA受容体の機能にもまったく影響しなかった.微小抑制性シナプス後電流にも影響を及ぼさなかった.以上の結果から,アセト酢酸は細胞レベルでも有効であり,1個のシナプス小胞内のグルタミン酸の分子数を低下させるものと結論した.
アセト酢酸のもつグルタミン酸の放出抑制効果と抗てんかん作用との関連を微量還流法により調べた.その結果,ラット脳に4-アミノピリジンを投与して人工てんかんを発症させると同時に,ニューロンからグルタミン酸とドーパミンが放出された.アセト酢酸により,てんかん症状が軽減しグルタミン酸放出も低下した.この低下作用はアセト酢酸の濃度に依存しており,しかも,可逆的であった.一方,アセト酢酸はドーパミンの放出には無効であった.以上の結果は,アセト酢酸のグルタミン酸の放出抑制がin vivoでも起こることを示していた.
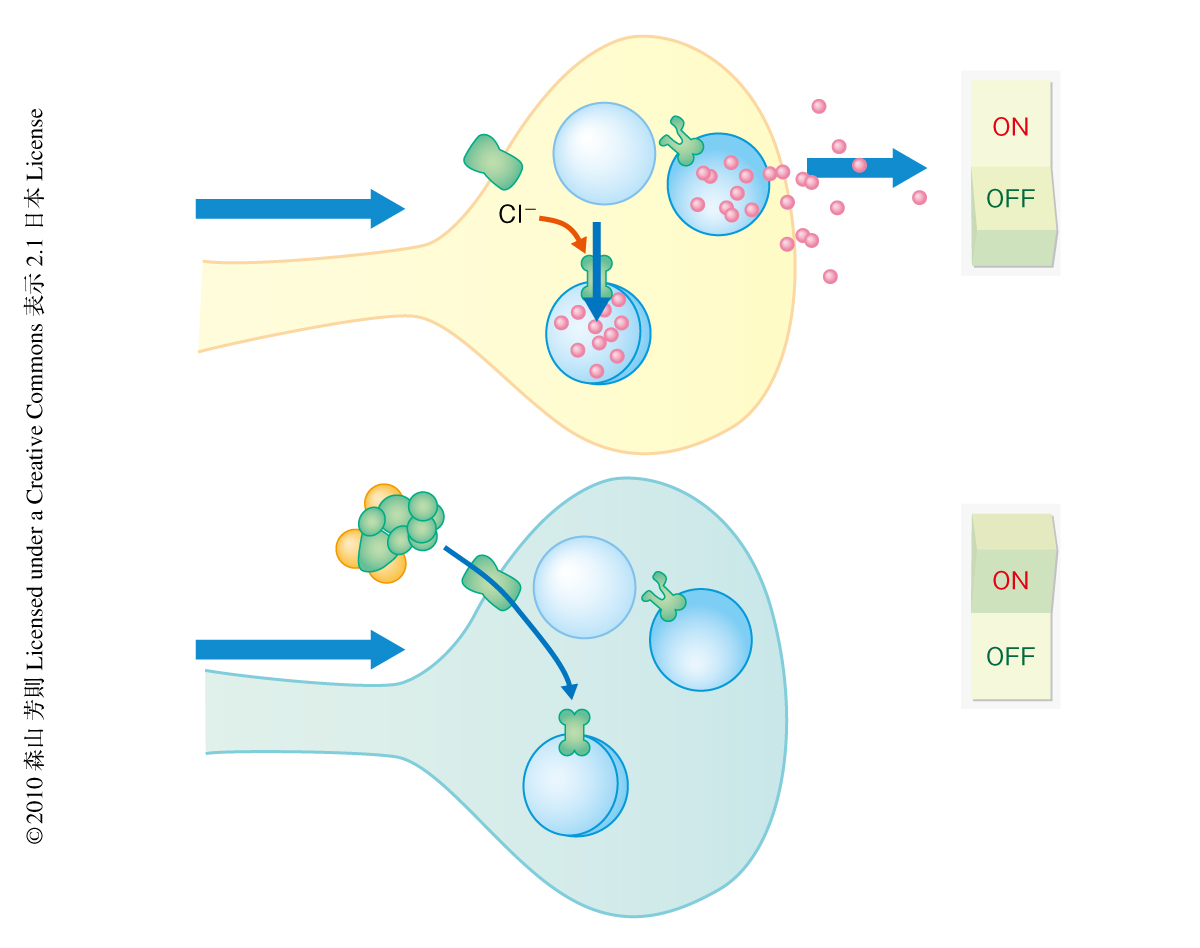
以上の結果から,小胞型グルタミン酸トランスポーターにはCl-でオンになりケトン体でオフになる分子スイッチの存在することがわかった(図2).通常の生理条件下ではニューロン内部のCl-は約10 mMであり小胞型グルタミン酸トランスポーターはつねにオンの状態にある.飢餓やケトン食の摂取でケトン体の含量が増加するとケトン体が小胞型グルタミン酸トランスポーターの結合部位に結合してスイッチをオフにする.その結果,グルタミン酸の量子放出が低下しグルタミン酸化学伝達が低下して,てんかん症状が緩和されるものと考えられる.ケトン食による抗てんかん作用には効果が現われるまで長時間の摂取が必要であるが,甘味(スイーツ)をとるとたちどころに効果の消失することが知られている.筆者らの発見は,このスイーツの作用をよく説明する.すなわち,スイーツの摂取により高ケトン体状態が解消した結果,小胞型グルタミン酸トランスポーターのスイッチが再びオンになり化学伝達効率が回復する(てんかん発作が起こりやすくなる)ものと考えられる.このスイッチの性質を解明するためにはその部分の構造を明らかにすることが必要である.ケトン体の効果がニューロンに特異的でありアストロサイトでは観察されないことは興味深い.その理由は現段階では不明であるが,アストロサイトがケトン体の合成能をもっている点と無関係ではないだろう.
小胞型グルタミン酸トランスポーターのCl-による活性化機構を研究するなかで,スイッチイングによる制御機構を発見した.代謝状態の変化によりこのスイッチがオンオフされ,それにあわせてグルタミン酸化学伝達もオンオフされる.このスイッチの本体の解明は,難治性てんかんだけでなく種々の神経疾患の有効な治療薬の開発につながるものと考えられる.同様のスイッチは小胞型ヌクレオチドトランスポーターにも存在していた.このことは,代謝によりプリン作動性化学伝達も制御されていることを示唆している.
略歴:岡山大学大学院薬学研究科を修了後,帝京大学薬学部,米国Roche Institute of Molecular Biology,大阪大学産業科学研究所,広島大学理学部などを経て,1999年より岡山大学薬学部 教授(現 同 大学院医歯薬学総合研究科 教授).
研究テーマ:トランスポーターの生化学,化学伝達の制御.
関心事:レモンの栽培.
© 2010 森山 芳則 Licensed under CC 表示 2.1 日本
(岡山大学大学院医歯薬学総合研究科 生体膜機能生化学研究室)
email:森山芳則
DOI: 10.7875/first.author.2010.038
Metabolic control of vesicular glutamate transport and release.
Narinobu Juge, John A. Gray, Hiroshi Omote, Takaaki Miyaji, Tsuyoshi Inoue, Chiaki Hara, Hisayuki Uneyama, Robert H. Edwards, Roger A. Nicoll, Yoshinori Moriyama
Neuron, 68, 99-112 (2010)
要 約
飢餓がてんかん発作に有効なことは旧約聖書の時代から知られていたが,その機構は不明であった.小胞型グルタミン酸トランスポーターはシナプス小胞におけるグルタミン酸の濃縮をつかさどるトランスポーターであり,Cl-により活性の制御されることがわかっていた.筆者らは,精製した小胞型グルタミン酸トランスポーターを埋め込んだ再構成リポソームを用いた解析から,Cl-が小胞型グルタミン酸トランスポーターのアロステリック活性化因子として機能していることを見い出した.飢餓により体内で発生するケトン体がCl-と小胞型グルタミン酸トランスポーターの結合部位において競合し,グルタミン酸の輸送を阻害した.さらに,ケトン体の一種であるアセト酢酸はニューロンからのグルタミン酸の量子的な放出を阻害し,脳内に投与した4-アミノピリジンにより誘導されたけいれん発作を抑制した.これらの結果は,興奮性化学伝達が代謝により小胞型グルタミン酸トランスポーターを介し制御されていることを示していた.
はじめに
てんかんは世界人口の約1%の発症する神経疾患である.その多くは抗てんかん薬で治療できるが,約30%の患者は抗てんかん薬が無効のいわゆる難治性てんかんである.その治療には飢餓やケトン食(高脂肪,低タンパク質,低炭水化物食)が有効であることが旧約聖書の時代から知られていた.飢餓やケトン食を摂取すると脂肪が酸化され体内にケトン体(とくに,アセト酢酸とβヒドロキシ酪酸)が増加する.これらは血液を介してニューロンに取り込まれエネルギー源として消費される.通常の生理的な条件下でのケトン体の濃度は0.3 mM程度であるが,飢餓状態やケトン食により約10 mMにまで達する.さらに,ケトン体にはけいれんを抑制する効果が認められた.このことから,ケトン体が抗てんかん作用の有効成分であるものと考えられている.ケトン体はどのようにしててんかんを抑制するのだろう? ケトン体は興奮性化学伝達を抑制するのかもしれないし,あるいは,抑制性化学伝達を亢進するのかもしれない.有史以来,この疑問を解くために多くの研究がなされてきたが,いまだ解明されていない1-3).
興奮性化学伝達において小胞型グルタミン酸トランスポーター(vesicular glutamate transporter:VGLUT)はグルタミン酸がシナプス小胞に濃縮される過程をつかさどっている.小胞型グルタミン酸トランスポーターにはVGLUT1,VGLUT2,VGLUT3という3つのアイソフォームがあり,いずれも液胞型プロトンポンプ(V-ATPase)の形成する膜電位差を用いてグルタミン酸を能動輸送している.小胞型グルタミン酸トランスポーターの欠失によりグルタミン酸の化学伝達は失われ,その結果,脳機能には大きな影響が現われる4).このように,小胞型グルタミン酸トランスポーターはグルタミン酸の化学伝達に本質的に重要であるが,その構造と機能・制御についてはよく知られていない.
小胞型グルタミン酸トランスポーターがもつユニークな性質のひとつがCl-要求性である.シナプス小胞を用いた研究から,小胞型グルタミン酸トランスポーターはCl-に対して2相性を示すことがわかっている.すなわち,Cl-は低濃度(mMレベル)では小胞型グルタミン酸トランスポーターを活性化するのに対し,10 mM以上になるとこれが抑制に転じる.筆者らは,精製したVGLUT2と大腸菌のプロトンポンプ(F-ATPase)とをリポソームに組み込みATP依存性のグルタミン酸輸送を再構成した.その結果,この2相性が極端になり,Cl-がないと活性は検出限界以下になった5).このCl-要求性を説明する機構については,これまでに3つの説が提出されている(図1).すなわち,1)Cl-はアロステリック因子であり小胞型グルタミン酸トランスポーターの結合部位と結合することで活性化するというアロステリック因子説6,7).2)小胞型グルタミン酸トランスポーターによるグルタミン酸輸送にともないCl-が輸送されるためみかけのうえで活性化したようにみえるとするコンダクタンス説8).3)コンダクタンス説をより複雑にしたもので,2009年,Takamoriらが,精製VGLUT1と好熱菌F-ATPaseとの共再構成系を用い提唱したもの9).すなわち,VGLUT1には少なくとも2つの輸送モードがあって,通常の条件下ではグルタミン酸はCl-と共輸送されておりカウンターイオンとしてH+が逆輸送される.その一方で,小胞の内部に高濃度のCl-が存在するとき,たとえば,シナプス小胞がリサイクルされ細胞膜より陥入した直後などには,VGLUT1はグルタミン酸とCl-との電気的に中性(つまり,1対1)の逆輸送をするようなるという.さらに,高濃度のCl-で阻害されるのは駆動力が低下するためではなく,グルタミン酸とCl-とが結合部位で競合するからであると説明した.したがって,彼らの説によれば,駆動力である膜電位差を一定に保っても高濃度のCl-の存在下ではグルタミン酸の輸送は低下するはずである.しかしながら,彼らはもっとも重要な点,すなわち,グルタミン酸の輸送にともないCl-が実際に輸送されるのかどうかを確かめていなかった.
筆者らは,この論文において,Cl-による小胞型グルタミン酸トランスポーターの活性化機構を詳細に解析した.その解析の途上,Cl-の活性化とケトン体によるけいれんの抑制効果とのあいだに予想外の,しかし,明確な関連があることに気づいたのである.
1.Cl-はVGLUT2に結合しこれを活性化する
単離シナプス小胞やこれまでのリポソームを用いた解析には,輸送の1次ポンプとしてV-ATPaseやF-ATPaseが必要であった.このため,Cl-の濃度を変化させると輸送の駆動力である膜電位差も変化してしまい,一定の駆動力のもとでCl-の活性化効果だけを解析することが困難であった.そこで,単一タンパク質にまで精製したVGLUT2のみをリポソームに組み込み,もっとも単純な測定系をつくった.膜電位差はK+-バリノマイシンで,pH勾配はpHジャンプで形成した.小胞型グルタミン酸トランスポーターによるグルタミン酸の輸送は膜電位差で駆動された.一定の膜電位差(約90 mV)の存在下,グルタミン酸の輸送をさまざまなCl-濃度下で測定した.2 mMまではまったく活性はないが,2 mMから5 mMにかけて指数関数的に活性化され,そのまま飽和して,以後,100 mM以上になっても活性は低下せず維持された.すなわち,F-ATPaseを除くことによりこれまでの実験系で観察されていた高濃度Cl-における活性の低下現象は消失した.これまでの報告における高濃度Cl-条件下での輸送活性の低下はF-ATPaseによる2次的な効果であるものと考えられた.活性が0から100%までに変化する狭いCl-濃度域におけるHill係数は3.3であり,非常に強い正の協調性があった.Takamoriらの報告と異なり,小胞内部に封入したCl-は活性化にはなんら寄与しなかった.Cl-は小胞外部にくわえたときのみ有効であった.
2.VGLUT2はCl-を輸送しない
VGLUT2がグルタミン酸を輸送する際,Cl-は輸送されるのかどうかをCl-の放射性同位体や蛍光プローブを用いて調べた.小胞型GABAトランスポーターは1分子のGABAと2分子のCl-を共輸送する10).この小胞型GABAトランスポーターを陽性対照,ただのリポソームを陰性対照として用い,結果の信頼性に万全を期した.VGLUT2によるCl-輸送はまったく検出できなかった.Cl-はVGLUT2の輸送基質ではなく,アロステリック活性化因子であると結論した.
3.アセト酢酸はVGLUT2のCl-要求性を調節する
この結論をさらに強化するため,Cl-のアロステリック能に影響をあたえる生体成分を探索した.そのような物質はCl-と結合部位おいて競合しCl-の効果を変化させる可能性がある.30以上の代謝成分をスクリーニングした結果,ケトン体がグルタミン酸輸送を阻害することを見い出した.なかでも,アセト酢酸がもっとも強力であった(50%阻害濃度が0.2 mM).この阻害は予想どおり,アセト酢酸により小胞型グルタミン酸トランスポーターがCl-要求性を変化させたことによるものであった.アセト酢酸の効果は可逆的であった.さらに,アセト酢酸とCl-は小胞上のVGLUT2の外側からのみ有効であり,競合実験により同じ部位に結合することが判明した.以上の結果より,ケトン体,とくに,アセト酢酸がVGLUT2のCl-要求性を調節する生体因子であると結論した.
4.Cl-依存性はSLC17ファミリーに共通する性質である
小胞型グルタミン酸トランスポーター以外に,これまで5種の小胞型神経伝達物質トランスポーターが知られている.すなわち,小胞型ヌクレオチドトランスポーター,小胞型興奮性アミノ酸トランスポーター,小胞型GABAトランスポーター,小胞型アセチルコリントランスポーター,小胞型モノアミントランスポーターである.これらのトランスポーターにCl-要求性とケトン体感受性が備わっているかどうか調べることは重要である.そこで,これらのトランスポーターを精製しVGLUT2と同様にリポソームに再構成して輸送活性を測定した.その結果,VGLUT1とVGLUT3にはもちろん,小胞型ヌクレオチドトランスポーターと小胞型興奮性アミノ酸トランスポーターにもVGLUT2とほぼ同様のCl-要求性とケトン体感受性の備わっていることが判明した.VGLUT2と同様にCl-を輸送する能力はなかった.小胞型GABAトランスポーターは前述のようにCl-を輸送するためCl-要求性は認められるが,ケトン体感受性は認められなかった.小胞型アセチルコリントランスポーターと小胞型モノアミントランスポーターはCl-要求性とケトン体感受性のいずれも備わってはいなかった.小胞型グルタミン酸トランスポーター,小胞型ヌクレオチドトランスポーター,小胞型興奮性アミノ酸トランスポーターは同じSLC17ファミリーに属するトランスポーターであるため,Cl-要求性とケトン体感受性はこのファミリーに共通する特性であるものと考えられた.さらに,ショウジョウバエの小胞型興奮性アミノ酸トランスポーターにも同様の性質があることがわかった.Cl-要求性とケトン体感受性という性質は広く動物全般に共通した性質であるものと考えられた.
5.アセト酢酸はグルタミン酸の量子放出を制御する
ケトン体はin vivoでも小胞型グルタミン酸トランスポーターの活性を抑制するだろうか? もしもそうであるなら,小胞型グルタミン酸トランスポーターにある結合部位を介してグルタミン酸の化学伝達を制御できる可能性がある.この仮説を実証するため,海馬よりニューロンとアストロサイトとを単離・培養し,グルタミン酸のエキソサイトーシスにおけるケトン体の効果を調べた.10 mMのアセト酢酸によって脱分極により誘導されるグルタミン酸のエキソサイトーシスはほぼ完全に阻害された.アセト酢酸を培養液から除去すると阻害効果もなくなった.一方,アセト酢酸はアストロサイトからのグルタミン酸の放出には無効であった.
さらに,海馬の切片標本を用いて,グルタミン酸の量子的な放出におけるアセト酢酸の効果を電気生理学的に調べた.10 mMのアセト酢酸により微小興奮性シナプス後電流が抑制された.アセト酢酸はさらにその頻度も低下させた.その一方で,アセト酢酸はグルタミン酸の放出増強にはまったく影響をあたえず,AMPA受容体とNMDA受容体の機能にもまったく影響しなかった.微小抑制性シナプス後電流にも影響を及ぼさなかった.以上の結果から,アセト酢酸は細胞レベルでも有効であり,1個のシナプス小胞内のグルタミン酸の分子数を低下させるものと結論した.
6.アセト酢酸はグルタミン酸放出を抑制してんかん症状を緩和する
アセト酢酸のもつグルタミン酸の放出抑制効果と抗てんかん作用との関連を微量還流法により調べた.その結果,ラット脳に4-アミノピリジンを投与して人工てんかんを発症させると同時に,ニューロンからグルタミン酸とドーパミンが放出された.アセト酢酸により,てんかん症状が軽減しグルタミン酸放出も低下した.この低下作用はアセト酢酸の濃度に依存しており,しかも,可逆的であった.一方,アセト酢酸はドーパミンの放出には無効であった.以上の結果は,アセト酢酸のグルタミン酸の放出抑制がin vivoでも起こることを示していた.
7.グルタミン酸化学伝達は小胞型グルタミン酸トランスポーターのアニオンスイッチで制御できる
以上の結果から,小胞型グルタミン酸トランスポーターにはCl-でオンになりケトン体でオフになる分子スイッチの存在することがわかった(図2).通常の生理条件下ではニューロン内部のCl-は約10 mMであり小胞型グルタミン酸トランスポーターはつねにオンの状態にある.飢餓やケトン食の摂取でケトン体の含量が増加するとケトン体が小胞型グルタミン酸トランスポーターの結合部位に結合してスイッチをオフにする.その結果,グルタミン酸の量子放出が低下しグルタミン酸化学伝達が低下して,てんかん症状が緩和されるものと考えられる.ケトン食による抗てんかん作用には効果が現われるまで長時間の摂取が必要であるが,甘味(スイーツ)をとるとたちどころに効果の消失することが知られている.筆者らの発見は,このスイーツの作用をよく説明する.すなわち,スイーツの摂取により高ケトン体状態が解消した結果,小胞型グルタミン酸トランスポーターのスイッチが再びオンになり化学伝達効率が回復する(てんかん発作が起こりやすくなる)ものと考えられる.このスイッチの性質を解明するためにはその部分の構造を明らかにすることが必要である.ケトン体の効果がニューロンに特異的でありアストロサイトでは観察されないことは興味深い.その理由は現段階では不明であるが,アストロサイトがケトン体の合成能をもっている点と無関係ではないだろう.
おわりに
小胞型グルタミン酸トランスポーターのCl-による活性化機構を研究するなかで,スイッチイングによる制御機構を発見した.代謝状態の変化によりこのスイッチがオンオフされ,それにあわせてグルタミン酸化学伝達もオンオフされる.このスイッチの本体の解明は,難治性てんかんだけでなく種々の神経疾患の有効な治療薬の開発につながるものと考えられる.同様のスイッチは小胞型ヌクレオチドトランスポーターにも存在していた.このことは,代謝によりプリン作動性化学伝達も制御されていることを示唆している.
文 献
- Bailey, E. E., Pfeifer, H. H. & Thiele, E. A.: The use of diet in the treatment of epilepsy. Epilepsy Behav., 6, 4-8 (2005)[PubMed]
- Freeman, J., Veggiotti, P., Lanzi, G. et al.: The ketogenic diet: from molecular mechanisms to clinical effects. Epilepsy Res., 68, 145-180 (2006)[PubMed]
- Hartman, A. L., Gasior, M., Vining, E. P. et al.: The neuropharmacology of the ketogenic diet. Pediatr. Neurol., 36, 281-292 (2007)[PubMed]
- Edwards, R. H.: The neurotransmitter cycle and quantal size. Neuron, 55, 835-858 (2007)[PubMed]
- Juge, N., Yoshida, Y., Yatsushiro, S. et al.: Vesicular glutamate transporter contains two independent transport machineries. J. Biol. Chem., 281, 39499-39506 (2006)[PubMed]
- Hartinger, J. & Jahn, R.: An anion binding site that regulates the glutamate transporter of synaptic vesicles. J. Biol. Chem., 268, 23122-23127 (1993)[PubMed]
- Moriyama, Y. & Yamamoto, A.: Vesicular L-glutamate transporter in microvesicles from bovine pineal glands. Driving force, mechanism of chloride anion activation, and substrate specificity. J. Biol. Chem., 270, 22314-22320 (1995)[PubMed]
- Bellocchio, E. E., Reimer, R. J., Fremeau, R. T. et al.: Uptake of glutamate into synaptic vesicles by an inorganic phosphate transporter. Science, 289, 957-960 (2000)[PubMed]
- Schenck, S., Wojcik, S. M., Brose, N. et al.: A chloride conductance in VGLUT1 underlies maximal glutamate loading into synaptic vesicles. Nat. Neurosci., 12, 156-162 (2009)[PubMed]
- Juge, N., Muroyama, A., Hiasa, M. et al.: Vesicular inhibitory amino acid transporter is a Cl-/γ-aminobutyrate co-transporter. J. Biol. Chem., 284, 35073-35078 (2009)[PubMed]
著者プロフィール
略歴:岡山大学大学院薬学研究科を修了後,帝京大学薬学部,米国Roche Institute of Molecular Biology,大阪大学産業科学研究所,広島大学理学部などを経て,1999年より岡山大学薬学部 教授(現 同 大学院医歯薬学総合研究科 教授).
研究テーマ:トランスポーターの生化学,化学伝達の制御.
関心事:レモンの栽培.
© 2010 森山 芳則 Licensed under CC 表示 2.1 日本