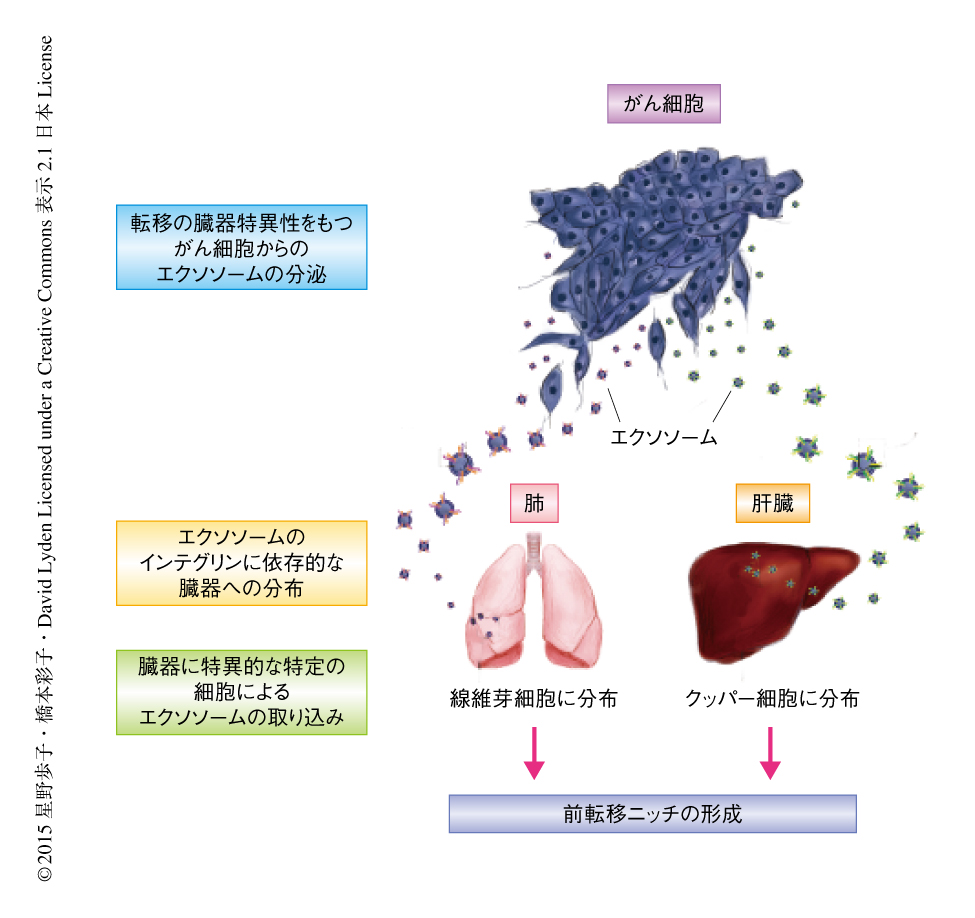
がんの転移先はがん細胞に由来するエキソソームが規定しその臓器特異性はエキソソームに含まれるインテグリンにより決定される
星野歩子・橋本彩子・David Lyden
(米国Weill Cornell Medicine,Departments of Pediatrics)
email:星野歩子
DOI: 10.7875/first.author.2015.136
Tumour exosome integrins determine organotropic metastasis.
Ayuko Hoshino, Bruno Costa-Silva, Tang-Long Shen, Goncalo Rodrigues, Ayako Hashimoto, Milica Tesic Mark, Henrik Molina, Shinji Kohsaka, Angela Di Giannatale, Sophia Ceder, Swarnima Singh, Caitlin Williams, Nadine Soplop, Kunihiro Uryu, Lindsay Pharmer, Tari King, Linda Bojmar, Alexander E. Davies, Yonathan Ararso, Tuo Zhang, Haiying Zhang, Jonathan Hernandez, Joshua M. Weiss, Vanessa D. Dumont-Cole, Kimberly Kramer, Leonard H. Wexler, Aru Narendran, Gary K. Schwartz, John H. Healey, Per Sandstrom, Knut Jørgen Labori, Elin H. Kure, Paul M. Grandgenett, Michael A. Hollingsworth, Maria de Sousa, Sukhwinder Kaur, Maneesh Jain, Kavita Mallya, Surinder K. Batra, William R. Jarnagin, Mary S. Brady, Oystein Fodstad, Volkmar Muller, Klaus Pantel, Andy J. Minn, Mina J. Bissell, Benjamin A. Garcia, Yibin Kang, Vinagolu K. Rajasekhar, Cyrus M. Ghajar, Irina Matei, Hector Peinado, Jacqueline Bromberg, David Lyden
Nature, 527, 329-335 (2015)
長年にわたり,がん転移の成立には転移に適するニッチが必要であるとされてきたが,がんが特定の臓器に転移する転移の臓器特異性については,がん転移の研究における最大の謎のひとつとされている.今回,筆者らは,マウスおよびヒトにおいて,臓器特異性をもつがん細胞に由来するエキソソームが転移先の細胞に優先的に取り込まれ,そこでがん転移に適するニッチを形成することを明らかにした.マウスに肺に特異性をもつがん細胞に由来するエキソソームを投与すると,骨に特異性をもつがん細胞の転移先は骨から肺へと変化した.さらに,プロテオミクス解析によりエキソソームに含まれるインテグリンの発現にはその臓器特異性によりパターンのあることが判明し,インテグリンα6β4およびインテグリンα6β1は肺への転移と,インテグリンαvβ5は肝臓への転移と関連がみられた.エキソソームに含まれるインテグリンα6β4の発現を低下させると肺におけるエキソソームの取り込みは減少し,肺への転移も減少した.同様に,エキソソームに含まれるインテグリンαvβ5の発現を低下させると肝臓におけるエキソソームの取り込みは減少し,肝臓への転移も減少した.臨床データからは,患者の血中のエキソソームに含まれるインテグリンが将来の転移先の予測に有用である可能性が示された.
126年前,がん細胞が特定の臓器にのみ転移するのはその臓器の環境ががん細胞の生着および増殖に適しているからであるとする仮説が提唱されて以来1),がん転移の臓器特異性を解明しようとする研究は数多く報告されてきたが,その分子機構はいまだ明らかではない.転移の臓器特異性はがん細胞それ自体の性質によるものとする報告は多く2-5),また,転移先の臓器においても,がん細胞が産生するタンパク質により転移しやすい環境が形成されている可能性が示唆されてきた6-8).エキソソームはがん細胞を含むすべての細胞から分泌される直径30~100 nmほどの脂質二重膜により形成される小胞であり,タンパク質,RNA,DNAなどが含まれる9).近年,筆者らは,がん細胞に由来するエキソソームに含まれるタンパク質METによりメラノーマの転移が促進されることや10),膵臓がん細胞に由来するエキソソームに含まれるタンパク質MIFにより膵臓がんの肝臓への転移がどのように進行するかについて報告してきた11).これらの報告を含めて,エキソソームによるがんの進展についての研究は増えつつあるが,エキソソームがどの臓器に分布し,また,その分布は何に規定されているかについては知られていなかった.筆者らは,エキソソームが臓器に選択的に分布することによりがん転移の臓器特異性が決定されているのではないかという仮説をたてた.
がん細胞に由来するエキソソームが臓器に選択的に分布するかどうか検討するため,将来の転移先が肺である乳がん細胞および肝臓である膵臓がん細胞からエキソソームを回収し,マウスへ投与して24時間後にその分布を測定した.その結果,エキソソームの分布はがん細胞の将来の転移先において有意に高いことがわかった.さらに,同一の乳がん細胞株を親株として樹立された肺,骨,脳それぞれに特異的な転移能をもつがん細胞に由来するエキソソームを回収し,同様にマウスに投与したところ,肺への転移性をもつがん細胞に由来するエキソソームは肺に,脳への転移性をもつがん細胞に由来するエキソソームは脳に,有意に高く分布することが確認された.エキソソームが特異的な転移先へ分布するだけでなく,その臓器において転移に適するニッチを形成するかどうか検討するため,マウスに肺への転移性をもつ乳がん細胞に由来するエキソソームを3週間にわたり静脈投与し(エキソソームによる肺への転移性の“教育”),そののち,骨への転移性をもつ乳がん細胞を尾静脈あるいは心臓から投与し,肺への転移能について検討した.その結果,いずれの場合においても,がん細胞それ自体は肺への転移能はもたないにもかかわらず,がん細胞は肺へと転移した.以上より,がん細胞に由来するエキソソームの分布には臓器選択性があり,このエキソソームが将来の転移先に取り込まれ転移に適する前転移ニッチを形成することがわかった.
エキソソームの分布の臓器特異性がどのように決定されているのか明らかにするため,臓器特異的に転移する6種類のがん細胞に由来するエキソソームに対し,定量的プロテオミクス解析による網羅的な検討を行った.in vivoにおいて臓器特異的にエキソソームが取り込まれたことから,エキソソームにおいて高く発現する細胞接着因子に着目したところ6種類のインテグリンが含まれていた.これらのインテグリンについて,臓器特異性をもつ30種類のがん細胞に由来するエキソソームに対し定性的プロテオミクス解析を行ったところ,がんの種類にはよらず,肺に特異的に転移するがん細胞ではインテグリンα6β4およびインテグリンα6β1,肝臓に特異的に転移するがん細胞ではインテグリンαvβ5,脳に特異的に転移するがん細胞ではインテグリンαvβ3と,転移先の臓器とインテグリンの発現パターンとのあいだに強い関連がみられた.また,エキソソームは,肺においては線維芽細胞および上皮細胞,肝臓においては常駐マクロファージであるクッパー細胞,脳においては血管内皮細胞に選択的に取り込まれた.このことから,エキソソームは臓器特異性とともに,それぞれの臓器において特定の種類の細胞に取り込まれる性質のあることがわかり,エキソソームには臓器別に行き先を決定する“郵便番号”のような役割をはたすインテグリンの発現パターンがあることが示唆された.
エキソソームに含まれるインテグリンがエキソソームの分布の臓器特異性において機能しているかどうか検討するため,インテグリンβ4を発現する肺に特異的に転移する乳がん細胞においてインテグリンβ4をノックダウンした.この乳がん細胞に由来するエキソソームにおいてもインテグリンβ4が低下していることを確認したうえで,このエキソソームをマウスに静脈投与したところ肺への取り込みが有意に減少した.インテグリンβ4の阻害ペプチドによりインテグリンβ4を阻害したときにも,同様に肺への取り込みは低下した.さらに,インテグリンβ4を発現しない骨に特異的に転移する乳がん細胞に由来するエキソソームにおいてインテグリンβ4を強制発現させたところ,肺への分布が有意に増加した.同様に,インテグリンβ5を発現する肝臓に特異的に転移する膵がん細胞においてインテグリンβ5をノックダウン,あるいは,その阻害ペプチドにより阻害したところ,この膵がん細胞に由来するエキソソームの肝臓への取り込みは有意に減少した.以上の結果から,エキソソームの肺への取り込みの特異性にはインテグリンα6β4が,肝臓への取り込みの特異性にはインテグリンαvβ5が,寄与していることが明らかにされた.
がん細胞に発現するインテグリンβ4およびエキソソームに含まれるインテグリンβ4がそれぞれ転移能におよぼす影響について検討した.肺に特異的に転移する乳がん細胞におけるインテグリンβ4のノックダウンではがん細胞それ自体の肺への転移能が有意に低下したが,インテグリンβ4の低下したエキソソームによりマウスを3週間にわたり“教育”したのち,このインテグリンβ4をノックダウンした乳がん細胞を投与したところ,肺への転移能に変化はみられなかった.一方で,インテグリンβ4の低下していないエキソソームにより教育したところ,インテグリンβ4をノックダウンした乳がん細胞の肺への転移能は回復した.以上より,肺への転移能はがん細胞それ自体ではなく,エキソソームに含まれるインテグリンβ4に依存することが証明された.
エキソソームがおのおのの臓器において特定の細胞に取り込まれたのち,細胞においてどのような変化がもたらされるのかin vitroにおいて調べた.肺においてエキソソームを取り込む線維芽細胞および上皮細胞を肺に特異的に分布するエキソソームにより,また,肝臓においてエキソソームを取り込むクッパー細胞を肝に特異的に分布するエキソソームにより処理し,それぞれの細胞における遺伝子の発現について調べた結果,炎症性タンパク質をコードするS100遺伝子ファミリーに属するそれぞれ異なる遺伝子の発現が,肺の線維芽細胞およびクッパー細胞において上昇することが確認された.
がん細胞に由来するエキソソームがインテグリンの発現パターンによる臓器別の“郵便番号”をもち,それが将来の転移先の臓器に分布することから,がん患者の血中のエキソソームからがんの転移先を予測する可能性について検証した.すでに転移のあるがん患者の血液から回収したエキソソームに含まれるインテグリンを定量した結果,乳がん,メラノーマ,横紋筋肉腫,膵臓がんの患者において,すでに肺への転移のある患者の血中のエキソソームは肺への転移のない患者に比べインテグリンα6β4の量が有意に多く,肝臓への転移のある患者の血中のエキソソームは肝臓への転移のない患者に比べインテグリンαvβ5の量が有意に多いことが判明した.それでは,血中のエキソソームから将来の転移先の臓器は予測できるのだろうか.乳がんの患者において,血液を採取したときには転移はなかったが3年以内に肺へ転移した患者と,肺への転移のない患者の血中のエキソソームに含まれるインテグリンβ4の量を比較したところ,肺への転移のみられた患者はインテグリンβ4の量が有意に多かった.また,膵臓がんの患者においても,3年以内に肝臓へ転移した患者の血中のエキソソームに含まれるインテグリンαvβ5の量は,肝臓への転移を起こさなかった患者に比べ有意に多いことがわかった.これらの結果から,がん患者の血中のエキソソームに含まれるインテグリンの量を調べることにより,肺および肝臓への転移を予測する可能性が示唆され,今後,バイオマーカーとして活用されることが期待される.
長年にわたり,がん転移の臓器特異性の分子機構は謎とされてきたが,この研究によりその一端が解明された.筆者らは,がん細胞の分泌するエキソソームがそこに含まれるインテグリンの発現パターンにより決定された特定の臓器の特定の細胞に取り込まれ,そこで前転移ニッチを形成することによりがん細胞の臓器特異的な転移を誘導することを証明した(図1).この研究は,がん転移の臓器特異性の分子機構を解明しただけでなく,今後,このエキソソームに含まれるインテグリンをがん患者において転移先を予測するバイオマーカーとして活用する可能性をも示唆した.さらに,エキソソームが転移に適する前転移ニッチを形成することから,エキソソームの臓器への分布を阻害することによる治療も考えられる.この研究により示された新たな知見により,今後,がんの研究がさらに進展し,がん転移の治療にも活かされることを期待したい.
略歴:2011年 東京大学大学院新領域創成科学研究科 修了,同年 米国Weill Cornell Medical College(現Weill Cornell Medicine)にてPostdoctoral Fellowを経て,2015年より同Research Associate.
研究テーマ:がんの転移におけるエキソソームの役割.
抱負:局部的にみえる事象(疾病)にインパクトをあたえるシステミックな機構を解明したい.
橋本 彩子(Ayako Hashimoto)
米国Weill Cornell MedicineにてResearch Fellow.
David Lyden
米国Weill Cornell MedicineにてProfessor.
© 2015 星野歩子・橋本彩子・David Lyden Licensed under CC 表示 2.1 日本
(米国Weill Cornell Medicine,Departments of Pediatrics)
email:星野歩子
DOI: 10.7875/first.author.2015.136
Tumour exosome integrins determine organotropic metastasis.
Ayuko Hoshino, Bruno Costa-Silva, Tang-Long Shen, Goncalo Rodrigues, Ayako Hashimoto, Milica Tesic Mark, Henrik Molina, Shinji Kohsaka, Angela Di Giannatale, Sophia Ceder, Swarnima Singh, Caitlin Williams, Nadine Soplop, Kunihiro Uryu, Lindsay Pharmer, Tari King, Linda Bojmar, Alexander E. Davies, Yonathan Ararso, Tuo Zhang, Haiying Zhang, Jonathan Hernandez, Joshua M. Weiss, Vanessa D. Dumont-Cole, Kimberly Kramer, Leonard H. Wexler, Aru Narendran, Gary K. Schwartz, John H. Healey, Per Sandstrom, Knut Jørgen Labori, Elin H. Kure, Paul M. Grandgenett, Michael A. Hollingsworth, Maria de Sousa, Sukhwinder Kaur, Maneesh Jain, Kavita Mallya, Surinder K. Batra, William R. Jarnagin, Mary S. Brady, Oystein Fodstad, Volkmar Muller, Klaus Pantel, Andy J. Minn, Mina J. Bissell, Benjamin A. Garcia, Yibin Kang, Vinagolu K. Rajasekhar, Cyrus M. Ghajar, Irina Matei, Hector Peinado, Jacqueline Bromberg, David Lyden
Nature, 527, 329-335 (2015)
この論文に出現する遺伝子・タンパク質のUniprot ID
インテグリン, インテグリンα6(P23229), β4(P16144), β1(P05556), インテグリンαv(P06756), β5(P18084), MET(P16056), MIF(P34884), β3(P05106), インテグリンβ4(P16144), インテグリンβ5(P18084), S100
要 約
長年にわたり,がん転移の成立には転移に適するニッチが必要であるとされてきたが,がんが特定の臓器に転移する転移の臓器特異性については,がん転移の研究における最大の謎のひとつとされている.今回,筆者らは,マウスおよびヒトにおいて,臓器特異性をもつがん細胞に由来するエキソソームが転移先の細胞に優先的に取り込まれ,そこでがん転移に適するニッチを形成することを明らかにした.マウスに肺に特異性をもつがん細胞に由来するエキソソームを投与すると,骨に特異性をもつがん細胞の転移先は骨から肺へと変化した.さらに,プロテオミクス解析によりエキソソームに含まれるインテグリンの発現にはその臓器特異性によりパターンのあることが判明し,インテグリンα6β4およびインテグリンα6β1は肺への転移と,インテグリンαvβ5は肝臓への転移と関連がみられた.エキソソームに含まれるインテグリンα6β4の発現を低下させると肺におけるエキソソームの取り込みは減少し,肺への転移も減少した.同様に,エキソソームに含まれるインテグリンαvβ5の発現を低下させると肝臓におけるエキソソームの取り込みは減少し,肝臓への転移も減少した.臨床データからは,患者の血中のエキソソームに含まれるインテグリンが将来の転移先の予測に有用である可能性が示された.
はじめに
126年前,がん細胞が特定の臓器にのみ転移するのはその臓器の環境ががん細胞の生着および増殖に適しているからであるとする仮説が提唱されて以来1),がん転移の臓器特異性を解明しようとする研究は数多く報告されてきたが,その分子機構はいまだ明らかではない.転移の臓器特異性はがん細胞それ自体の性質によるものとする報告は多く2-5),また,転移先の臓器においても,がん細胞が産生するタンパク質により転移しやすい環境が形成されている可能性が示唆されてきた6-8).エキソソームはがん細胞を含むすべての細胞から分泌される直径30~100 nmほどの脂質二重膜により形成される小胞であり,タンパク質,RNA,DNAなどが含まれる9).近年,筆者らは,がん細胞に由来するエキソソームに含まれるタンパク質METによりメラノーマの転移が促進されることや10),膵臓がん細胞に由来するエキソソームに含まれるタンパク質MIFにより膵臓がんの肝臓への転移がどのように進行するかについて報告してきた11).これらの報告を含めて,エキソソームによるがんの進展についての研究は増えつつあるが,エキソソームがどの臓器に分布し,また,その分布は何に規定されているかについては知られていなかった.筆者らは,エキソソームが臓器に選択的に分布することによりがん転移の臓器特異性が決定されているのではないかという仮説をたてた.
1.がん細胞に由来するエキソソームは将来の転移先に取り込まれ前転移ニッチを形成する
がん細胞に由来するエキソソームが臓器に選択的に分布するかどうか検討するため,将来の転移先が肺である乳がん細胞および肝臓である膵臓がん細胞からエキソソームを回収し,マウスへ投与して24時間後にその分布を測定した.その結果,エキソソームの分布はがん細胞の将来の転移先において有意に高いことがわかった.さらに,同一の乳がん細胞株を親株として樹立された肺,骨,脳それぞれに特異的な転移能をもつがん細胞に由来するエキソソームを回収し,同様にマウスに投与したところ,肺への転移性をもつがん細胞に由来するエキソソームは肺に,脳への転移性をもつがん細胞に由来するエキソソームは脳に,有意に高く分布することが確認された.エキソソームが特異的な転移先へ分布するだけでなく,その臓器において転移に適するニッチを形成するかどうか検討するため,マウスに肺への転移性をもつ乳がん細胞に由来するエキソソームを3週間にわたり静脈投与し(エキソソームによる肺への転移性の“教育”),そののち,骨への転移性をもつ乳がん細胞を尾静脈あるいは心臓から投与し,肺への転移能について検討した.その結果,いずれの場合においても,がん細胞それ自体は肺への転移能はもたないにもかかわらず,がん細胞は肺へと転移した.以上より,がん細胞に由来するエキソソームの分布には臓器選択性があり,このエキソソームが将来の転移先に取り込まれ転移に適する前転移ニッチを形成することがわかった.
2.がん細胞に由来するエキソソームは発現するインテグリンによりそれぞれの転移先となる臓器において特定の種類の細胞に取り込まれる
エキソソームの分布の臓器特異性がどのように決定されているのか明らかにするため,臓器特異的に転移する6種類のがん細胞に由来するエキソソームに対し,定量的プロテオミクス解析による網羅的な検討を行った.in vivoにおいて臓器特異的にエキソソームが取り込まれたことから,エキソソームにおいて高く発現する細胞接着因子に着目したところ6種類のインテグリンが含まれていた.これらのインテグリンについて,臓器特異性をもつ30種類のがん細胞に由来するエキソソームに対し定性的プロテオミクス解析を行ったところ,がんの種類にはよらず,肺に特異的に転移するがん細胞ではインテグリンα6β4およびインテグリンα6β1,肝臓に特異的に転移するがん細胞ではインテグリンαvβ5,脳に特異的に転移するがん細胞ではインテグリンαvβ3と,転移先の臓器とインテグリンの発現パターンとのあいだに強い関連がみられた.また,エキソソームは,肺においては線維芽細胞および上皮細胞,肝臓においては常駐マクロファージであるクッパー細胞,脳においては血管内皮細胞に選択的に取り込まれた.このことから,エキソソームは臓器特異性とともに,それぞれの臓器において特定の種類の細胞に取り込まれる性質のあることがわかり,エキソソームには臓器別に行き先を決定する“郵便番号”のような役割をはたすインテグリンの発現パターンがあることが示唆された.
3.がん細胞に由来するエキソソームに含まれるインテグリンはエキソソームの取り込みの臓器特異性に寄与する
エキソソームに含まれるインテグリンがエキソソームの分布の臓器特異性において機能しているかどうか検討するため,インテグリンβ4を発現する肺に特異的に転移する乳がん細胞においてインテグリンβ4をノックダウンした.この乳がん細胞に由来するエキソソームにおいてもインテグリンβ4が低下していることを確認したうえで,このエキソソームをマウスに静脈投与したところ肺への取り込みが有意に減少した.インテグリンβ4の阻害ペプチドによりインテグリンβ4を阻害したときにも,同様に肺への取り込みは低下した.さらに,インテグリンβ4を発現しない骨に特異的に転移する乳がん細胞に由来するエキソソームにおいてインテグリンβ4を強制発現させたところ,肺への分布が有意に増加した.同様に,インテグリンβ5を発現する肝臓に特異的に転移する膵がん細胞においてインテグリンβ5をノックダウン,あるいは,その阻害ペプチドにより阻害したところ,この膵がん細胞に由来するエキソソームの肝臓への取り込みは有意に減少した.以上の結果から,エキソソームの肺への取り込みの特異性にはインテグリンα6β4が,肝臓への取り込みの特異性にはインテグリンαvβ5が,寄与していることが明らかにされた.
がん細胞に発現するインテグリンβ4およびエキソソームに含まれるインテグリンβ4がそれぞれ転移能におよぼす影響について検討した.肺に特異的に転移する乳がん細胞におけるインテグリンβ4のノックダウンではがん細胞それ自体の肺への転移能が有意に低下したが,インテグリンβ4の低下したエキソソームによりマウスを3週間にわたり“教育”したのち,このインテグリンβ4をノックダウンした乳がん細胞を投与したところ,肺への転移能に変化はみられなかった.一方で,インテグリンβ4の低下していないエキソソームにより教育したところ,インテグリンβ4をノックダウンした乳がん細胞の肺への転移能は回復した.以上より,肺への転移能はがん細胞それ自体ではなく,エキソソームに含まれるインテグリンβ4に依存することが証明された.
エキソソームがおのおのの臓器において特定の細胞に取り込まれたのち,細胞においてどのような変化がもたらされるのかin vitroにおいて調べた.肺においてエキソソームを取り込む線維芽細胞および上皮細胞を肺に特異的に分布するエキソソームにより,また,肝臓においてエキソソームを取り込むクッパー細胞を肝に特異的に分布するエキソソームにより処理し,それぞれの細胞における遺伝子の発現について調べた結果,炎症性タンパク質をコードするS100遺伝子ファミリーに属するそれぞれ異なる遺伝子の発現が,肺の線維芽細胞およびクッパー細胞において上昇することが確認された.
4.ヒトの血中のエキソソームに含まれるインテグリンを測定することにより転移の臓器特異性を予測できる
がん細胞に由来するエキソソームがインテグリンの発現パターンによる臓器別の“郵便番号”をもち,それが将来の転移先の臓器に分布することから,がん患者の血中のエキソソームからがんの転移先を予測する可能性について検証した.すでに転移のあるがん患者の血液から回収したエキソソームに含まれるインテグリンを定量した結果,乳がん,メラノーマ,横紋筋肉腫,膵臓がんの患者において,すでに肺への転移のある患者の血中のエキソソームは肺への転移のない患者に比べインテグリンα6β4の量が有意に多く,肝臓への転移のある患者の血中のエキソソームは肝臓への転移のない患者に比べインテグリンαvβ5の量が有意に多いことが判明した.それでは,血中のエキソソームから将来の転移先の臓器は予測できるのだろうか.乳がんの患者において,血液を採取したときには転移はなかったが3年以内に肺へ転移した患者と,肺への転移のない患者の血中のエキソソームに含まれるインテグリンβ4の量を比較したところ,肺への転移のみられた患者はインテグリンβ4の量が有意に多かった.また,膵臓がんの患者においても,3年以内に肝臓へ転移した患者の血中のエキソソームに含まれるインテグリンαvβ5の量は,肝臓への転移を起こさなかった患者に比べ有意に多いことがわかった.これらの結果から,がん患者の血中のエキソソームに含まれるインテグリンの量を調べることにより,肺および肝臓への転移を予測する可能性が示唆され,今後,バイオマーカーとして活用されることが期待される.
おわりに
長年にわたり,がん転移の臓器特異性の分子機構は謎とされてきたが,この研究によりその一端が解明された.筆者らは,がん細胞の分泌するエキソソームがそこに含まれるインテグリンの発現パターンにより決定された特定の臓器の特定の細胞に取り込まれ,そこで前転移ニッチを形成することによりがん細胞の臓器特異的な転移を誘導することを証明した(図1).この研究は,がん転移の臓器特異性の分子機構を解明しただけでなく,今後,このエキソソームに含まれるインテグリンをがん患者において転移先を予測するバイオマーカーとして活用する可能性をも示唆した.さらに,エキソソームが転移に適する前転移ニッチを形成することから,エキソソームの臓器への分布を阻害することによる治療も考えられる.この研究により示された新たな知見により,今後,がんの研究がさらに進展し,がん転移の治療にも活かされることを期待したい.
文 献
- Paget, S.: The distribution of secondary growths in cancer of the breast. 1889. Cancer Metastasis Rev., 8, 98-101 (1989)[PubMed]
- Muller, A., Homey, B., Soto, H. et al.: Involvement of chemokine receptors in breast cancer metastasis. Nature, 410, 50-56 (2001)[PubMed]
- Lu, X. & Kang, Y.: Organotropism of breast cancer metastasis. J. Mammary Gland Biol. Neoplasia, 12, 153-162 (2007)[PubMed]
- Minn, A. J., Gupta, G. P., Siegel, P. M. et al.: Genes that mediate breast cancer metastasis to lung. Nature, 436, 518-524 (2005)[PubMed]
- Bos, P. D., Zhang, X. H., Nadal, C. et al.: Genes that mediate breast cancer metastasis to the brain. Nature, 459, 1005-1009 (2009)[PubMed]
- Cox, T. R., Rumney, R. M., Schoof, E. M. et al.: The hypoxic cancer secretome induces pre-metastatic bone lesions through lysyl oxidase. Nature, 522, 106-110 (2015)[PubMed]
- Kaplan, R. N., Riba, R. D., Zacharoulis, S. et al.: VEGFR1-positive haematopoietic bone marrow progenitors initiate the pre-metastatic niche. Nature, 438, 820-827 (2005)[PubMed]
- Hiratsuka, S., Nakamura, K., Iwai, S. et al.: MMP9 induction by vascular endothelial growth factor receptor-1 is involved in lung-specific metastasis. Cancer Cell, 2, 289-300 (2002)[PubMed]
- Thakur, B. K., Zhang, H., Becker, A. et al.: Double-stranded DNA in exosomes: a novel biomarker in cancer detection. Cell Res., 24, 766-769 (2014)[PubMed]
- Peinado, H., Aleckovic, M., Lavotshkin, S. et al.: Melanoma exosomes educate bone marrow progenitor cells toward a pro-metastatic phenotype through MET. Nat. Med., 18, 883-891 (2012)[PubMed]
- Costa-Silva, B., Aiello, N. M., Ocean, A. J. et al.: Pancreatic cancer exosomes initiate pre-metastatic niche formation in the liver. Nat. Cell Biol., 17, 816-826 (2015)[PubMed]
著者プロフィール
略歴:2011年 東京大学大学院新領域創成科学研究科 修了,同年 米国Weill Cornell Medical College(現Weill Cornell Medicine)にてPostdoctoral Fellowを経て,2015年より同Research Associate.
研究テーマ:がんの転移におけるエキソソームの役割.
抱負:局部的にみえる事象(疾病)にインパクトをあたえるシステミックな機構を解明したい.
橋本 彩子(Ayako Hashimoto)
米国Weill Cornell MedicineにてResearch Fellow.
David Lyden
米国Weill Cornell MedicineにてProfessor.
© 2015 星野歩子・橋本彩子・David Lyden Licensed under CC 表示 2.1 日本