ショウジョウバエにおけるモルフォゲンDppによる細胞の増殖および分化のたくみな制御
秋山 琢也
(米国Stowers Institute for Medical Research)
email:秋山琢也
10.7875/first.author.2015.134
Decapentaplegic and growth control in the developing Drosophila wing.
Takuya Akiyama, Matthew C. Gibson
Nature, 527, 375-378 (2015)
生物はどのようにかたちづくられるのだろうか? この問題を理解するうえで,細胞の増殖および運命決定を制御するモルフォゲンは鍵となる重要な分子である.ショウジョウバエのDppはモルフォゲンの機能を解析するモデルとして中心的な役割をはたしてきた.Dppは翅原基の前後部の区画の境界にそった前部側の細胞において産生され,前後軸にそった濃度勾配を形成することにより翅原基におけるパターン形成および細胞増殖を制御すると考えられている.しかしながら,パターン形成の理解に比べ,Dppの濃度勾配がどのように細胞増殖を制御するかについては不明な点が多く議論の的になっていた.今回,筆者らは,CRISPR/Cas9を利用したゲノム編集技術を用いてDppの発現を時空間的に制御する系を構築し,翅原基からDppの濃度勾配を取り除くことによりこの問題に直接的に取り組んだ.その結果,幼虫初期の翅原基においてDppは細胞増殖に必須だが,幼虫後期においてDppの濃度勾配は細胞増殖には必須ではなく,おもにパターン形成を制御していることが明らかにされた.これまで考えられていたモデルとは異なり,幼虫期におけるパターン形成および細胞増殖におけるDppの必要性は時空間的にダイナミックに変化しているのではないかと考えられた.
多細胞生物の発生は受精卵からはじまる.受精卵はいったいどのように増殖し異なる運命を獲得していくのか? 複雑な組織あるいは器官はどのように構築され,最終的に約37兆個の細胞からなる人体がつくりだされるのか? このシンプルかつ重要な問題は長年にわたり多くの発生生物学者を虜にしてきた.そして,ショウジョウバエやマウスなどのモデル生物を用いた研究により,多くの分泌性の増殖シグナル分子がモルフォゲンとしてはたらき,細胞の増殖および分化を制御していることが明らかにされてきた.
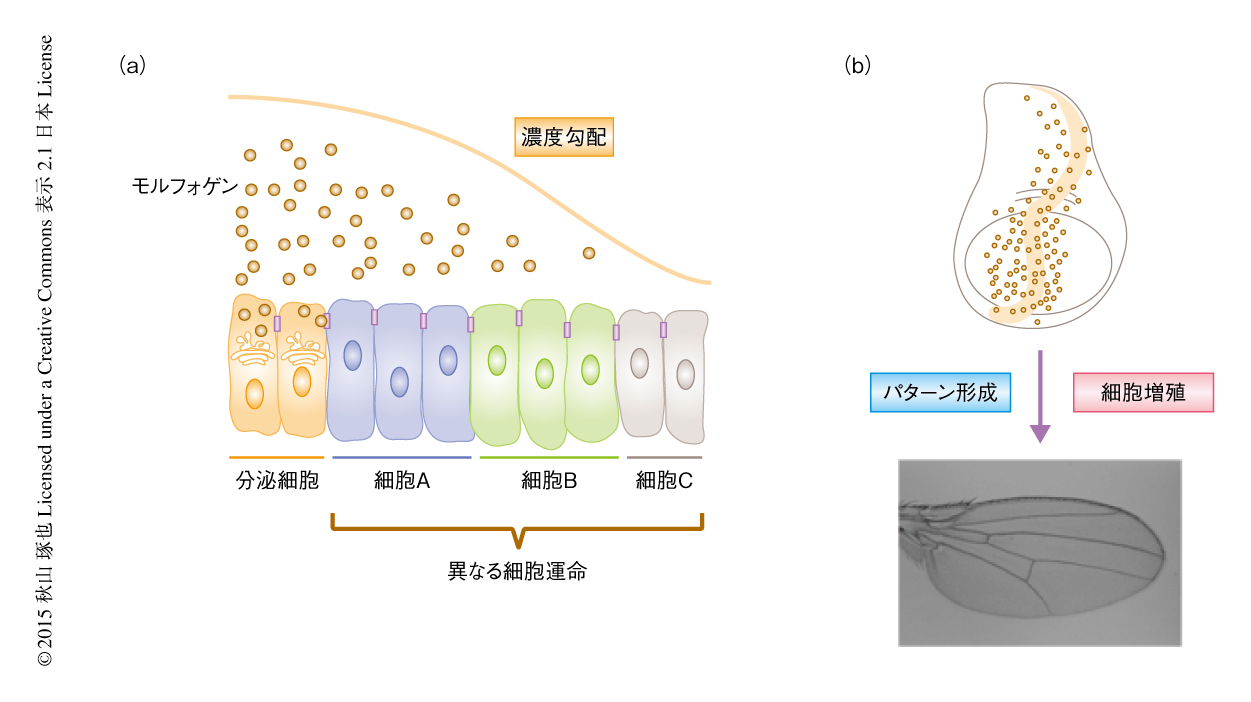
1952年,生物の多種多様かつ複雑な形態形成は仮想上の化学物質“モルフォゲン”の反応拡散により説明することができるという仮説が唱えられた1).この仮説は,1960年代後半から体系的にまとめられモルフォゲン濃度勾配説になった2,3).局在する分泌細胞から産生されたモルフォゲンは未分化の細胞塊において拡散し濃度勾配を形成することにより,細胞に位置情報をあたえ濃度に依存して細胞に異なる分化を導く(図1a).現在,このモルフォゲン濃度勾配説は発生生物学における重要な礎のひとつであるが,この仮説が提唱されてから最初のモルフォゲンの分子実体が発見されるまで,約40年の年月を要している.
1988年,最初のモルフォゲンとしてショウジョウバエにおいてBicoidが同定された.卵の形成の過程においてメスの哺育細胞にて転写され卵母細胞の前側へと輸送されたBicoid遺伝子のmRNAは受精卵において翻訳され,Bicoidは細胞質分裂をともなわないシンシチウム胞胚において前部側から濃度勾配を形成し胚における前後軸のパターン形成を制御する4).そののち1990年代には,分泌型のモルフォゲンとしてショウジョウバエにおいてBMP2/4ホモログであるDppが発見された4).今日まで,BMPのみならず,TGFβ,FGF,Wnt,Hedgehogなど多くの分泌性の細胞増殖シグナル分子が脊椎動物および無脊椎動物の発生の過程においてモルフォゲンとしてはたらき生物のかたちづくりを制御することがわかっている.
ショウジョウバエなどの完全変態昆虫においては,幼虫の体内に成虫の形態づくりのもとになる組織成虫原基が準備されている.1982年,15個の成虫原基が正常に発生できない変異としてdpp変異が見い出された5).Dppのモルフォゲンとしての活性が翅原基をモデルとして証明された大きな要因のひとつとして,1980年代から急速に発展した分子生物学的な手法の貢献は大きい.生体において遺伝子の発現パターンを可視化するin situハイブリダイゼーションや,出芽酵母に由来する組換え配列をショウジョウバエの染色体に導入し組換え酵素を介した体細胞組換えにより変異をもつ細胞クローンを誘導するモザイク技術などを駆使することにより,Dppは翅原基の前後部の区画の境界にそった前部側の細胞から分泌され前後軸にそった濃度勾配を形成し,濃度に依存して標的となる遺伝子の発現を制御することにより翅脈の位置を決定することが明らかにされた(図1b).
幼虫期において,翅原基の細胞は組織にて空間的に均一な細胞分裂をくり返し成虫の翅を形成する準備をしている.それでは,いったいどのようにDppの濃度勾配が均一な細胞分裂を制御するのだろうか? この問題は濃度に依存的な翅原基のパターン形成に比べむずかしい.とくに,翅原基の大きさが2倍以上も大きくなる幼虫後期において,Dppはいかにして均一な細胞増殖を制御するのか? 2000年以降,翅原基の扱いやすさとあいまって,この問題は多くの発生生物学者および数学者の興味をひいた.そして,複数の研究グループから互いにあいいれないモデルが提唱され大きな議論の的になってきた6).たとえば代表的なモデルとして,翅原基の均一な細胞分裂は,相対的なDppの活性により制御されるというモデルと7).Dppと細胞増殖阻害タンパク質との協調により制御されるというモデルとがある8,9).前者のモデルでは,翅原基の個々の細胞はDppの活性を測定しそのレベルが相対的に50%増加するごとに1回の細胞分裂をする.これにより,Dppの濃度に依存せず均一な細胞増殖を達成することができる.後者のモデルでは,Dppは翅原基の中央部においてDppの標的であり細胞増殖阻害タンパク質であるBrkの発現を抑制することにより細胞増殖を促進する.翅原基の側部ではBrkが細胞分裂の頻度を制御し,このDppとBrkを介した翅原基の中央部と側部との協調により均一な細胞増殖が達成されるとする.それでは,どうしてこのように異なるモデルが提唱されたのか?
これまで,Dppはおもに大量発現系を用いて研究されてきた.モルフォゲンの濃度勾配の形成はその発現量および安定性に大きく影響される.そのため,大量発現系を利用して得られた観察の結果は本来のモルフォゲンの濃度勾配を反映していない可能性が高い.このようなおのおのの研究グループの異なる実験アプローチが,相反するモデルの提唱につながったのかもしれない.それでは,なぜシンプルにDppの濃度勾配を翅原基から遺伝学的に取り除いて,その細胞増殖に対する影響を観察しなかったのだろうか? これには,dpp遺伝子のもつ性質が大きくかかわっている.
生物は相同染色体に同じ遺伝子を2つもち,通常,一方の遺伝子に変異が生じても,もうひとつの遺伝子により補われる.しかしながら,dpp遺伝子は片方の遺伝子からつくられる産物では不十分であり,優勢的に表現型を表わすハプロ不全を生じ,1コピーのdpp遺伝子しかもたない個体は胚性致死になる.このため,dpp遺伝子の機能を完全に欠失した変異体を用いて幼虫期においてDppの機能を解析することができなかった.また,内在性のDppの発現を確認する抗体などの手段もなかった.このような状況が,Dppの濃度勾配による細胞増殖の制御において議論をまき起こすひとつの要因になったのかもしれない.
翅原基の前後部の区画の境界にそってDppの発現を検出する抗体を作製した.モザイク技術によりdpp遺伝子の活性を部分的に欠失したハイポモルフィック変異を生じた細胞クローンをDppを発現する領域に誘導してこの抗体の特異性を調べたところ,Dppの発現は変異をもつ細胞クローンにおいていちじるしく低下していた.しかしながら,サイズの大きな細胞クローンをDppを発現する領域に形成させても翅原基の成長にはほとんど影響を及ぼさなかった.このハイポモルフィック変異を用いたモザイク実験の結果は,Dppの濃度勾配は翅原基の細胞増殖において必ずしも必要ではないことを示した.
この実験をdpp遺伝子の機能を完全に欠失した変異体において行うため,CRISPR/Cas9を利用したゲノム編集技術により,dpp遺伝子のコンディショナルノックアウトショウジョウバエを作製した.まず,CRISPR/Cas9によりdpp遺伝子の領域に2本鎖DNA切断を導入し,相同組換え修復機構を利用して2つの組換え配列をdpp遺伝子の上流および下流に順向きに挿入した.このコンディショナルノックアウトショウジョウバエは組換え酵素の活性のない状態ではdpp遺伝子をホモでもつため,野生型と変わらない形質をもつ.そのため,組換え酵素の発現を時間的あるいは空間的に制御することによりdpp遺伝子を完全に破壊することができる.また,この方法により,dpp遺伝子のハプロ不全の問題を克服し,幼虫期および成虫期におけるDppの機能の解析が可能になった.
幼虫の初期において組織の全体にてDppの発現を欠失させると,これまでの知見と一致して,翅原基は成長不全になった5).また,この結果からdpp遺伝子のコンディショナルノックアウト系がショウジョウバエにおいてはたらいていることが示された.幼虫後期におけるDppの濃度勾配の細胞増殖への影響について調べるため,組換え酵素の発現を翅原基の前後部の区画の境界において特異的に誘導した.産卵後72時間から120時間にかけてDppの発現およびDppシグナルの活性を継時的にモニターした結果,Dppの濃度勾配が幼虫後期をとおして正常に形成されず,パターン形成に異常をきたすことがわかった.しかしながら,これまでのDppの濃度勾配による細胞増殖の制御のモデルとは異なり,この濃度勾配は細胞増殖には必須でないことが示された.Dppの濃度勾配を完全に欠失した翅原基はほぼ正常な大きさにまで成長し,幼虫後期におけるDppの濃度勾配の主要な役割はパターン形成であることが明らかにされた.
Nature誌のこの論文と同じ号には,異なる遺伝学的な手法により同じ問題に取り組んだ論文が掲載された10).手法の違いのためか,すべての結論において一致はしてないが,翅原基における均一な細胞分裂はDppの濃度勾配に依存して制御されていないことが示された.
今回,筆者らは,幼虫初期においてDppは細胞増殖に必要不可欠だが,大きさが2倍以上も大きくなる幼虫後期の翅原基においてDppの濃度勾配は細胞増殖には必須でなく,パターン形成を制御していることを明らかにした.これまで考えられていたモデルとは異なり,Dppの役割は幼虫期をとおして時間的にも空間的にもダイナミックに変化していると思われた.モルフォゲンとしてはたらくほかの分泌性の細胞増殖シグナル分子もDppと同じように細胞の増殖および運命決定をつねに同時に制御しているのではなく,発生の時期に応じてその役割をたくみに変化させることにより生物をかたちづくっているのかもしれない.
近年,CRISPR/Cas9を利用したゲノム編集技術に代表される分子生物学的な手法,また,生体分子の機能や動態を可視化する技術などの発展がいちじるしい.今後,これら最新の手法を駆使して幹細胞,再生医学,エピジェネティクスなどの研究がますます進んでいくであろう.しかし,筆者は,“温故知新”という故事成語にあるように,このような最先端の技術を用いて先人たちが発見した問題や完全に解けなかった謎に取り組むこと,そして,モルフォゲンによる細胞増殖や分化の制御のような教科書的な事実を鵜呑みにせず,まだそこに存在する未解決の重要な問題を研究することも,これからのサイエンスのひとつの方向性だと考える.そして,そのような研究から得られる“故くて新しい学問”があると信じている.
略歴:2003年 東京都立大学大学院理学研究科にて博士号取得,米国Minnesota大学 博士研究員,米国Brown大学 博士研究員を経て,米国Stowers Institute for Medical Research博士研究員.
研究テーマ:BMPによる細胞増殖および分化の制御機構.
抱負:流行りに左右されず,己が大切だと信じる研究をつづけ,自ら新たなトレンドをつくりだしたい.
© 2015 秋山 琢也 Licensed under CC 表示 2.1 日本
(米国Stowers Institute for Medical Research)
email:秋山琢也
10.7875/first.author.2015.134
Decapentaplegic and growth control in the developing Drosophila wing.
Takuya Akiyama, Matthew C. Gibson
Nature, 527, 375-378 (2015)
この論文に出現する遺伝子・タンパク質のUniprot ID
Dpp(P07713), Bicoid(P09081), BMP2(P12643), /4(P12644), BMP, TGFβ, FGF, Wnt, Hedgehog, dpp(P07713), Brk(Q9XTN4)
要 約
生物はどのようにかたちづくられるのだろうか? この問題を理解するうえで,細胞の増殖および運命決定を制御するモルフォゲンは鍵となる重要な分子である.ショウジョウバエのDppはモルフォゲンの機能を解析するモデルとして中心的な役割をはたしてきた.Dppは翅原基の前後部の区画の境界にそった前部側の細胞において産生され,前後軸にそった濃度勾配を形成することにより翅原基におけるパターン形成および細胞増殖を制御すると考えられている.しかしながら,パターン形成の理解に比べ,Dppの濃度勾配がどのように細胞増殖を制御するかについては不明な点が多く議論の的になっていた.今回,筆者らは,CRISPR/Cas9を利用したゲノム編集技術を用いてDppの発現を時空間的に制御する系を構築し,翅原基からDppの濃度勾配を取り除くことによりこの問題に直接的に取り組んだ.その結果,幼虫初期の翅原基においてDppは細胞増殖に必須だが,幼虫後期においてDppの濃度勾配は細胞増殖には必須ではなく,おもにパターン形成を制御していることが明らかにされた.これまで考えられていたモデルとは異なり,幼虫期におけるパターン形成および細胞増殖におけるDppの必要性は時空間的にダイナミックに変化しているのではないかと考えられた.
はじめに
多細胞生物の発生は受精卵からはじまる.受精卵はいったいどのように増殖し異なる運命を獲得していくのか? 複雑な組織あるいは器官はどのように構築され,最終的に約37兆個の細胞からなる人体がつくりだされるのか? このシンプルかつ重要な問題は長年にわたり多くの発生生物学者を虜にしてきた.そして,ショウジョウバエやマウスなどのモデル生物を用いた研究により,多くの分泌性の増殖シグナル分子がモルフォゲンとしてはたらき,細胞の増殖および分化を制御していることが明らかにされてきた.
1.モルフォゲンの発見
1952年,生物の多種多様かつ複雑な形態形成は仮想上の化学物質“モルフォゲン”の反応拡散により説明することができるという仮説が唱えられた1).この仮説は,1960年代後半から体系的にまとめられモルフォゲン濃度勾配説になった2,3).局在する分泌細胞から産生されたモルフォゲンは未分化の細胞塊において拡散し濃度勾配を形成することにより,細胞に位置情報をあたえ濃度に依存して細胞に異なる分化を導く(図1a).現在,このモルフォゲン濃度勾配説は発生生物学における重要な礎のひとつであるが,この仮説が提唱されてから最初のモルフォゲンの分子実体が発見されるまで,約40年の年月を要している.
1988年,最初のモルフォゲンとしてショウジョウバエにおいてBicoidが同定された.卵の形成の過程においてメスの哺育細胞にて転写され卵母細胞の前側へと輸送されたBicoid遺伝子のmRNAは受精卵において翻訳され,Bicoidは細胞質分裂をともなわないシンシチウム胞胚において前部側から濃度勾配を形成し胚における前後軸のパターン形成を制御する4).そののち1990年代には,分泌型のモルフォゲンとしてショウジョウバエにおいてBMP2/4ホモログであるDppが発見された4).今日まで,BMPのみならず,TGFβ,FGF,Wnt,Hedgehogなど多くの分泌性の細胞増殖シグナル分子が脊椎動物および無脊椎動物の発生の過程においてモルフォゲンとしてはたらき生物のかたちづくりを制御することがわかっている.
2.ショウジョウバエのモルフォゲンDpp
ショウジョウバエなどの完全変態昆虫においては,幼虫の体内に成虫の形態づくりのもとになる組織成虫原基が準備されている.1982年,15個の成虫原基が正常に発生できない変異としてdpp変異が見い出された5).Dppのモルフォゲンとしての活性が翅原基をモデルとして証明された大きな要因のひとつとして,1980年代から急速に発展した分子生物学的な手法の貢献は大きい.生体において遺伝子の発現パターンを可視化するin situハイブリダイゼーションや,出芽酵母に由来する組換え配列をショウジョウバエの染色体に導入し組換え酵素を介した体細胞組換えにより変異をもつ細胞クローンを誘導するモザイク技術などを駆使することにより,Dppは翅原基の前後部の区画の境界にそった前部側の細胞から分泌され前後軸にそった濃度勾配を形成し,濃度に依存して標的となる遺伝子の発現を制御することにより翅脈の位置を決定することが明らかにされた(図1b).
3.Dppの濃度勾配による細胞増殖の制御
幼虫期において,翅原基の細胞は組織にて空間的に均一な細胞分裂をくり返し成虫の翅を形成する準備をしている.それでは,いったいどのようにDppの濃度勾配が均一な細胞分裂を制御するのだろうか? この問題は濃度に依存的な翅原基のパターン形成に比べむずかしい.とくに,翅原基の大きさが2倍以上も大きくなる幼虫後期において,Dppはいかにして均一な細胞増殖を制御するのか? 2000年以降,翅原基の扱いやすさとあいまって,この問題は多くの発生生物学者および数学者の興味をひいた.そして,複数の研究グループから互いにあいいれないモデルが提唱され大きな議論の的になってきた6).たとえば代表的なモデルとして,翅原基の均一な細胞分裂は,相対的なDppの活性により制御されるというモデルと7).Dppと細胞増殖阻害タンパク質との協調により制御されるというモデルとがある8,9).前者のモデルでは,翅原基の個々の細胞はDppの活性を測定しそのレベルが相対的に50%増加するごとに1回の細胞分裂をする.これにより,Dppの濃度に依存せず均一な細胞増殖を達成することができる.後者のモデルでは,Dppは翅原基の中央部においてDppの標的であり細胞増殖阻害タンパク質であるBrkの発現を抑制することにより細胞増殖を促進する.翅原基の側部ではBrkが細胞分裂の頻度を制御し,このDppとBrkを介した翅原基の中央部と側部との協調により均一な細胞増殖が達成されるとする.それでは,どうしてこのように異なるモデルが提唱されたのか?
4.これまでのDppの研究における問題点
これまで,Dppはおもに大量発現系を用いて研究されてきた.モルフォゲンの濃度勾配の形成はその発現量および安定性に大きく影響される.そのため,大量発現系を利用して得られた観察の結果は本来のモルフォゲンの濃度勾配を反映していない可能性が高い.このようなおのおのの研究グループの異なる実験アプローチが,相反するモデルの提唱につながったのかもしれない.それでは,なぜシンプルにDppの濃度勾配を翅原基から遺伝学的に取り除いて,その細胞増殖に対する影響を観察しなかったのだろうか? これには,dpp遺伝子のもつ性質が大きくかかわっている.
生物は相同染色体に同じ遺伝子を2つもち,通常,一方の遺伝子に変異が生じても,もうひとつの遺伝子により補われる.しかしながら,dpp遺伝子は片方の遺伝子からつくられる産物では不十分であり,優勢的に表現型を表わすハプロ不全を生じ,1コピーのdpp遺伝子しかもたない個体は胚性致死になる.このため,dpp遺伝子の機能を完全に欠失した変異体を用いて幼虫期においてDppの機能を解析することができなかった.また,内在性のDppの発現を確認する抗体などの手段もなかった.このような状況が,Dppの濃度勾配による細胞増殖の制御において議論をまき起こすひとつの要因になったのかもしれない.
5.Dppによる発生の過程に特異的な細胞の増殖および運命決定の制御
翅原基の前後部の区画の境界にそってDppの発現を検出する抗体を作製した.モザイク技術によりdpp遺伝子の活性を部分的に欠失したハイポモルフィック変異を生じた細胞クローンをDppを発現する領域に誘導してこの抗体の特異性を調べたところ,Dppの発現は変異をもつ細胞クローンにおいていちじるしく低下していた.しかしながら,サイズの大きな細胞クローンをDppを発現する領域に形成させても翅原基の成長にはほとんど影響を及ぼさなかった.このハイポモルフィック変異を用いたモザイク実験の結果は,Dppの濃度勾配は翅原基の細胞増殖において必ずしも必要ではないことを示した.
この実験をdpp遺伝子の機能を完全に欠失した変異体において行うため,CRISPR/Cas9を利用したゲノム編集技術により,dpp遺伝子のコンディショナルノックアウトショウジョウバエを作製した.まず,CRISPR/Cas9によりdpp遺伝子の領域に2本鎖DNA切断を導入し,相同組換え修復機構を利用して2つの組換え配列をdpp遺伝子の上流および下流に順向きに挿入した.このコンディショナルノックアウトショウジョウバエは組換え酵素の活性のない状態ではdpp遺伝子をホモでもつため,野生型と変わらない形質をもつ.そのため,組換え酵素の発現を時間的あるいは空間的に制御することによりdpp遺伝子を完全に破壊することができる.また,この方法により,dpp遺伝子のハプロ不全の問題を克服し,幼虫期および成虫期におけるDppの機能の解析が可能になった.
幼虫の初期において組織の全体にてDppの発現を欠失させると,これまでの知見と一致して,翅原基は成長不全になった5).また,この結果からdpp遺伝子のコンディショナルノックアウト系がショウジョウバエにおいてはたらいていることが示された.幼虫後期におけるDppの濃度勾配の細胞増殖への影響について調べるため,組換え酵素の発現を翅原基の前後部の区画の境界において特異的に誘導した.産卵後72時間から120時間にかけてDppの発現およびDppシグナルの活性を継時的にモニターした結果,Dppの濃度勾配が幼虫後期をとおして正常に形成されず,パターン形成に異常をきたすことがわかった.しかしながら,これまでのDppの濃度勾配による細胞増殖の制御のモデルとは異なり,この濃度勾配は細胞増殖には必須でないことが示された.Dppの濃度勾配を完全に欠失した翅原基はほぼ正常な大きさにまで成長し,幼虫後期におけるDppの濃度勾配の主要な役割はパターン形成であることが明らかにされた.
おわりに
Nature誌のこの論文と同じ号には,異なる遺伝学的な手法により同じ問題に取り組んだ論文が掲載された10).手法の違いのためか,すべての結論において一致はしてないが,翅原基における均一な細胞分裂はDppの濃度勾配に依存して制御されていないことが示された.
今回,筆者らは,幼虫初期においてDppは細胞増殖に必要不可欠だが,大きさが2倍以上も大きくなる幼虫後期の翅原基においてDppの濃度勾配は細胞増殖には必須でなく,パターン形成を制御していることを明らかにした.これまで考えられていたモデルとは異なり,Dppの役割は幼虫期をとおして時間的にも空間的にもダイナミックに変化していると思われた.モルフォゲンとしてはたらくほかの分泌性の細胞増殖シグナル分子もDppと同じように細胞の増殖および運命決定をつねに同時に制御しているのではなく,発生の時期に応じてその役割をたくみに変化させることにより生物をかたちづくっているのかもしれない.
近年,CRISPR/Cas9を利用したゲノム編集技術に代表される分子生物学的な手法,また,生体分子の機能や動態を可視化する技術などの発展がいちじるしい.今後,これら最新の手法を駆使して幹細胞,再生医学,エピジェネティクスなどの研究がますます進んでいくであろう.しかし,筆者は,“温故知新”という故事成語にあるように,このような最先端の技術を用いて先人たちが発見した問題や完全に解けなかった謎に取り組むこと,そして,モルフォゲンによる細胞増殖や分化の制御のような教科書的な事実を鵜呑みにせず,まだそこに存在する未解決の重要な問題を研究することも,これからのサイエンスのひとつの方向性だと考える.そして,そのような研究から得られる“故くて新しい学問”があると信じている.
文 献
- Turing, A. M.: The chemical basis of morphogenesis. Philos. Trans. R. Soc. Lond. B. Biol. Sci., 237, 37-72 (1952)
- Wolpert, L.: Positional information and the spatial pattern of cellular differentiation. J. Theor. Biol., 25, 1-47 (1969)[PubMed]
- Crick, F.: Diffusion in embryogenesis. Nature, 225, 420-422 (1970)[PubMed]
- Akiyama, T. & Gibson, M. C.: Morphogen transport: theoretical and experimental controversies. Wiley Interdiscip. Rev. Dev. Biol., 4, 99-112 (2015)[PubMed]
- Spencer, F. A., Hoffmann, F. M. & Gelbart, W. M.: Decapentaplegic: a gene complex affecting morphogenesis in Drosophila melanogaster. Cell, 28, 451-461(1982)[PubMed]
- Restrepo, S., Zartman, J. J. & Basler, K.: Coordination of patterning and growth by the morphogen DPP. Curr. Biol., 24, R245-R255 (2014)[PubMed]
- Wartlick, O., Julicher, F. & Gonzalez-Gaitan, M.: Dynamics of Dpp signaling and proliferation control. Science, 331, 1154-1159 (2011)[PubMed]
- Schwank, G., Restrepo, S. & Basler, K.: Growth regulation by Dpp: an essential role for Brinker and a non-essential role for graded signaling levels. Development, 135, 4003-4013 (2008)[PubMed]
- Schwank, G., Yang, S. F., Restrepo, S. et al.: Comment on "Dynamics of dpp signaling and proliferation control". Science, 335, 401 (2012)[PubMed]
- Harmansa, S., Hamaratoglu, F., Affolter, M. et al.: Dpp spreading is required for medial but not for lateral wing disc growth. Nature, 527, 317-322 (2015)[PubMed]
著者プロフィール
略歴:2003年 東京都立大学大学院理学研究科にて博士号取得,米国Minnesota大学 博士研究員,米国Brown大学 博士研究員を経て,米国Stowers Institute for Medical Research博士研究員.
研究テーマ:BMPによる細胞増殖および分化の制御機構.
抱負:流行りに左右されず,己が大切だと信じる研究をつづけ,自ら新たなトレンドをつくりだしたい.
© 2015 秋山 琢也 Licensed under CC 表示 2.1 日本