REI-1は線虫の初期胚においてRAB-11の局在および機能を制御するGEFである
坂口愛沙1・佐藤美由紀2・佐藤 健1
(群馬大学生体調節研究所 1細胞構造分野,2生体膜機能分野)
email:坂口愛沙,佐藤 健
DOI: 10.7875/first.author.2015.131
REI-1 is a guanine nucleotide exchange factor regulating RAB-11 localization and function in C. elegans embryos.
Aisa Sakaguchi, Miyuki Sato, Katsuya Sato, Keiko Gengyo-Ando, Tomohiro Yorimitsu, Junichi Nakai, Taichi Hara, Ken Sato, Ken Sato
Developmental Cell, 35, 211-221 (2015)
低分子量GTPaseであるRab11は,細胞における局在をダイナミックに変化させながら,膜タンパク質のエンドソームからのリサイクリングおよび分泌,細胞質分裂など,多様な生理機能を制御する.筆者らは,線虫のRab11と結合する新規のタンパク質としてREI-1を同定し,REI-1はRab11に対するGEFとしてはたらくことを明らかにした.また,REI-1のヒトにおけるホモログであるSH3BP5もRab11に対し強いGEF活性をもっていた.REI-1およびSH3BP5は既知のRab-GEFドメインをもたないことから,Rabに対するまったく新しいタイプのGEFであると考えられた.REI-1は線虫の生殖腺において発現しており,後期ゴルジ体においてRAB-11と共局在していた.REI-1の欠損変異体では,初期胚におけるRAB-11の後期ゴルジ体およびリサイクリングエンドソームへの局在が低下していた.さらに,細胞分裂の際にRAB-11が分裂溝に適切に局在せず,細胞質分裂の遅延がみられた.以上の結果から,REI-1は線虫の初期胚においてRAB-11の局在および機能を特異的に制御するRAB-11に対するGEFであると結論づけた.
Rab/Ypt低分子量GTPaseファミリータンパク質は酵母から哺乳動物まで高度に保存されており,膜輸送,オルガネラの動態,細胞質分裂などにおいて多様な機能をもつ.ヒトには60種類以上のRabが存在し,このうちRab11は細胞膜とエンドソームとのあいだの膜タンパク質のリサイクリングおよび分泌,細胞の移動,細胞分裂など,生命にとり非常に重要な役割を担う.RabはGEF(guanine nucleotide exchange factor,グアニンヌクレオチド交換因子)によりGDP結合型からGTP結合型へと変換されることにより,さまざまなエフェクタータンパク質を介し活性を示す1,2).これまで,数種類のRabに対するGEFが明らかにされているが,そのアミノ酸配列や構造には多様性があり,さらに,Rab11に対するGEFは同定されていなかった.
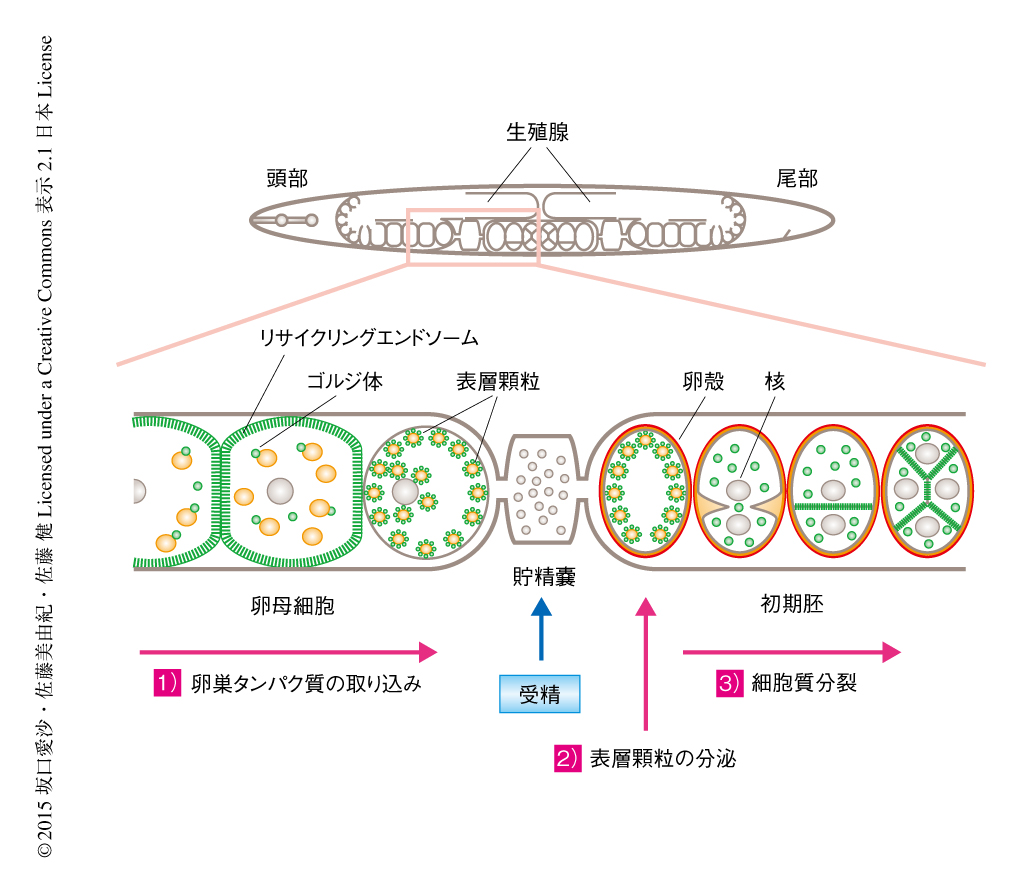
線虫のRab11であるRAB-11.1は,卵母細胞においてはおもにリサイクリングエンドソームおよびゴルジ体に局在し,卵黄タンパク質受容体のリサイクリングを制御し栄養分の取り込みに寄与しているが,受精の直前になると細胞外マトリックス成分を含有する表層顆粒へ移動して受精の直後の表層顆粒の分泌を制御する3,4)(図1).表層顆粒の分泌は卵殻の形成に必須である.初期胚において,RAB-11.1はリサイクリングエンドソームおよびゴルジ体に再局在し,細胞分裂のときには分裂溝に集積して細胞質分裂を制御する5).このRAB-11.1の機能を制御するタンパク質を同定するため,GDP結合変異型のRAB-11.1と結合するタンパク質を酵母ツーハイブリッド法により探索した.その結果,RAB-11.1と結合する新規のタンパク質としてREI-1およびそのホモログであるREI-2が同定された.
REI-1はタンパク質ファミリーを形成しており,ヒトやショウジョウバエにおいても保存されていた6,7).REI-2およびヒトにおけるホモログであるSH3BP5は,長いヘリックス構造を形成するF-BARドメインあるいはBARドメインをもち,REI-1にも類似したヘリックス構造が存在した.F-BARドメインおよびBARドメインは,二量体化,脂質との結合,膜の曲率の感知などに機能することが示唆されている8).酵母ツーハイブリッド法により結合のパターンを解析した結果,REI-1とREI-2とは結合しないが,REI-1どうし,および,REI-2どうしは結合することがわかった.そこで,ゲルろ過クロマトグラフィーにより組換えREI-1の分子量を調べたところ,二量体,四量体,および,多量体を形成したときの分子量に対応する位置に検出された.これらの結果から,REI-1はホモ二量体もしくは多量体を形成すると考えられた.
REI-1はGTP結合型のRAB-11.1よりも,GDP結合型のRAB-11.1,および,GTPあるいはGDPと結合しない変異型RAB-11.1と強く結合し,これは既知のRabに対するGEFとRabとの結合のパターンと同様であった.そこで,蛍光標識したGDPアナログとリポソームを用いたin vitro GEFアッセイにより9),RAB-11.1からのGDPの放出の速度を測定した.その結果,REI-1はRAB-11.1に対し強いGEF活性を示すことが判明した.このREI-1のRAB-11.1に対するGEF活性はリポソームに依存しており,膜構造の重要性が示唆された.そこで,REI-1が膜に直接的に結合する可能性についてスクロース勾配フローテーションアッセイにより調べた結果,REI-1はリポソームと直接的に結合する能力をもつことが判明した.また,REI-1ファミリータンパク質がF-BARドメインやBARドメインに類似したヘリックス構造をもつことから,大きさの異なるリポソームを用いてREI-1の活性が膜の曲率に依存するかどうかについて調べた.しかしながら,直径50 nmのリポソームと直径400 nmのリポソームとで違いがみられなかったことから,少なくともin vitro GEFアッセイからは,膜の曲率はREI-1のGEF活性に影響しないと考えられた.
ヒトにおけるホモログであるSH3BP5はSabともよばれ,無ガンマグロブリン血症において変異の報告されているBtkのSH3ドメインと結合するタンパク質として発見された7).REI-1の機能が哺乳動物におけるホモログでも保存されているかどうか調べた結果,SH3BP5もGDP結合型,および,GTPあるいはGDPと結合していないヒトのRab11と強く結合することがわかった.また,SH3BP5はリポソームの非存在下においてもRab11に対しGEF活性を示し,リポソームをくわえることによりその活性は増強した.線虫のREI-1もヒトのRab11に対し強いGEF活性を示したことから,REI-1のGEFとしての機能は種をこえて保存されていると考えられた.
REI-1の発現および細胞における局在について調べるため,線虫においてGFPとREI-1との融合タンパク質をrei-1遺伝子のプロモーターの制御のもと発現させたところ,おもに生殖腺において発現がみられた.GFP-REI-1融合タンパク質は卵母細胞においては表層顆粒やドット状のゴルジ体に局在し,一部はRAB-11.1と共局在した.初期胚においてはおもにドット状の局在を示し,後期ゴルジ体のマーカーであるSYN-16 10) と共局在した.また,REI-1およびSYN-16のシグナルはRAB-11.1とも共局在したことから,REI-1は後期ゴルジ体においてRAB-11.1と共局在していると考えられた.ただし,RAB-11.1のシグナルはREI-1およびSYN-16よりも広い範囲にみられたことから,一部のRAB-11.1は輸送小胞あるいはリサイクリングエンドソームなどゴルジ体よりさきのコンパートメントに局在していると考えられた.
線虫におけるREI-1ファミリータンパク質の機能を調べるため,REI-1とそのホモログであるREI-2の欠失変異体を作製した.rei-1変異体およびrei-2変異体は野生型と同様の生育および産仔の数を示したが,rei-1;rei-2二重変異体においては産仔の数が3割ほど減少した.RAB-11.1の局在に対する影響について調べたところ,rei-1変異体の初期胚においてはRAB-11.1のドット状の局在がほとんどみられなくなった.このとき,胚の全体におけるGFP-RAB-11.1のシグナルおよび発現量に変化はなかったことから,rei-1変異体においてはRAB-11.1のゴルジ体やリサイクリングエンドソームへの局在が阻害されていると考えられた.このようなRAB-11.1の局在の異常はrei-2変異体においてはほとんどみられなかったが,rei-1;rei-2二重変異体においてはrei-1変異体に比べ増強していた.rei-1変異体およびrei-2変異体において,初期エンドソームのマーカーであるRAB-5および後期ゴルジ体のマーカーであるSYN-16の分布および卵母細胞におけるRAB-11.1の局在に異常はみられなかったことから,REI-1ファミリータンパク質はおもに初期胚においてRAB-11.1の局在を特異的に制御すると考えられた.また,rei-1;rei-2二重変異体の初期胚の抽出物を超遠心により分画したところ,膜の画分とサイトゾルの画分とのRAB-11.1の量比は野生型と変わらなかった.このことから,rei-1;rei-2二重変異体においてRAB-11.1は,特異的には局在できないが,なんらかの膜構造に結合していると思われた.
線虫の初期胚や動物の培養細胞において,Rab11は細胞分裂のときには分裂溝に集積し細胞質分裂にはたらくことが知られている5).そこで,rei-1変異体およびrei-2変異体において細胞分裂の際のRAB-11.1の局在について調べた.その結果,rei-1変異体では細胞質分裂の際に細胞膜の陥入は起こったが,RAB-11.1がドット状や分裂溝に局在せず,細胞質分裂の遅延がみられた.細胞質分裂の際のRAB-11.1の局在の異常および細胞質分裂の遅延は,rei-2変異体ではほとんどみられなかったが,rei-1;rei-2二重変異体では増強していた.これらの結果から,REI-1ファミリータンパク質は初期胚の細胞分裂においてRAB-11.1の局在を制御し,適切な細胞質分裂に寄与していることがわかった.このとき,REI-1やゴルジ体マーカーであるSYN-16は分裂溝に局在しなかったことから,後期ゴルジ体におけるREI-1によるGTP型への変換ののち,RAB-11.1が分裂溝に局在するというモデルが考えられた(図2).
筆者らは,この研究において,RAB-11に対する新規のGEFとしてREI-1を同定した.REI-1ファミリータンパク質は既知のRab-GEFドメインをもたない新しいタイプのRabに対するGEFであった.興味深いことに,REI-1ファミリータンパク質は二量体化や脂質との結合などに関与するF-BARドメインおよびBARドメインをもつ.REI-1はBARドメインをもつ既知のタンパク質と同様に,ホモ二量体を形成して膜に直接的に結合する能力をもっていたことから,F-BARドメインおよびBARドメインはREI-1ファミリータンパク質の特異的な膜への局在を介し,Rab11の活性化の空間的な制御に寄与しているのかもしれない.さらに,REI-1ファミリータンパク質はリポソームの存在のもとでGEF活性が増強したことから,膜への結合がGEF活性を制御する可能性も考えられた.
この研究により,REI-1は細胞分裂のときにもRAB-11の局在を制御し,適切な細胞質分裂に寄与することが明らかにされた.細胞のなかでもとくに大きな初期胚の細胞質分裂には,表面積の増加にともない多量の膜成分の挿入が必要になる.線虫の初期胚において,ブレフェルジンAによる小胞体からゴルジ体への輸送の阻害,および,RAB-11の欠失が細胞質分裂の異常をひき起こすことがわかっている.REI-1はゴルジ体におけるRAB-11のGTP結合型への変換を介してRAB-11を含むポストゴルジ小胞の分裂溝への輸送を促進し,適したタイミングでの多量の膜成分の供給に寄与している可能性がある(図2).REI-1ファミリータンパク質のさらなる解析は,Rab11の機能を時空間的に制御する分子機構の理解につながると期待される.
略歴:2007年 名古屋大学大学院理学研究科博士課程 修了,米国Ohio州立大学 ポスドク研究員,米国North Carolina大学 ポスドク研究員,群馬大学生体調節研究所 助教を経て,2015年より大阪大学大学院理学研究科 助教.
佐藤 美由紀(Miyuki Sato)
群馬大学生体調節研究所 准教授.
佐藤 健(Ken Sato)
群馬大学生体調節研究所 教授.
研究室URL:http://traffic.dept.med.gunma-u.ac.jp/
© 2015 坂口愛沙・佐藤美由紀・佐藤 健 Licensed under CC 表示 2.1 日本
(群馬大学生体調節研究所 1細胞構造分野,2生体膜機能分野)
email:坂口愛沙,佐藤 健
DOI: 10.7875/first.author.2015.131
REI-1 is a guanine nucleotide exchange factor regulating RAB-11 localization and function in C. elegans embryos.
Aisa Sakaguchi, Miyuki Sato, Katsuya Sato, Keiko Gengyo-Ando, Tomohiro Yorimitsu, Junichi Nakai, Taichi Hara, Ken Sato, Ken Sato
Developmental Cell, 35, 211-221 (2015)
要 約
低分子量GTPaseであるRab11は,細胞における局在をダイナミックに変化させながら,膜タンパク質のエンドソームからのリサイクリングおよび分泌,細胞質分裂など,多様な生理機能を制御する.筆者らは,線虫のRab11と結合する新規のタンパク質としてREI-1を同定し,REI-1はRab11に対するGEFとしてはたらくことを明らかにした.また,REI-1のヒトにおけるホモログであるSH3BP5もRab11に対し強いGEF活性をもっていた.REI-1およびSH3BP5は既知のRab-GEFドメインをもたないことから,Rabに対するまったく新しいタイプのGEFであると考えられた.REI-1は線虫の生殖腺において発現しており,後期ゴルジ体においてRAB-11と共局在していた.REI-1の欠損変異体では,初期胚におけるRAB-11の後期ゴルジ体およびリサイクリングエンドソームへの局在が低下していた.さらに,細胞分裂の際にRAB-11が分裂溝に適切に局在せず,細胞質分裂の遅延がみられた.以上の結果から,REI-1は線虫の初期胚においてRAB-11の局在および機能を特異的に制御するRAB-11に対するGEFであると結論づけた.
はじめに
Rab/Ypt低分子量GTPaseファミリータンパク質は酵母から哺乳動物まで高度に保存されており,膜輸送,オルガネラの動態,細胞質分裂などにおいて多様な機能をもつ.ヒトには60種類以上のRabが存在し,このうちRab11は細胞膜とエンドソームとのあいだの膜タンパク質のリサイクリングおよび分泌,細胞の移動,細胞分裂など,生命にとり非常に重要な役割を担う.RabはGEF(guanine nucleotide exchange factor,グアニンヌクレオチド交換因子)によりGDP結合型からGTP結合型へと変換されることにより,さまざまなエフェクタータンパク質を介し活性を示す1,2).これまで,数種類のRabに対するGEFが明らかにされているが,そのアミノ酸配列や構造には多様性があり,さらに,Rab11に対するGEFは同定されていなかった.
1.線虫のREI-1はRAB-11に特異的にはたらくGEFである
線虫のRab11であるRAB-11.1は,卵母細胞においてはおもにリサイクリングエンドソームおよびゴルジ体に局在し,卵黄タンパク質受容体のリサイクリングを制御し栄養分の取り込みに寄与しているが,受精の直前になると細胞外マトリックス成分を含有する表層顆粒へ移動して受精の直後の表層顆粒の分泌を制御する3,4)(図1).表層顆粒の分泌は卵殻の形成に必須である.初期胚において,RAB-11.1はリサイクリングエンドソームおよびゴルジ体に再局在し,細胞分裂のときには分裂溝に集積して細胞質分裂を制御する5).このRAB-11.1の機能を制御するタンパク質を同定するため,GDP結合変異型のRAB-11.1と結合するタンパク質を酵母ツーハイブリッド法により探索した.その結果,RAB-11.1と結合する新規のタンパク質としてREI-1およびそのホモログであるREI-2が同定された.
REI-1はタンパク質ファミリーを形成しており,ヒトやショウジョウバエにおいても保存されていた6,7).REI-2およびヒトにおけるホモログであるSH3BP5は,長いヘリックス構造を形成するF-BARドメインあるいはBARドメインをもち,REI-1にも類似したヘリックス構造が存在した.F-BARドメインおよびBARドメインは,二量体化,脂質との結合,膜の曲率の感知などに機能することが示唆されている8).酵母ツーハイブリッド法により結合のパターンを解析した結果,REI-1とREI-2とは結合しないが,REI-1どうし,および,REI-2どうしは結合することがわかった.そこで,ゲルろ過クロマトグラフィーにより組換えREI-1の分子量を調べたところ,二量体,四量体,および,多量体を形成したときの分子量に対応する位置に検出された.これらの結果から,REI-1はホモ二量体もしくは多量体を形成すると考えられた.
REI-1はGTP結合型のRAB-11.1よりも,GDP結合型のRAB-11.1,および,GTPあるいはGDPと結合しない変異型RAB-11.1と強く結合し,これは既知のRabに対するGEFとRabとの結合のパターンと同様であった.そこで,蛍光標識したGDPアナログとリポソームを用いたin vitro GEFアッセイにより9),RAB-11.1からのGDPの放出の速度を測定した.その結果,REI-1はRAB-11.1に対し強いGEF活性を示すことが判明した.このREI-1のRAB-11.1に対するGEF活性はリポソームに依存しており,膜構造の重要性が示唆された.そこで,REI-1が膜に直接的に結合する可能性についてスクロース勾配フローテーションアッセイにより調べた結果,REI-1はリポソームと直接的に結合する能力をもつことが判明した.また,REI-1ファミリータンパク質がF-BARドメインやBARドメインに類似したヘリックス構造をもつことから,大きさの異なるリポソームを用いてREI-1の活性が膜の曲率に依存するかどうかについて調べた.しかしながら,直径50 nmのリポソームと直径400 nmのリポソームとで違いがみられなかったことから,少なくともin vitro GEFアッセイからは,膜の曲率はREI-1のGEF活性に影響しないと考えられた.
2.REI-1ファミリータンパク質のもつGEF活性は種をこえて保存されている
ヒトにおけるホモログであるSH3BP5はSabともよばれ,無ガンマグロブリン血症において変異の報告されているBtkのSH3ドメインと結合するタンパク質として発見された7).REI-1の機能が哺乳動物におけるホモログでも保存されているかどうか調べた結果,SH3BP5もGDP結合型,および,GTPあるいはGDPと結合していないヒトのRab11と強く結合することがわかった.また,SH3BP5はリポソームの非存在下においてもRab11に対しGEF活性を示し,リポソームをくわえることによりその活性は増強した.線虫のREI-1もヒトのRab11に対し強いGEF活性を示したことから,REI-1のGEFとしての機能は種をこえて保存されていると考えられた.
3.REI-1は生殖腺において発現しゴルジ体にてRAB-11と共局在する
REI-1の発現および細胞における局在について調べるため,線虫においてGFPとREI-1との融合タンパク質をrei-1遺伝子のプロモーターの制御のもと発現させたところ,おもに生殖腺において発現がみられた.GFP-REI-1融合タンパク質は卵母細胞においては表層顆粒やドット状のゴルジ体に局在し,一部はRAB-11.1と共局在した.初期胚においてはおもにドット状の局在を示し,後期ゴルジ体のマーカーであるSYN-16 10) と共局在した.また,REI-1およびSYN-16のシグナルはRAB-11.1とも共局在したことから,REI-1は後期ゴルジ体においてRAB-11.1と共局在していると考えられた.ただし,RAB-11.1のシグナルはREI-1およびSYN-16よりも広い範囲にみられたことから,一部のRAB-11.1は輸送小胞あるいはリサイクリングエンドソームなどゴルジ体よりさきのコンパートメントに局在していると考えられた.
4.REI-1は初期胚におけるRAB-11の局在を制御し細胞質分裂に関与する
線虫におけるREI-1ファミリータンパク質の機能を調べるため,REI-1とそのホモログであるREI-2の欠失変異体を作製した.rei-1変異体およびrei-2変異体は野生型と同様の生育および産仔の数を示したが,rei-1;rei-2二重変異体においては産仔の数が3割ほど減少した.RAB-11.1の局在に対する影響について調べたところ,rei-1変異体の初期胚においてはRAB-11.1のドット状の局在がほとんどみられなくなった.このとき,胚の全体におけるGFP-RAB-11.1のシグナルおよび発現量に変化はなかったことから,rei-1変異体においてはRAB-11.1のゴルジ体やリサイクリングエンドソームへの局在が阻害されていると考えられた.このようなRAB-11.1の局在の異常はrei-2変異体においてはほとんどみられなかったが,rei-1;rei-2二重変異体においてはrei-1変異体に比べ増強していた.rei-1変異体およびrei-2変異体において,初期エンドソームのマーカーであるRAB-5および後期ゴルジ体のマーカーであるSYN-16の分布および卵母細胞におけるRAB-11.1の局在に異常はみられなかったことから,REI-1ファミリータンパク質はおもに初期胚においてRAB-11.1の局在を特異的に制御すると考えられた.また,rei-1;rei-2二重変異体の初期胚の抽出物を超遠心により分画したところ,膜の画分とサイトゾルの画分とのRAB-11.1の量比は野生型と変わらなかった.このことから,rei-1;rei-2二重変異体においてRAB-11.1は,特異的には局在できないが,なんらかの膜構造に結合していると思われた.
線虫の初期胚や動物の培養細胞において,Rab11は細胞分裂のときには分裂溝に集積し細胞質分裂にはたらくことが知られている5).そこで,rei-1変異体およびrei-2変異体において細胞分裂の際のRAB-11.1の局在について調べた.その結果,rei-1変異体では細胞質分裂の際に細胞膜の陥入は起こったが,RAB-11.1がドット状や分裂溝に局在せず,細胞質分裂の遅延がみられた.細胞質分裂の際のRAB-11.1の局在の異常および細胞質分裂の遅延は,rei-2変異体ではほとんどみられなかったが,rei-1;rei-2二重変異体では増強していた.これらの結果から,REI-1ファミリータンパク質は初期胚の細胞分裂においてRAB-11.1の局在を制御し,適切な細胞質分裂に寄与していることがわかった.このとき,REI-1やゴルジ体マーカーであるSYN-16は分裂溝に局在しなかったことから,後期ゴルジ体におけるREI-1によるGTP型への変換ののち,RAB-11.1が分裂溝に局在するというモデルが考えられた(図2).
おわりに
筆者らは,この研究において,RAB-11に対する新規のGEFとしてREI-1を同定した.REI-1ファミリータンパク質は既知のRab-GEFドメインをもたない新しいタイプのRabに対するGEFであった.興味深いことに,REI-1ファミリータンパク質は二量体化や脂質との結合などに関与するF-BARドメインおよびBARドメインをもつ.REI-1はBARドメインをもつ既知のタンパク質と同様に,ホモ二量体を形成して膜に直接的に結合する能力をもっていたことから,F-BARドメインおよびBARドメインはREI-1ファミリータンパク質の特異的な膜への局在を介し,Rab11の活性化の空間的な制御に寄与しているのかもしれない.さらに,REI-1ファミリータンパク質はリポソームの存在のもとでGEF活性が増強したことから,膜への結合がGEF活性を制御する可能性も考えられた.
この研究により,REI-1は細胞分裂のときにもRAB-11の局在を制御し,適切な細胞質分裂に寄与することが明らかにされた.細胞のなかでもとくに大きな初期胚の細胞質分裂には,表面積の増加にともない多量の膜成分の挿入が必要になる.線虫の初期胚において,ブレフェルジンAによる小胞体からゴルジ体への輸送の阻害,および,RAB-11の欠失が細胞質分裂の異常をひき起こすことがわかっている.REI-1はゴルジ体におけるRAB-11のGTP結合型への変換を介してRAB-11を含むポストゴルジ小胞の分裂溝への輸送を促進し,適したタイミングでの多量の膜成分の供給に寄与している可能性がある(図2).REI-1ファミリータンパク質のさらなる解析は,Rab11の機能を時空間的に制御する分子機構の理解につながると期待される.
文 献
- Barr, F. & Lambright, D. G.: Rab GEFs and GAPs. Curr. Opin. Cell Biol., 22, 461-470 (2010)[PubMed]
- Bos, J. L., Rehmann, H. & Wittinghofer, A.: GEFs and GAPs: critical elements in the control of small G proteins. Cell, 129, 865-877 (2007)[PubMed]
- Grant, B. & Hirsh, D.: Receptor-mediated endocytosis in the Caenorhabditis elegans oocyte. Mol. Biol. Cell, 10, 4311-4326 (1999)[PubMed]
- Sato, M., Grant, B. D., Harada, A. et al.: Rab11 is required for synchronous secretion of chondroitin proteoglycans after fertilization in Caenorhabditis elegans. J. Cell Sci., 121, 3177-3186 (2008)[PubMed]
- Skop, A. R., Bergmann, D., Mohler, W. A. et al.: Completion of cytokinesis in C. elegans requires a brefeldin A-sensitive membrane accumulation at the cleavage furrow apex. Curr. Biol., 11, 735-746 (2001)[PubMed]
- Sinka, R., Jankovics, F., Somogyi, K. et al.: poirot, a new regulatory gene of Drosophila oskar acts at the level of the short Oskar protein isoform. Development, 129, 3469-3478 (2002)[PubMed]
- Matsushita, M., Yamadori, T., Kato, S. et al.: Identification and characterization of a novel SH3-domain binding protein, Sab, which preferentially associates with Bruton's tyrosine kinase (BtK). Biochem. Biophys. Res. Commun., 245, 337-343 (1998)[PubMed]
- Qualmann, B., Koch, D. & Kessels, M. M.: Let's go bananas: revisiting the endocytic BAR code. EMBO J., 30, 3501-3515 (2011)[PubMed]
- Ebine, K., Inoue, T., Ito, J. et al.: Plant vacuolar trafficking occurs through distinctly regulated pathways. Curr. Biol., 24, 1375-1382 (2014)[PubMed]
- Sato, M., Saegusa, K., Sato, K. et al.: Caenorhabditis elegans SNAP-29 is required for organellar integrity of the endomembrane system and general exocytosis in intestinal epithelial cells. Mol. Biol. Cell, 22, 2579-2587 (2011)[PubMed]
著者プロフィール
略歴:2007年 名古屋大学大学院理学研究科博士課程 修了,米国Ohio州立大学 ポスドク研究員,米国North Carolina大学 ポスドク研究員,群馬大学生体調節研究所 助教を経て,2015年より大阪大学大学院理学研究科 助教.
佐藤 美由紀(Miyuki Sato)
群馬大学生体調節研究所 准教授.
佐藤 健(Ken Sato)
群馬大学生体調節研究所 教授.
研究室URL:http://traffic.dept.med.gunma-u.ac.jp/
© 2015 坂口愛沙・佐藤美由紀・佐藤 健 Licensed under CC 表示 2.1 日本