活性X染色体からのXist遺伝子の発現の抑制はマウス体細胞クローンの効率を改善する
井上貴美子・小倉淳郎
(理化学研究所バイオリソースセンター 遺伝工学基盤技術室)
email:小倉淳郎
DOI: 10.7875/first.author.2010.039
Impeding Xist expression from the active X chromosome improves mouse somatic cell nuclear transfer.
Kimiko Inoue, Takashi Kohda, Michihiko Sugimoto, Takashi Sado, Narumi Ogonuki, Shogo Matoba, Hirosuke Shiura, Rieko Ikeda, Keiji Mochida,Takashi Fujii, Ken Sawai, Arie P. Otte, X. Cindy Tian, Xiangzhong Yang, Fumitoshi Ishino, Kuniya Abe, Atsuo Ogura
Science, 330, 496-499 (2010)
哺乳類の体細胞核移植クローンはすでに約20種の動物に応用され産子の獲得に成功しているが,その効率はきわめて低いままである.その原因が体細胞ゲノムの再プログラム化におけるエラーにあることはまちがいないが,具体的にどのようなエラーが生じているかについてはまだ不明である.マウスの体細胞核移植に由来する胚盤胞の遺伝子発現を詳細に調べたところ,X染色体の不活性化を誘導するXist遺伝子が本来は活性であるX染色体から異常に発現していることが明らかになった.そこで,Xistノックアウトマウスを用いてこの異所性のXist遺伝子の発現を抑制したところ,ゲノムワイドに遺伝子発現パターンが改善しクローン産子の出生率も8~9倍まで上昇した.また,Xist遺伝子に非依存的に発現の低下しているX染色体遺伝子も特定できた.この研究では,体細胞核移植の改善につながるエピジェネティックなエラーをはじめて明らかにした.このような体細胞核移植に特異的なエラーは,今後のクローン技術改善のターゲットとなりうるだろう.
体細胞核移植クローン(somatic cell nuclear transfer)技術は核移植技術のひとつであり,核を除いた未受精卵子(除核卵子)へ体細胞核(ドナー核)を移植し,ドナー核と同じ遺伝情報をもつ個体を作出するというものである.いわゆる“コピー”動物を無限に生産できることから,畜産分野をはじめ,製薬や医療の分野への応用が大いに期待されている.しかしながら,クローン動物の生産効率は著しく低く,移植した胚の数%以下しか生まれてこないのが現状である.これは,分化した体細胞ゲノムが受精卵ゲノムと同じ状態になるという,分化とは逆方向の再プログラム化をうけるためであると考えられる.しかし,この再プログラム化の本態は不明であり,体細胞ゲノムに生じるエラーについても不確実な情報しか得られていない.そこで筆者らは,まず,体細胞核移植に由来する胚盤胞の遺伝子発現パターンを網羅的に解析し,体細胞ゲノムの再プログラム化におけるエラーに由来する異常の検出を試みた.
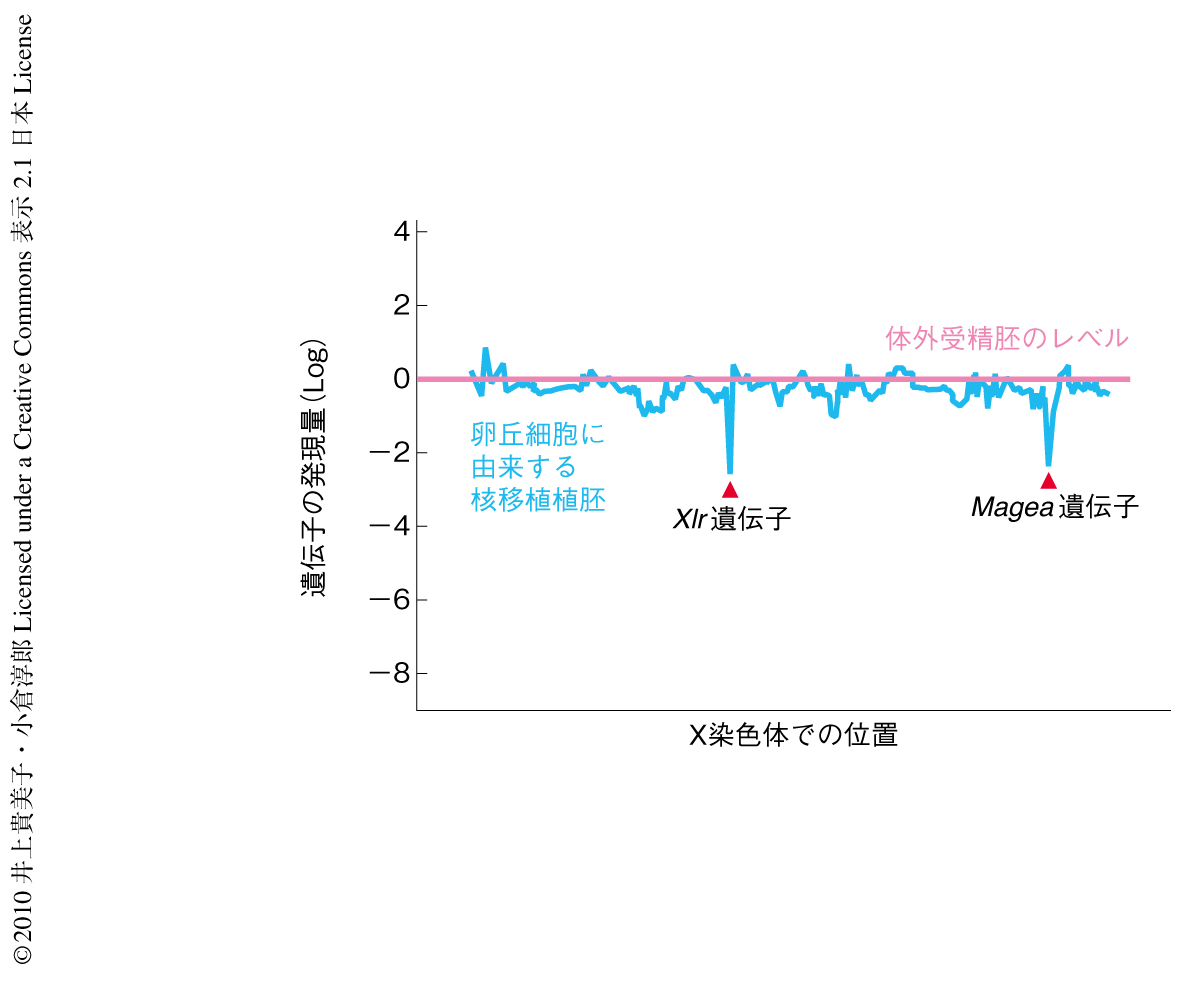
最初に,マウス核移植実験に標準的に用いられているB6D2F1マウス(近交系間雑種F1系統)の卵丘細胞(排卵卵子のまわりに存在する体細胞)をドナー細胞とした胚盤胞における遺伝子発現パターンを解析した.性および遺伝子背景の一致した体外受精胚を対照として,解析したすべての遺伝子について染色体別にその発現レベルを観察したところ,体細胞核移植胚におけるX染色体遺伝子の発現低下が顕著であった.実際に,X染色体のみに限定してプロットしたところ,X染色体のほぼ全体にわたって遺伝子発現の低下していることがわかった(図1).この傾向は雄を含むほかの3種類のドナー細胞を用いても同様であり,一方,4細胞期胚の割球をドナー細胞とした核移植胚ではこの傾向はみられなかった.よって,このX染色体の全域にわたる遺伝子発現の低下は体細胞核移植に特異的であり,核移植技術そのものが原因ではないことが確認された.
マウスにおいては,体細胞核移植による再構築胚にtrichostatin Aなどのヒストン脱アセチル化酵素阻害剤による処理を行うと,顕著に発生能の向上することが知られている1).しかしながら,trichostatin A処理を行っても体細胞核移植に由来する胚盤胞におけるX染色体遺伝子の発現低下は改善しなかった.
X染色体の全域にわたる遺伝子発現抑制は“X染色体の不活性化”現象を思い起こさせる.このX染色体の不活性化とは,通常は雌の細胞に2本存在するX染色体のうちの1本を抑制し,雄の細胞のもつ1本のX染色体の機能と同等にさせるための機構である.このX染色体の全域にわたる抑制にはX染色体にあるXist遺伝子から転写される抑制性RNAがシスにはたらいていることが知られている2).そこで,体細胞核移植胚のXist遺伝子の発現量を調べたところ,雌では通常の数倍まで上昇し,雄の胚からも有意に発現していることが明らかになった.本来は発現しないのはずの雄の胚からもXist遺伝子が発現していたという事実は,活性X染色体から異所的にXist遺伝子の発現していることを示唆していた.そこで,体細胞核移植胚を用いてXist遺伝子に対するRNA蛍光in situハイブリダイゼーション実験を実施しそのシグナルを観察した.その結果,多くの割球から雌の胚で2つ,雄の胚で1つの核内シグナルが認められ,これらの胚においては活性X染色体からXist遺伝子の発現していることが確実となった.
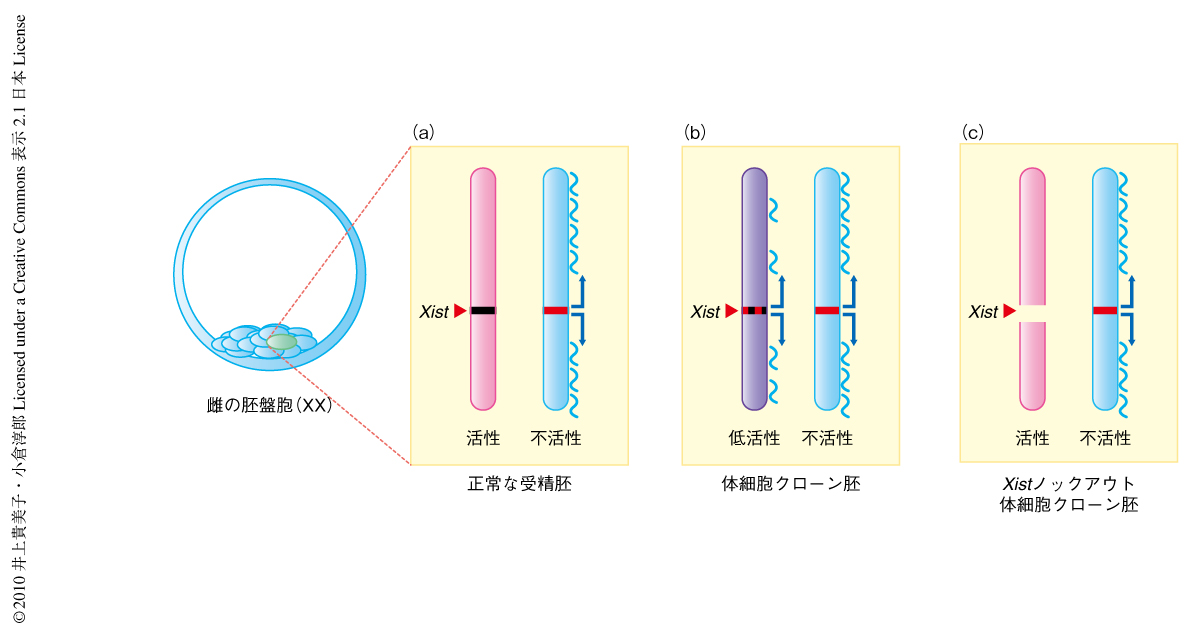
正常な着床前胚におけるX染色体の不活性化はインプリント制御をうけている.すなわち,精子に由来するX染色体はつねに雌の胚にのみ存在し不活性化をうける運命にある.一方,卵子に由来するX染色体は雌雄の胚に含まれておりつねに活性状態にある3).そこで,Xistノックアウトマウスを用い,母方(卵子)からノックアウトされた対立遺伝子をひき継いだ雌マウスあるいは雄マウスの体細胞をドナー細胞として核移植を実施し,活性X染色体からXist遺伝子の発現しない胚を作出した(図2).これらの胚の遺伝子発現を解析したところ,予想どおり,X染色体にある遺伝子の発現は改善し,さらに,常染色体にある低発現遺伝子のほとんど(85%)もその発現が正常レベルに復した.この結果から,体細胞核移植胚の着床前胚におけるX染色体遺伝子の発現低下がきわめて広範囲の(ゲノムワイドな)影響をあたえていたことがわかった.
さらに,これらXist遺伝子をノックアウトした体細胞核移植胚を雌に移植したところ,胚移植あたり13~14%の率で産子へと発生した.これは,野生型核移植胚の8~9倍に相当するものであった.
このように,Xist遺伝子による活性X染色体の抑制は体細胞核移植胚の発生に非常に大きな影響をあたえていたことがわかったが,Xist遺伝子をノックアウトした体細胞核移植胚を用いても改善の認められない遺伝子が2つ認められた.それは,XqF3およびXqA7.2-7.3領域に分布するMagea遺伝子ファミリーおよびXlr遺伝子ファミリーであった(図1).Magea遺伝子はヒストンアセチル化酵素のひとつであるG9aをノックアウトした胚性幹細胞(ES細胞)で上昇することが知られており4),通常の体細胞ではヒストンH3の9番目のリジン残基のジメチル化修飾により発現抑制をうけているものと考えられている.最近,この抑制性のジメチル化修飾はゲノムにおいてブロック状に分布していることが判明し,LOCK(large organized chromatin K9 modification)と名づけられた5).このX染色体のMagea遺伝子およびXlr遺伝子はちょうどLOCK領域に含まれており,おそらく,体細胞におけるヒストンH3の9番目のリジン残基のジメチル化修飾が再プログラム化されず,核移植胚でも抑制をうけつづけているものと考えられた.Magea遺伝子やXlr遺伝子は生殖細胞,着床前胚,腫瘍などで発現することが知られているが,その機能は不明である.
哺乳類の卵子には未同定のゲノム再プログラム化因子(あるいは,初期化因子)が存在しているといわれている.この因子は生殖細胞(卵子および精子)のゲノムに全能性を付与し新しい生命の誕生をつかさどる.核移植技術はこの卵子に備わっている再プログラム化能を利用してドナー細胞のゲノムを受精卵のゲノムと同等にしようとするものである.よって,本来の卵子の再プログラム化能力をこえてドナー細胞の状態を改変することはできないはずである.この仮定のもと,筆者らは,体細胞核移植にともなう再プログラム化のエラーには,ランダムに生じるものと定型的(ノンランダム)に生じるものとがあると考えている.前者のランダムなエラーは卵子の再プログラム化能の効果をあげることで改善される性質のもので,おそらく,trichostatin Aなどヒストン脱アセチル化酵素阻害剤はこのエラーを減少させクローン産子の作出の効率を上げているものと考えられる.一方,今回,報告したX染色体の異常な不活性化はXist遺伝子の異所的な発現および体細胞に由来する抑制性のヒストン修飾(LOCK)に起因していることから,明らかに後者の定型的なエラーに分類される.この異常はtrichostatin A処理でも改善しなかった.よって,明らかに卵子の再プログラム化能をこえており,それにはなんらかの強力な対処法が必要である.この研究では,Xist遺伝子をノックアウトすることで予想以上の改善効果が得られた.この論文の共著者のひとり澤井 健(岩手大学農学部)は,ウシの体細胞核移植胚でもXist遺伝子の発現が上昇していることを明らかにしている.今後,X染色体での遺伝子発現を正常化することにより哺乳類の体細胞クローン技術を実用化することができるかもしれない.
略歴:1987年 東京大学大学院農学系研究科博士課程 修了,同年 国立予防衛生研究所(現 国立感染症研究所),その間1991~1992年 米国Hawaii州立大学にて柳町隆造教授に師事(科学技術庁 特別研究員 併任),2002年より理化学研究所バイオリソースセンター 室長.
研究テーマ:生殖工学全般,とくに,顕微授精と核移植クローン.
© 2010 井上貴美子・小倉淳郎 Licensed under CC 表示 2.1 日本
(理化学研究所バイオリソースセンター 遺伝工学基盤技術室)
email:小倉淳郎
DOI: 10.7875/first.author.2010.039
Impeding Xist expression from the active X chromosome improves mouse somatic cell nuclear transfer.
Kimiko Inoue, Takashi Kohda, Michihiko Sugimoto, Takashi Sado, Narumi Ogonuki, Shogo Matoba, Hirosuke Shiura, Rieko Ikeda, Keiji Mochida,Takashi Fujii, Ken Sawai, Arie P. Otte, X. Cindy Tian, Xiangzhong Yang, Fumitoshi Ishino, Kuniya Abe, Atsuo Ogura
Science, 330, 496-499 (2010)
要 約
哺乳類の体細胞核移植クローンはすでに約20種の動物に応用され産子の獲得に成功しているが,その効率はきわめて低いままである.その原因が体細胞ゲノムの再プログラム化におけるエラーにあることはまちがいないが,具体的にどのようなエラーが生じているかについてはまだ不明である.マウスの体細胞核移植に由来する胚盤胞の遺伝子発現を詳細に調べたところ,X染色体の不活性化を誘導するXist遺伝子が本来は活性であるX染色体から異常に発現していることが明らかになった.そこで,Xistノックアウトマウスを用いてこの異所性のXist遺伝子の発現を抑制したところ,ゲノムワイドに遺伝子発現パターンが改善しクローン産子の出生率も8~9倍まで上昇した.また,Xist遺伝子に非依存的に発現の低下しているX染色体遺伝子も特定できた.この研究では,体細胞核移植の改善につながるエピジェネティックなエラーをはじめて明らかにした.このような体細胞核移植に特異的なエラーは,今後のクローン技術改善のターゲットとなりうるだろう.
はじめに
体細胞核移植クローン(somatic cell nuclear transfer)技術は核移植技術のひとつであり,核を除いた未受精卵子(除核卵子)へ体細胞核(ドナー核)を移植し,ドナー核と同じ遺伝情報をもつ個体を作出するというものである.いわゆる“コピー”動物を無限に生産できることから,畜産分野をはじめ,製薬や医療の分野への応用が大いに期待されている.しかしながら,クローン動物の生産効率は著しく低く,移植した胚の数%以下しか生まれてこないのが現状である.これは,分化した体細胞ゲノムが受精卵ゲノムと同じ状態になるという,分化とは逆方向の再プログラム化をうけるためであると考えられる.しかし,この再プログラム化の本態は不明であり,体細胞ゲノムに生じるエラーについても不確実な情報しか得られていない.そこで筆者らは,まず,体細胞核移植に由来する胚盤胞の遺伝子発現パターンを網羅的に解析し,体細胞ゲノムの再プログラム化におけるエラーに由来する異常の検出を試みた.
1.体細胞核移植に由来する胚盤胞ではX染色体遺伝子の発現が異常に低下する
最初に,マウス核移植実験に標準的に用いられているB6D2F1マウス(近交系間雑種F1系統)の卵丘細胞(排卵卵子のまわりに存在する体細胞)をドナー細胞とした胚盤胞における遺伝子発現パターンを解析した.性および遺伝子背景の一致した体外受精胚を対照として,解析したすべての遺伝子について染色体別にその発現レベルを観察したところ,体細胞核移植胚におけるX染色体遺伝子の発現低下が顕著であった.実際に,X染色体のみに限定してプロットしたところ,X染色体のほぼ全体にわたって遺伝子発現の低下していることがわかった(図1).この傾向は雄を含むほかの3種類のドナー細胞を用いても同様であり,一方,4細胞期胚の割球をドナー細胞とした核移植胚ではこの傾向はみられなかった.よって,このX染色体の全域にわたる遺伝子発現の低下は体細胞核移植に特異的であり,核移植技術そのものが原因ではないことが確認された.
マウスにおいては,体細胞核移植による再構築胚にtrichostatin Aなどのヒストン脱アセチル化酵素阻害剤による処理を行うと,顕著に発生能の向上することが知られている1).しかしながら,trichostatin A処理を行っても体細胞核移植に由来する胚盤胞におけるX染色体遺伝子の発現低下は改善しなかった.
2.体細胞核移植に由来する胚盤胞では活性X染色体からXist遺伝子が発現する
X染色体の全域にわたる遺伝子発現抑制は“X染色体の不活性化”現象を思い起こさせる.このX染色体の不活性化とは,通常は雌の細胞に2本存在するX染色体のうちの1本を抑制し,雄の細胞のもつ1本のX染色体の機能と同等にさせるための機構である.このX染色体の全域にわたる抑制にはX染色体にあるXist遺伝子から転写される抑制性RNAがシスにはたらいていることが知られている2).そこで,体細胞核移植胚のXist遺伝子の発現量を調べたところ,雌では通常の数倍まで上昇し,雄の胚からも有意に発現していることが明らかになった.本来は発現しないのはずの雄の胚からもXist遺伝子が発現していたという事実は,活性X染色体から異所的にXist遺伝子の発現していることを示唆していた.そこで,体細胞核移植胚を用いてXist遺伝子に対するRNA蛍光in situハイブリダイゼーション実験を実施しそのシグナルを観察した.その結果,多くの割球から雌の胚で2つ,雄の胚で1つの核内シグナルが認められ,これらの胚においては活性X染色体からXist遺伝子の発現していることが確実となった.
3.活性化X染色体のXist遺伝子のノックアウトは遺伝子発現をゲノムワイドに改善する
正常な着床前胚におけるX染色体の不活性化はインプリント制御をうけている.すなわち,精子に由来するX染色体はつねに雌の胚にのみ存在し不活性化をうける運命にある.一方,卵子に由来するX染色体は雌雄の胚に含まれておりつねに活性状態にある3).そこで,Xistノックアウトマウスを用い,母方(卵子)からノックアウトされた対立遺伝子をひき継いだ雌マウスあるいは雄マウスの体細胞をドナー細胞として核移植を実施し,活性X染色体からXist遺伝子の発現しない胚を作出した(図2).これらの胚の遺伝子発現を解析したところ,予想どおり,X染色体にある遺伝子の発現は改善し,さらに,常染色体にある低発現遺伝子のほとんど(85%)もその発現が正常レベルに復した.この結果から,体細胞核移植胚の着床前胚におけるX染色体遺伝子の発現低下がきわめて広範囲の(ゲノムワイドな)影響をあたえていたことがわかった.
さらに,これらXist遺伝子をノックアウトした体細胞核移植胚を雌に移植したところ,胚移植あたり13~14%の率で産子へと発生した.これは,野生型核移植胚の8~9倍に相当するものであった.
4.X染色体のヒストンH3のジメチル化は体細胞核移植胚においてXist遺伝子に非依存的に抑制をうける
このように,Xist遺伝子による活性X染色体の抑制は体細胞核移植胚の発生に非常に大きな影響をあたえていたことがわかったが,Xist遺伝子をノックアウトした体細胞核移植胚を用いても改善の認められない遺伝子が2つ認められた.それは,XqF3およびXqA7.2-7.3領域に分布するMagea遺伝子ファミリーおよびXlr遺伝子ファミリーであった(図1).Magea遺伝子はヒストンアセチル化酵素のひとつであるG9aをノックアウトした胚性幹細胞(ES細胞)で上昇することが知られており4),通常の体細胞ではヒストンH3の9番目のリジン残基のジメチル化修飾により発現抑制をうけているものと考えられている.最近,この抑制性のジメチル化修飾はゲノムにおいてブロック状に分布していることが判明し,LOCK(large organized chromatin K9 modification)と名づけられた5).このX染色体のMagea遺伝子およびXlr遺伝子はちょうどLOCK領域に含まれており,おそらく,体細胞におけるヒストンH3の9番目のリジン残基のジメチル化修飾が再プログラム化されず,核移植胚でも抑制をうけつづけているものと考えられた.Magea遺伝子やXlr遺伝子は生殖細胞,着床前胚,腫瘍などで発現することが知られているが,その機能は不明である.
おわりに
哺乳類の卵子には未同定のゲノム再プログラム化因子(あるいは,初期化因子)が存在しているといわれている.この因子は生殖細胞(卵子および精子)のゲノムに全能性を付与し新しい生命の誕生をつかさどる.核移植技術はこの卵子に備わっている再プログラム化能を利用してドナー細胞のゲノムを受精卵のゲノムと同等にしようとするものである.よって,本来の卵子の再プログラム化能力をこえてドナー細胞の状態を改変することはできないはずである.この仮定のもと,筆者らは,体細胞核移植にともなう再プログラム化のエラーには,ランダムに生じるものと定型的(ノンランダム)に生じるものとがあると考えている.前者のランダムなエラーは卵子の再プログラム化能の効果をあげることで改善される性質のもので,おそらく,trichostatin Aなどヒストン脱アセチル化酵素阻害剤はこのエラーを減少させクローン産子の作出の効率を上げているものと考えられる.一方,今回,報告したX染色体の異常な不活性化はXist遺伝子の異所的な発現および体細胞に由来する抑制性のヒストン修飾(LOCK)に起因していることから,明らかに後者の定型的なエラーに分類される.この異常はtrichostatin A処理でも改善しなかった.よって,明らかに卵子の再プログラム化能をこえており,それにはなんらかの強力な対処法が必要である.この研究では,Xist遺伝子をノックアウトすることで予想以上の改善効果が得られた.この論文の共著者のひとり澤井 健(岩手大学農学部)は,ウシの体細胞核移植胚でもXist遺伝子の発現が上昇していることを明らかにしている.今後,X染色体での遺伝子発現を正常化することにより哺乳類の体細胞クローン技術を実用化することができるかもしれない.
文 献
- Kishigami, S., Mizutani, E., Ohta, H. et al.: Significant improvement of mouse cloning technique by treatment with trichostatin A after somatic nuclear transfer. Biochem. Biophys. Res. Commun., 340, 183-189 (2006)[PubMed]
- Huynh, K. D. & Lee, J. T.: X-chromosome inactivation: a hypothesis linking ontogeny and phylogeny. Nat. Rev. Genet., 6, 410-418 (2005)[PubMed]
- Navarro, P., Chambers, I., Karwacki-Neisius, V. et al.: Molecular coupling of Xist regulation and pluripotency. Science, 321, 1693-1695 (2008)[PubMed]
- Tachibana, M., Sugimoto, K., Nozaki, M. et al.: G9a histone methyltransferase plays a dominant role in euchromatic histone H3 lysine 9 methylation and is essential for early embryogenesis. Genes Dev., 16, 1779-1791 (2002)[PubMed]
- Wen, B., Wu, H., Shinkai, Y. et al.: Large histone H3 lysine 9 dimethylated chromatin blocks distinguish differentiated from embryonic stem cells. Nat. Genet., 41, 246-250 (2009)[PubMed]
著者プロフィール
略歴:1987年 東京大学大学院農学系研究科博士課程 修了,同年 国立予防衛生研究所(現 国立感染症研究所),その間1991~1992年 米国Hawaii州立大学にて柳町隆造教授に師事(科学技術庁 特別研究員 併任),2002年より理化学研究所バイオリソースセンター 室長.
研究テーマ:生殖工学全般,とくに,顕微授精と核移植クローン.
© 2010 井上貴美子・小倉淳郎 Licensed under CC 表示 2.1 日本